离子液体超声辅助提取磷脂酰肌醇
,, ,
(河南省农业科学院,农副产品加工研究中心,河南郑州 450002)
离子液体超声辅助提取磷脂酰肌醇
宋范范,张康逸*,杨妍,杨帆
(河南省农业科学院,农副产品加工研究中心,河南郑州450002)
以大豆粉末磷脂为原料,采用离子液体超声波辅助萃取的方法对磷脂酰肌醇进行了分离提取研究。考察了不同萃取次数、料液比、乙醇-离子液体(氢氧化1-丁基-3-甲基咪唑,[Bmim]OH)溶剂比、萃取温度、萃取时间和萃取功率对磷脂酰肌醇纯度和提取率的影响。结果表明:萃取次数3次,料液比1∶12 (w/v),溶剂乙醇-[Bmim]OH体积比100∶7 (v/v),萃取温度35 ℃,萃取时间15 min,萃取功率360 W条件下磷脂酰肌醇的纯度为79.53%±3.26%,提取率为68.26%±1.15%。
大豆粉末磷脂,磷脂酰肌醇,超声波辅助萃取,离子液体
Abstract:The extraction methods of phosphatidylinositol from soybean lecithin powder by ionic liquid and ultrasonic wave were studied. The effects of extraction times,solid-liquid ratio,ehanol-[Bmim]OH ratio,extraction temperature,extraction time and ultrasonic power on the purity and extraction ratio of phosphatidylinositol were investigated. The purified phosphatidylinositol products were obtained at the conditions as follows:extraction times 3,solid-liquid ratio 1∶12,ehanol-[Bmim]OH ratio 100∶7,extraction temperature 35 ℃,extraction time 15 min and ultrasonic power 360 W. Under these conditions,the purity and extracting yield of phosphatidylinositol were 79.53%±3.26% and 68.26%±1.15%,respectively.
Keywords:soybean lecithin powder;phosphatidylinositol;ultrasonic assisted extraction;ionic liquid
磷脂酰肌醇(phosphatidylinositol,PI)是磷脂的组分之一,大豆粉末磷脂中PI含量丰富,约占总磷脂的18%~21%。PI是细胞的信息分子,常作为细胞内信号传导通路,对于维持中枢神经系统、调节钙稳态方面有重要作用[1]。由于PI是一种重要的生理活性物质,且具有重要的生理功能和乳化特性,已被广泛用于医药、保健品、化妆品及食品等行业。
很多学者对PI的制备方法进行了研究,包括溶剂萃取法[2]、柱层析法[3]、酶催化法[4]、化学合成法[5]等。刘代成等采用碱性乙醇抽提的方法首先去除大豆磷脂中的磷脂酰胆碱和磷脂酰乙醇胺,然后用非极性溶剂溶解粗品,再用含碱性的极性溶剂萃取PI,最后加入金属盐纯化,但该种方法制备过程繁琐、PI回收率过低且提取时间长(60 min)[6]。柱层析法所得到的PI产品纯度较高,但是分离周期过长,负载量较低,不利于放大生产。酶催化法过程简便,PI纯度和得率较高,但是生产投入较大,仍未得到广泛应用。化学合成法会用到吡啶、乙腈、DMF等有机溶剂,可能对产品的安全性造成影响。
离子液体作为新型的绿色环保溶剂,已广泛应用于有机合成、催化及萃取领域[7]。作为萃取介质,离子液体可以替代传统的有机溶剂,并可提高萃取的效率和选择性,且在环境友好和回收利用方面具有很大的优势和潜力,适用于对安全性要求高的医药及食品工业领域[8-9]。
超声波萃取利用超声波空化效应,在液体中形成强大的冲击波或高速射流,加快传质速度,此外,超声波的热作用和机械作用也能促进超声波的强化萃取[10-11],已有学者利用超声来强化磷脂的提取[12-14]。余祥英等人以大豆粉末磷脂为原料,研究了超声波辅助萃取制备大豆磷脂酰胆碱的过程[15]。刘玲娜用超声辅助丙酮萃取粉末磷脂,与非超声溶剂萃取相比,萃取时间少,磷脂含量高[16]。本文在前人的研究基础上,选用无毒溶剂乙醇和绿色溶剂离子液体来萃取制备PI,借助了超声波的空化效应来增加溶剂的穿透力,以此来提高PI的溶出速度和纯度。
1 材料与方法
1.1 材料与仪器
大豆粉末磷脂 纯度≥96%,磷脂酰胆碱(PC)30%、磷脂酰乙醇胺(PE)25%、磷脂酰肌醇25%、溶血磷脂酰乙醇胺(LPE)0.5%,河南新百维食品科技有限公司;PI、PE、PC、溶血磷脂酰胆碱(LPC)(99%)标准品 Sigma公司(St. Louis,MO,USA);甲醇 色谱纯,美国Honeywell公司;无水乙醇(纯度≥99%)、氨水(NH3含量≥25%)、甲醇(纯度≥99%) 国药集团化学试剂有限公司;氯仿 分析纯,烟台市双双化工有限公司;离子液体[氢氧化1-丁基-3-甲基咪唑Bmim]OH、1-丁基-3-甲基咪唑盐[Bmim]Im、1-丁基-3-甲基咪唑醋酸盐[Bmim]OAc、氢氧化1-乙基-3-甲基咪唑[Emim]Im 上海成捷化学有限公司。
Agilent 1260型高效液相色谱仪 安捷伦科技有限公司;KQ-600DE型数控超声波清洗器 昆山市超声仪器有限公司;JW-1042低速离心机 安徽嘉文仪器装备有限公司;D27-6050真空干燥箱 上海精宏实验设备有限公司。
1.2 实验方法
1.2.1 PI的制备方法 称取一定量的粉末磷脂,加入一定比例的混合溶剂,置于超声波清洗器中,按设定条件进行超声提取,4000 r/min离心10 min分离出沉淀重复操作,将沉淀在真空度0.1 MPa,干燥温度40 ℃条件下真空干燥即得到PI产品。
1.2.2 PI纯度的测定
1.2.2.1 标准曲线的绘制 将PI标准品配成1.0、1.5、2.0、2.5、3.0、3.5 mg/mL不同浓度的标准溶液,用HPLC-ELSD测定峰面积,以峰面积对浓度做标准曲线。
1.2.2.2 HPLC-ELSD条件 色谱柱:ZORBAXRX-SIL(4.6 mm×250 mm,5 μm),柱温35 ℃,进样量20 μL,漂移管温度30 ℃;流动相:A为甲醇,B为甲醇∶水=8∶1 (v/v),流量1.0 mL/min;梯度洗脱程序:0~10.0 min,60%~40% A;10.0~20.0 min,40% A;20.0~20.1 min,40%~60% A;20.1~25.0 min,60% A。
1.2.2.3 样品测定 PI产品溶解定容后进行HPLC-ELSD分析,由回归方程计算出PI的浓度,按下式计算提取率和纯度。
Y(%)=C×V×D×100/M
式中:Y为纯度,%;C为待测溶液中PI的浓度,mg/mL;V为待测溶液的体积,mL;D为稀释倍数;M为样品质量,g。
1.2.3 单因素实验 以萃取方式、离子液体种类、萃取次数、料液比、乙醇-[Bmim]OH混合溶剂比、萃取时间、萃取温度及萃取功率为研究因素,以PI的纯度和提取率为指标进行单因素实验。
1.2.3.1 萃取方式对PI纯度和提取率的影响 在料液比为1∶5 (w/v)、乙醇-[Bmim]OH溶剂比100∶3 (v/v)、萃取时间15 min、萃取3次,萃取温度40 ℃的条件下,分别考察磁力搅拌(转速500 r/min)和超声辅助(功率480 W)萃取方式对PI纯度和提取率的影响。
1.2.3.2 离子液体种类对PI纯度和提取率的影响 在料液比1∶5 (w/v)、乙醇-离子液体溶剂比100∶3 (v/v)、萃取时间15 min、萃取3次,萃取温度40 ℃、超声波萃取功率480 W的条件下,分别考察四种常见碱性离子液体[Bmim]OH、[Bmim]Im、[Bmim]OAc、[Emim]Im及单一乙醇(空白)体系对PI纯度和提取率的影响。
1.2.3.3 萃取次数对PI纯度和提取率的影响 在料液比1∶5 (w/v)、乙醇-[Bmim]OH溶剂比100∶3 (v/v)、萃取时间15 min、萃取温度40 ℃、萃取功率480 W的条件下,分别考察萃取次数1、2、3、4次对PI纯度和提取率的影响。
1.2.3.4 料液比对PI纯度和提取率的影响 在萃取次数3次、乙醇-[Bmim]OH溶剂比100∶3 (v/v),萃取时间15 min、萃取温度40 ℃、萃取功率480 W的条件下,分别考察料液比1∶3、1∶5、1∶9、1∶12、1∶18 (w/v)对PI纯度和提取率的影响。
1.2.3.5 溶剂比对PI纯度和提取率的影响 在萃取次数3次,料液比1∶5 (w/v)、萃取时间15 min、萃取温度40 ℃、萃取功率480 W的条件下,分别考察乙醇-[Bmim]OH溶剂比100∶1、100∶3、100∶5、100∶7、100∶9 (v/v)对PI纯度和提取率的影响。
1.2.3.6 萃取时间对PI纯度和提取率的影响 在萃取次数3次、料液比1∶5 (w/v)、乙醇-[Bmim]OH溶剂比100∶3 (v/v)、萃取温度40 ℃、萃取功率480 W的条件下,分别考察萃取时间3、5、10、15、30 min对PI纯度和提取率的影响。
1.2.3.7 萃取温度对PI纯度和提取率的影响 在萃取次数3次、料液比1∶5 (w/v)、乙醇-[Bmim]OH溶剂比100∶3 (v/v)、萃取时间15 min、萃取功率480 W的条件下,分别考察温度20、30、35、40、50 ℃对PI纯度和提取率的影响。
1.2.3.8 萃取功率对PI纯度和提取率的影响 在萃取次数3次、料液比1∶5 (w/v)、乙醇-[Bmim]OH溶剂比100∶3 (v/v)、萃取时间15 min、萃取温度40 ℃的条件下,分别考察超声功率240、300、360、480、600 W对PI纯度和提取率的影响。
1.3 数据处理
数据采用Origin 9.0软件作图,并用SPSS 17.0单因素方差、多因素方差分析进行处理。
2 结果与讨论
2.1 PI标准曲线的绘制
PI标准曲线方程为Y=9.2739X-8.3799(R2=0.9910),二者呈良好的线性关系,见图1。

图1 PI标准曲线Fig.1 The standard curve of PI
2.2 单因素实验
2.2.1 萃取方式对PI纯度和提取率的影响 磷脂作为一种混合物,其主要成分有磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)及PI三种[17]。由图2可以看出,采用超声辅助萃取得到的PI的纯度和提取率较高,磁力搅拌萃取3次后粗PI纯度为49.12%,超声辅助萃取后粗PI纯度为68.35%,PI提取率也较高,这主要与超声波所产生的强烈机械振荡及空化效应等作用有关,这些作用力能够使溶剂体系与磷脂之间接触面积增大,使磷脂中的PC和PE更易被浸提到溶剂中,从而使不溶物中的PI含量增加,故PI纯度升高。因此,选择超声辅助的萃取方法。

图2 萃取方式对PI纯度和提取率的影响Fig.2 Effect of extraction technology on PI purity and extraction ratio
2.2.2 离子液体种类对PI纯度和提取率的影响 PC易溶解于乙醇中,PE的溶解度在碱性乙醇中要高于乙醇,故利用碱性乙醇能有效去除磷脂中的PC和PE组分,进而可得到纯度较高的PI。文献中向乙醇中添加的碱性物质主要为氢氧化钠、氨水、碳酸钠等碱性试剂[6],这些物质的存在对产品和生产环境的安全性会存在一定的影响,且不利于反应溶剂的回收利用。结合离子液体作为萃取介质的优势,本研究选择了几种碱性离子液体来替代之前所用到的碱性物质,以此解决产品和生产环境的安全性及溶剂回收利用等问题。由图3看出,[Bmim]OH存在的溶剂体系比其他离子液体溶剂体系所得到的PI纯度较高,可能由于该离子液体与乙醇可形成分子间氢键、互溶性好,同时二者组成的溶剂体系对磷脂的溶解能力较强,能够形成均一稳定的体系[18]。此外,乙醇-[Bmim]OH溶剂体系下的提取率高于其他几种离子液体存在的溶剂体系。在单一乙醇体系下PI的纯度为53.96%,提取率为73%,虽然提取率高于有离子液体存在的溶剂体系,但考虑到PI的纯度并不高,故选择乙醇-[Bmim]OH作为碱性提取溶剂。
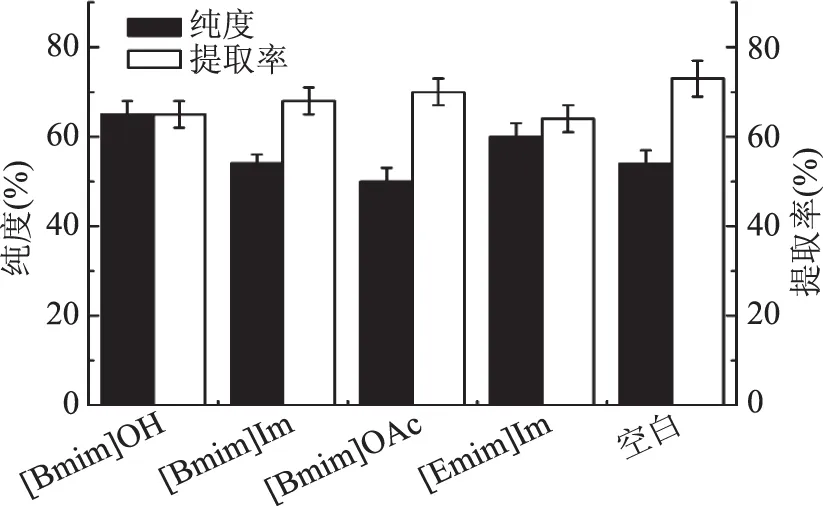
图3 离子液体种类对PI纯度和提取率的影响Fig.3 Effect of type of ionic liquid on PI purity and extraction ratio
2.2.3 萃取次数对PI纯度和提取率的影响 随着萃取次数的增加,产品中PI的纯度先增加后趋于稳定。萃取次数越多,大豆粉末磷脂中的PC和PE会被萃取到溶剂体系中,产品中的PI纯度逐渐增加,但随着萃取次数的再增加,PC和PE在溶剂体系中的溶解趋于饱和,PI的纯度趋于稳定。由图4可知,当萃取次数为3次时,PI的纯度及提取率基本已趋于稳定,再增加萃取次数,PI提取率会下降,同时为了避免造成溶剂的浪费,选择3次为最佳萃取次数。

图4 萃取次数对PI纯度和提取率的影响Fig.4 Effect of extraction times on PI purity and extraction ratio
2.2.4 料液比对PI纯度和提取率的影响 由图5可知,随着料液比的增加,PI纯度呈逐渐增加的趋势,当料液比为1∶12时PI的纯度最大,提取率也比较高,这是因为料液比的增加会导致体系粘度降低,PC和PE的溶出速度增大;继续增大料液比,纯度反而开始下降,这种现象的产生主要是因为磷脂中的PI组分也开始溶解到溶剂体系中,故导致不溶物中的PI含量下降,纯度和提取率均降低。综合以上因素,选择1∶12为最佳料液比。

图5 液料比对PI纯度和提取率的影响Fig.5 Effect of the ratio of liquid to solid on PI purity and extraction ratio
2.2.5 溶剂比对PI纯度和提取率的影响 随着乙醇-[Bmim]OH溶剂比的增大,产品中PI的纯度先增加后降低,同时PI提取率呈下降趋势。当溶剂比为100∶7时PI纯度最大。随着溶剂中[Bmim]OH量的增加,溶剂体系的黏度加大,当溶剂比为100∶9时,体系中磷脂颜色严重结块呈胶状,不利于传质,这是因为随着溶剂中离子液体含量的增加,体系变的黏稠,磷脂不能充分溶解在溶剂体系中,也就不利于溶剂对PC和PE的溶出,故PI纯度降低,此外,体系流动性变差也导致PI的提取率下降的原因。综合以上因素,选择100∶7为最佳溶剂比。

图6 溶剂比对PI纯度和提取率的影响Fig.6 Effect of solvent ratio on PI purity and extraction ratio
2.2.6 萃取时间对PI纯度和提取率的影响 随着萃取时间的延长,产品中的PI纯度先升高后降低。超声波萃取5 min就可提取到纯度为61.00%的PI,适当延长萃取时间有利于溶质的溶解和扩散,PC和PE越易被萃取出来,PI的纯度越高,但是随着萃取时间的继续延长,原料磷脂中的PI等其他组分也会被提取到溶剂体系中,使得产品中PI纯度降低。碱性离子液体[Bmim]OH在很多类型的催化反应中表现出较高的催化活性[19-21],因此当萃取时间过长时,[Bmim]OH有可能会对少量的磷脂或PI进行催化,使其转化为其他的物质,故而导致PI的提取率和纯度降低。当萃取时间为15 min时,PI的纯度达到最大值。故选择15 min为最佳萃取时间。

图7 萃取时间对PI纯度和提取率的影响Fig.7 Effect of extraction time on phosphatidylinositol purity and extraction ratio
2.2.7 萃取温度对PI纯度和提取率的影响 由图8看出,适当升温有利于提高溶质的传质速率,随着温度的升高,产物中的PI纯度逐渐增加,在40 ℃的萃取温度下产物中PI纯度最高,随后PI纯度开始减少。升高温度有利于PC和PE的浸出,但当温度超过40 ℃时,部分PI也会溶解到溶剂体系中,导致PI的纯度降低,这种现象的产生也有可能与[Bmim]OH的催化活性有关,因为[Bmim]OH可能会对部分的PI进行催化[22]。由于35 ℃和40 ℃的纯度差别很小,且35 ℃时的提取率较高,综合以上因素,选择35 ℃为最佳萃取温度。
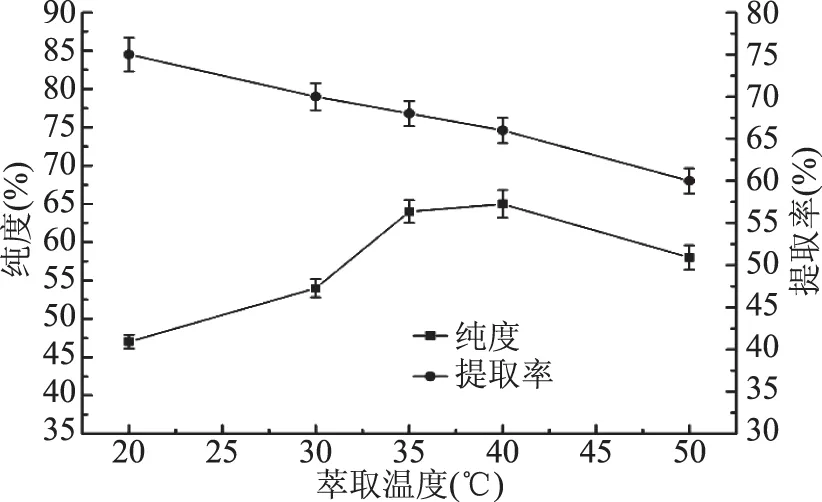
图8 温度对PI纯度和提取率的影响Fig.8 Effect of temperature on phosphatidylinositol purity and extraction ratio
2.2.8 萃取功率对PI纯度和提取率的影响 由图9看出,随功率的升高,产物中PI的纯度先增加后减少,当萃取功率360 W时PI纯度最高。提高超声功率有利于提高溶质的运动频率和速度,增加溶剂的穿透力,加速溶质的溶解,因此,提高功率有利于PC和PE的浸出。当功率为360 W时,继续增大功率会导致溶剂体系温度升高,从而使部分PI进入溶剂体系,导致PI的含量降低。综合以上因素,选择360 W为最佳萃取功率。

图9 功率对PI纯度和提取率的影响Fig.9 Effect of power on PI purity and extraction ratio
2.2.9 最佳条件验证 在萃取次数3次,料液比1∶12 (w/v),乙醇-[Bmim]OH溶剂体积比100∶7 (v/v),萃取温度35 ℃,萃取时间15 min,萃取功率360 W的条件下,PI的纯度为79.53%±3.26%,提取率为68.26%±1.15%,PI的液相色谱图如图10所示。

图10 粉末磷脂(A)和PI(B)的色谱图Fig.10 Chromatograms of soybean lecithin powder(A)and PI(B)
3 结论与讨论
本文采用新型离子液体[Bmim]OH替代了传统的碱性试剂,降低了溶剂体系的毒性,并且提高了产品PI的纯度及安全性。[Bmim]OH和乙醇能够形成均一稳定的体系,在提高对原料粉末磷脂中PI的选择性的同时还能最大限度的降低乙醇的挥发。此外,超声波辅助下5 min就可提取到纯度为61.00%的PI,与传统的溶剂萃取法(提取时间60 min)[6]相比,节约了大量的提取时间。
实验结果表明最佳工艺条件为萃取次数3次,料液比1∶12 (w/v),溶剂乙醇-[Bmim]OH体积比100∶7 (v/v),萃取温度35 ℃,萃取时间15 min,萃取功率360 W,在此条件件下PI的纯度为79.53%±3.26%,提取率为68.26%±1.15%。与单一的乙醇体系(53.96%)相比,PI的纯度提高了将近25%。此外,溶剂体系经过简单的蒸馏就可实现分离和循环利用。但实验过程中发现长时间或稍高温度下萃取会使PI的纯度下降,这种现象可能与[Bmim]OH的催化活性有关,故使产品纯度降低。因此,后续实验会考察[Bmim]OH对磷脂的催化性能,而这一方面的研究还未见报道。
[1]Tóth J T,Gulyás G,Tóth D J,et al.BRET-monitoring of the dynamic changes of inositol lipid pools in living cells reveals a PKC-dependent PtdIns4P increase upon EGF and M3 receptor activation[J].Biochim Biophys Acta,2016,1861(3):177-187.
[2]李琳,吴清平,张菊梅,等.显色底物磷脂酰肌醇的化学法制备及应用[J].精细化工,2012,29(5):42-46.
[3]宋华,陈福明.柱层析法分离大豆磷脂[J].中国油脂,2005,30(2):41-43.
[4]Damnjanovic J,Lwasaki Y. Phospholipase D as a catalyst:application in phospholipid synthesis,molecular structure and protein engineering[J]. Biosci Bioeng,2013,116(3):271-280.
[5]邓启刚,齐红,安红.大豆肌醇磷脂的分离技术研究[J].化学工程师,2001,19(4):344-346.
[6]刘代成,安立国,陶务端,等.高纯度磷脂酰肌醇的制备方法[D].济南:山东师范大学,2005.
[7]Luo J,Xin T,Wang Y. A PEG bridged tertiary amine functionalized ionic liquid exhibiting thermoregulated reversible biphasic behavior with cyc1ohexane/isopropanol:Synthesis and application in Knoevenagel condensation[J].New Journal of Chemistry,2013,37(2):269-273.
[8]Alice Ci,Sebastian K,Katharina B.Surface-active ionic liquids in catalysis:Impact of structure and concentration on the aerobic oxidation of octanol in water[J].Journal of Colloid and Interface Science,2017,492:136-145.
[9]Martak J,Schlosser S. Extraction of lactic acid by phosphoniurn ionic liquids[J].Separation and Purification Technology,2007,57(3):483-494.
[10]Dietrich K,Marco Z,Volker H,et al. Applications and potential of ultrasonics in food processing[J]. Trends in Food Science and Technology,2004,15(5):261-266.
[11]邓小莉,吴羽晨,常景玲.超声辅助提取石榴皮中鞣花酸的研究[J].中国农学报,2016,32(28):195-199.
[12]张梦莹,赵玉娟,李倩竹,等.超声波辅助提取梅花鹿茸中磷脂的工艺研究[J].农产品加工,2014(4):28-31.
[13]张丽,殷燕.金枪鱼脑中磷脂及脂肪酸组成分析[J].粮食流通技术,2016(10):91-93.
[14]肖虹,周裔彬,尚岩岩,等.超声辅助提取鸡蛋卵磷脂的工艺研究[J].食品工业科技,2010,31(8):255-257.
[15]余祥英,王志祥,周黎明.超声波辅助提取大豆磷脂酰胆碱的研究[J].中国粮油学报,2010,25(7):26-29.
[16]刘玲娜.超声波辅助萃取菜籽磷脂酰胆碱的研究[D].郑州:河南工业大学,2010.
[17]吴平,安红,何锡凤,等.大豆肌醇磷脂制备优化条件的研究[J].中国油脂,2006,31(6):87-89.
[18]许雪磊.离子液体的合成及其在银杏黄酮分离纯化中的应用研究[D].长沙:中南大学,2014.
[19]龙金星,袁正求,马浩,等.碱性离子液体催化合成三羟甲基丙烷[J].物理化学报,2015,31(2):337-343.
[20]张敏,李梦耀,许小英,等.碱性离子液体催化大豆油制备生物柴油[J].应用化工,2015,44(8):1482-1484.
[21]韩磊,包桂蓉,王华,等.碱性离子液体[Bmim]OH催化菜籽油制备生物柴油[J].中国油脂,2010,35(8):47-50.
[22]Yi Y X,Shen Y,Sun J K,et al.Basic ionic liquids promoted the synthesis of glycerol 1,2-carbonate from glycerol[J]. Chinese Journal of Catalysis,2014,35(5):757-762.
Extractionofphosphatidylinositolbyionicliquidandultrasonicwavemethod
SONGFan-fan,ZHANGKang-yi*,YANGYan,YANGFan
(Institute of Agricultural Products Processing,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
TS229
B
1002-0306(2017)18-0155-05
2017-03-01
宋范范(1988-),女,硕士,研究方向:脂质化学,E-mail:495536703@qq.com。
*通讯作者:张康逸(1981-),男,博士,副研究员,研究方向:脂质化学,E-mail:kangyiz@163.com。
河南省农业科学院科研发展专项资金项目(YCY20167822);河南省科技开放合作项目(152106000054)。
10.13386/j.issn1002-0306.2017.18.030

