毛细管电泳法同时测定发酵制品中D-和L-乳酸含量
汪雪莲,於钊庆,朱 莉,张裕铃,何 进
(华中农业大学生命科学技术学院,湖北 武汉 430070)
毛细管电泳法同时测定发酵制品中D-和L-乳酸含量
汪雪莲,於钊庆,朱 莉,张裕铃,何 进*
(华中农业大学生命科学技术学院,湖北 武汉 430070)
发酵制品中的乳酸通常是D,L-混合型,而D-乳酸的每日摄入量是有限制的。因此开发准确测定发酵制品中D-和L-乳酸含量方法,对于控制食品品质、保障食品安全具有重要意义。建立了同时测定发酵制品中D-和L-乳酸含量的毛细管电泳分析方法,考察了2-羟丙基-β-环糊精浓度、缓冲溶液pH值、分离电压、分离温度等因素对乳酸手性分离的影响。结果表明,使用中性毛细管,以500 mmol·L-12-羟丙基-β-环糊精为手性选择剂,200 mmol·L-1磷酸缓冲液(pH值为6.0)为电泳缓冲液,在分离电压为-20 kV、分离温度为20 ℃条件下可使D-和L-乳酸达到基线分离,分离度为1.5。
毛细管电泳;手性分离;乳酸;D-乳酸;L-乳酸
Abstract:Usually,both D- and L-lactic acids exist in the fermentation products.But D-lactic acid intake should be limited.So,developing an accurate method for the determination of D- and L-lactic acids in fermentation products is very important for controlling food quality and guaranteeing food security.We established a capillary electrophoresis assay for the simultaneous determination of D- and L-lactic acids in fermentation products,and investigated the effects of 2-hydroxypropyl-β-cyclodextrin concentration,pH value of buffer solution,separation voltage,and separation temperature on the chiral separation of lactic acid.Results showed that D- and L-lactic acids reached the baseline separation,and the resolution was 1.5 under the conditions as follows: using neutral capillary,500 mmol·L-12-hydroxypropyl-β-cyclodextrin as a chiral selector, 200 mmol·L-1phosphate buffer (pH value 6.0) as electrophoretic buffer,separation voltage of -20 kV,and column temperature of 20 ℃.
Keywords:capillary electrophoresis;chiral separation;lactic acid;D-lactic acid;L-lactic acid
乳酸(lactic acid)又名α-羟基丙酸(α-hydroxypropionic acid),为世界上公认的3大有机酸之一,广泛存在于生物体中,是生物细胞厌氧糖代谢的重要产物。乳酸是最小的手性分子,具有L(+)和D(-)2种对映体。许多乳酸菌细胞内表达乳酸消旋酶(lactate racemase)能催化L-或D-乳酸转化为相反的对映体。乳酸消旋酶的存在使得最终发酵产物仍为D,L-混合型乳酸[1]。
人和动物体内存在L-乳酸脱氢酶,能代谢L-乳酸,因而L-乳酸在食品工业上用作酸味剂和防腐剂,与柠檬酸、苹果酸等食用酸相比具有很强的竞争力。但是人和动物体内并不存在D-乳酸脱氢酶,不能分解与代谢D-乳酸[2]。因此摄入过量的D,L-乳酸或D-乳酸会导致血液中D-乳酸积累,引起代谢紊乱,甚至出现酸中毒症状[3-4]。世界卫生组织(WHO)明确规定人体每天的D-乳酸摄入量不能超过100 mg·kg-1,而对L-乳酸摄入量则不加限制[5]。
因此,乳酸制品中不仅需要测定乳酸总量,还需要准确测定D-和L-乳酸的含量,这对于控制食品品质、提高食品安全具有重要意义。利用乳酸脱氢酶的酶分析法是检测乳酸对映体的简单方法,但该方法反应时间长,误差也较大[6]。色谱是最常用的分离技术,已经建立了许多拆分乳酸对映体的HPLC[6-11]与GC[12-13]方法,但均需要专一性的手性色谱柱。毛细管电泳(capillary electrophoresis,CE)具有快速、高效、灵敏及对环境污染小等优点。已经有许多研究者建立了血液与体液中拆分乳酸对映体的CE方法[14-15]。鉴于此,作者针对发酵制品,优化并建立了分析D-和L-乳酸的CE分析方法,为发酵制品中D-乳酸的控制提供了一种简便方法。同时,该方法可为筛选高产L-乳酸的乳酸菌提供直接的鉴定方法。
1 实验
1.1 材料、试剂与仪器
3种酸奶、1种泡菜,购于武汉市超市。
D-乳酸锂、L-乳酸锂,Sigma公司;2-羟丙基-β-环糊精,山东新大生物科技有限公司;乳酸(分析纯)、磷酸二氢钾、氢氧化钠、磷酸,国药集团化学试剂有限公司。
P/ACE MDQ型毛细管电泳仪、中性毛细管,Beckman Coulter 公司;S-320型pH计,Mettler Toledo公司;5415D型离心机,Eppendorf 公司。
1.2 方法
1.2.1 毛细管电泳条件
在涂层的中性毛细管(60 cm×50 μm)中,以2-羟丙基-β-环糊精(500 mmol·L-1)为手性选择剂;检测波长为200 nm,分离电压为-20 kV,柱温为20 ℃;压力进样(0.5 psi × 40 s);缓冲液经0.22 μm微孔滤膜过滤;每次运行前用双蒸水、1 mmol·L-1磷酸、双蒸水各洗5 min。
1.2.2 样品测定
配制80 mmol·L-1乳酸于-18 ℃保存,使用当天取出稀释10倍,离心(10 000×g、5 min)后加入样品管进行电泳。
酸奶、泡菜均稀释200倍,离心(10 000×g、5 min)后加入样品管进行电泳。
1.2.3 正交实验设计
在单因素实验基础上,为得到最佳的分离条件,设计正交实验如表1。
表1正交实验设计
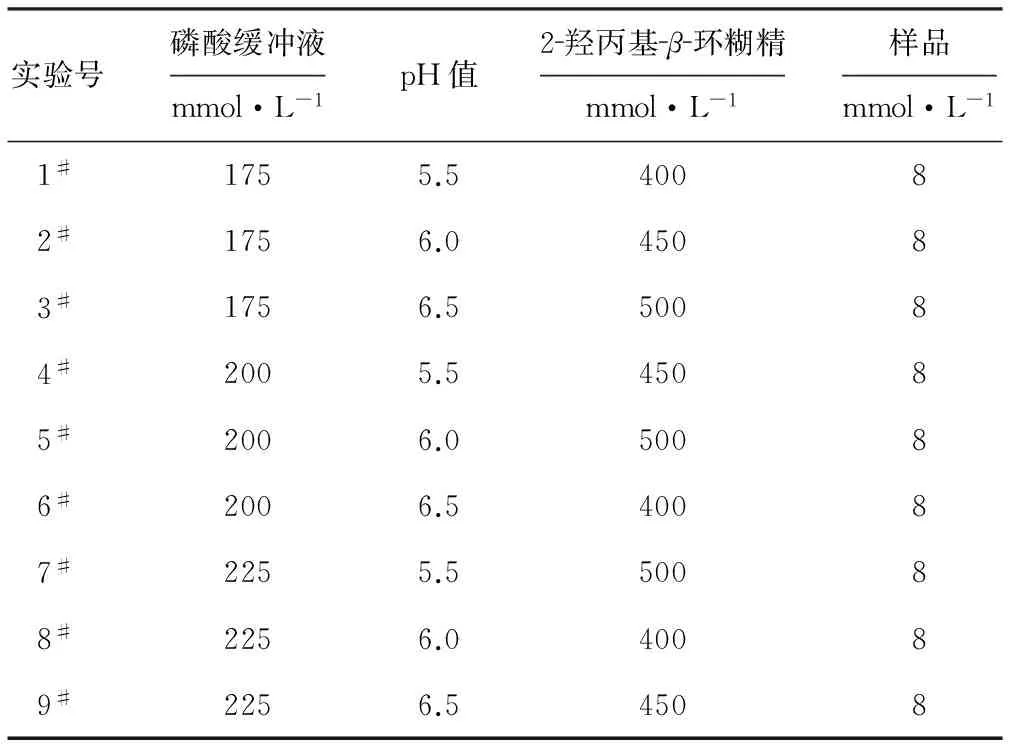
Tab.1 Design of orthogonal experiment
2 结果与讨论
2.1 手性选择剂
环糊精及其衍生物是最为常用的手性选择剂[16]。本实验比较了不同环糊精的效果,结果表明,2-羟丙基-β-环糊精可以成功拆分乳酸对映体。这可能是由2-羟丙基-β-环糊精的特殊结构所决定的,其羟丙基上的羟基自由度较高,恰好能与乳酸的手性碳——羧基α-位碳原子很好地结合[17]。
2.2 分离电压、分离温度对手性拆分的影响
毛细管内的温度影响分离度。温度低,涡流或振动能减弱,从而增强D-或L-乳酸与2-羟丙基-β-环糊精内部和边缘的结合力,提高手性选择剂对对映体的选择性[18]。在17.5~30 kV电压范围内,分离度随着电压的升高而升高,当电压为20 kV时分离度达到最大,而后随着电压的升高分离效果反而变差,这可能与焦耳热有关。综合考虑,选择分离温度为20 ℃,分离电压为-20 kV。
2.3 正交实验结果
在9种电泳缓冲液中,5#缓冲液(即pH值为6.0,磷酸缓冲液浓度为200 mmol·L-1,2-羟丙基-β-环糊精浓度为500 mmol·L-1)的分离度最大(Rs=1.5),已达基线分离(如图1)。而根据所得数据,用正交设计软件计算出的最优条件为:pH值6.0,磷酸缓冲液浓度225 mmol·L-1,2-羟丙基-β-环糊精浓度500 mmol·L-1。
进一步比较了这两种条件下的分离情况,结果表明5#缓冲液更利于分离。这说明考察的三因素之间可能还存在着交互作用,不能仅凭正交实验来确定最优条件。因此,确定以500 mmol·L-12-羟丙基-β-环糊精为手性选择剂,200 mmol·L-1磷酸缓冲液(pH值为6.0)为电泳缓冲液。

图1 乳酸的手性分离电泳图Fig.1 Chiral separation electrophoretogram of lactic acid
2.4 线性范围、检测限
配制浓度为0.1~10.0 mmol·L-1的乳酸系列标准溶液,在优化条件下进行电泳分离,以浓度为纵坐标、峰面积为横坐标绘制标准曲线,进行线性回归,线性关系见表2。
采用稀释法测得L-乳酸及D-乳酸的最低检测限分别为0.25 mmol·L-1和0.28 mmol·L-1。
2.5 重现性实验
以4 mmol·L-1乳酸溶液在优化条件下进行3次重复实验。结果表明,迁移时间和峰面积的相对标准偏差(RSD)分别小于1.0%和2.0%,表明该方法重现性好。
2.6 回收率
将乳酸配制成1.59 mmol·L-1的溶液,分别与1 mmol·L-1D-乳酸(1#)和1 mmol·L-1L-乳酸(2#)及水(3#)以1∶1的比例混合,测定回收率,结果见表3。
表2方法的线性关系与检测限
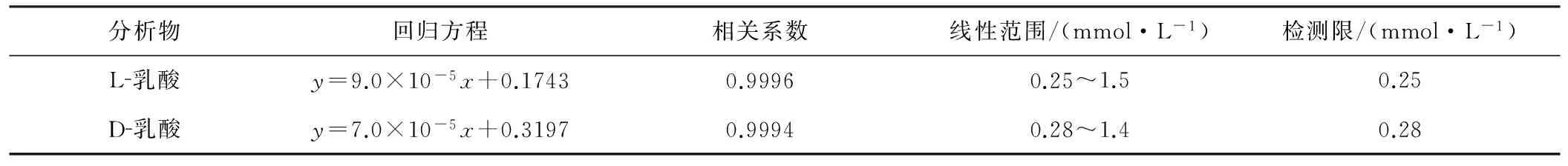
Tab.2 Linear relationship and detection limit of the method
表3乳酸的回收率
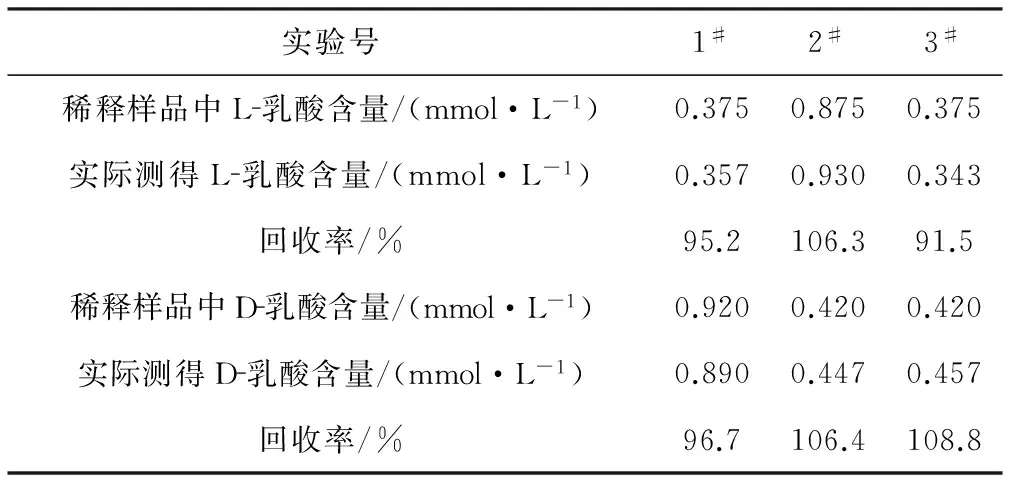
Tab.3 Recovery of lactic acid
由表3可知,L-乳酸和D-乳酸的回收率分别为91.5%~106.3%和96.7%~108.8%,表明该方法准确度好。
2.7 样品的测定
在被测定的4种发酵制品中,只有酸奶C同时检测出L-乳酸和D-乳酸,其它发酵制品只检测出L-乳酸。根据回归方程,计算出4种发酵制品中L-乳酸含量分别为:酸奶A 112 mmol·L-1、酸奶B 122 mmol·L-1、酸奶C 114 mmol·L-1、泡菜36 mmol·L-1,其中酸奶C中D-乳酸含量为42 mmol·L-1。
3 结论
建立了乳酸对映体的手性拆分毛细管电泳法,并达到基线分离。L-乳酸在0.25~1.5 mmol·L-1、D-乳酸在0.28~1.4 mmol·L-1范围内线性关系好,重现性好、准确度高,而且简便易操作,能连续自动地进行发酵制品中D-乳酸和L-乳酸的测定。
[1] XU T,WODRICH M D,SCOPELLITI R,et al.Nickel pincer model of the active site of lactate racemase involves ligand participation in hydride transfer[J].Proceedings of the National Academy of Sciences of the United States of America,2017,114(6):1242-1245.
[2] GIORGIO C,ANNAMARIA P,CARLO S,et al.A simple,sensitive and efficient assay for the determination of D- and L-lactic acid enantiomers in human plasma by high-performance liquid chromatography[J].Journal of Chromatography A,2011,1218(6):787-792.
[3] KOWLGI N G,CHHABRA L.D-lactic acidosis:an underrecognized complication of short bowel syndrome[J].Gastroenterology Research and Practice,2015:476215.doi:10.1155/2015/476215.
[4] URIBARRI J,OH M S,CARROLL H J.D-lactic acidosis:a review of clinical presentation,biochemical features,and pathophysiologic mechanisms[J].Medicine,1998,77(2):73-82.
[5] WEE Y J,KIM J N,RYU H W.Biotechnological production of lactic acid and its recent applications[J].Food Technology and Biotechnology,2006,44(2):163-172.
[6] EWASCHUK J B,ZELLO G A,NAYLOR J M,et al.Metabolic acidosis:separation methods and biological relevance of organic acids and lactic acid enantiomers[J].Journal of Chromatography B,2002,781(1/2):39-56.
[7] BUGLASS A L,LEE S H.Sequential analysis of malic acid and both enantiomers of lactic acid in wine using a high performance liquid chromatog raphic column-switching procedure[J].Journal of Chromatographic Science,2001,39(11):453-458.
[8] 白冬梅,赵学明,胡宗定.高效液相色谱法测定米根霉乳酸发酵液中乳酸的光学纯度[J].色谱,2001,19(1):13-15.
[9] 黎婕,刘冬梅,冯细漫.几种泡菜中的乳酸两种手性对映体和亚硝酸盐的测定[J].食品研究与开发,2010,31(12):129-133.
[10] 何悦铭,王杉,揭琴丰,等.手性色谱法测定L-乳酸锌[J].食品科学,2015,36(14):107-110.
[11] 孙晶,朱学伸,王苑,等.食品中L-乳酸检测方法及其研究进展[J].安徽农业科学,2010,38(31):17801-17802,17805.
[12] BETSCHINGER F,LIBMAN J,SHAZER A.Gas chromatographic enantiomer separation on a chiral self associating selector[J].Journal o f Chromatography A,1996,746(1):53-62
[13] 常影,邱静,魏吉安,等.衍生化气相色谱法检测瘤胃液和青贮液中乳酸对映体和挥发酸[J].中国农业大学学报,2006,11(2):49-53.
[14] 王羽,葛卫红.高效毛细管电泳法同时测定人血浆D,L-乳酸对映体[J].中国药科大学学报,2007,38(5):412-414.
[15] SAAVEDRA L,BARBAS C.Optimization of the separation lactic acid enantiomers in body fluids by capillary electrophoresis[J].Journal of Chromatography B,2002,766(2):235-24
[16] 李德茂,李从发,刘四新,等.苯基乳酸的手性毛细管电泳拆分[J].色谱,2004,22(3):281-283.
[17] CLOHS L,MCERLANE K M.Development of a capillary electrophoresis assay for the determination of carvedilol enantiomers in serum using cyclodextrins[J].Journal of Pharmaceutical and Biomedical Analysis,2001,24:545-554.
[18] KODAMA S,YAMAMOTO A,MATSUNAGE A,et al.Direct chiral resolution of lactic acid in food product by capillary electrophoresis[J].Journal of Chromatography A,2000,875(1/2):371-377.
SimultaneousDeterminationofD-andL-LacticAcidsbyCapillaryElectrophoresis
WANG Xue-lian,YU Zhao-qing,ZHU Li,ZHANG Yu-ling,HE Jin*
(CollegeofLifeScienceandTechnology,HuanzhongAgriculturalUniversity,Wuhan430070,China)
O657.8
A
1672-5425(2017)09-0064-03
中央高校基本科研业务费专项资金项目(HZAU:2662017PY112)
2017-06-13
汪雪莲(1986-),女,湖北宜昌人,硕士研究生,研究方向:微生物学与生物信息学,E-mail:wangxuelian1215@163.com;通讯作者:何进,教授,E-mail:hejin@mail.hzau.edu.cn。
10.3969/j.issn.1672-5425.2017.09.014
汪雪莲,於钊庆,朱莉,等.毛细管电泳法同时测定发酵制品中D-和L-乳酸含量[J].化学与生物工程,2017,34(9):64-66,70.

