木质素磺酸镁对不同纤维素原料酶解的影响机制
任继巍,刘蕾,钱子俊,张一瞳,欧阳嘉,3
木质素磺酸镁对不同纤维素原料酶解的影响机制
任继巍1,刘蕾2,钱子俊1,张一瞳2,欧阳嘉2,3
(1南京林业大学林学院,江苏南京 210037;2南京林业大学化学工程学院,江苏南京210037;3林木遗传与生物技术省部共建教育部重点实验室,江苏南京 210037)
为探讨木质素磺酸镁作为辅助添加剂在纤维原料酶解过程的作用机制,以两种木质素磺酸镁为研究对象,考察了不同来源木质素磺酸镁组构差异及其在不同纤维原料酶解过程中的作用。研究发现,商品木质素磺酸镁较自制木质素磺酸镁具有更高的磺化度,但自制木质素磺酸镁具有更高总羟基相对含量。商品木质素磺酸镁和自制木质素磺酸镁对微晶纤维素酶解均有促进作用;对于木质纤维原料酶解,两种木质素磺酸镁对水热法预处理物料均有抑制作用。对亚硫酸氢镁预处理物料酶解,仅低浓度的自制木质素磺酸镁表现出促进作用。该研究为解释木质素磺酸镁对纤维素原料酶解的影响机制提供了理论依据。
木质素磺酸镁;纤维素;酶解;表面活性剂;生物质;生物乙醇
引 言
木质纤维资源是地球上最丰富的可再生资源之一。利用木质纤维资源炼制生物乙醇因具有清洁、可再生等优点,被认为具有潜在应用前景[1-3],但木质纤维资源制备乙醇通常需要经过预处理、酶解和发酵等步骤[4]。其中,酶解通常被认为是制约乙醇产率的关键步骤[5]。提高酶解效率的方式有很多,如开发高效预处理方式、提高酶用量等[6],但是上述方式通常成本较高,而表面活性剂近年来被发现不仅可以促进酶解,而且价格低廉[7-8]。基于此,开展表面活性辅助促进酶解技术的研究有利于低成本下提高酶解效率,实现资源的最大化利用。
表面活性剂分为非离子型和离子型[8-9]。早期研究认为,非离子型表面活性剂,如吐温、PEG系列,对酶解的促进作用更为明显[10],主要因为其减少了纤维素酶对木质素的非产物性吸附[11-13]。但是近年来,有研究学者发现离子型表面活性剂对酶解也有明显促进作用,如木质素磺酸盐[14]。研究发现,酶解过程添加木质素磺酸盐显著地提高了葡萄糖转化率[15]。进一步研究表明,木质素磺酸盐对酶解的作用受木质素磺酸盐性质及底物性质影响。Lou 等[16]研究发现低分子量、高磺化度的木质素磺酸盐对酶解的促进作用更显著。Wang等[17]发现木质素磺酸盐对纯纤维素酶解存在抑制作用,但对木质纤维原料酶解有促进作用。基于此,木质素磺酸盐对酶解的作用越来越受到关注,但是其作用机制至今没有明确的定论,作用效果也存在较大差异,以往报道多集中于单一来源木质素对物料酶解效果的影响,并未从木质素磺酸盐本身结构性质特点和底物结构特点两个方面综合比较和考虑木质素磺酸盐对纤维素酶解的影响机制。
本文首先对两种不同来源的木质素磺酸镁进行性能表征,在此基础上考察了两种木质素磺酸镁对纯纤维素和不同木质纤维原料酶解的影响效果,探讨了木质素磺酸镁对酶解的作用机制,以期为提高木质纤维原料高效酶解糖化提供新的思路。
1 材料和方法
1.1 原料
亚硫酸氢镁预处理麦秆制备:采用实验室油浴蒸煮器(YGR2-10×1.25, 南京杰正科技发展有限公司)作为预处理反应器。称取麦秆50 g(绝干)置于1 L油浴罐中,按照固液比(质量体积比)1:6,亚硫酸氢镁用量35.1 g·L-1,亚硫酸镁:亚硫酸(质量体积比)1:4。预处理温度170℃,保温40 min。保温结束将蒸煮罐立即取出,放入冷水中冷却至室温,打开。固液分离,固体部分用蒸馏水洗至中性得亚硫酸氢镁预处理麦秆,于4℃冰箱平衡水分。
水热法预处理麦秆制备:采用实验室油浴蒸煮器作为预处理反应器。称取麦秆50 g(绝干)置于1 L油浴罐中,按照固液比(质量体积比)1:10加入蒸馏水。预处理温度170℃,保温60 min。保温结束将蒸煮罐立即取出,放入冷水中冷却至室温,打开。固液分离,固体部分用蒸馏水洗至中性得水热法预处理麦秆,于4℃冰箱平衡水分。
微晶纤维素(Avicel PH 101),粒径小于50 μm,购自上海Sigma-Aldrich。
1.2 试剂
商品纤维素酶(Cellic® CTec2,CTec 2),由诺维信(北京)提供;商品木质素磺酸镁(commercial magnesium lignosulfonate,CML),购自江苏新沂飞皇化工有限公司,木质素磺酸镁含量为57%,还原物含量10%,有机酸含量20%,水分含量13%;自制木质素磺酸镁(ML),亚硫酸氢镁预处理麦秆废液直接喷雾干燥制得,其中木质素磺酸镁含量为51%,还原物含量为23%,有机酸含量15%,水分含量11%。亚硫酸氢镁预处理条件见1.1;亚硫酸,ACS reagent≥6%,购自上海Sigma-Aldrich;亚硫酸钠,六水合氯化镁,一水合柠檬酸,均为分析纯,购自国药集团化学试剂有限公司;氢氧化钠,分析纯,购自南京化学试剂有限公司。
1.3 酶解实验
以麦秆或者微晶纤维素为底物,底物浓度30 g·L-1(以纤维素含量计),CTec2酶用量15 FPU·(g 纤维素)-1的条件下,添加不同浓度的木质素磺酸镁,0.05 mol·L-1柠檬酸缓冲液使酶解体系pH为4.8, 150 r·min-1,50℃下酶解48 h。酶解结束沸水浴灭活5 min,离心,稀释适当倍数,生物传感器分析仪(山东省科学院生物研究所)分析酶解液中葡萄糖含量。葡萄糖得率计算公式如下

式中,1.1为纤维素到葡萄糖的转换系数。
1.4 木质素磺酸盐对纤维素的吸附实验
以麦秆或者微晶纤维素为底物,底物浓度30 g·L-1(以纤维素含量计),无CTec2添加,添加不同浓度的木质素磺酸镁(0、2、8 g·L-1),0.05 mol·L-1柠檬酸缓冲液使酶解体系pH为4.8,150 r·min-1,50℃下振荡1 h。振荡结束立即取出,10000 r·min-1离心5 min。取上清,稀释适当倍数,于紫外分光光度计280 nm下测定吸光度,换算后即为游离木质素磺酸镁含量。
1.5 元素分析
样品中的NCHS元素含量在Elementarvario EL cube元素分析仪(德国Elemantar公司)上测定。样品元素测定前烘干水分,粉碎至840 μm以下。准确称取样品5 mg于锡舟,包样,将包好的样品精确称量至0.1 mg,记录质量数据后放入进样盘中进行测定。
1.6 磺酸基团含量分析
木质素磺酸镁经过阴阳离子交换树脂纯化,采用电导滴定法测定磺酸基团含量[18]。
1.7 木质素磺酸镁含量测定
木质素磺酸镁含量测定参考Wang等[17]的 方法。
1.8 FT-IR分析
使用傅里叶变换红外光谱仪(VERTEX 80,德国Bruker)分析木质素磺酸镁的化学结构特征。取小于74 μm的木质素磺酸镁粉末,并在105℃下烘至绝干。采用KBr压片法,木质素磺酸镁和KBr的比例为1:50。扫描范围4000~400 cm-1,分辨率为2.0 cm-1。得到的FT-IR谱图使用Origin 8.5科学作图软件处理。
2 结果与讨论
2.1 不同来源木质素磺酸镁的性能表征
不同来源木质素磺酸镁在溶解性、基团、分子量、磺化度等性质上往往具有一定差异[19],木质素磺酸镁在酶解过程中的表现可能会受这些性能的影响。基于此,首先利用FT-IR及元素分析仪对来源于芦苇亚硫酸盐制浆工艺副产品的木质素磺酸镁(CML)和来源于亚硫酸氢镁预处理麦秆废液喷雾干燥制得的木质素磺酸镁(ML)进行性能表征。
2.1.1 FT-IR分析 FT-IR分析不同来源的木质素磺酸镁分子基团,不同来源木质素磺酸镁的FT-IR谱图见图1。CML的1045 cm-1处吸收峰明显、稳定,因此以此峰为参照峰。CML和ML具有基本一致吸收峰。1517、1428 cm-1处是木质素苯环的收缩振动吸收峰,说明CML和ML具有木质素典型特征[20];1328 cm-1代表紫丁香基团的CO伸缩振 动[21];1045 cm-1为磺酸基和烷基醚键振动的混合特征吸收峰[22],CML较ML吸收强度增加;另外,ML在1715 cm-1处的非共轭羧基吸收峰明显,CML在此处基本无吸收[23];CML在836 cm-1处有更为明显的紫丁香基团CH弯曲[24],而ML在此处则没有吸收峰,这些结果反映出不同来源木质素磺酸镁在化学结构上存在一些差异。

表1 不同来源木质素磺酸镁元素及磺酸基团含量分析

图1 不同来源木质素磺酸镁FT-IR谱图

图2 添加不同来源木质素磺酸镁对微晶纤维素酶解的影响
2.1.2 元素及磺化度分析 木质素磺酸镁是由愈创木基、紫丁香基与对羟基苯丙烷3种结构单元构成具有疏水骨架的网络结构[25]。分子中大量存在的磺酸基团和羟基等亲水基团使其具有良好的分散、吸附和表面活性[26],分别对两种木质素磺酸镁进行了元素分析、磺酸基和羟基含量测定,结果见表1。
由表1可以看出,两种来源的木质素磺酸镁其N、C、H含量接近说明主体元素组成一致;S元素基本都来自于木质素磺酸镁中的磺酸基团[26],CML和 ML的S含量分别为9.62%和8.09%,可推测CML具有更多的磺酸基团。进一步测定磺酸基含量证实商品木质素磺酸镁较自制木质素磺酸镁具有更高的磺化度,CML和ML磺酸基含量分别为0.75和0.51 mmol·g-1。采用FC法测定羟基含量[27],表1显示,CML具有更高的羟基含量。
2.2 木质素磺酸镁对微晶纤维素酶解的影响
为了研究不同来源木质素磺酸镁对纤维原料酶解的影响,首先探讨了不同来源木质素磺酸镁对微晶纤维素酶解的辅助作用。图2为添加不同浓度的CML或ML酶解48 h的实验结果。
由图2(a)可以看出,添加CML可以明显提高微晶纤维素的酶解效率。添加1 g·L-1CML48h酶解得率达到71.55%,较未添加提高了10.42%;继续提高CML添加量至4 g·L-1时,葡萄糖得率达到最大值74.25%,较未添加CML的实验组提高了14.58%;但是过高浓度CML的存在不利于酶解,CML浓度为8 g·L-1时,酶解得率为72%,较最大得率略有下降,这与Wang等[28]结果一致。图2(b)为添加ML后酶解48 h的实验结果。ML对微晶 纤维素酶解的作用规律与添加CML基本相似。ML添加量提高到4 g·L-1时酶解得率达到最大为71.55%,较对照组提高了12.77%,ML添加量为8 g·L-1时,葡萄糖得率明显下降,仅为54.45%。在微晶纤维素水解体系,CML对酶解促进作用较ML更显著,而ML在较高浓度下表现出比CML更强的抑制作用。
2.3 木质素磺酸镁对水热法预处理麦秆酶解的影响
为进一步探讨木质素磺酸镁对木质纤维物料酶解的作用,设计以水热法预处理的麦秆为底物,添加不同量CML或ML(0、1、2、4、8 g·L-1),分析其对酶解的作用。
分析水热法预处理麦秆可知(表2),水热法预处理麦秆是一种高木质素含量的底物。半纤维素在高温高压热水下溶出后,预处理麦秆纤维素含量为50.81%,半纤维素含量仅为12.83%,而木质素含量高达26.34%。木质素磺酸镁对水热法预处理麦秆酶解的影响如图3所示,与微晶纤维素相比,水热法预处理麦秆酶解效率较低,48 h酶解得率为43.78%。两种木质素磺酸镁添加后对酶解均出现一定的抑制效果,其中磺酸基含量较低的ML表现更为明显。当ML添加量增加至8 g·L-1时,酶解得率降至37.95%,较空白对照组下降了13.32%。

表2 麦秆组分分析
2.4 木质素磺酸镁对亚硫酸氢镁预处理麦秆酶解的影响
亚硫酸氢镁预处理技术是近年由本实验室发展的木质纤维原料预处理方法,采用本方法过程由于预处理去除了大量的半纤维素和木质素,预处理原料具有良好的酶解效率[29]。分析亚硫酸氢镁预处理麦秆组分(表2)可知预处理麦秆纤维素含量可达68.43%,而半纤维素和木质素含量较少,仅为9.99%和11.17%。选择木质素含量较少的亚硫酸氢镁预处理麦秆为原料,酶解过程中添加不同量CML或者ML(0、1、2、4、8 g·L-1),分析其对酶解的作用,结果如图4。
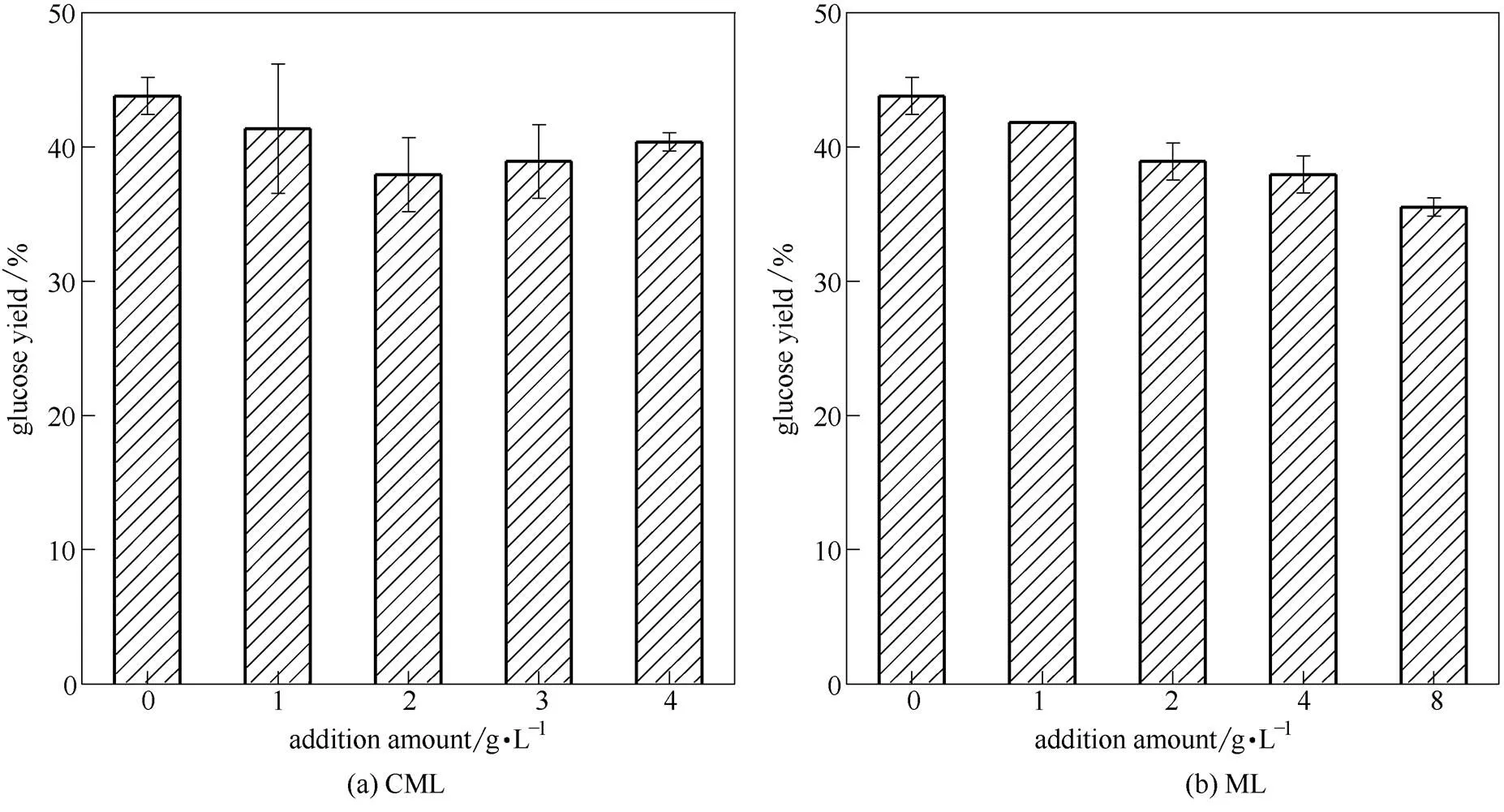
图3 添加不同来源木质素磺酸镁对水热法预处理麦秆酶解的影响
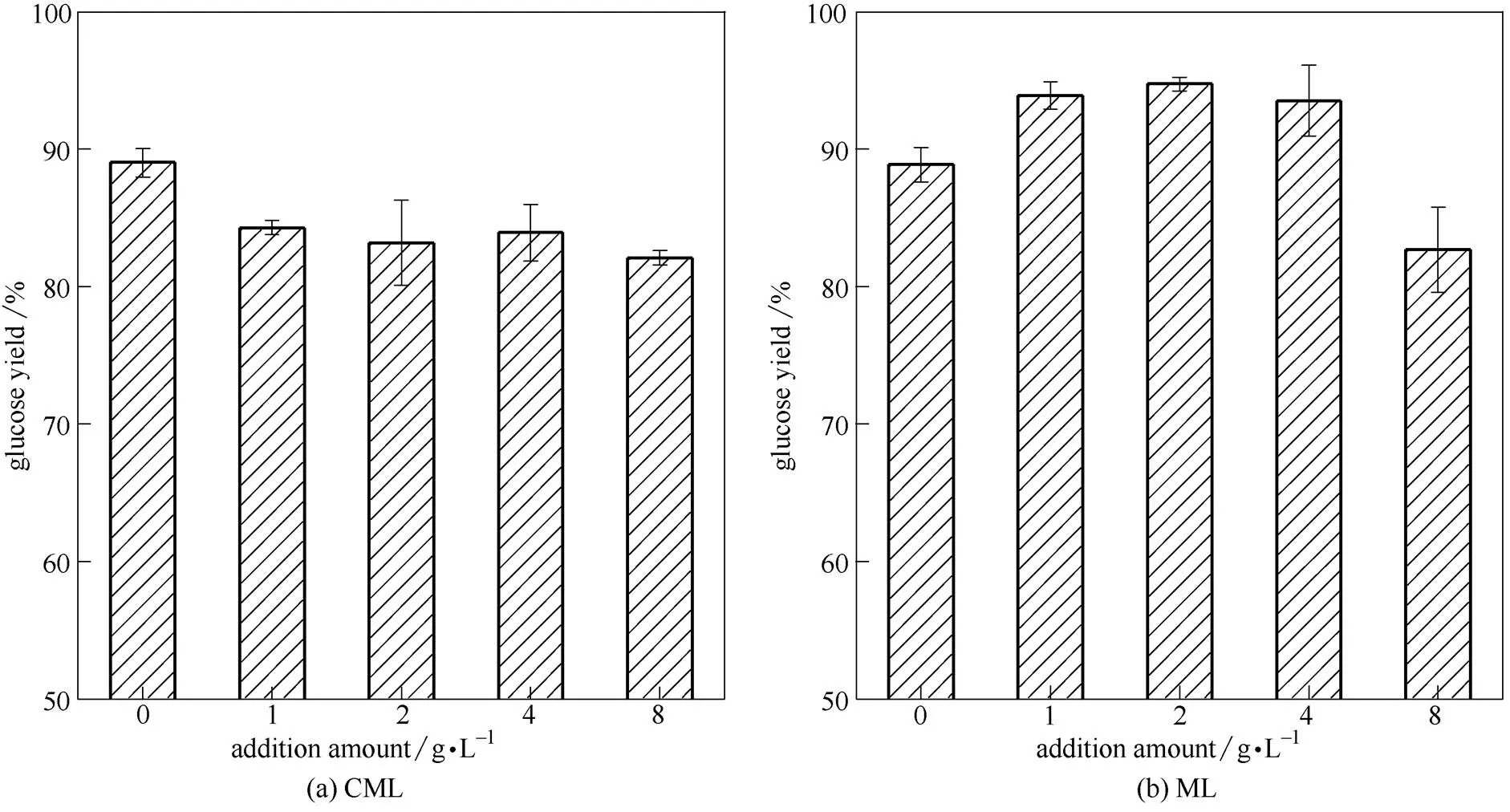
图4 添加不同来源木质素磺酸镁对亚硫酸氢镁预处理麦秆酶解的影响
CML和ML对亚硫酸氢镁预处理麦秆酶解的影响呈现出截然不同的作用规律。亚硫酸氢镁预处理麦秆是一种容易酶解的纤维素底物,48 h酶解得率为89.03%,添加CML会一定程度抑制亚硫酸氢镁预处理麦秆的酶解。添加1 g·L-1时酶解得率降至84.28%,添加量为8 g·L-1时酶解得率仅为82.09%,添加ML呈现出与微晶纤维素酶解类似的规律。较低浓度ML对酶解有明显的促进作用,添加量为2 g·L-1时,酶解得率为94.74%,较未添加提高了5.55%,但是添加量为8 g·L-1时,葡萄糖得率仅 为82.70%。

表3 CML和ML对各种底物的吸附
Note: Data are concentration of mangnesium lignosulfonate in supernatant.
2.5 机制解析
上述研究结果显示不同木质素磺酸镁对不同纤维原料酶解发挥的作用是不同的。对于纯纤维素底物,木质素磺酸盐对酶解的作用是通过有效形成纤维素酶-木质素盐聚集体实现的[11],本实验中两种木质素磺酸盐对酶解的影响均随浓度出现先上升后下降的趋势,分析认为木质素磺酸盐较好的两亲性有利于增强酶与纤维素底物的吸附从而促进酶解,而在较高浓度下会由于过多羟基存在容易在聚集体间产生架桥作用从而不利于酶和纯纤维素的吸附[30-31],间接抑制水解。
对于含有木质素的天然纤维原料底物,为揭示木质素磺酸盐对酶解的作用机制,在底物溶液中添加不同量的木质素磺酸盐考察木质素磺酸盐对底物的作用,结果见表3。当加入相同量木质素磺酸盐时,上清液中ML的量均低于CML表明磺化度较低的ML更有利于与物料的吸附,揭示过高的磺化度并不利于物料的吸附[11]。对两种含木质素物料,木质素含量高的热水法预处理麦秆对木质素磺酸盐的吸附作用更强,说明木质素磺酸盐与底物中木质素发生了疏水性吸附[12]。但对比酶解数据发现,木质素磺酸盐与含木质素底物的吸附似乎并不利于酶解,木质素磺酸盐对于吸附力较强的热水法预处理麦秆均有抑制作用,而对于亚硫酸氢镁预处理麦秆吸附作用是相同的,磺化度较低的ML有较强的促进作用。基于以上结论,认为在含木质素底物酶解过程,木质素磺酸镁有两个去向:一部分木质素磺酸镁与底物发生疏水性吸附从而使物料带有一定的负电荷和亲水性,另一部分木质素磺酸镁和酶形成纤维素酶-木质素磺酸镁(Cel-ML)复合体,也带负电。当磺化度较低时物料亲水性占主导从而促进纤维素酶的吸附加强酶解,但磺化度较高时物料与酶复合体易形成静电排斥不利于酶与底物的吸附,从而抑制了酶解。
3 结 论
(1)通过FTIR和元素分析发现,CML和ML在组构上存在一定差异。CML中具有更高的S含量和磺化度,但ML具有更高的总羟基相对含量。
(2)低浓度CML和ML对微晶纤维素酶解均有促进作用,且CML的促进作用更强。
(3)当木质素磺酸镁添加到木质纤维原料中,对水热法预处理麦秆酶解均表现出抑制作用; CML对亚硫酸氢镁预处理麦秆酶解有抑制作用,但较低浓度ML对亚硫酸氢镁预处理麦秆酶解有明显促进作用。
(4)木质素磺酸镁对酶解的影响与其磺化度、羟基含量及物料本身木质素含量有关。对于纯纤维素底物,木质素磺酸盐较好的两亲性增强了酶与纤维素底物的吸附从而促进酶解,但过高浓度,羟基积累,形成架桥作用不利于酶解。对于木质纤维原料,木质素磺酸镁有两个去向:一部分木质素磺酸镁与底物发生疏水性吸附,另一部分木质素磺酸镁和酶形成纤维素酶-木质素磺酸镁(Cel-ML)复合体。当磺化度较低时物料亲水性占主导从而促进纤维素酶的吸附加强酶解,但磺化度较高时物料与酶复合体易形成静电排斥不利于酶与底物的吸附,从而抑制了酶解。
References
[1] KHOO H H. Review of bio-conversion pathways of lignocellulose-to-ethanol: sustainability assessment based on land footprint projections [J]. Renewable and Sustainable Energy Reviews, 2015, 46: 100-119.
[2] MANZETTI S, ANDERSEN O. A review of emission products from bioethanol and its blends with gasoline. Background for new guidelines for emission control [J]. Fuel, 2015, 14: 293-301.
[3] CHEN H, ZHAO J, HU T,. A comparison of several organosolv pretreatments for improving the enzymatic hydrolysis of wheat straw: substrate digestibility, fermentability and structural features [J]. Applied Energy, 2015, 150: 224-232.
[4] WAHLSTR M R M, SUURN KKI A. Enzymatic hydrolysis of lignocellulosic polysaccharides in the presence of ionic liquids [J]. Green Chemistry, 2015, 17 (2): 694-714.
[5] KHARE S K, PANDEY A, LARROCHE C. Current perspectives in enzymatic saccharification of lignocellulosic biomass [J]. Biochemical Engineering Journal, 2015, 102: 38-44.
[6] ALVIRA P, TOMAS-PEJO E, BALLESTEROS M,. Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis: a review [J]. Bioresource Technology, 2010, 101 (13): 4851-4861.
[7] ZHANG H, YE G, WEI Y,Enhanced enzymatic hydrolysis of sugarcane bagasse with ferric chloride pretreatment and surfactant [J]. Bioresource Technology, 2017, 229: 96.
[8] MENEGOL D, SCHOLL A L, FONTANA R C,. Increased release of fermentable sugars from elephant grass by enzymatic hydrolysis in the presence of surfactants [J]. Energy Conversion and Management, 2014, 88: 1252-1256.
[9] LIN X, CAI C, LOU H,. Effect of cationic surfactant cetyltrimethylammonium bromide on the enzymatic hydrolysis of cellulose [J]. Cellulose,2017, 24 (1): 61-68.
[10] TU M, SADDLER J N. Potential enzyme cost reduction with the addition of surfactant during the hydrolysis of pretreated softwood [J]. Applied Biochemistry and Biotechnology, 2010, 161 (1-8): 274-287.
[11] SIPOS B, SZIL GYI M, SEBESTY N Z,. Mechanism of the positive effect of poly(ethylene glycol) addition in enzymatic hydrolysis of steam pretreated lignocelluloses [J]. Comptes Rendus Biologies, 2011, 334 (11): 812-823.
[12] ALKASRAWI M, ERIKSSON T, B RJESSON J,. The effect of Tween-20 on simultaneous saccharification and fermentation of softwood to ethanol [J]. Enzyme and Microbial Technology, 2003, 33 (1): 71-78.
[13] 姚兰, 赵建, 谢益民, 等. 木质素结构以及表面活性剂对木质素吸附纤维素酶的影响 [J]. 化工学报, 2012, 63 (8): 2612-2616.YAO L, ZHAO J, XIE Y M,. Effect of lignin structure and surfactant on cellulase adsorption by lignin [J].CIESC Journal, 2012, 63 (8): 2612-2616.
[14] LIN X L, QIU X Q, LOU H M,. Enhancement of lignosulfonate-based polyoxyethylene ether on enzymatic hydrolysis of lignocelluloses [J]. Industrial Crops and Products, 2016, 80: 86-92.
[15] WANG Z, ZHU J Y, FU Y,. Lignosulfonate-mediated cellulase adsorption: enhanced enzymatic saccharification of lignocellulose through weakening nonproductive binding to lignin [J]. Biotechnology for Biofuels, 2013, 6 (1): 156.
[16] LOU H, ZHOU H, LI X,. Understanding the effects of lignosulfonate on enzymatic saccharification of pure cellulose [J]. Cellulose, 2014, 21 (3): 1351-1359.
[17] WANG Z, LAN T, ZHU J. Lignosulfonate and elevated pH can enhance enzymatic saccharification of lignocelluloses [J]. Biotechnology for Biofuels, 2013, 6 (1): 1-11.
[18] 庞煜霞, 杨东杰, 邱学青, 等. 木质素磺酸盐磺化度测定方法的改进 [J]. 中华纸业, 2006, 27 (11): 38-40.Pang Y X, Yang D J, Qiu X Q,. An improvement on the measuring method of the sulphonation degree of lignosulfonate [J]. China Pulp and Paper Industry, 2006, 27 (11): 38-40.
[19] 周明松, 邱学青, 杨东杰, 等. 不同来源木质素磺酸钠的结构特征及用作水煤浆分散剂 [J]. 化工学报, 2006, 57 (10): 2445-2449.ZHOU M S, QIU X Q, YANG D J,. Molecular structure of sodium lignosulphonate from different materials and their properties as dispersant of coal water slurry [J]. Journal of Chemical Industry and Engineering (China), 2006,57 (10): 2445-2449.
[20] DONOHOE B S, DECKER S R, TUCKER M P,. Visualizing lignin coalescence and migration through maize cell walls following thermochemical pretreatment [J]. Biotechnology and Bioengineering, 2008, 101 (5): 913–925.
[21] WANG S R, LIN H Z, RU B,Comparison of the pyrolysis behavior of pyrolytic lignin and milled wood lignin by using TG-FTIR analysis [J]. Journal of Analytical and Applied Pyrolysis, 2014, 108 (7): 78-85.
[22] SARKANEN K V, LUDWIG C H. Lignins: Occurrence, Formation, Structure and Reactions [M]. Wiley-Interscience, 1971.
[23] 郑大锋, 邱学青, 楼宏铭, 等. 不同相对分子质量木质素磺酸钙在盾构砂浆中的应用 [J]. 化工学报, 2007, 58 (9): 2382-2387. ZHENG D F, QIU X Q, LOU H M,. Utilization of calcium lignosulfonate with different molecular masses in mortar for shield tunneling method [J]. Journal of Chemical Industry and Engineering (China), 2007, 58 (9): 2382-2387.
[24] CHANG G Y, KIM H, LU F,. Understanding the physicochemical characteristics and the improved enzymatic saccharification of corn stover pretreated with aqueous and gaseous ammonia [J]. BioEnergy Research, 2016, 9 (1): 1-10.
[25] PEREIRA S R, PORTUGAL-NUNES D J, EVTUGUIN D V,. Advances in ethanol production from hardwood spent sulphite liquors [J]. Process Biochemistry, 2013, 48 (2): 272-282.
[26] ZHOU H, LOU H, YANG D,Lignosulfonate to enhance enzymatic saccharification of lignocelluloses: role of molecular weight and substrate lignin [J]. Industrial and Engineering Chemistry Research, 2013, 52 (25): 8464-8470.
[27] ZHOU H F, YANG D J, WU X L,Structure and adsorption characterization of sodium lignosulfonate by laccase modification [J]. Chemical Journal of Chinese Universities, 2013, 34 (1): 218-224.
[28] WANG W, ZHU Y, DU J,. Influence of lignin addition on the enzymatic digestibility of pretreated lignocellulosic biomasses [J]. Bioresource Technology, 2015, 181: 7-12.
[29] YU H, REN J, LIU L,A new magnesium bisulfite pretreatment (MBSP) development for bio-ethanol production from corn stover [J]. Bioresource Technology, 2016, 199:188-193.
[30] AISYAH I S, MURSHED M F, NORLI I. Influence of different treatment condition on biopolymer yield production for coagulation- flocculation process [J]. IOP Conf. Series: Materials Science and Engineering, 2016, 133 (1): 012027.
[31] WANG Q, LIU S, YANG G,. Cationic polyacrylamide enhancing cellulase treatment efficiency of hardwood kraft-based dissolving pulp [J]. Bioresource Technology, 2015, 183: 42-46.
Influence mechanism of magnesium lignosulfonates on enzymatic hydrolysis of different cellulose materials
REN Jiwei1, LIU Lei2, QIAN Zijun1, ZHANG Yitong2, OUYANG Jia2,3
(1College of Forestry, Nanjing Forestry University,Nanjing 210037, Jiangsu,China;2College of Chemical Engineering, Nanjing Forestry University,Nanjing 210037,Jiangsu,China;3Key Laboratory of Forest Genetics and Biotechnology of Ministry of Education, Nanjing Forestry University, Nanjing 210037,Jiangsu,China)
In order to investigate the influence mechanism of magnesium lignosulfonates as assisted additives on enzymatic of cellulose hydrolysis, two kinds of magnesium lignosulfonates from different materials were selected to study the fabric differences and influences on enzymatic hydrolysis of different lignocellulose materials. It could be found that commercial magnesium lignosulfonate had higher sulfonation degree than homemade magnesium lignosulfonate, but ML had higher total hydroxy related content. Both commercial magnesium lignosulfonate and homemade magnesium lignosulfonate could enhance the enzymatic hydrolysis of Avicel. For enzymatic hydrolysis of lignocellulose material, two kinds of lignosulfonates showed inhibit influences on wheat straw pretreated by liquid hot water pretreatment. Only low concentration homemade magnesium lignosulfonate indicated the positive influence on wheat straw pretreated by magnesium bisulfite pretreatment. This study provided the theoretical references for explanation on influence mechanism of magnesium lignosulfonates on enzymatic hydrolysis.
magnesium lignosulfonate; cellulose; enzymatic hydrolysis; surfactants; biomass; biofuel
10.11949/j.issn.0438-1157.20170170
TQ 353.6
A
0438—1157(2017)08—3275—07
欧阳嘉。第一作者:任继巍(1991—),男,硕士研究生。
国家自然科学基金项目(51561145015);江苏省高校自然科学研究重大项目(16KJA220004);江苏省高校优势学科建设工程资助项目(PAPD)。
2017-02-22收到初稿,2017-04-23收到修改稿。
2017-02-22.
Prof. OUYANG Jia, hgouyj@njfu.edu.cn
supported by the National Natural Science Foundation of China (51561145015), the Major Natural Science Research Program of Jiangsu Higher Education Institutions (16KJA220004) and the Priority Academic Program Development of Jiangsu Higher Education Institutions (PAPD).

