从福寿螺卵中提取虾青素的研究
华 杰,张玉琪,朱 娇,王 清,雷键政
(湖南理工学院 化学化工学院,湖南 岳阳 414006 )
从福寿螺卵中提取虾青素的研究
华 杰,张玉琪,朱 娇,王 清,雷键政
(湖南理工学院 化学化工学院,湖南 岳阳 414006 )
研究福寿螺卵中虾青素的溶剂浸取方法,运用正交实验法对福寿螺卵中虾青素的浸取条件进行了优化,在最优浸取条件下,虾青素的收率达0.058%; 采用制备型液相色谱仪分离提纯虾青素,对螺卵虾青素进行了定性分析,推断该来源的虾青素为左旋型(3S,3’S); 探索了两种大孔树脂吸附虾青素的规律,实验发现AB-8树脂的吸附平衡时间为3h,吸附率可达94.2%,适用于螺卵虾青素的大规模工业分离提纯.
福寿螺卵; 虾青素; 大孔树脂; 制备色谱
Abstract: The extraction of astaxanthin from apple snail eggs by solvent leaching was studied,and an orthogonal array design was used to optimize the leaching process.Under the optimum conditions,the recovery of astaxanthin was 0.058%.The obtained crude astaxanthin was further purified by preparative high performance liquid chromatography,and this astaxanthin was confirmed as the left - handed type (3S,3's)by instrumental analysis.Two kinds of macroporous resin were evaluated for the extraction of astaxanthin from snail eggs,and the results show that the adsorption equilibrium time for AB-8 resin is 3 hours,and the adsorption rate could reach 94.2%,indicating the possibility of this resin in the separation and purification of astaxanthin from snail eggs on large-scale industrial application.
Key words: eggs of snails,astaxanthin,macroporous resin,preparative chromatography
0 引言
虾青素(Astaxanthin,化学名称为 3,3’-二羟基-β,β’-胡萝卜素-4,4’-二酮)是一种强抗氧化剂,在抗氧化、着色、促进动物繁殖、增强人体免疫能力、保护心脑血管及中枢神经等方面具有优良的生物学功能,可以作为自由基清除剂和免疫调节剂,在医疗、食品、保健、化妆品、特种饲料添加剂等方面有着广泛的应用[1].虾青素可以通过合成、发酵和从动植物中提取等三种方式获得.虾青素有三种光学异构体,即左旋型(3S,3’S)、右旋型(3R,3’R)和内消旋型(3S,3’R).人工合成虾青素主要为三种结构的混合物(3S,3’S占25%、3R,3’R占25%,3S,3’R占50%左右)[2],其抗氧化活性较弱,而红法夫酵母中的虾青素是以3 R ,3’R为主,具有部分活性[3].藻源虾青素是以3S,3’S为主,具有极强的抗氧化活性.近年来许多研究表明,3S,3’S虾青素具有重要的生物学功能,如抗氧化、抗肿瘤、免疫调节以及增强机体免疫力等[4~7]; 藻源虾青素的安全性已经得到了广泛认可,1999年8月美国FDA批准虾青素作为食品营养补充剂及水产品饲料添加剂;日本政府已批准虾青素用于食品和饲料添加剂; 加拿大食品监察局(FIA)已批准虾青素用于水产品饲料添加剂; 2010年11月我国卫生部(第17号公告)认定雨生红球藻为新资源食品.因此,加强天然虾青素的研究工作,将有助于促进相关产业的健康发展.天然虾青素除富含在雨生红球藻以外,还广泛存在于虾、蟹、鲑鱼等物种之中[8].福寿螺是一种淡水养殖贝类,Wu等人[9]研究发现可以从福寿螺卵及卵巢中提取虾青素,该专利技术采取了溶剂超声波提取、酶解、硅胶柱提纯等步骤,提取工艺复杂、成本较高,而且产品纯度不高,产品质量有待进一步提高.本研究将针对现有技术存在的问题,探索新的提取方法,同时提高虾青素的纯度,以便应用于对质量要求更高的医药、化妆品行业.
1 实验部分
1.1 仪器与试剂
Agilent 1200高效液相色谱仪(安捷伦科技有限公司)、傅立叶红外光谱仪AVATAR 370(美国Thermo Nicollet公司)、RE-2000B旋转蒸发仪(巩义市予华仪器有限责任公司)、DLSB-51/30低温冷却液循环泵(巩义市予华仪器有限责任公司)、SHB-B95A循环水式多用真空泵(郑州长科工贸有限公司)、KQ-300DA数控声波清洗剂(昆山市超声仪器有限公司)、TY-1901紫外光谱仪(北京谱析通用仪器有限公司).
二氯甲烷、无水乙醇、无水甲醇、石油醚、丙酮、四氯化碳、氯仿、CR薄层层析硅胶均为分析纯试剂; AB-8大孔树脂、D101大孔树脂为工业品,左旋(3S,3’S)虾青素标准品购自德国Dr.Ehrenstorfer公司,福寿螺螺卵从养殖场采购.
1.2 虾青素定量测定方法
用分析天平准确称取6.4mg虾青素标准品,将二氯甲烷作为溶剂,用5.0 ml容量瓶定容,得到浓度为1.28 mg·ml-1虾青素母液; 将配置好的虾青素母液再稀释,分别配制浓度为0.00064mg·ml-1,0.00128 mg·ml-1,0.0512mg·ml-1,0.128mg·ml-1,0.1792 mg·ml-1的虾青素溶液.将稀释后的虾青素溶液进行HPLC分析,记录峰面积.以虾青素含量为横坐标,峰面积为纵坐标,绘制标准曲线.在虾青素的提取过程中,取样分析不同萃取条件下所得到的虾青素浸取液,在相同的色谱条件下,测定相应的峰面积,根据标准曲线查得产品浓度,根据浸取液的浓度和体积计算虾青素的收率.
色谱分析条件: 色谱柱C18柱(4.6×250mm); 流动相: 纯甲醇; 流速: 0.5ml·min-1; 柱温: 25℃; 检测波长: 480nm; 进样量: 20μl.
1.3 福寿螺中虾青素的提取
取一定量的福寿螺卵置于研钵中,用研磨棒将螺卵磨碎,加入无水乙醇进行脱水处理,抽滤后将脱水螺卵转移至烧瓶中,加入萃取剂,浸泡一段时间后抽滤,得到红色浸取液,采取减压蒸馏进行浓缩,浓缩液备用.采用正交实验法考察不同萃取剂的用量、温度、时间等因素对浸取效果的影响,探索最佳浸取条件.根据正交实验法的原理,制定四因素三水平的正交表; 四因素分别为: A萃取剂种类、B萃取温度、C萃取时间、D萃取剂与螺卵的质量比; 各因素的三水平值的范围见表1.

表1 虾青素提取条件正交表
1.4 虾青素的分离纯化及定性分析
称取100 g福寿螺卵,用研钵磨碎,加入150ml无水乙醇,浸泡10min,抽滤,用10 ml无水乙醇洗涤滤饼,得含水量较低的滤饼,向滤饼中加入60 ml二氯甲烷,浸泡10min,抽滤,再次用30 ml二氯甲烷浸泡滤饼,过滤,合并滤液.将滤液在氮气保护下减压蒸馏,浓缩至5 ml.将浓缩后的溶液用微孔滤膜过滤,然后通过半制备型液相色谱进行分离,分别收集各个色谱峰的流出组份,对各组份进行HPLC分析,确定虾青素的流出峰.在氮气保护下将含虾青素组份的溶液浓缩,得到虾青素粗品; 虾青素粗品再次通过制备液相色谱进行二次分离,得到虾青素纯品,采用仪器分析方法进行定性分析.
色谱分离条件: 色谱柱为10×250mm,C18; 流速: 1.0ml·min-1; 检测波长: 480nm; 进样量: 1ml; 流动相: 纯甲醇.
1.5 大孔树脂吸附虾青素的研究
选用AB-8型和D101型大孔树脂吸附提纯.按厂家提供的预处理方法,分别采取无水乙醇浸泡、5 %HCl、2 %NaOH处理,纯水洗涤至中性,备用.分别称取2.0g的AB-8和D101树脂,倒入2份50ml经过初步脱水处理的福寿螺卵乙醇浸取液内,并在室温下将溶液置于300 rpm振荡器里进行震荡吸附,每隔1h从溶液中取样进行高效液相色谱分析,研究虾青素含量变化,考察虾青素的吸附效果.
2 结果与讨论
2.1 虾青素标准曲线的绘制
分别对0.00064mg·ml-1,0.00128 mg·ml-1,0.0512mg·ml-1,0.128mg·ml-1,0.1792 mg·ml-1的虾青素溶液进行HPLC分析,记录虾青素的峰面积,然后以虾青素浓度为横坐标,峰面积为纵坐标,绘制标准曲线图.采用Origin7进行数据处理,得标准曲线方程:y=a+bx; 其中a=-7994.47,b=674066.68,R2=0.9987.
2.2 虾青素浸取条件的优化
采用正交实验法来考察不同因素对螺卵中虾青素的提取效果的影响规律.参照从雨生红球藻中提取虾青素的研究文献[10~13],选取了几种常见溶剂(二氯甲烷、无水乙醇、乙酸乙酯)做浸取剂,同时采用单因素实验法确定了浸取时间、温度和物料比例等因素的取值范围.正交实验的结果见表2.

表2 螺卵虾青素提取条件的极差结果分析
通过上表极差分析可知,各因素对虾青素提取量的影响: 萃取剂种类>萃取时间>萃取温度>萃取剂与螺卵质量比.从福寿螺卵中提取虾青素的最佳条件是浸取剂为二氯甲烷,提取温度30℃、提取40min、料液比为l: 2.在最优浸取条件下,虾青素的收率为0.058%.
2.3 产品定性分析
采用半制备型液相色谱仪对螺卵的溶剂浸取液进行制备性分离,每次进样量为1.0 ml,分多次进样,收集含虾青素的流出峰,合并后通过旋转蒸发仪进行浓缩,粗产品再次采用HPLC进行制备性提纯,样品用于分子结构的鉴定.制备色谱的典型出峰情况如图1所示,过载平台区为目标收集组份.

图1 螺卵虾青素浸取液的制备液相色谱图
将经过纯化的虾青素样品用分析型HPLC进行分析,测定产品的纯度,典型的色谱图如图2所示.从图2中可以看出,产品中杂质含量少.通过与标准品对照可知,两者的保留时间完全吻合.
进一步采用红外光谱分析仪对产品进行了鉴定,IR分析结果如图3所示. 分析图中的主要特征峰包括: 在3440cm-1处的吸收峰属于虾青素六元环上羟基的伸缩振动吸收峰; 2924cm-1、2856cm-1和1457cm-1的吸收峰是亚甲基的特征吸收峰;1597cm-1处的强吸收峰是虾青素六元环上羰基的伸缩振动吸收峰; 1080cm-1处的吸收峰是虾青素六元环上仲醇的吸收峰.通过与虾青素标准品的红外光谱图进行比对可知,两者基本吻合,表明从螺卵中提取的产品为左旋型(3S,3’S)虾青素.
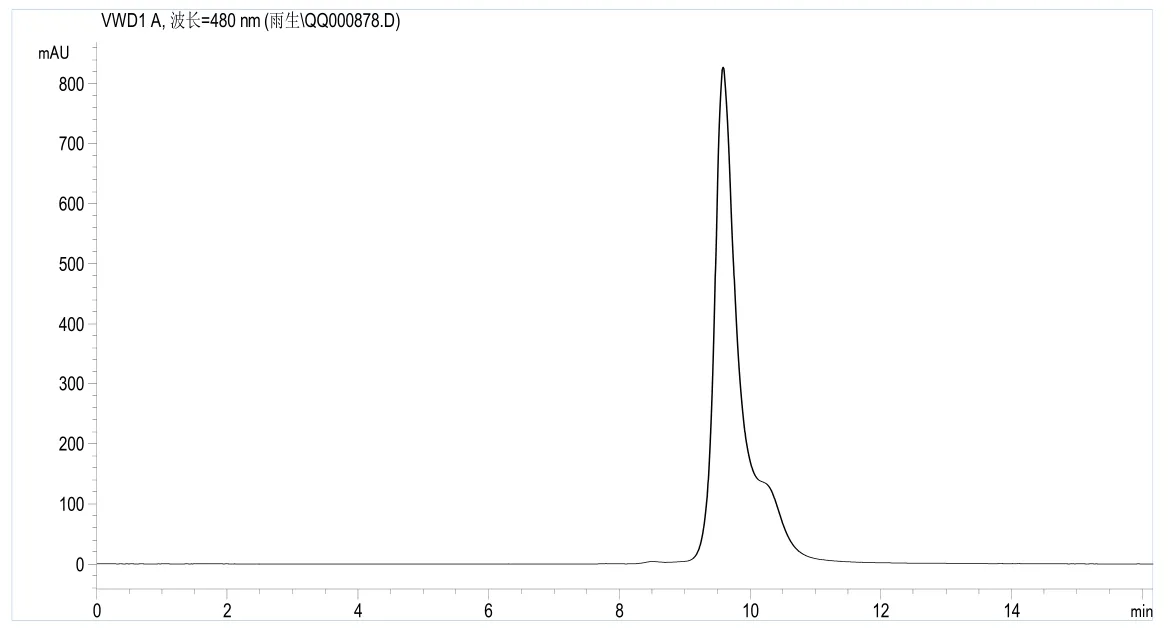
图2 螺卵虾青素纯品的HPLC分析

图3螺卵虾青素纯品的IR分析图(KBr压片)
2.4 大孔树脂吸附条件的选择
针对文[9]中存在的虾青素提取路线复杂、成本很高的问题,参照文[14,15]采用大孔树脂从螺卵中提取虾青素.考察了两种大孔树脂对虾青素的静态吸附情况,以D101树脂为例,将预处理好的2.0 g树脂加入到螺卵虾青素浸取液中,并在300rpm的转速下进行震荡吸附,吸附一定时间后,从浸取液里取样进行高效液相色谱分析,根据标准曲线计算浸取液中剩余虾青素的浓度,从而推算树脂吸附虾青素的量,结果如图4所示.
类似地,将预处理好的2.0g AB-8树脂加入到上述虾青素浸取液中,并于300 rpm的转速下进行震荡吸附,每隔一个小时进行高效液相色谱分析,以震荡时间为横坐标,虾青素含量为纵坐标,得到AB-8树脂对虾青素的吸附规律,如图5所示.

图4 D101树脂吸附虾青素的规律
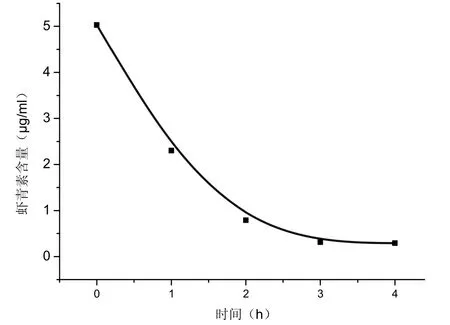
图5 AB-8树脂吸附虾青素的规律
从上述实验结果可以看出,采用AB-8大孔树脂吸附虾青素,达到吸附平衡的时间为3h,吸附率可达94.2%; 而D101树脂所需时间为5h,吸附率为68.6%.可见AB-8大孔树脂对虾青素吸附效果较D101树脂好,推荐在进行柱层析分离螺卵虾青素浸取液时,选用AB-8树脂作为层析介质.
3 结论
采用正交实验对螺卵虾青素的浸取条件进行了优化,研究发现萃取剂的选择对于浸取效率的影响最大,在最佳条件下,以二氯甲烷为浸取剂,浸取温度30℃、浸取为40 min、料液比为l: 2时,螺卵中的虾青素的收率可达0.058%.这表明螺卵中的虾青素含量虽然没有雨生红球藻中的丰富,但比一般虾蟹中所含的虾青素含量高,是一种经济可行的虾青素资源.
对螺卵虾青素的结构进行了定性分析,通过与虾青素标准品进行HPLC保留时间的对比分析,以及红外光谱仪的鉴定,判断该来源的产品为(3S,3’S)左旋虾青素,在医药、食品、化妆品等高端市场有良好的应用前景.
为了降低虾青素的提取成本,同时提高产品品质,研究了采用大孔树脂层析法来提纯螺卵虾青素的方法.实验发现AB-8树脂具有吸附平衡时间短、吸附率高的特点,可以应用于虾青素的大规模分离提纯.
[1]Goswami S,Chaudhuri D,Dutta.The present perspective of Astaxanthin with reference to biosynthesis and pharmacological importance[J].World J Microbiol Biotechnol,2010,26: 1925~1939
[2]Lorenz R T,Cysewski G R.Commercial potential for Haematococcus microalgae as a natural source of astaxanthin[J].Trends in Biotechnology,2000,18(4):160~167
[3]Tangeras A,Slinde E.Coloring of salmonids in aquaculture: the yeast Phaffia rhodozyma as a source of astaxanthin[M].New York: Springer US,1994: 391~431
[4]Fassett R G,Coombes J S.Astaxanthin: a potential therapeutic agent in cardiovascular disease[J].Marine Drugs,2011,9(3): 447~465
[5]Tanaka T,Shnimizu M,Moriwaki H.Cancer chemoprevention by carotenoids[J].Molecules,2012,17(3): 3202~3242
[6]Park J S,Chyum J H,Kim Y K,et al.Astaxanthin decreased oxidative stress and inflammation and enhanced immune response in humans[J].Nutrition and Metabolism,2010,7(18): 1~10
[7]Chew B P,Park J S.Carotenoid action on the immune response[J].The Journal of Nutrition,2004,134(1): 257~261
[8]Higuera-Ciapara,Félix-Valenzuela L.,Goycoolea F.M..Astaxanthin:A Review of its Chemistry and Applications[J].Critical Reviews in Food Science and Nutrition,2007,46(2): 185~196
[9]Wu Yi-Lung,Yang Chin-Chang.Method for obtaining natural astaxanthin from eggs and gonads of snails[P].United States Patent,8,030,523,2011-10-04
[10]Karsten Holtin et al.Determination of astaxanthin and astaxanthin esters in the microalgae Haematococcus pluvialis by LC-(APCI)MS and characterization of predominant carotenoid isomers by NMR spectroscopy[J].Anal,Bioanal Chem,2009,395: 1613~1622
[11]周湘池,刘必谦,曾庆国,等.雨生红球藻破壁方法对虾青素提取率的影响[J].海洋与湖沼,2006,37(5)
[12]高桂玲,成家杨,马 炯.雨生红球藻和虾青素的研究[J].水产学报,2014,38(2): 297~304
[13]杨叶欣,顾党恩,牟希东,等.常用萃取剂提取福寿螺卵中类胡萝卜素的初步研究[J].生物安全学报,2012,21(4): 291~294
[14]姜启兴,宋素梅,夏文水,等.大孔树脂分离纯化南极磷虾壳中的虾青素[J].食品科学,2014,35(16): 1~5
[15]陈志强,金 杨,任 璐.非水介质大孔树脂分离纯化虾壳中虾青素[J].生物加工过程,2009,7(3): 39~42
Extraction of Astaxanthin from Snail Eggs
HUA Jie,ZHANG Yuqi,ZHU Jiao,WANG Qing,LEI Jianzheng
(College of Chemistry and Chemical Engineering,Hunan Institute of Science and Technology,Yueyang 414006,China)
TQ028
A
1672-5298(2017)03-0058-05
2017-07-15
湖南师范大学化学生物学及中药分析教育部重点实验室开放基金(KLCBTCMR2015-08)
华 杰(1963− ),男,湖南岳阳人,博士,湖南理工学院化学化工学院教授.主要研究方向: 色谱分离技术,精细化工

