酸解法制备纤维素纳米晶体水解残液的糖酸分离
王 帅 刘鹏涛 侯佳玲
(天津市制浆造纸重点实验室,天津科技大学造纸学院,天津,300457)
酸解法制备纤维素纳米晶体水解残液的糖酸分离
王 帅 刘鹏涛*侯佳玲
(天津市制浆造纸重点实验室,天津科技大学造纸学院,天津,300457)
硫酸法制备纤维素纳米晶体(CNC)的水解残液中含有大量的硫酸、一些未充分水解的纤维素片段以及以单体和寡聚形式存在的糖,直接丢弃不仅会污染环境,更是对资源的一种极大浪费。通过向水解残液中加入硫酸(质量分数80%)的方法,调节水解残液中的硫酸浓度,并通过水浴加热使残液中未充分水解的物质转化为葡萄糖;然后用阴离子交换膜将水解残液中的硫酸和葡萄糖分离,再将分离后的液体用旋转蒸发仪浓缩,以提高硫酸和葡萄糖的浓度。研究结果表明,调节水解残液中硫酸质量分数为56%,在45℃水浴中反应3 h,水解残液中葡萄糖含量达到最大值13.73 g/L;处理后的水解残液通过2次阴离子交换膜过滤,硫酸的回收率达到90.31%,浓缩可得到10.06 mol/L的浓硫酸和36 g/L的葡萄糖溶液。回收得到的硫酸和副产品葡萄糖溶液可分别用于CNC的制备和用作生物发酵的碳源。
纤维素纳米晶体;水解残液;阴离子交换膜;葡萄糖;硫酸
纤维素纳米晶体(CNC)是由纤维素派生而成的具有多种优异性能的生物聚合物[1],可应用于复合增强、催化、光电材料、酶固定化、抗菌和医用材料、生物传感仪、荧光探针和药物释放等方面,是最有潜力的材料之一[2-3]。
目前,常用硫酸水解法制备CNC[4]。硫酸具有价格低、水解效率高的特点;然而此法制备CNC的得率一般不高于45%[5-6],当CNC分离出来以后,会有一些未水解充分的纤维素片段以及以单体和寡聚形式存在的糖残留于水解残液中,造成水解残液体系不稳定,影响硫酸的再次利用;直接将水解残液丢弃不仅会污染环境,更是对资源的一种极大浪费。因此有必要寻找一种有效方法回收水解残液中的硫酸并降低其中生物质的浪费。
水解残液中的生物质能够进一步水解成葡萄糖,然后用糖酸分离的方法将残液中的硫酸和葡萄糖分离。常用的糖酸分离方法有:中和及蒸馏法、溶剂萃取法、双极性膜电渗析法、离子排斥色谱法等[7-8]。这些方法均存在一定的缺点,如:无法回收到酸、成本高等。使用卷式扩散渗析器,利用扩散渗析原理,可达到高效、低成本分离回收的目的。
扩散渗析是指使浓度较高的溶质透过薄膜向浓度较低的溶液中迁移的过程。它有2个关键部分:一是膜两侧的溶液必须有一定的浓度差;二是膜的选择透过性。在扩散渗析过程中,膜两侧的浓度差是离子进行传输的推动力,这是应用唐南平衡同离子排斥和电中性维持的相关理论,实现离子的选择性渗透从而达到分离的目的。这种方法在湿法冶金工艺中实现了废液中酸碱的回收[9]。
本课题详细阐述了CNC水解残液体系中糖酸分离的方法,考察了水解残液的进一步水解工艺和分离所用扩散渗析阴离子交换膜使用条件和效果,探讨用此法回收硫酸并得到副产品葡萄糖的可行性。
1 实 验
1.1提取CNC水解残液
取10 g(绝干)阔叶木溶解浆,加入100 mL质量分数为64%的硫酸并搅拌(IKA RW20型数字搅拌器),在45℃恒温水浴(HWS24型电热恒温水浴锅)中反应40 min[10];然后向反应体系中加入200 mL去离子水,将混合液在0℃、10000 r/min条件下离心(TGL-20M型台式冷冻离心机)10 min,上清液为需要提取的CNC水解残液,呈淡黄色透明液体,下层的白色沉淀则为CNC。
1.2水解残液中葡萄糖含量测定
采用生物传感分析仪(SBA-40C型)检测水解残液中的葡萄糖含量。首先用100 g/L的葡萄糖标准液定标,然后将样品中和稀释至葡萄糖含量在20~80 g/L,再用定量进样针准确吸取25 μL,并注入反应池。反应原理见式(1)。
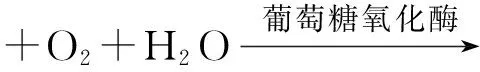
(1)
酶电极对H2O2分子的浓度呈线性相应。据此可直接在显示屏上读出葡萄糖浓度。
1.3CNC水解残液进一步处理
用硫酸(质量分数80%)调节水解残液中的硫酸质量分数为50%~66%,并测出30℃、40℃、45℃温度下分别水解3 h、5 h时的水解残液中葡萄糖的含量,按照式(2)计算葡萄糖的实际增加量,确定最佳的水解条件。

(2)
式中,k增为葡萄糖的增加量,%;m后为加酸水解后葡萄糖总量,g/L;m前为水解残液中葡萄糖的初始量,g/L。
1.4糖酸分离
在最佳水解条件的基础上,分离水解残液中的葡萄糖和硫酸。加去离子水调节水解残液中硫酸浓度到阴离子交换膜的耐酸上限以下,再用卷式扩散渗析膜分离其中的葡萄糖和硫酸[11-13]。2次分离后,可得到纯度较高的硫酸溶液和葡萄糖溶液。
阴离子交换膜为SWDD-D110-S1型卷式扩散渗析膜,膜组件种类:动态卷式有机膜,组件长度60~70 cm,直径10 cm,膜有效面积1 m2,处理速度5~10 mL/min,耐酸上限为质量分数40%的硫酸。
2 结果与讨论
2.1水解条件的确定
用无水碳酸钠(分析纯)标定所得水解残液中硫酸质量分数为36.5%,并用生物传感分析仪测得葡萄糖含量8.36 g/L;由于此时所得残液中含有葡萄糖、纤维素片段、各种低聚糖,为了得到较纯净的葡萄糖并提高葡萄糖浓度,可采用加入硫酸的方法进一步将残液水解;同时,用这种方法处理过的水解残液,可以防止分离时对扩散渗析阴离子交换膜的堵塞和污染。为了得到适宜的酸解条件,可分别取少量水解残液(20 mL)加入不同用量的硫酸(质量分数80%),将水解残液中硫酸质量分数调到58%、60%、62%、64%、66%,测定在30℃下水解3 h、5 h时水解残液中的葡萄糖含量,结果见图1。
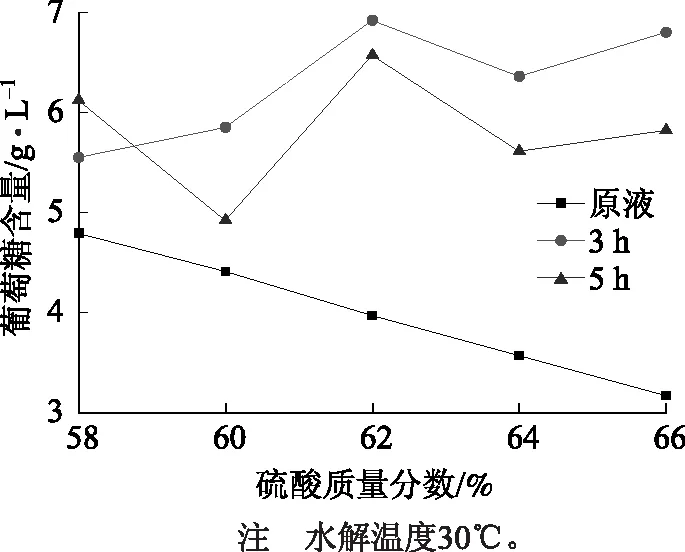
图1 硫酸质量分数及水解时间对水解残液中葡萄糖含量的影响
由图1可知,30℃下水解得到的葡萄糖含量均比较低,水解5 h时的葡萄糖含量反而低于水解3 h时的含量,这是由于反应体系中部分葡萄糖在酸的催化作用下异构化为左旋糖及降解成糠醛、5-羟甲基糠醛(HMF)等物质[14-15];另外,随着水解时间的延长,会有葡萄糖及其脱水和降解产物形成的胡敏素型聚合物的积累,使反应体系呈黑褐色,其反应过程如图2所示。该现象在硫酸浓度高的情况下更明显,高浓度的酸催化剂能够促进胡敏素型聚合物的生成[16];因此,30℃不是酸解反应的最佳温度条件。
提高水解温度至40℃,水解残液中硫酸质量分数对葡萄糖含量的影响见图3。由图3可知,水解温度40℃条件下反应3 h时,水解得到的葡萄糖含量相对较高,但总增加量仍然不高;另外,当水解残液中的硫酸质量分数为66%时,溶液已经变成黑褐色,有较多的胡敏素型聚合物形成。由此可认为40℃条件下,当硫酸质量分数为66%时不适宜进行水解,且此时容易使水解残液发生不可逆变化。
继续提升水解温度到45℃,并将水解残液中硫酸质量分数调到56%、58%、60%、62%、64%。
由图4中B液,经计算葡萄糖的增加量可知,当硫酸质量分数为56%、反应温度45℃、水解3 h时,葡萄糖增加量最高,为164.73%;继续延长反应时间,溶液中胡敏素型聚合物的生成量增加,葡萄糖的生成速率小于其降解速率[11],葡萄糖含量降低。将水解残液在更低酸浓度下水解,如图4中A液,经过分析计算可知,当硫酸质量分数在54%以下时,水解5 h葡萄糖含量仍有增加,但增加量已经很少;继续增加反应时间,所得葡萄糖增加量仍不高于水解3 h,硫酸质量分数56%的水解残液中葡萄糖增加量为166.09%。由于葡萄糖在富酸环境、温和条件下即会有向HMF等物质转化的趋势[17],温度升高会造成更多葡萄糖转化为其他物质,因此不宜再次提高水浴温度。由此可认为,水解残液在硫酸质量分数为56%、45℃温度下水解3 h是葡萄糖生成率最适宜的反应条件,此时葡萄糖含量最高可达13.73 g/L。
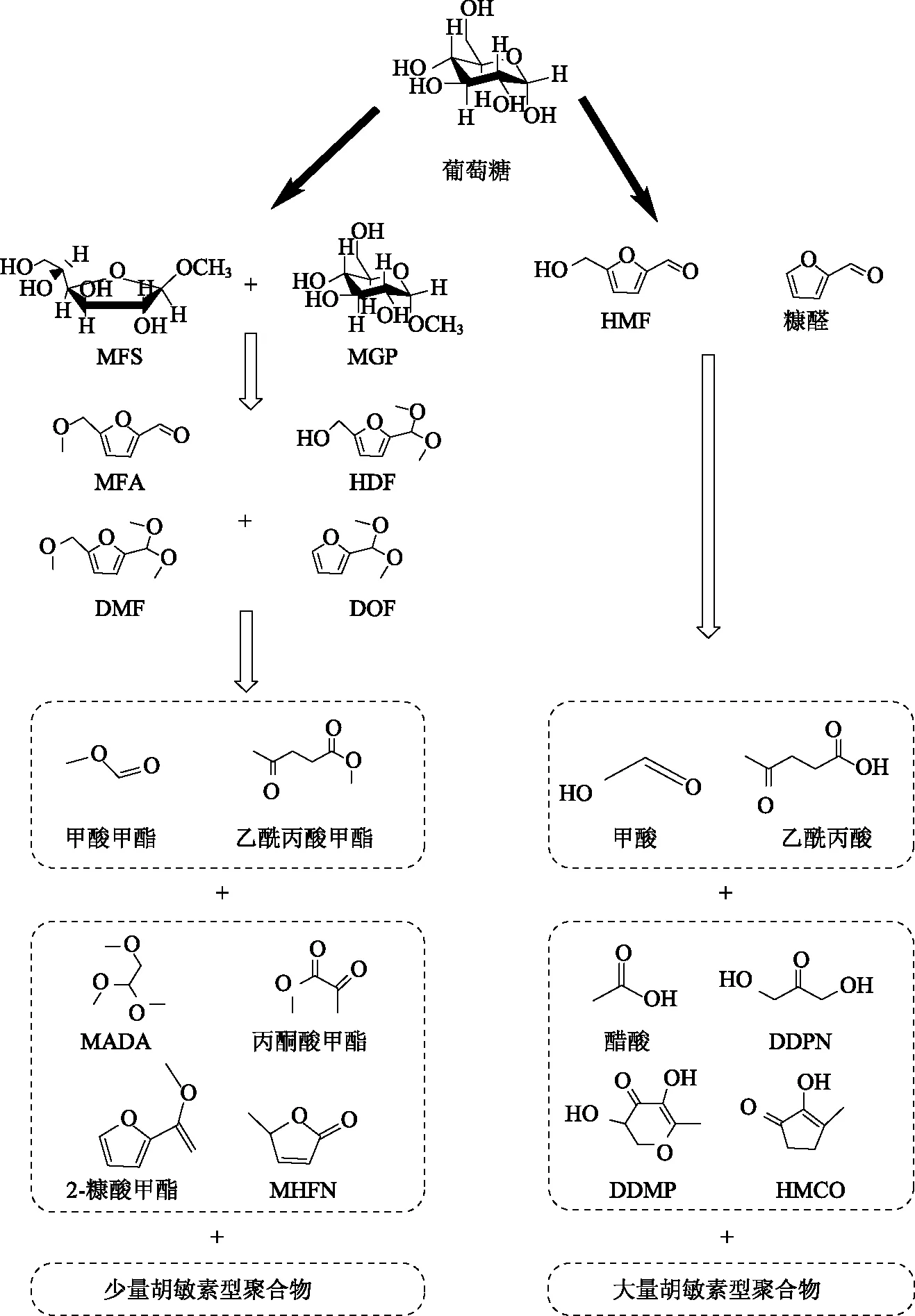
图2 水解残液中葡萄糖异构化及降解最终形成胡敏素型聚合物的反应途径[17]

图3 40℃时不同硫酸质量分数水解残液在水解3 h时葡萄糖含量
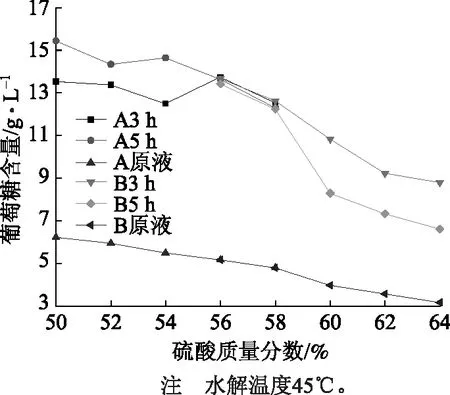
图4 水解残液在不同硫酸质量分数及水解时间下的葡萄糖含量
2.2糖酸分离效果考察
水解残液中的葡萄糖和硫酸若不能及时从体系中分离,则会使葡萄糖进一步异构化和降解,同时也会污染硫酸,影响其二次利用。为使反应终止,可采用向体系中加入去离子水的方法降低体系的温度和硫酸浓度,从而大幅度降低其反应进程,再用扩散渗析阴离子交换膜分离出葡萄糖溶液和硫酸溶液。
取水解残液500 mL,加入质量分数为80%的硫酸310 mL,45℃条件下水解3 h;由于阴离子交换膜的耐酸上限为40%,并为稳定溶液体系,降低反应进程,可加入400 mL去离子水,将溶液中硫酸质量分数调到40%以下,此时溶液中的葡萄糖含量为9.38 g/L。使用扩散渗析阴离子交换膜处理,分离出葡萄糖溶液和硫酸溶液,分离结果见表1。
由表1中“第一次分离”分析可知,经过扩散渗析阴离子交换膜处理后,硫酸的回收率为70.58%。此时的酸液中只含有少量葡萄糖,但糖液中硫酸浓度仍然较高,为1.60 mol/L。为回收到更多的硫酸,再次用阴离子交换膜处理经过一次分离后的糖液。结果如表1中“第二次分离”所示。
由“第二次分离”计算分析可知,再次用阴离子交换膜处理后,得到的糖液中硫酸浓度已经很少,为0.49 mol/L,且经过多次实验发现:硫酸的单次回收率均低于第一次分离时的回收率,而葡萄糖的单次损失率则均高于第一次的损失率;经过两次分离后,硫酸的总回收率为90.31%,葡萄糖的总损失率为28.81%,达到了用阴离子交换膜分离回收硫酸并得到副产品葡萄糖的目的。
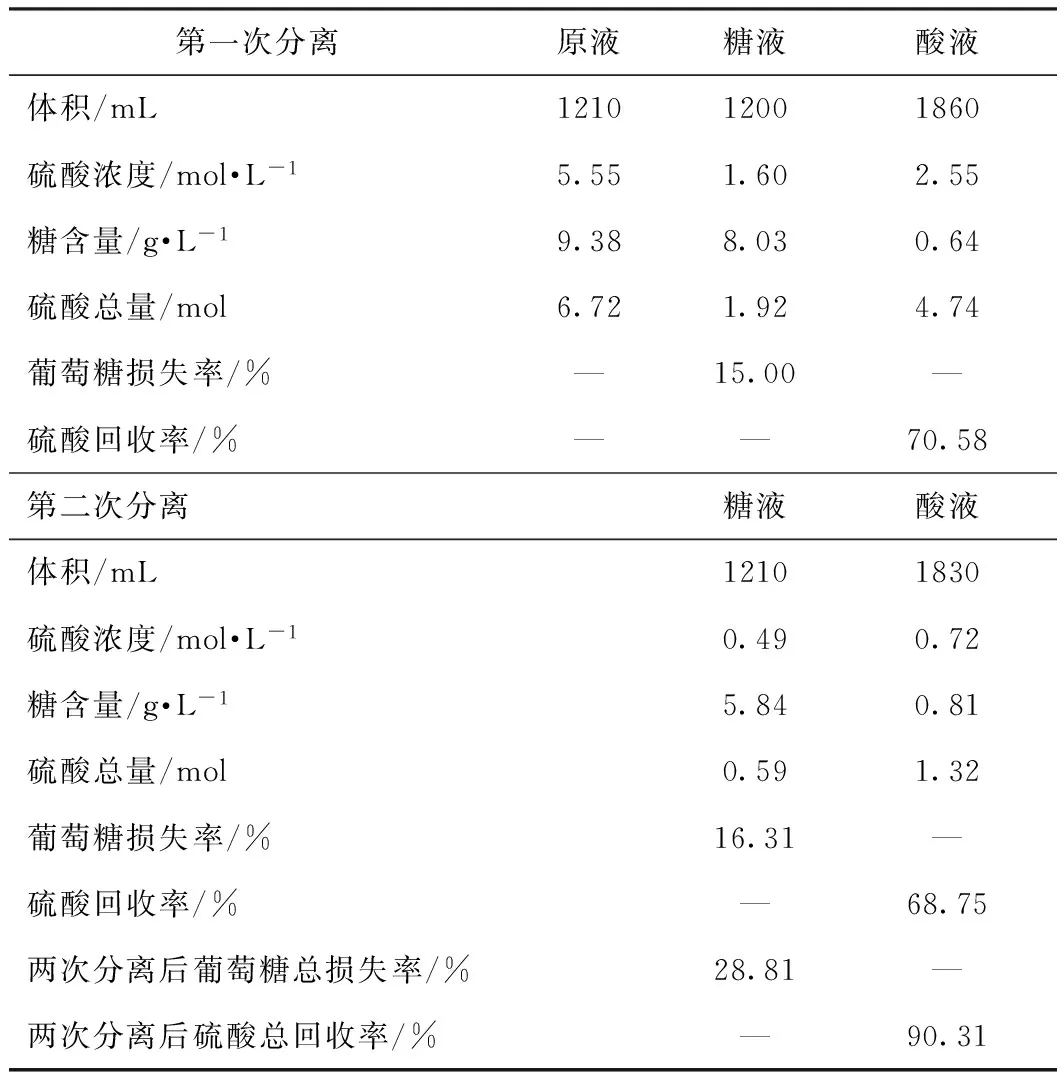
表1 调整后水解残液用阴离子交换膜处理的结果
2.3葡萄糖与硫酸的回收利用
由表1可知,最终得到的糖液中葡萄糖含量为5.84 g/L,硫酸浓度为0.49 mol/L;酸液中的硫酸浓度分为两部分,对原液分离后酸液中硫酸浓度为2.55 mol/L,对第一次分离后的糖液再次分离后酸液中硫酸浓度为0.72 mol/L。两次分离后酸液中的硫酸可分别用旋转蒸发仪浓缩至浓度为10.06 mol/L,再次用于CNC的制备。在糖液中加入稍过量的生石灰,将其中的硫酸中和,中和后的葡萄糖溶液再用旋转蒸发仪浓缩[18],浓缩条件为:温度55℃,时间75 min,浓缩量250 mL/次,浓缩后溶液中葡萄糖含量为36 g/L,可以作为生物发酵的碳源[19]。
3 结 论
用硫酸法制备纤维素纳米晶体(CNC)的水解残液加入硫酸的方法,调节水解残液中硫酸质量分数至56%,在45℃下水解3 h,将溶液中的生物质水解为葡萄糖。得到的水解残液用阴离子交换膜分离两次,分离出硫酸溶液和葡萄糖溶液,并回收硫酸、获得副产品葡萄糖;硫酸的回收率可达90.31%。回收得到的硫酸和副产品葡萄糖,进一步处理后可分别用于CNC的制备和用作生物发酵的碳源。
[1] Brinchi L,Cotana F,Fortunati E,et al.Production of nanocrystalline cellulose from lignocellulosic biomass:technology and applications[J].Carbohydrate Polymers,2013,94(1):154.
[2] 吴伟兵,张 磊.纳晶纤维素的功能化及应用[J].化学进展,2014,26(增刊):403.
[3] 张开涛,商士斌,刘 鹤,等.纤维素纳米晶体制备及其在无机纳米复合材料方面的应用 [J].化工新型材料,2015,43(7):194.
[4] 王 帅,刘鹏涛,侯佳玲.纤维素纳米晶体彩色膜制备进展[J].中国造纸,2016,35(12):60.
[5] Sun B,Zhang M,Hou Q,et al.Further characterization of cellulose nanocrystal (CNC) preparation from sulfuric acid hydrolysis of cotton fibers[J].Cellulose,2016,23(1):439.
[6] Rhim J W,Reddy J P,Luo X.Isolation of cellulose nanocrystals from onion skin and their utilization for the preparation of agar-based bio-nanocomposites films[J].Cellulose,2015,22(1):407.
[7] Han K W,Ko K H,ABU-Hakmeh K,et al.Molecular Dynamics Simulation Study of a Polysulfone-Based Anion Exchange Membrane in Comparison with the Proton Exchange Membrane [J].Journal of Physical Chemistry,2014,118(24):12577.
[8] Singh S,Jasti A,Kumar M,et al.A green method for the preparation of highly stable organic-inorganic hybrid anion-exchange membranes in aqueous media for electrochemical processes[J].Polymer Chemistry,2010,1(8):1302.
[9] 侯晓川,肖连生,高丛堦,等.扩散渗析技术在湿法冶金工业上的应用现状及展望[J].有色金属工程,2011,1(3):9.
[10] Abraham E,DEEPA B,Pothan L A,et al.Extraction of nanocellulose fibrils from lignocellulosic fibres:A novel approach[J].Carbohydr Polym,2011,86(4):1468.
[11] 华 伟,李传润,张 旭,等.卷式扩散渗析膜法回收 H2SO4/FeSO4体系中的 H2SO4[J].化工进展,2012,31(1):222.
[12] 朱秋华,方荣茂,张玲文,等.扩散渗析法回收湿法炼铜厂电解贫液中的硫酸[J].膜科学与技术,2013,33(1):62.
[13] Bendova H,PALAT05 Z.Continuous Separation of an H2SO4/CuSO4Mixture by Diffusion Dialysis[J].Chemical Engineering & Technology,2011,34(2):217.
[14] 石 宁,刘琪英,王铁军,等.葡萄糖催化脱水制取5-羟甲基糠醛研究进展[J].化工进展,2012,31(4):792.
[15] Swift T D,Nguyen H,Erdman Z,et al.Tandem Lewis acid/Brønsted acid-catalyzed conversion of carbohydrates to 5-hydroxymethylfurfural using zeolite beta[J].Journal of Catalysis,2016,333:149.
[16] Gao X,Peng L,Li H,et al.Formation of Humin and Alkyl Levulinate in the Acid-catalyzed Conversion of Biomass-derived Furfuryl Alcohol[J].BioResources,2015,10(4):6548.
[17] Hu X,Lievens C,Larcher A,et al.Reaction pathways of glucose during esterification:Effects of reaction parameters on the formation of humin type polymers[J].Bioresource Technology,2011,102(21):10104.
[18] 李 敏,李坚斌,梁欣泉,等.甘蔗叶低聚木糖的分离纯化[J].食品科技,2012,37(4):241.
[19] 王风芹,仝银杏,李传斌,等.蒸汽爆破玉米芯水解液脱毒及其发酵生产燃料丁醇[J].农业工程学报,2016,32(5):257.
Abstract:There were lots of sulfuric acid,some of not fully hydrolyzed cellulose fragments,monomer sugars and oligo in the waste liquid from preparing cellulose nanocrystals (CNC) by sulfuric acid hydrolysis process.If the waste liquid was discarded directly without recycling,and it could cause environmental pollution and a great waste of resource.This paper studied the method for recovering both sulfuric acid and glucose.The concentration of sulfuric acid in the waste liquid was adjusted by adding 80%(wt) sulfuric acid,then the materials not fully hydrolyzed were converted to glucose by heating in water bath.The sulfuric acid and glucose were separated by anion exchange membrane,then concentrated by using rotary evaporating and concentrating system.Results showed that glucose concentration in the waste liquid reached maximum when sulfuric acid concentration was 56%(wt) and heating at 45℃ for 3 h in water bath.The recovery rate of sulfuric acid was 90.31% after the liquid was treated twice by anion exchange membrane,10.06 mol/L sulfuric acid and 36 g/L glucose solution were obtained after being concentrated.
Keywords:CNC; waste liquor from acid hydrolysis; anion exchange membrane; glucose; sulfuric acid
(责任编辑:刘振华)
SeparationofAcidandSugarintheWasteLiquidfromAcidHydrolysisforPreparingCelluloseNanocrystals
WANG Shuai LIU Peng-tao*HOU Jia-ling
(TianjinKeyLaboratoryofPulpandPaper,CollegeofPapermakingScienceandTechnology,TianjinUniversityofScience&Technology,Tianjin, 300457)
TQ353.9;X793
A
1000-6842(2017)03-0027-05
2016-09-22
天津市制浆造纸重点实验室(天津科技大学)开放基金(NO.201313)。
王 帅,男,1990年生;在读硕士研究生;主要研究方向:生物质资源利用。
*通信联系人:刘鹏涛,E-mail:pengtaoliu@tust.edu.cn。

