新常态下猪圆环病毒病的流行病学、诊断、防控新趋势
林文耀,刘国民,冯 凯,王景成,黄 超,张开放,尚 策,刘 辉,李志杰
(金宇保灵生物药品有限公司,内蒙古 呼和浩特 010030)
新常态下猪圆环病毒病的流行病学、诊断、防控新趋势
林文耀,刘国民,冯 凯,王景成,黄 超,张开放,尚 策,刘 辉,李志杰
(金宇保灵生物药品有限公司,内蒙古 呼和浩特 010030)
自2010年以来,随着猪圆环病毒病疫苗在国内的普及免疫,猪圆环病毒病得到了较好控制。然而在免疫新常态下,随着养猪业进一步朝着规模化集约化急速发展,猪圆环病毒病的流行、诊断、防控也出现了一些新的变化。文章就猪圆环病毒病的流行病学、诊断、防控新趋势做一阐述,为该病的防控提供参考。
猪圆环病毒病;流行病学;诊断;防控;新趋势
猪圆环病毒病(Porcine circovirus diseases,PCVD)是由猪圆环病毒2型(Porcine circovirus type 2,PCV2)所引起的猪圆环病毒病及圆环病毒相关疾病。PCV2侵入机体后攻击猪的免疫系统,引起B淋巴细胞凋亡,导致严重的免疫抑制,从而导致继发感染其他致病性病原体或混合感染,给世界养猪业带来巨大的损失[1]。
1 猪圆环病毒病的历史回顾
断奶仔猪多系统衰竭综合征(Postweaning multisystemic wasting syndrome,PMWS)是对PCV2感染导致的疾病的最早认识。20世纪90年代初期在加拿大发现5~12周的仔猪临床出现皮肤苍白、被毛粗乱、渐进性消瘦、黄疸等症状,病理变化最主要的特征为淋巴结肿大,统称为PMWS。随后该病在世界范围内相继报道,随着疾病的发展和认识的加深,为更好地体现疾病的关联性,现已经用PCV2系统性疾病(PCV2-systemic disease,PCV2-SD)替代 PMWS。其实,根据病毒溯源研究显示,猪圆环病毒2型早在1962年已经在猪群存在。而且,通过系统发育和共进化研究推断,PCV2在猪群存在的历史可能已经超过100年[2]。
除了PCV2系统性疾病,临床病理学发现,PCV2还能引起一系列疾病,如肠道疾病、肺部疾病、亚临床感染、皮炎肾病综合征(porcine dermatitis and nephropathy syndrome,PDNS)、繁殖障碍[3](表1)。其中,PCV2导致的繁殖障碍应该引起足够的重视:母猪和公猪都可能由于感染PCV2而导致繁殖障碍。母猪感染PCV2可导致流产,产死胎、木乃伊胎,弱仔偏多。公猪感染PCV2的最大危害在于精液带毒,通过人工授精感染母猪,减少产仔数,出现死胎、木乃伊胎[4-5]。
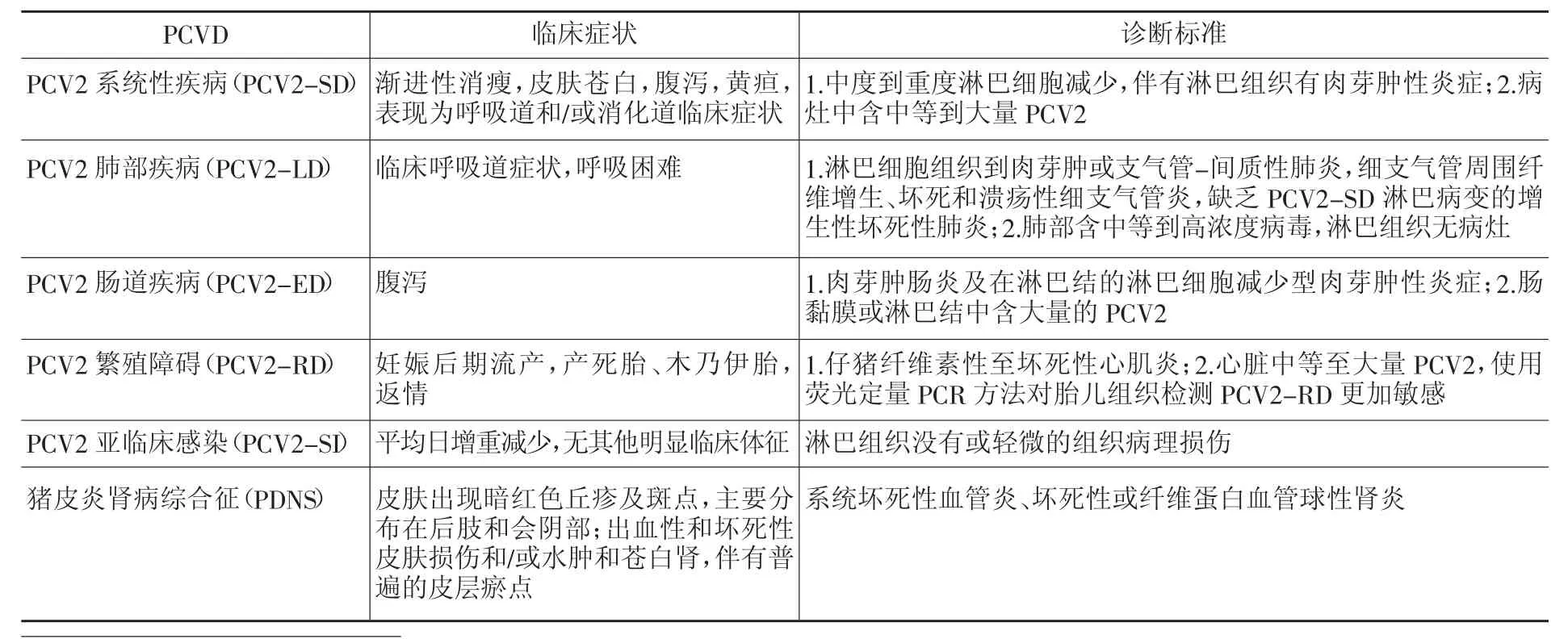
表1 猪圆环病毒病临床症状及诊断标准
2 流行病学
血清学和分子流行病学调查表明,猪圆环病毒2型在全球养猪国家均有流行。通过对比患有PMWS的猪和健康猪的气管、扁桃体、血清、鼻、粪便和尿拭子中PCV2病毒的含量,发现气管中病毒的含量最高,其次是血液、扁桃体、鼻腔和粪便,尿液中病毒含量最低,推测病毒主要经呼吸道和口腔排出,口鼻接触是病毒的主要传播途径[6]。此外,感染PCV2的成年公猪可通过精液向体外排毒,携带感染性PCV2的精液通过人工授精可导致母猪繁殖障碍。
PCV2虽然只有一个血清型,但却有不同的基因型。2003年以前世界范围内的PCV2流行毒株以PCV2a基因型为主,随后PCV2b取代PCV2a成为当前的优势流行毒株,同时也伴随着全球猪圆环病毒病的严重暴发,提示PCV2b致病性可能强于PCV2a。而临床动物试验也证明不同PCV2基因型的致病性是不同的,PCV2b比PCV2a毒力更强[7-8]。基因型转变的主要原因可能是PCV2b在细胞间的扩散能力以及对宿主的吸附能力均强于PCV2a[9]。2010年,随着研究的深入,在中国发现新的基因型PCV2d,也被称为mPCV2b(PCV2b的突变型)[10]。2012年在北美也发现PCV2d的存在,通过监测发现PCV2d有替代PCV2b成为优势流行毒株的趋势[8,11]。
近来,美国从断奶仔猪多系统衰竭综合征的仔猪,以及有繁殖障碍和皮炎肾病综合征的母猪中分别检测到猪圆环病毒3型,基因测序发现核衣壳和复制酶蛋白与PCV2和蝙蝠圆环病毒的同源性分别只有37%和55%[12]。国内的研究人员也检测到PCV3的存在[13]。但是目前还没成功分离到病毒,也无法复制病例,而且猪圆环病毒病是个多因素的疾病,因此关于新型的PCV3还有很多未知信息需要去探索,需要充分考虑病原、宿主、非传染病等因素,确定病原与疾病的关系。
3 诊断
因为猪圆环病毒病是个多因素疾病,所以诊断必须遵循临床诊断、病理解剖、实验室诊断3个步骤,忽略其中任何一个步骤都可能会导致错误的诊断。
根据以往的临床经验,PCV2-SD主要发生在5~12周龄的仔猪。但是我们发现在现实生产中圆环病毒病的发病时间有往后推迟的现象,由保育期推迟到肥育期,主要发病阶段为70~140日龄,这与实验室圆环病毒病抗体检测数据较为一致:10周或13周仔猪圆环病毒病抗体为阴性,但在16周或20周圆环病毒病抗体突然上升,提示可能由于野毒的感染导致抗体的上升。所以我们临床观察时必须全面检查不同阶段的猪只,发现提示猪圆环病毒病的相关临床症状:仔猪渐进性消瘦、生长缓慢、皮毛粗糙苍白、体重均匀度较差、腹泻、呼吸困难、黄疸,皮肤出现暗红色丘疹及斑点,母猪妊娠后期流产,产死胎、木乃伊胎,返情,弱仔偏多等繁殖障碍。
疑似猪圆环病毒病的剖检病变以淋巴结肿大(尤其是浅表腹股沟和肠系膜淋巴结),间质性肺水肿(表明间质性肺炎),猪皮炎肾病综合征症状,繁殖障碍如产死胎、弱仔、木乃伊胎,仔猪纤维素性至坏死性心肌炎等较为常见。但是,其他病原微生物如高致病性蓝耳病病毒也会产生类似的临床症状和病理变化,因此,猪圆环病毒病的确诊需要依靠实验室检测。
实验室诊断手段有:组织切片中抗原或病原的组织病理学检测(免疫组织化学,原位杂交技术);血清学(区别IgG和IgM,推断疾病是处于初期还是末期;Rep蛋白区别疫苗毒或野毒)、分子技术(常规PCR和实时荧光定量PCR)。因为常规PCR操作较为容易,所以在实验室诊断应用较多。但由于PCV2广泛存在,并存在假阳性和PCR污染的可能,而且临床发病与亚临床感染的猪群中PCV2含量存在明显差异,不同组织器官病毒含量也存在差异,常规PCR容易造成漏检。更为重要的是猪圆环病毒病的发病与病毒载量的高低成正比。有研究表明,健康猪血清中病毒载量低于104拷贝,病猪血清或气管病毒载量≥107拷贝,扁桃体病毒载量≥106拷贝,粪便病毒载量≥105拷贝,这些可作为诊断PCV2-SD的一个阈值[6]。与常规PCR比较,实时荧光定量PCR检测灵敏度高,不仅可以定性,而且可以定量,有利于猪圆环病毒病的诊断。不管采用哪种检测方法,猪圆环病毒病的诊断始终要有一个概念,即猪圆环病毒病是一个多因素疾病,科赫法不适用于圆环病毒病的诊断。因为科赫法是单病因学说,把病原微生物作为疾病的唯一原因,忽略了环境和宿主因素、非传染病等因素对疾病的影响。对于猪圆环病毒病的诊断,可能Evans氏假说更为合理。Evans氏假说认为疾病是由多因素引起的,是一种多病因学说,与现代流行病学的病因观相符合,不仅适用于传染病,也适用于非传染病。
4 防控
自2010年猪圆环病毒2型疫苗在国内上市以来,疫苗免疫成为防治猪圆环病毒病的主要手段。疫苗的应用有效改善了种猪和仔猪的生产成绩。对种猪而言,疫苗免疫可以有效预防PCV2导致的流产,产死胎、木乃伊胎等繁殖障碍问题。对仔猪而言,疫苗免疫可以提高日增重,降低料重比,提高猪群均匀度,降低混合感染几率和减少抗生素的使用。但PCV2免疫失败的现象也时有发生。深入分析免疫失败的原因,必须考虑以下几个问题。
如何选择合适的疫苗?PCV2基因型多,但目前市场的疫苗主要基于PCV2a毒株研发。虽然PCV2a疫苗能够交叉保护PCV2b毒株,但PCV2a与PCV2b毒株之间的抗原性是存在一定差异的,且与PCV2a比较,PCV2b疫苗能够更有效地预防不同基因型的感染。因此选择PCV2b基因型的疫苗对圆环病毒病的防控效果更为理想[14]。而且,目前有些产品注册注明使用对象是仔猪,因此选择圆环病毒病疫苗时必须考虑可以同时用于种猪和仔猪的圆环病毒病疫苗。
如何制定合理的免疫程序?目前有部分猪场只免疫仔猪,种猪不免。PCV2可以感染不同阶段的猪只,因此正确防控猪圆环病毒病的前提是对种猪和仔猪都实行免疫。Pejsak等比较3种不同的免疫方式(只免疫母猪、只免疫仔猪、母仔同免)的免疫效果,结果发现母仔同免可以有效降低仔猪从出生到肥育全程的死亡率,尤其是断奶前仔猪的死亡率。母仔同免不仅降低母猪的感染风险与排毒,减少环境中病毒的载量,同时母源抗体也给仔猪提供早期的保护[15]。由于母源抗体的存在,仔猪圆环病毒病疫苗的首免日龄必须考虑母源抗体的干扰作用。Ferrando等把没有免疫圆环病毒病疫苗的母猪所产的小猪分别在3周龄、6周龄或10周龄首免圆环病毒病疫苗,发现3周龄或6周龄首免效果较为一致,均可以更快地发生血清转阳,且病毒血症的持续时间比10周龄首免短[16]。国内梁恒英等[17]研究不同时间免疫圆环病毒病疫苗对猪生长性能的影响,发现6周龄免疫死淘率最低。考虑到目前所有圆环病毒病疫苗的免疫有效期几乎都在4个月,而且目前肥猪出栏的体重也由传统的110千克调整到130千克左右,甚至150千克,饲养周期明显延长,同时圆环病毒病的防控关口已经后移到肥育期,因此仔猪圆环病毒病疫苗免疫程序的制定需要充分考虑母源抗体、生产感染阶段、饲养周期等。如果母猪免疫圆环病毒病疫苗,为避免母源抗体的干扰,或肥育期出现圆环病毒病临床症状,仔猪在6周龄免疫。母猪不免疫圆环病毒病疫苗或保育舍有圆环病毒感染压力,仔猪在2~3周龄免疫。
此外,其他疾病的影响,如蓝耳病、伪狂犬病、猪瘟的感染均可导致圆环病毒病疫苗的免疫失败。尤其是蓝耳病病毒(PRRSV)与圆环病毒混合感染导致的协同致病危害性更大[18]。PRRSV与PCV2共感染时,PCV2能够加重PRRSV引起间质性肺炎的程度,感染PRRSV则为PCV2的大量复制创造了条件,PCV2大量复制导致机体免疫系统受到更为严重的损伤,临床上表现出更严重的致病性。而且PRRSV的感染导致单核细胞和巨噬细胞及周围的其他淋巴细胞凋亡更为严重,从而使机体的先天性免疫系统遭到破坏而不能充分调动特异性免疫系统,导致免疫失败。
5 结论
PCV2疫苗的广泛使用,降低了病毒载量,但是现在市场上所有的圆环病毒病疫苗都无法引起消除性免疫力,所以并不能完全根除猪场的PCV2,即在免疫的情况下猪只仍可以感染PCV2,给PCV2提供了在猪体内进化的机会,加快PCV2的进化速度,从而导致新的基因型的出现。因此,监测PCV2流行毒株的基因型,根据流行病学变化评估现有圆环病毒病疫苗的交叉免疫效果,是今后猪圆环病毒病研究需要考虑的重要问题。
[1] Schibahara T,Sato K,Ishikawa Y.J Vet Med Sci[J] ,2000,62(11):1125-1131.
[2] Gagnon C A,Tremblay D,Tijssen P,et al.Can Vet J[J] ,2007,48(8):811-819.
[3] Segalés J.Virus Res[J] ,2012,164(1-2):10-19.
[4] Saha D,Lefebvre D J,Van Doorsselaere J,et al.Vet Microbiol[J] ,2010,145(1-2):62-68.
[5] Sarli G,Morandi F,Panarese S,et al.Acta Vet Scand[J] ,2012,31:1-9.
[6] Segalés J,Calsamiglia M,Olvera A,et al.Vet Microbiol[J] ,2005,111(3-4):223-229.
[7] Opriessnig T,Langohr I.Vet Pathol[J] ,2013,50(1):23-38.
[8] Xiao C T,Halbur P G,Opriessnig T.J Gen Virol[J] ,2015,96:1830-1841.
[9] Li W,Wang X,Ma T,et al.Virus Genes[J] ,2010,40:244-251.
[10] Guo L J,Lu Y H,Wei Y W,et al.Virol J[J] ,2010,273(7):1-12.
[11] Jiang C G,Wang G,Tu Y B,et al.Archives of Virology[J] ,2017,162(9):2715-2726.
[12] Palinski R,Piñeyro P,Shang P,et al.J Virol[J] ,2016,91(1):1-13.
[13] Shen H,Liu X,Zhang P,et al.Transbound Emerg Dis[J] ,2017,1:1-3.
[14] Opriessnig T,O'Neill K,Gerber P F,et al.Vaccine[J] ,2013,31(3):487-494.
[15] Pejsak Z,Podgórska K,Truszczyński M,et al.Comp Immunol Microbiol Infect Dis[J] ,2010,33(6):1-5.
[16] SOliver-Ferrando,J Segalés,S López-Soria,et al.Vet Res[J] ,2016,47(121):1-11.
[17] 梁恒英,邓强,陈远鹏,等.养猪[J] ,2017(1):123-124.
[18] 范培虎,危艳武,郭龙军,等.中国农业科学[J] ,2012,45(18):3859-3872.
(编辑:富春妮)
S858.28
A
1002-1957(2017)05-0105-03
2017-08-28
林文耀(1985-),男,广东吴川人,执业兽医师,硕士,主要从事规模化猪场生产管理和猪病防控工作.
E-mail:linwenyao@jinyubaoling.com.cn

