组蛋白去乙酰化酶5下调SIX1的表达以抑制结直肠癌细胞增殖的研究
王加伟,许安东,朱云祥
(扬州大学附属医院 普外科,江苏 扬州,225000)
论著
组蛋白去乙酰化酶5下调SIX1的表达以抑制结直肠癌细胞增殖的研究
王加伟,许安东,朱云祥
(扬州大学附属医院 普外科,江苏 扬州,225000)
目的探讨组蛋白去乙酰化酶5(HDAC5)在结直肠癌组织中的表达情况以及在结直肠癌细胞系中的机制。方法采用免疫组织化学技术检测HDAC5在结直肠癌组织中的表达情况,分析HDAC5表达量与患者生存预后的关系。在细胞水平敲除HDAC5后,观察细胞的增殖、迁移能力以及凋亡功能的变化。结果HDAC5在结直肠癌组织中的阳性表达与生存预后较差显著相关。在肿瘤细胞系中,HDAC5通过调控SIX1影响细胞的增殖。结论HDAC5在结直肠癌组织表达有差异,与结直肠癌生存预后相关,并可通过调控SIX1的表达影响细胞的增殖。
结直肠癌;组蛋白去乙酰化酶;SIX1;增殖
ABSTRACT:ObjectiveTo investigate expression of histone deacetylase 5 (HDAC5) in normal and colorectal cancer (CRC) tissues and its mechanism.MethodsImmunohistochemistry was used to detect the expression of HDAC5 in CRC tissues.The relationship between HDAC5 expression content and survival prognosis was analyzed.Proliferation,immigration and apoptosis changes were observed after knockdown of HDAC5.ResultsPositive expression of HDAC5 in tumor tissue was related with poor prognosis of CRC patients,and HDAC5 could inhibit the LS174T cell proliferation by regulating the SIX1 expression.ConclusionOur results reveal that HDAC5 expression is variant in CRC tissues,and it is correlated with prognosis of colorectal cancer,and can affect cell proliferation by regulating the SIX1 expression.
KEYWORDS:colorectal cancer;histone deacetylase;SIX1;proliferation
结直肠癌是常见消化道恶性肿瘤之一,其发病率随年龄增长而逐渐升高,而远期生存率则逐渐降低,且男性发病率和死亡率相对于女性较高,总体发病率和死亡率逐年升高[1]。肿瘤早期无转移的患者5年生存率80%~90%,而晚期转移的患者仅为10%~20%[2]。肿瘤的根治性切除已经明显增加了患者的5年生存率,但是结直肠癌是一种具有高度特异性的恶性肿瘤,其在临床病理特征、组织形态、免疫表型、治疗效果以及生物学行为等方面存在较大差异,肿瘤的转移和复发仍然是患者重要的死亡原因[3-4]。
组蛋白的乙酰化与去乙酰化的平衡是调节DNA复制与修复、有丝分裂过程、染色质结构的重要机制。组蛋白的去乙酰化是去除赖氨酸残基上乙酰基的作用,恢复组蛋白的正电性,增加组蛋白与带负电的DNA间的吸引力,从而阻止转录调控元件靠近启动子而达到抑制基因转录的作用[5-7]。去乙酰化过度会导致调节肿瘤细胞增殖与迁移、血管生成与分化、浸润和转移相关的抑癌基因的转录抑制,从而引起肿瘤的发生,而去乙酰化这一反应主要由去乙酰化酶催化[8-9]。作为Ⅱ型去乙酰化酶家族成员之一的去乙酰化酶5(HDAC5)[10],在急性髓性白血病[11]、骨肉瘤[12]、髓母细胞瘤[13]、肺癌[14]等肿瘤细胞中均有表达上调,且在髓母细胞瘤中,HDAC5的表达上调和该疾病的预后呈负相关[13],在结直肠癌中的也有相关报道[15-16]。作者设想HDAC5在结直肠癌中的表达程度与肿瘤患者的预后是否相关,能否通过抑制HDAC5在结直肠癌细胞系中的表达来影响细胞的增殖、迁移和凋亡功能。
1 材料与方法
1.1 组织样本及细胞培养
本研究中,患者蜡块组织来自新华医院结直肠癌诊治中心(免疫组织化学芯片,包含180例患者样本信息)。本实验通过了新华医院伦理委员会,每位参与者都签订了知情同意书。研究中用到的细胞系(RKO,LOVO,HT29,SW48,HCT116,LS174T,SW480,SW620,293FT)均从中国科学院购买,培养条件是DMEM培养基+10%胎牛血清+1%双抗,细胞培养在37℃、5%CO2条件下。
1.2 质粒构建和慢病毒包装感染
HDAC5,SIX1敲除序列参考Sigma公司网站,插入PLKO载体中,与包装质粒PAPAX2和PMD2G共转染293FT细胞,收取上清病毒液离心后感染细胞,采用Puromycin (Sigma)筛选稳转细胞株。
1.3 实时定量PCR和Western Blot
cDNA均由细胞中的总RNA(Trizol法)反转录获得,使用SYBR Green Premix Ex Taq 试剂盒于ABI 7500系统进行实施定量PCR实验,试剂盒均买自Takara公司。
参考碧云天细胞裂解试剂盒(P0013B),裂解细胞提取总蛋白,采用BCA试剂盒(碧云天)进行蛋白定量,取20 μg总蛋白,10%聚丙烯酰胺凝胶电泳分离,电转移到NC膜上,5%浓度的牛奶封闭后,一抗(1∶1 000)稀释后加入孵育,β-Actin作为内参,二抗孵育后(2∶1 000),用 Milipol化学发光试剂盒检测蛋白强度。见表1。

表1 HDAC5的相关引物
1.4 免疫组织化学
免疫组织化学实验采用SP法,操作过程严格参照说明书进行,一抗购自Sigma公司,阳性对照使用由既往实验证实的阳性组织,阴性对照使用PBS代替一抗。结果分析:棕黄色颗粒为阳性颗粒,根据染色强弱,染色强度评分为0分(阴性)、1分(弱阳性)、2分(阳性)以及3分(强阳性);根据染色百分比,染色百分比评分为1分(<25%细胞染色),2分(25%~50%细胞染色),3分(51%~75%细胞染色),以及 4分(>75%细胞染色),最后的免疫评分(IRS)为细胞染色强度评分和染色百分比评分的乘积。IRS 0~4分为阴性,IRS 5~12分阳性。采用SPSS 16.0统计软件,图片数据使用Graphpad处理。
2 结 果
组织芯片免疫组织化学结果显示,HDAC5在结直肠癌组织中存在差异性表达,通过分析生存预后数据发现,HDAC5阳性的患者生存预后相对于阴性的患者较差,差异有统计学意义(P<0.05)。HDAC5蛋白表达的阳性率与结直肠癌临床分期、浸润深度以及生长部位、性别等其他临床特征无关,而Ⅲ期和Ⅳ期的阳性率显著高于Ⅰ期和Ⅱ期(0.738∶0.545,P=0.011),见表2,图1A、B。180位患者HDAC5组织芯片Kaplan-Meier生存曲线显示,在80个月的随访中,高表达HDAC5的患者生存时间较低表达的患者显著较短(P=0.002)。见图1C。
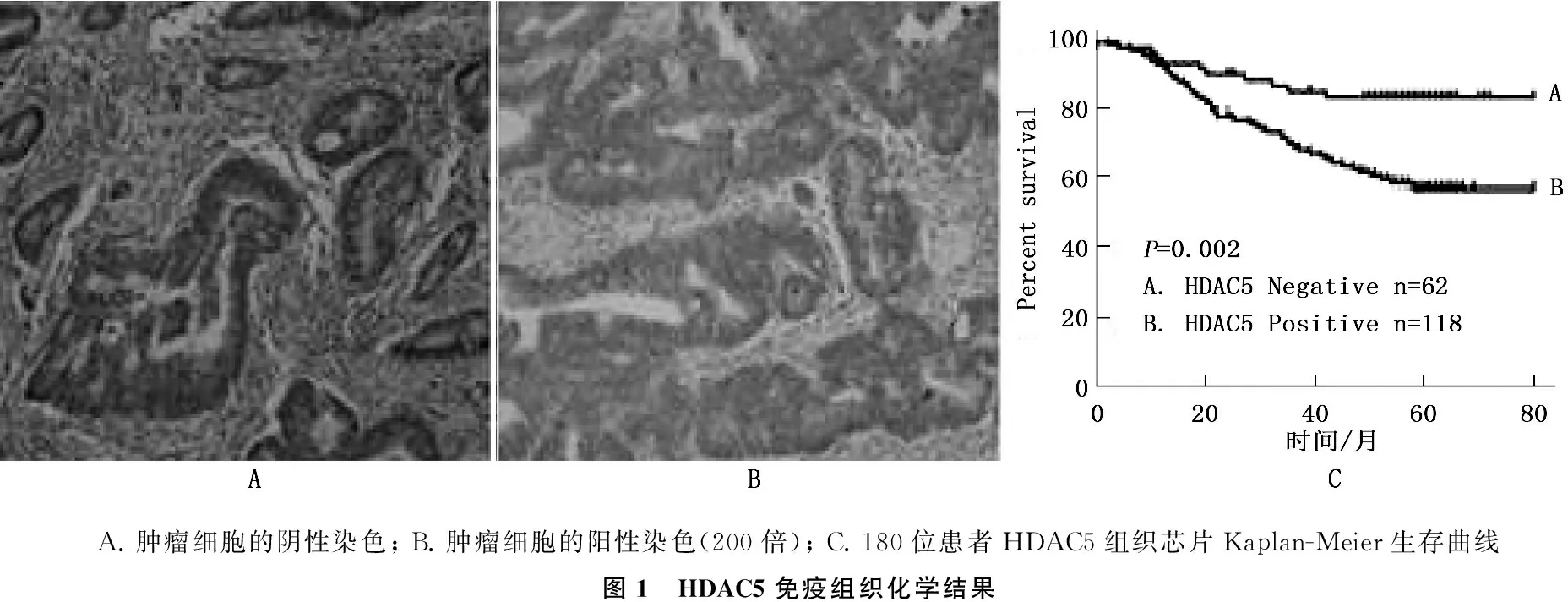
A.肿瘤细胞的阴性染色;B.肿瘤细胞的阳性染色(200倍);C.180位患者HDAC5组织芯片Kaplan-Meier生存曲线图1 HDAC5免疫组织化学结果
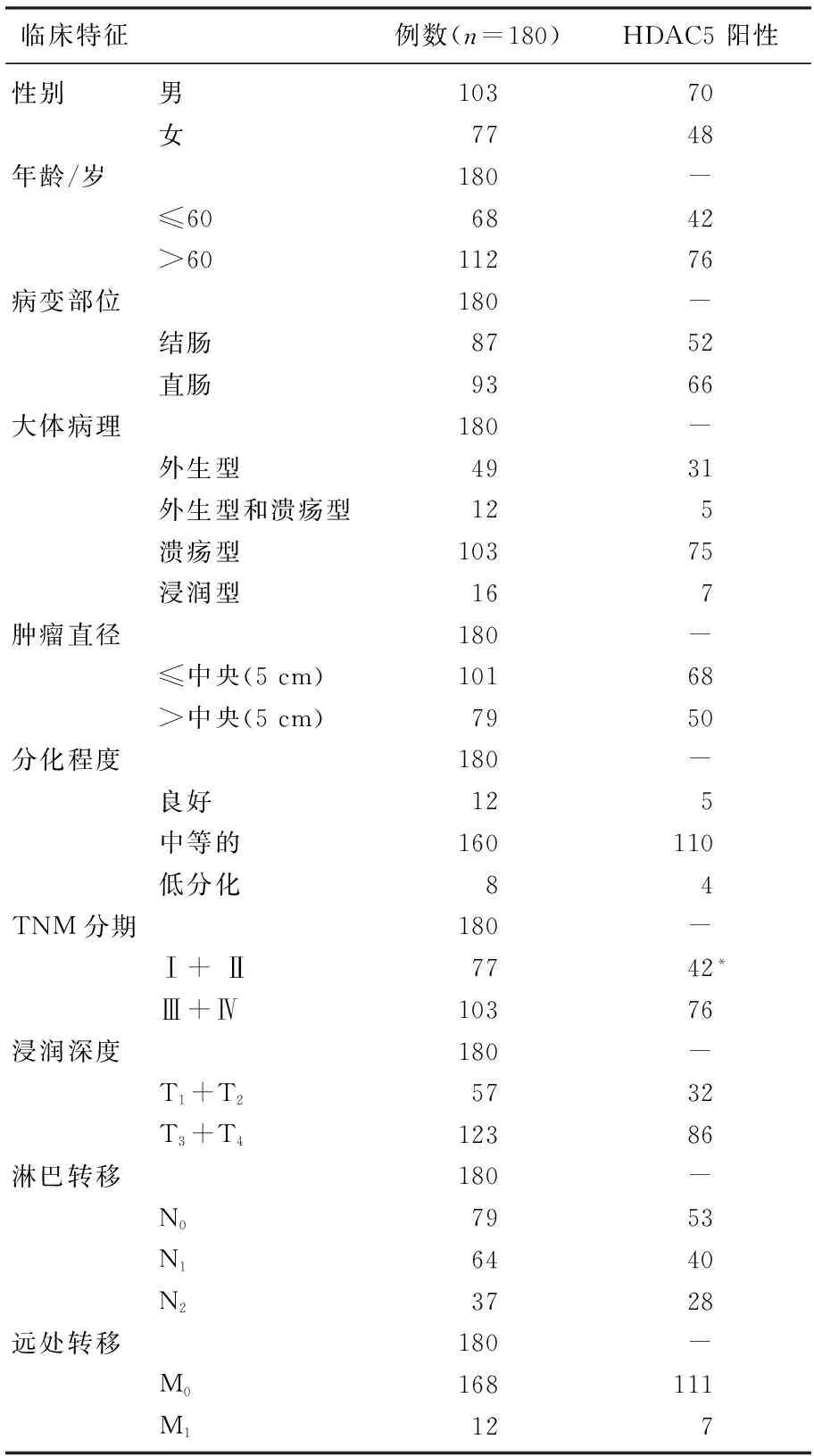
表2 HDAC5的阳性表达与临床特征的关系
与同一临床特征另一亚项比较,*P<0.05。
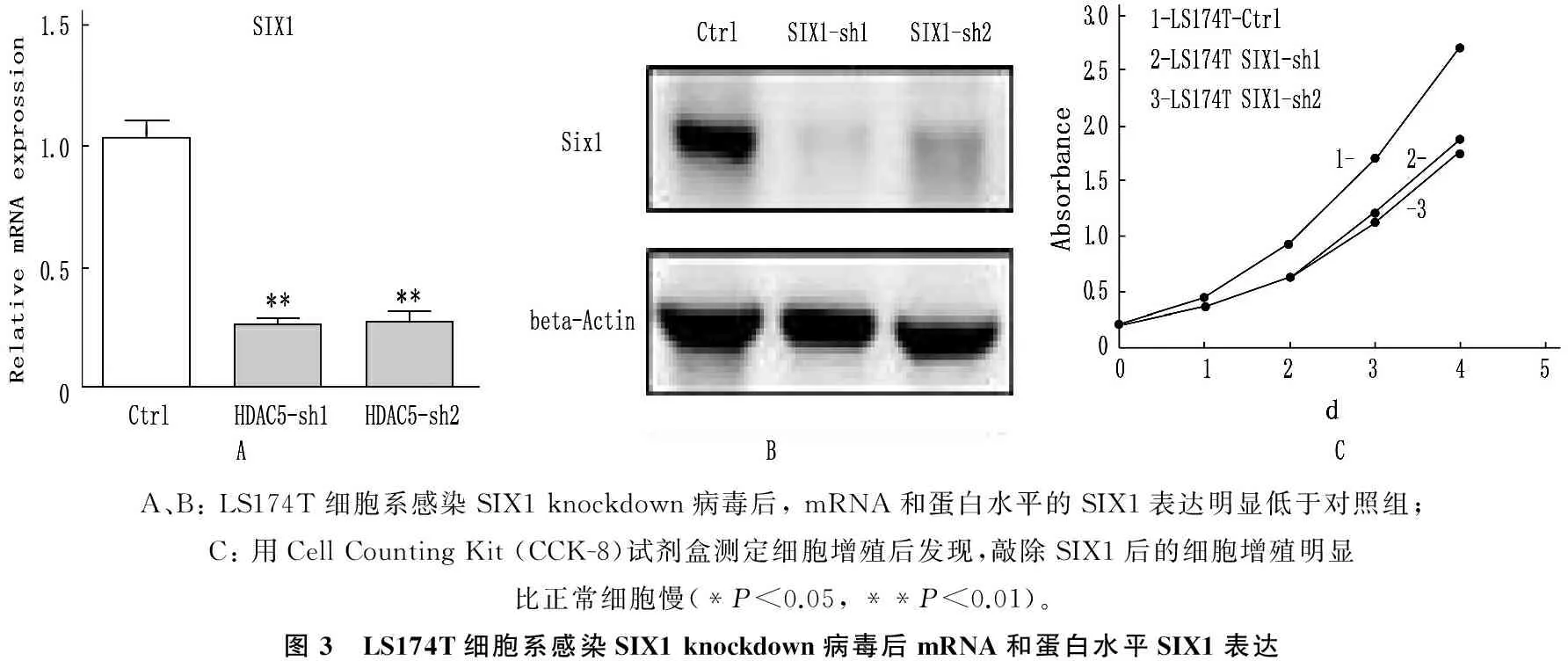
在本实验中心,所有的结直肠癌细胞系(RKO,LOVO,HT29,SW48,HCT116,LS174T,SW480,SW620)中检测蛋白水平HDAC5的表达情况发现,LS174T细胞系中的HDAC5表达水平明显比其他细胞系高。将此细胞系感染HDAC5 knockdown病毒后发现,HDAC5在mRNA和蛋白水平敲除效率均较好,同时发现HDAC5敲低后SIX1的表达下调明显,且敲除HDAC5后的细胞增殖明显比对照组的细胞慢。见图2。LS174T细胞系感染SIX1 knockdown病毒后,在mRNA和蛋白水平SIX1均得到了明显的敲低,同样细胞的增殖也明显比对照组细胞慢。见图3。
3 讨 论
目前,结直肠癌作为世界上最常见的消化道恶性肿瘤之一,其发病机制仍不明确,尽管根治性切除已经很大程度上延长了患者的生存期,但肿瘤的早期症状不明显,大部分肿瘤患者确诊时已处于中晚期,无法通过手术或放化疗达到根治疾病的目的,肿瘤的晚期转移和复发仍然是结直肠癌患者死亡的重要原因[17]。组蛋白的乙酰化与去乙酰化的平衡影响着细胞的多项功能,HDAC5作为Ⅱ型去乙酰化酶家族成员之一,在多种肿瘤的发生发展起着重要的作用,影响患者的预后。分析组织芯片免疫组织化学结果发现,HDAC5蛋白表达量较高的患者的生存预后比蛋白低表达患者要短,进一步综合分析后发现,HDAC5蛋白在结直肠癌Ⅲ期和Ⅳ期患者组织中的阳性率高于Ⅰ期和Ⅱ期的患者(0.738∶0.545,P=0.011)。
在8种结直肠癌细胞系中检测HDAC5的蛋白表达情况发现,LS174T细胞中的HDAC5表达显著高于其他细胞系,由此采用该细胞系进行进一步的下游实验。采用293FT细胞包装HDAC5 knockdown病毒后感染LS174T细胞后发现,无论是mRNA水平还是蛋白水平,HDAC5的表达都显著降低。当HDAC5表达降低后,作者发现SIX1的表达水平也有所降低。通过进行HDAC5knockdown稳系的功能实验发现,HDAC5 knockdown细胞的增殖明显比对照组的细胞慢。作者构建SIX1 knockdown的病毒,并感染LS174T细胞后发现,mRNA水平和蛋白水平上,SIX1的表达均明显降低,同样细胞功能实验发现SIX1 knockdown的细胞的增殖比对照组慢。
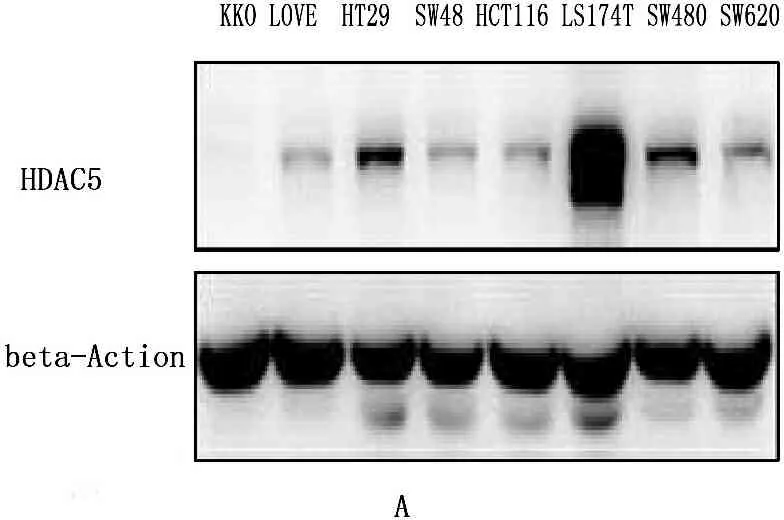
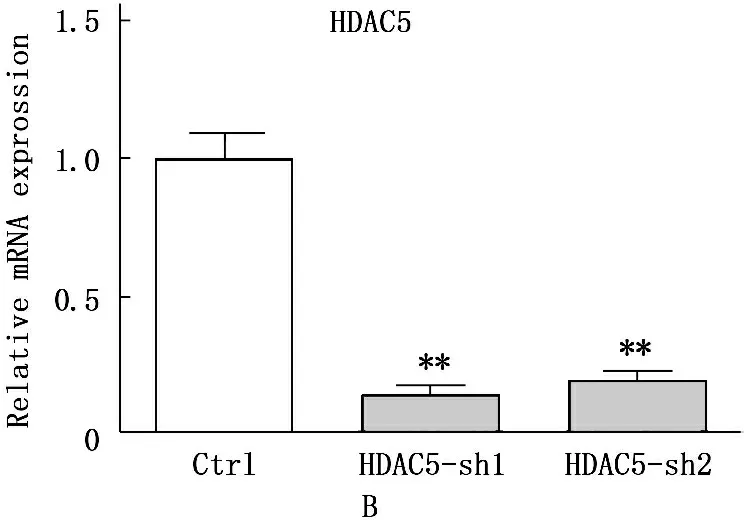
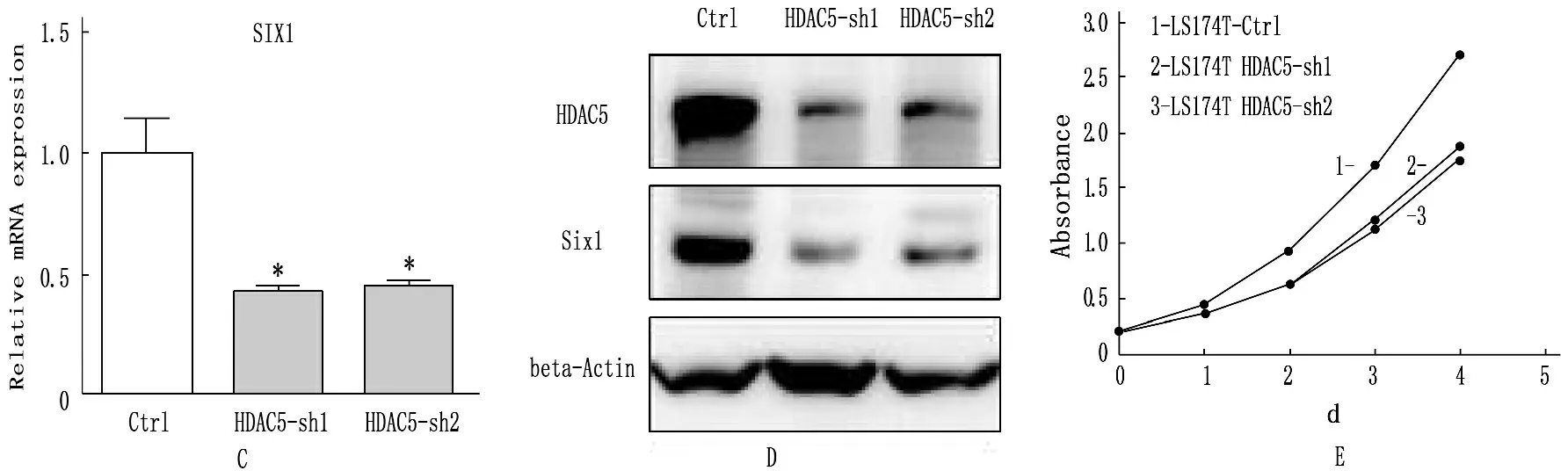
A:结直肠肿瘤细胞系中HDAC5蛋白水平表达情况;B、C、D:LS174T细胞系感染HDAC5 knockdown病毒后,mRNA和蛋白水平的HDAC5和SIX1表达均比对照组明显降低;E:采用Cell Counting Kit (CCK-8)试剂盒测定细胞增殖后发现,敲除HDAC5后的细胞增殖明显比对照组细胞慢(*P<0.05,**P<0.01)。
SIX1是一种与果蝇正弦眼发育有关的基因,在人类组织中相对比较保守[18]。在多种器官的发育早期,SIX1的表达相对较高,但是在成人的组织器官中较低甚至是缺失[19]。Coletta等[20]发现SIX1可以通过上调Cyclin A1促进乳腺癌细胞的增殖,以及在横纹肌肉瘤的转移功能中起着重要的作用[21-24]。作者发现HDAC5在患者组织中高表达与预后较差相关,且HDAC5可以通过下调SIX1来抑制结直肠肿瘤细胞的增殖,为HDAC5抑制剂的研究和临床应用提供一定的理论和实验基础[25-27]。
[1] Siegel R L,Miller K D,Jemal A.Cancer statistics,2015[J].CA Cancer J Clin,2015,65(1):5-29.
[2] Zhu Y,Tang W,Liu Y,et al.CCX-CKR expression in colorectal cancer and patient survival[J].Int J Biol Markers,2014,29(1):e40-e48.
[3] Tang W,Zhu Y,Gao J,et al.MicroRNA-29a promotes colorectal cancer metastasis by regulating matrix metalloproteinase 2 and E-cadherin via KLF4[J].Br J Cancer,2014,110(2):450-458.
[4] Mina L A,Sledge GW Jr.Rethinking the metastatic cascade as a therapeutic target[J].Nat Rev Clin Oncol,2011,8(6):325-332.
[5] Gronbaek K,Hother C,Jones P A.Epigenetic changes in cancer[J].APMIS,2007,115(10):1039-1059.
[6] Budillon A,Di Gennaro E,Bruzzese F,et al.Histone deacetylase inhibitors:a new wave of molecular targeted anticancer agents[J].Recent Pat Anticancer Drug Discov,2007,2(2):119-134.
[7] Brest P,Gustafsson M,Mossberg A K,et al.Histone deacetylase inhibitors promote the tumoricidal effect of HAMLET[J].Cancer Res,2007,67(23):11327-11334.
[8] Grabarska A,Dmoszyńska-Graniczka M,Nowosadzka E,et al.Histone deacetylase inhibitors - molecular mechanisms of actions and clinical applications[J].Postepy Hig Med Dosw (Online),2013,67:722-735.
[9] Glozak M A,Seto E.Histone deacetylases and cancer[J].Oncogene,2007,26(37):5420-5432.
[10] Hehlgans S,Storch K,Lange I,et al.The novel HDAC inhibitor NDACI054 sensitizes human cancer cells to radiotherapy[J].Radiother Oncol,2013,109(1):126-132.
[11] Kitamura Y,Shimizu K,Tanaka S,et al.Allelotyping of anaplastic thyroid carcinoma:frequent allelic losses on 1q,9p,11,17,19p,and 22q[J].Genes Chromosomes Cancer,2000,27(3):244-251.
[12] Chen J,Xia J,Yu Y L,et al.HDAC5 promotes osteosarcoma progression by upregulation of Twist 1 expression[J].Tumour Biol,2014,35(2):1383-1387.
[13] Milde T,Oehme I,Korshunov A,et al.HDAC5 and HDAC9 in medulloblastoma:novel markers for risk stratification and role in tumor cell growth[J].Clin Cancer Res,2010,16(12):3240-3252.
[14] Osada H,Tatematsu Y,Saito H,et al.Reduced expression of class II histone deacetylase genes is associated with poor prognosis in lung cancer patients[J].Int J Cancer,2004,112(1):26-32.
[15] Scanlan M J,Welt S,Gordon C M,et al.Cancer-related serological recognition of human colon cancer:identification of potential diagnostic and immunotherapeutic targets[J].Cancer Res,2002,62(14):4041-4047.
[17] Coussens L M,Werb Z.Inflammation and cancer[J].Nature,2002,420(6917):860-867.
[18] Anderson A M,Weasner B M,Weasner B P,et al.Dual transcriptional activities of SIX proteins define their roles in normal and ectopic eye development[J].Development,2012,139(5):991-1000.
[19] Ford H L,Kabingu E N,Bump E A,et al.Abrogation of the G2 cell cycle checkpoint associated with overexpression of HSIX1:a possible mechanism of breast carcinogenesis[J].Proc Natl Acad Sci USA,1998,95(21):12608-12613.
[20] Coletta R D,Christensen K,Reichenberger K J,et al.The Six1 homeoprotein stimulates tumorigenesis by reactivation of cyclin A1[J].Proc Natl Acad Sci USA,2004,101(17):6478-6483.
[21] Yu Y,Khan J,Khanna C,et al.Expression profiling identifies the cytoskeletal organizer ezrin and the developmental homeoprotein Six-1 as key metastatic regulators[J].Nat Med,2004,10(2):175-181.
[22] 罗慧,陈诚,梁志清.组蛋白H3、H4乙酰化及H3K4甲基化对人妊娠子宫平滑肌细胞PRA/PRB的影响[J]第三军医大学学报,2014,36(9):868-872.
[23] 洪伟俊,宁允叶,胥武剑,等.组蛋白去乙酰化酶5在非小细胞肺癌迁移中的作用研究[J].中国癌症杂志,2011,21(04):277-282.
[24] 吴延诲,刘扶摇,梁慧芳.组蛋白去乙酰化酶抑制剂增加结直肠癌对5-氟尿嘧啶的化疗敏感性的研究[J].临床合理用药杂志,2014(30):103-104.
[25] 王俊文,李俊,蔡伦,等.组蛋白去乙酰化酶3在星形细胞瘤中的表达及其临床意义[J].中国全科医学,2014(20):2333-2336.
[26] 刘燕燕,尤良顺,钱文斌,等.组蛋白去乙酰化酶抑制剂SAHA联合伊马替尼对K562细胞的协同杀伤作用[J].浙江大学学报:医学版,2012,41?(5):473-478.
[27] 李仲颖,牛朝诗,汪炎,等.组蛋白去乙酰化酶抑制剂Apicidin对胶质瘤细胞的凋亡及Nanog和p53表达的影响[J].中华神经医学杂志,2014,13?(3):246-251.
Studyoninhibitionofcolorectalcancercellproliferationviadown-regulationofSIX1expressionofhistonedeacetylase5
WANGJiawei,XUAndong,ZHUYunxiang
(DepartmentofGeneralSurgery,AffiliatedHospitalofYangzhouUniversity,Yangzhou,Jiangsu,225001)
R 735.3
A
1672-2353(2017)17-001-05
10.7619/jcmp.201717001
2017-03-20
中国博士后科学基金面上项目(2012M511109)
朱云祥

