牛乳中乳房链球菌PCR检测方法的建立
刁巧虹,卞国志,王 娟,罗蔼剑,张 莹,高潇祎,贾 坤,孙凌霜*,袁建丰*
(1.广东海大畜牧兽医研究院有限公司,广东广州 511400;2.广东海大集团股份有限公司,广东广州 511400;3.华南农业大学兽医学院,广东广州 510642;4.广东省兽医临床重大疾病综合防控重点实验室,广州广东 510642)
牛乳中乳房链球菌PCR检测方法的建立
刁巧虹1,3,4,卞国志2,3,王 娟1,2,罗蔼剑3,4,张 莹3,4,高潇祎3,贾 坤3,4,孙凌霜3,4*,袁建丰1,2*
(1.广东海大畜牧兽医研究院有限公司,广东广州 511400;2.广东海大集团股份有限公司,广东广州 511400;3.华南农业大学兽医学院,广东广州 510642;4.广东省兽医临床重大疾病综合防控重点实验室,广州广东 510642)
奶牛乳房炎是危害奶牛业最常见的疾病之一,对奶牛业造成了严重的经济损失。引起奶牛乳房炎的病原菌较多,其中乳房链球菌是常见的致病菌之一。为快速准确地检测样品中的该菌,参照GenBank公布的乳房链球菌pauA基因序列设计引物,建立了乳房链球菌的PCR检测方法。对460份临床奶样进行检测,传统细菌分离方法共检出11份(2.39%)阳性奶样;PCR方法共检出40份(8.70%)阳性奶样,2种方法的吻合率为93.7%。结果显示,建立的乳房链球菌PCR检测法敏感性高,特异性强,适用于临床检测。
奶牛乳房炎;乳房链球菌;聚合酶链反应
奶牛乳房炎是危害奶牛业最重要的疾病之一,不仅能引起牛产奶量减少,导致奶品质下降,造成严重经济损失,而且患病奶牛所产牛奶中的某些病原体亦可引起人类感染[1]。我国大部分地区奶牛乳房炎的检出率在40%~65%之间,乳房链球菌(Streptococcusuberis)是引起奶牛乳房炎最常见的致病菌之一[2-4],能够引起牛、山羊和绵羊的急性及慢性乳房炎。但病畜感染该菌后无明显的免疫反应,给该病的诊疗带来困难[5]。因此,建立快速检测乳房链球菌的方法对奶牛乳房炎的防控非常重要。
通常,临床样本中乳房链球菌的检测仍是通过细菌分离、生化试验和CAMP试验(Christie、Atkins、Munch-Peterson等人名的缩写)等经典方法。但是,由于经典方法有操作繁琐、耗时长、检出率低等缺点,影响对该菌快速准确检测及所致乳房炎的治疗;现有检测乳房链球菌的聚合酶链反应(polymerase chain reaction,PCR)技术有普通PCR、多重PCR、实时荧光定量PCR,以及环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)等,其中普通PCR方法具有操作简单、成本低的特点,应用广泛。目前检测乳房链球菌的普通PCR主要是基于16 S rRNA基因。在细菌基因组中,rRNA的操纵子通常是多基因的,对于16 S rDNA,从GenBank 检索的序列可以代表其中的一个操纵子,但基于这个序列设计出来的引物或探针可能不能检出种属里所有的菌株[6]。而纤溶酶原激酶A(plasminogen activactor A,pauA)是乳房链球菌重要的毒力因子,能分解血浆酶原,具有高度的保守性,广泛存在并有很强的免疫原性[7],更适于该菌的检测。
本试验将普通PCR技术应用到奶牛乳房炎病原菌的检测,建立一种基于pauA基因检测乳房链球菌的方法,为快速检测奶牛乳房炎中乳房链球菌提供新的手段。
1 材料与方法
1.1 材料
1.1.1 菌株与奶样 乳房链球菌、无乳链球菌、停乳链球菌、金黄色葡萄球菌、大肠埃希菌和沙门菌为广东海大畜牧兽医研究院实验室临床分离鉴定保存。8株临床分离鉴定的乳房链球菌和460份临床奶样由华南农业大学临床实验室提供。
1.1.2 主要试剂及仪器 pMDTM18-T Vector Cloning Kit、EscherichiacoliDH5α Competent Cells、脱氧核糖核酸(deoxyribonucleic acid,DNA )Marker、Taq聚合酶(Taqpolymerase)和PCR相关试剂,宝生物工程(大连)有限公司产品;胶回收试剂盒,Omega公司产品;快速质粒小提试剂盒,天根生化科技(北京)有限公司产品;细菌基因组DNA小量试剂盒,AxyPrep公司产品;胰蛋白胨大豆琼脂培养基,广东环凯微生物科技有限公司产品;PCR仪,伯乐生命医学产品(上海)有限公司产品;电泳仪,北京市六一仪器厂生产;凝胶成像系统,上海天能科技有限公司产品;台式冷冻恒温振荡器,江苏太仓市实验设备厂生产。
1.2 方法
1.2.1 引物的设计与合成 根据GenBank公布的乳房链球菌保守序列pauA基因序列(KT006567.1),设计了1对特异性引物F1与R1和1对扩增基因全长引物F2与R2,以及16 S rRNA引物[8],由英潍捷基(上海)贸易有限公司合成,引物序列见表1。
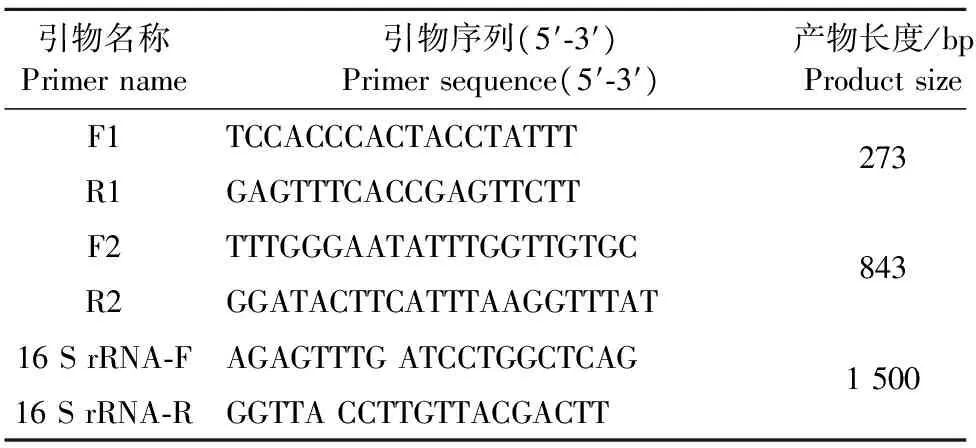
表1 引物名称及其序列
1.2.2 DNA模板制备 用AxyPrep细菌基因组DNA小量试剂盒提取DNA模板,置-20℃保存。
1.2.3 pMD-18T-pauA重组载体的构建 以乳房链球菌DNA为模板,用引物F2和R2 扩增pauA基因全长序列,琼脂糖凝胶电泳后胶回收目的片段,回收产物连接到pMD-18T载体,转化至大肠埃希菌DH5α,挑取单克隆经PCR鉴定,阳性克隆送至英潍捷基(上海)贸易有限公司测序。成功构建重组载体后,快速质粒小提试剂盒提取质粒DNA,置-20℃保存。
1.2.4 PCR的建立及条件优化 以提取的乳房链球菌DNA为模板,对PCR各反应条件进行优化。反应体系25 μL包括Taq酶1 U,10×PCR缓冲液2.5 μL,MgCl2浓度为2.0 mmol/L,dNTP 浓度为0.2 mmol/L,pauA上、下游引物浓度0.8 μmol/L,模板量25 ng,双蒸水补足到25 μL。依次对PCR的退火温度、Taq酶浓度和引物浓度进行优化。1.2.5 特异性试验 以乳房链球菌、无乳链球菌、停乳链球菌、金黄色葡萄球菌、大肠埃希菌和沙门菌的基因组DNA为模板,设置重组载体和无菌双蒸水分别为阳性对照和阴性对照, PCR后电泳分析结果。1.2.6 敏感性试验 以提取的重组载体,用无菌双蒸水做10倍梯度稀释,取108、107、106、105、104、103、102、101CFU/mL的8个浓度梯度分别为模板,设置无菌双蒸水为阴性对照。PCR后电泳分析结果。
1.2.7 临床菌株检测 对从广东多个规模化养殖场的牛群中分离鉴定的8株乳房链球菌进行检测,PCR后电泳分析结果。
1.2.8 临床样本检测 在广东地区奶牛场无菌采集临床乳汁样品460份,同时用传统细菌分离结合16 S rRNA测序鉴定法和建立的PCR检测方法对样品进行检测,记录并进行统计分析。
传统细菌分离结合16 S rRNA测序鉴定法是对从奶样分离到的菌株进行16 S rRNA PCR扩增、测序及序列比对,确定菌株种系,可作为细菌分离鉴定的金标准[9]。乳房链球菌在TSA平板上形成灰白、光滑、圆形,突起,闪光细小菌落[5]。将奶样细菌分离后,挑取革兰染色阳性球菌、触酶阴性且在TSA平板上菌落形态与乳房链球菌相同的菌,进行16 S rRNA序列PCR扩增,反应条件为:94℃ 5 min;94℃ 1 min,55℃ 1 min,72℃ 1 min,30个循环;72℃ 10 min。将PCR产物直接由华大基因公司测序。序列经比对,确定该菌株种系。
2 结果
2.1 pMD-18T-pauA重组载体的构建
构建重组载体后,经PCR鉴定的阳性大肠埃希菌DH5α菌液送测序,测序结果经BLAST比对,与pauA基因序列(KT006567.1)的同源性为100%,说明成功获得了pauA基因。
2.2 PCR反应条件优化结果
以乳房链球菌的DNA为模板,对乳房链球菌PCR的退火温度及引物浓度进行优化分析。结果显示,当退火温度为54.1℃时,目的条带最为清晰,52.4℃~55℃之间时,目的条带都比较清晰,低于52.4℃则逐渐减弱, 表明PCR最佳的退火温度为54℃(图1);当Taq酶为0.75U时,即可以扩增出清晰稳定的目的条带,表明0.75 U的Taq酶即可满足扩增效率(图2);当引物浓度为0.02 μmol/L 时,能扩增出目的条带,但条带较弱,引物浓度为0.2 μmol/L时,就能扩增出清晰的目的条带,表明引物浓度为0.2 μmol/L即可满足扩增效率(图3)。
综上所述,PCR反应体系25 μL为:Taq酶0.75 U,10×PCR缓冲液2.5 μL,MgCl2浓度为2.0 mmol/L,dNTP 浓度为200 μmol/L,上、下游引物浓度0.2 μmol/L,模板量25 ng,双蒸水补足到25 μL;反应程序为:95℃ 5 min;95℃ 30 s,55℃ 30 s,72℃ 30 s,35个循环;72℃ 10 min。
M.DNA标准DL 2 000; 1. 55℃; 2. 54.1℃; 3. 52.4℃; 4. 49.5℃; 5. 45.8℃; 6. 42.9℃; 7. 40℃;8.阴性对照
M.DNA Marker DL 2 000; 1. 55℃; 2. 54.1℃; 3. 52.4℃; 4. 49.5℃; 5. 45.8℃; 6. 42.9℃; 7. 40℃;8.Negative control
图1退火温度梯度试验
Fig.1 Annealing temperature gradient test

M.DNA标准DL 1 000; 1. 0.25 U; 2. 0.5 U; 3. 0.75 U; 4. 1 U; 5. 1.25 U; 6. 1.5 U; 7.阴性对照
M.DNA Marker DL 1 000; 1. 0.25 U; 2. 0.5 U; 3. 0.75 U; 4. 1 U; 5. 1.25 U; 6. 1.5 U; 7.Negative control
图2Taq酶浓度梯度试验
Fig.2Taqenzyme concentration gradient test
2.3 特异性试验结果
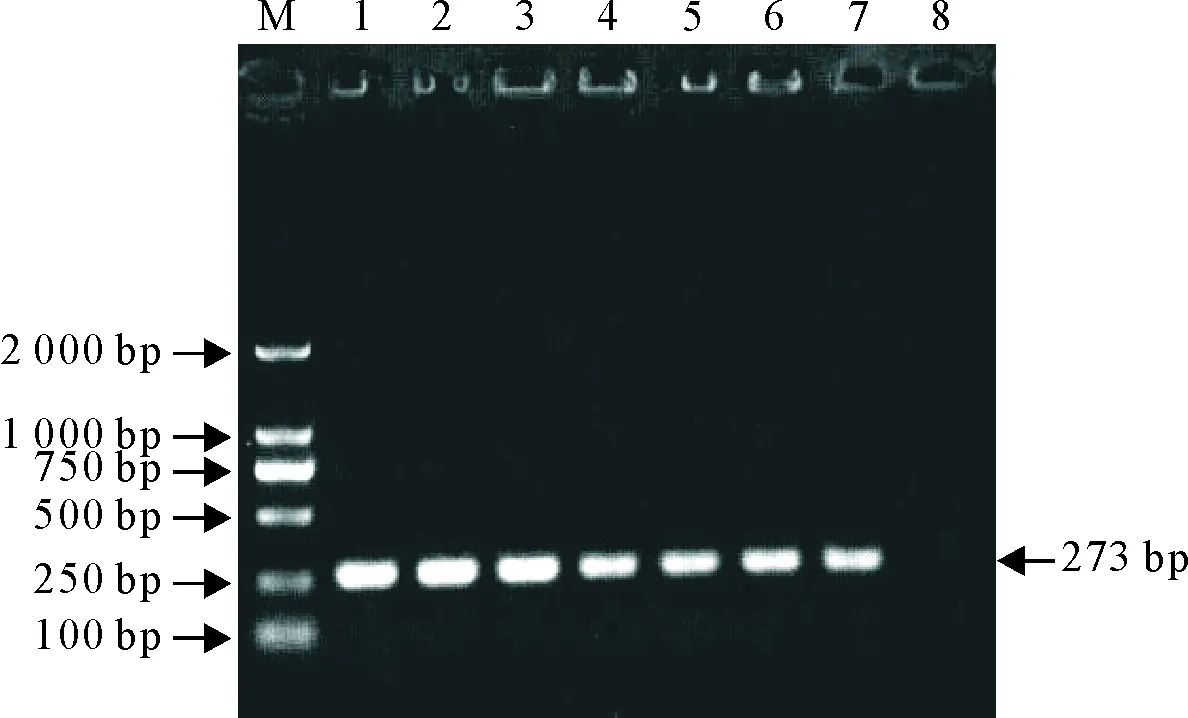
特异性试验除了乳房链球菌样品及阳性对照出现大小为273 bp的单一特异性条带外,其余样品的扩增结果均未见任何条带,表明该方法特异性良好(图4)。
2.4 敏感性试验结果
敏感性试验结果,其敏感性为103CFU/mL,表明具有较好的敏感性(图5)。
2.5 临床菌株检测结果
对临床中已分离鉴定的8株乳房链球菌的进行PCR检测试验,结果除了阴性对照外,从临床中分离到的乳房链球菌及阳性对照均有且仅有大小为273 bp的单一特异性条带,表明所建立的PCR检测方法能够准确、特异的检测出不同来源的乳房链球菌(图6)。

M.DNA标准DL 1 000; 1. 0.4 μmol/L; 2. 0.2 μmol/L; 3. 0.04 μmol/L; 4. 0.02 μmol/L; 5. 0.012 μmol/L; 6. 0.004 μmol/L; 7.阴性对照
M.DNA Marker DL 1 000; 1. 0.4 μmol/L; 2. 0.2 μmol/L; 3. 0.04 μmol/L; 4. 0.02 μmol/L; 5. 0.012 μmol/L; 6. 0.004 μmol/L; 7.Negative control
图3引物浓度优化试验
Fig.3 Primer concentration optimization test

M.DNA标准DL 1 000; 1.乳房链球菌; 2.无乳链球菌; 3.停乳链球菌; 4.金黄色葡萄球菌; 5.沙门菌; 6.大肠埃希菌; 7.阴性对照;8.阳性对照
M.DNA Marker DL 1 000; 1.Streptococcusuberis; 2.Streptococcusagalactiae; 3.Streptococcusdysgalactiae; 4.Staphylococcusaureus; 5.Salmonella; 6.Escherichiacoli; 7.Negative control; 8.Positive control
图4特异性试验
Fig.4 Specificity test
2.6 临床样本检测结果
分别用传统细菌分离和本PCR方法对广东地区10个奶牛场临床采集的460份临床型和亚临床型乳房炎奶样进行检测。结果显示,传统细菌分离结合16 S rRNA测序鉴定法共检测出11份奶样含有乳房链球菌,检出率为2.39%; PCR法共检出了40份奶样中含有乳房链球菌,检出率为8.70%(表2)。本试验检测方法与传统鉴定法相比,特异度为93.5%,灵敏度为100%, PCR法的检出率高于传统细菌分离方法,表明建立的PCR方法在保证准确性的同时,拥有更好的灵敏度,更适用于临床样本的检查。
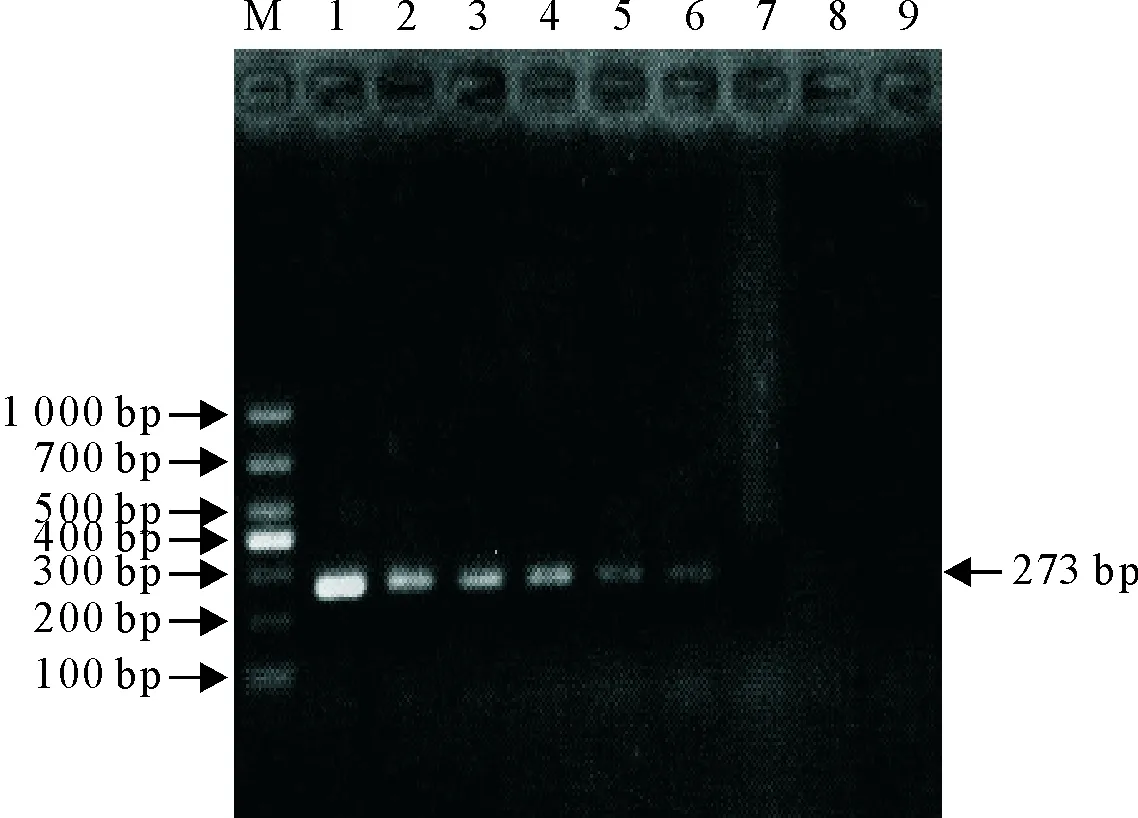
M.DNA标准DL 1 000; 1~8. 108CFU/mL~101CFU/mL;9.阴性对照
M.DNA Marker DL 1 000; 1-8. 108CFU/mL-101CFU/mL;9.Negative control
图5敏感性试验
Fig.5 Sensitivity test

M.DNA 标准DL 1 000; 1. 211zq-11; 2. 203zh-8; 3. 203zh-1; 4. 13-4; 5. 5185-7; 6. 110086-7; 7. 17-1;8. 6122-7;9.阴性对照; 10.阳性对照
M.DNA Marker DL 1 000; 1. 211zq-11; 2. 203zh-8; 3. 203zh-1; 4. 13-4; 5. 5185-7; 6. 110086-7; 7. 17-1;8.6122-7;9.Negative control; 10.Positive control

图6 临床菌株检测结果
3 讨论
奶牛乳房炎是危害奶牛业最常见的疾病之一,严重影响奶牛业健康稳定发展。乳房链球菌是该病的常见致病菌之一。建立简单、快速的乳房链球菌检测方法,能够加强对疾病的防治和减少抗生素的使用[10]。分子生物学检测方法与传统方法相比检测准确快速,适用于检测乳房链球菌的有实时荧光定量PCR[11]、多重PCR[12]、LAMP法[13]等。但是,实时荧光定量PCR费用昂贵,多重PCR其敏感性和特异性有所下降,LAMP法容易出现引物间相互反应,造成假阳性的情况[14],而普通PCR方法具有廉价、简单、快速的特点,与多重PCR和LAMP法相比拥有更高的可靠性。本研究建立的特异性检测奶牛乳房链球菌的PCR方法具有特异性强、敏感性高的特点,能够准确的对不同来源的乳房链球菌临床菌株进行检测,具有较高的可信度。与传统细菌分离结合16 S rRNA测序鉴定法相比,用传统细菌分离结合16 S rRNA测序鉴定法能够分离检测到乳房链球菌的奶样,用PCR方法均能检出,且PCR方法能够检测出传统鉴定法无法检测到乳房链球菌的样本,表明PCR方法具有更高的灵敏度。
PCR方法的灵敏度远高于传统细菌分离结合16 S rRNA测序鉴定法,在于PCR方法只要奶样中有少量的乳房链球菌DNA即可检测出来,而采用传统细菌分离方法,则有以下多种可能导致分离失败:①由于乳房链球菌营养要求高,增长速度慢,本身不易分离,而乳房炎多呈混合感染,分离时该菌容易受到其他优势菌抑制而导致分离失败;②有些临床奶样可能含有抗生素,这样的奶样细菌分离时生长受到抑制,难以分离;③假如细菌含量太少,没有带到平板中划线,或者平板划线时没有分离出单菌落,或者分离出单菌落后,出现漏挑的情况,都能导致分离失败;④细菌已经死亡,无法分离到该菌,但PCR方法仍可以检出。传统细菌分离结合16 S rRNA测序鉴定法能够准确的进行诊断,但是也存在着以上多种原因导致其灵敏度下降,且细菌分离鉴定耗时长,测序鉴定费用高,比较而言,本研究建立的PCR方法较传统细菌分离结合16 S rRNA测序鉴定法更适用于临床样品的检测。
[1] 黄冬青.浅谈奶牛乳房炎发病机理及对奶牛生产的影响[Z].河北石家庄,2016.
[2] Lundberg Å, Nyman A K, Aspán A,et al.Udder infections withStaphylococcusaureus,Streptococcusdysgalactiae,andStreptococcusuberisat calving in dairy herds with suboptimal udder health[J].J Dairy Sci,2016,99(3):2102-2117.
[3] 陈亚明.奶牛乳房炎致病菌分离鉴定及快速诊断试剂盒的研发与应用[D].广西南宁:广西大学,2014.
[4] 栾廷波,李蓓蓓.石河子地区规模化牛场奶牛隐性乳房炎的检测与流行特点分析[J].中国奶牛,2015(9):55-59.
[5] 陆承平.兽医微生物学[M].4版.北京:中国农业出版社,2007.
[6] Lin C K,Hung C L,Chiang Y C,et al.The sequence heterogenicities among 16 S rRNA genes ofSalmonellaserovars and the effects on the specificity of the primers designed[J].Int J Food Microbiol,2004,96(2):205-214.
[7] Perrig M S,Ambroggio M B,Buzzola F R,et al.Genotyping and study of the pauA and sua genes ofStreptococcusuberisisolates from bovine mastitis[J].Revista Argentina de Microbiología,2015,47(4):282-294.
[8] Edwards U,Rogall T,Blocker H,et al.Isolation and direct complete nucleotide determination of entire genes,characterization of a gene coding for 16S ribosomal RNA[J].Nucleic Acids Res,1989,17(19):7843-7853.
[9] 叶乃芳,王中新.16S rRNA及相关技术用于临床细菌鉴定的研究进展[J].国际检验医学杂志,2015(4):520-522.
[10] Trevisi E,Zecconi A,Cogrossi S,et al.Strategies for reduced antibiotic usage in dairy cattle farms[J].Res Vet Sci,2014,96(2):229-233.
[11] Surynek J,Knoll A,Vrtkova I.Construction of multiplex quantitative PCR for detection ofStreptococcalmastitis[J].Mendelnet,2014,2014:512-515.
[12] Jans C,Lacroix C,Meile L.A novel multiplex PCR/RFLP assay for the identification ofStreptococcusbovis/Streptococcusequinuscomplex members from dairy microbial communities based on the 16S rRNA gene[J].FEMS Microbiol Lett,2012,326(2):144-150.
[13] Cornelissen J B W J,De Greeff A,Heuvelink A E,et al.Rapid detection ofStreptococcusuberisin raw milk by loop-mediated isothermal amplification[J].J Dairy Sci,2016,99(6):4270-4281.
[14] Maruyama F,Kenzaka T,Yamaguchi N,et al.Detection of bacteria carrying the stx2 gene by in situ loop-mediated isothermal amplification[J].Appl Environ Microbiol,2003,69(8):5023-5028.
Abstract:Mastitis is one of the most popular diseases that causes significant economic loss in dairy cattle industry.Streptococcusuberisisis one of the pathogens leading to mastitis in dairy cows. According to the sequence ofStreptococcusuberispauA gene published by GenBank, one pair of primers were designed to establish a method for the detection ofStreptococcusuberis. And 460 milk samples were detected by this method, a total of 11 (2.39%) of positive milk samples were detected by traditional bacterial isolates, while 40(8.7%) of positive milk samples were detected by PCR, the coincidence rate between the 2 methods was 93.7%. The results showed that the new method is sensitive to detectStreptococcusuberisin clinical milk samples and had the advantages of high sensitivity and good specificity
Keywords:cows mastitis;Streptococcusuberis; polymerase chain reaction
DevelopmentofPCRforStreptococcusuberisDetectioninMilkofDairyCows
DIAO Qiao-hong1,3,4,BIAN Guo-zhi2,3,WANG Juan1,2,LUO Ai-jian3,4, ZHANG Ying3,4,GAO Xiao-yi3, JIA Kun3,4,SUN ling-shuang3,4,YUAN Jian-feng1,2
(1.GuangdongHaidInstituteofAnimalHusbandry&VeterinaryMedicine,Guangzhou,Guangdong,511400,China; 2.GuangdongHaidGroupCo.,Limited,Guangzhou,Guangdong,511400,China; 3.CollegeofVeterinaryMedicine,SouthChinaAgriculturalUniversity,Guangzhou,Guangdong,510642,China;4.GuangdongProvincialKeyLaboratoryofPreventionandControlforSevereClinicalAnimalDiseases,Guangzhou,Guangdong,510642,China)
S852.611;S858.23
A
1007-5038(2017)08-0014-05
2017-01-19
广州市科技计划项目(201510010250);广东省科技计划项目(2014A020208052,2015B020203005,2015A020224039);广东省兽医临床重大疾病综合防控重点实验室(2013A061401013);广东省现代农业科技创新联盟建设项目(2016LM2150);广州市珠江科技新星(201610010073)
刁巧虹(1991-),女,广东揭阳人,硕士研究生,主要从事临床兽医学研究。*

