热灭活无乳链球菌对奶牛乳腺成纤维细胞TGF-β1及其受体表达的影响
张芮今,丁玉林,毕艳楠,赵 弥,郭运泽,王凤龙
(内蒙古农业大学兽医学院,内蒙古呼和浩特 010018)
热灭活无乳链球菌对奶牛乳腺成纤维细胞TGF-β1及其受体表达的影响
张芮今,丁玉林,毕艳楠,赵 弥,郭运泽,王凤龙*
(内蒙古农业大学兽医学院,内蒙古呼和浩特 010018)
研究无乳链球菌(GBS)对奶牛乳腺成纤维细胞(BMFB)转化生长因子β1(TGF-β1)及其受体TβRⅠ表达的影响。6代和7代BMFB,在6、12、24、48 h时间点,分别用无血清培养液和105、106、108CFU/mL的不同浓度的热灭活GBS作用于BMFB细胞。 RT-qPCR法检测TGF-β1及TβRⅠ mRNA的表达,Western blot法检测TGF-β1和TβRⅠ蛋白的表达。与对照组相比,TGF-β1mRNA的表达量明显升高,于24 h达到最大值(P<0.05);TGF-β1蛋白的表达于12 h达到最大值,24 h蛋白表达量开始明显降低(P<0.05)。TβRⅠ mRNA的表达量较对照组的升高,在48 h达到峰值(P<0.05);TβRⅠ蛋白表达量在12 h低于6 h,24 h达到峰值,之后又下降(P<0.05)。说明热灭活无乳链球菌对BMFB TGF-β1及TβRⅠ mRNA和蛋白的表达有促进作用。
热灭活无乳链球菌;奶牛乳腺成纤维细胞;转化生长因子β1;TβRⅠ
无乳链球菌(Streptococcusagalactiae,也称group BStreptococcus,GBS)最初是从乳腺炎患牛中分离的,故被称为无乳链球菌[1]。无乳链球菌是一种致病性极强的病原菌,在医学临床上不仅可以造成孕妇产妇产科疾病,如子宫内膜炎、早产、晚期流产,还能造成新生婴儿肺炎、败血症,甚至会引起脑膜炎[2]。有研究发现,无乳链球菌也会引起水产鱼类的脏器病变[3],造成巨额损失。无乳链球菌也是引起奶牛乳腺炎的一种主要致病菌,它是一种专性乳腺寄生的高度接触传染性病原菌,主要引起隐性乳腺炎或部分临床型乳腺炎[4]。组织纤维化的发生是机体对损伤的一种修复反应,在组织损伤严重时,如果通过实质细胞的再生不能完全修复,常出现肉芽组织增生,并产生多量细胞外基质(ECM),器官发生纤维化[5]。转化生长因子β1(transforming growth factor β1,TGF-β1)不仅参与细胞的增殖、分化、凋亡、信号识别等生命活动,同时在胚胎发育过程中还可以诱导特定的器官发生。有研究证明,TGF-β1在肿瘤的发生和发展过程也起着重要作用[6]。研究发现,在TGF-β1作用下肺成纤维细胞可分化为肌成纤维细胞,通过TGF-β1/Smads信号通路参与肺纤维化的发生和发展[7]。同时,在肾脏纤维化启动和终止过程中TGF-β及其受体是发挥重要作用的关键细胞因子之一[8]。
目前对无乳链球菌的研究很多,却鲜有报道无乳链球菌对奶牛乳腺纤维化影响。本研究采用热灭活无乳链球菌作用于奶牛乳腺成纤维细胞,初步研究在奶牛乳腺纤维化过程中TGF-β1和TβRⅠ的相对表达量的变化,以探讨无乳链球菌感染与成纤维细胞TGF-β1和TβRⅠ表达的相互关系,为细菌性奶牛乳腺纤维化的防控提供依据。
1 材料与方法
1.1 材料
奶牛乳腺成纤维细胞(BMFB),来源于前期课题培养、分离、鉴定、冻存的荷斯坦奶牛乳腺细胞[9];无乳链球菌由内蒙古农业大学兽医学院药理组实验室提供[10]。DMEM/F12干粉培养基,Gibco公司产品;Trizol试剂(D910008A)、RT-qPCR扩增试剂盒(RR820A)、DNA Marker,TaKaRa公司产品;RNA反转录试剂盒(R122-01),Vazyme试剂公司产品;小鼠β-actin抗体(ab6276),Abcam公司产品;兔抗TGF-β1多克隆抗体,Millipore公司产品;兔抗TβRⅠ多克隆抗体(SC-399),Santa Cruz公司产品;细胞裂解液、PMSF、BCA蛋白浓度测定试剂盒、山羊抗鼠IgG-HRP及山羊抗兔IgG-HRP,碧云天生物技术研究所产品;无蛋白封闭液、预染蛋白Marker(26616)和ECL显影液(34095),Thermo公司产品。
1.2 方法
1.2.1 热灭活菌液的配制 取出冻存的无乳链球菌菌种,在30℃、120 r/min摇床环境下复苏菌液,培养12 h。活化菌液2次后,采用琼脂平板活菌计数法检测菌液浓度。用无血清的DMEM/F12培养液,将菌液稀释至105、106、108CFU/mL[11]。70℃灭活30 min,血琼脂培养基鉴定没有菌落生长,即可作为处理菌液。
1.2.2 细胞准备和菌液作用 将复苏的BMFB传至6代~7代后,用0.5 g/L胰酶消化悬浮细胞,倒置显微镜下计数,按1×105/mL的密度接种于6孔细胞培养板中,待细胞培养板底部铺满单层细胞后,用无血清DMEM/F12培养液处理细胞24 h。对照组加入无血清的培养液,试验组加入不同浓度的热灭活无乳链球菌菌液(105、106、108CFU/mL),分别培养6、12、24、48 h后收集细胞。
1.2.3 实时荧光定量PCR方法检测BMFB中TGF-β1和TβRⅠ mRNA的表达水平 按照TaKaRa RNAiso Plus操作说明书提取细胞总RNA。用酶标仪检测RNA的纯度和浓度,将RNA浓度统一调整为500 ng/μL,参照反转录试剂盒说明书进行反转录反应,将获得的cDNA置 -20℃保存备用。根据GenBank公布的β-actin、TβRⅠ和TGF-β1的序列,用 Primer 5.0 软件设计引物,由上海生物工程有限公司合成引物(表1)。β-actin和TGF-β1的扩增反应程序为:cDNA 95℃ 30 s;95℃ 5 s,60℃ 34 s,循环40次,熔解反应为60℃,1 min;TβRⅠ的扩增反应程序为:cDNA 95℃ 30 s,95℃ 5 s,55℃ 34 s,循环40次,熔解反应为65℃ 15 s。反应结束后,绘制终产物的熔解曲线,以β-actin为管家基因。
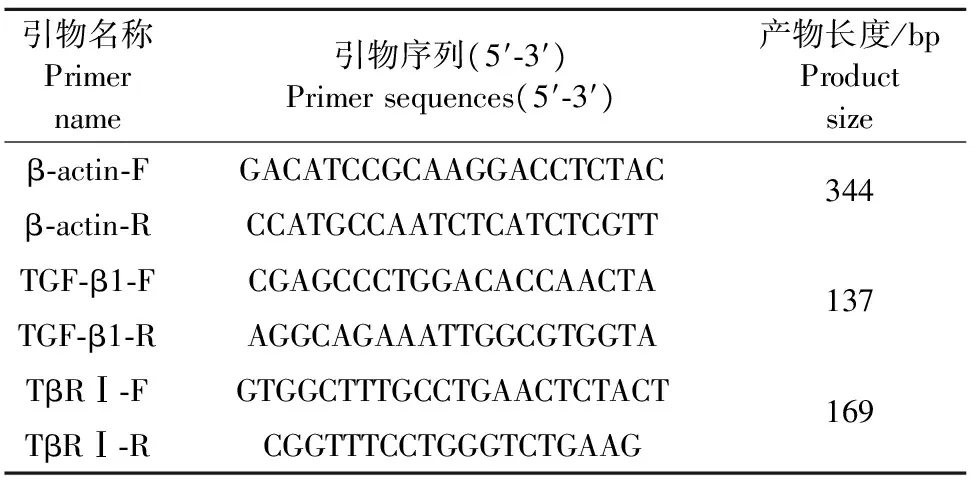
表1 引物序列及扩增参数
1.2.4 Western blot检测BMFB TβRⅠ和TGF-β1蛋白的表达 按“1.2.2”步骤处理细胞,根据细胞瓶中细胞生长的密度,每瓶加入250 μL裂解液,在冰上裂解10 min后,用刮刀刮取细胞,将裂解液全部吸到1.5 mL离心管中,4℃、12 000 r/min离心10 min。取上清液,用BCA法测定蛋白总浓度。根据抗体说明书上预测蛋白的大小,100 g/L SDS-聚丙烯酰胺凝胶 (SDS-polyacrylamide gel electrophoresis,SDS-PAGE) 电 泳。每上样孔的总蛋白量为25 μg,半干转法将条带电转移至聚偏二氟乙烯 (polyvinylidene fluoride,PVDF)膜上,50 g/L BSA 室温封闭2 h,一抗孵育16 h~18 h,4℃环境下过夜。一抗稀释比例见表2。HRP标记的二抗(1∶1 500)室温孵育1.5 h,按ECL超敏显色试剂盒说明书配置显色液,室温避光显色5 s~1 min,在凝胶成像仪中观察蛋白条带结果,以β-actin为内参。
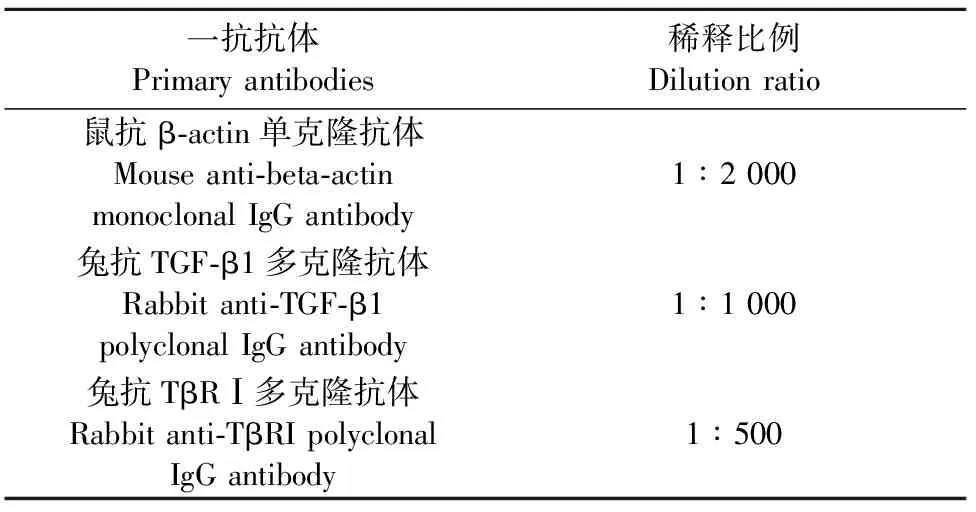
表2 抗体稀释比例
1.2.5 统计学分析 实时荧光定量PCR结果数据处理采用2-ΔCt法,Western blot条带用Image J软件进行灰度值分析,以目的蛋白灰度值/内参蛋白灰度值表示蛋白相对定量结果。然后用SPSS22软件进行统计分析,各组内差异采用单因素方差分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 β-actin、TGF-β1和TβRⅠ引物特异性鉴定
以稀释后的cDNA作为模板,β-actin作为内参基因,对目的基因TGF-β1和TβRⅠ进行荧光定量PCR检测,根据扩增得到的Ct值绘制标准曲线。结果显示引物反应性良好,相关系数R2均大于0.99,具有良好的相关性(图1 A~图1C)。RT-PCR产物条带单一清晰,未见其他非特异性条带,产物片段与预计产物大小相一致(图2)。
2.2 对BMFB TGF-β1mRNA及其蛋白表达的影响
从图3结果可以看出,在各个时间点(6、12、24、48 h),处理组(106CFU/mL、108CFU/mL)TGF-β1mRNA的表达量都高于对照组的(P<0.05);在相同时间点,108CFU/mL热灭活无乳链球菌刺激的BMFB TGF-β1mRNA表达量最高;108CFU/mL刺激24 h时TGF-β1mRNA表达达到最大值。图4结果表明,处理组的TGF-β1蛋白表达水平显著高于对照组的,相同时间点,随着刺激浓度的增大,TGF-β1蛋白表达量升高;在24 h 106CFU/mL处理组蛋白表达量最大,108CFU/mL处理组蛋白表达水平明显降低;在48 h 105CFU/mL处理组蛋白表达量最大,106CFU/mL和108CFU/mL处理组蛋白表达水平明显降低;在12 h 106CFU/mL TGF-β1蛋白表达量达到最高峰(P<0.05)。
2.3 无乳链球菌对BMFB TβRⅠ mRNA及其蛋白表达的影响
图5结果表明,在各个时间点(6、12、24、48 h),处理组(105、106、108CFU/mL)TβRⅠ mRNA的表达量均高于对照组的(P<0.05);在相同时间点,除了12 h 106CFU/mL浓度下TβRⅠ mRNA表达量最高,其他时间点108CFU/mL浓度的热灭活无乳链球菌刺激的BMFB TβRⅠ mRNA 表达量最高;108CFU/mL热灭活无乳链球菌刺激48 h时 TβRⅠ mRNA表达达到最大。从图6结果可以看出,TβRⅠ处理组蛋白表达量均高于对照组的(P<0.05),相同时间点,随着刺激浓度的增大,TGF-β1蛋白表达量升高;在各个时间点(6、12、24、48 h),105CFU/mL处理组蛋白表达量最大;105CFU/mL热灭活无乳链球菌刺激24 h时达到峰值。
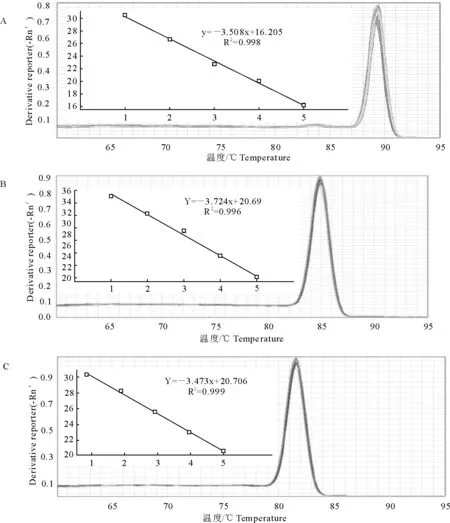
A.β-actin标准曲线及溶解曲线;B.TGF-β1标准曲线及溶解曲线;C.TβRⅠ标准曲线及溶解曲线
A.Standard curve and melting curve of β-actin; B.Standard curve and melting curve of TGF-β1; C.Standard curve and melting curve of TβRⅠ
图1 β-actin、TGF-β1及TβRⅠ标准曲线、熔解曲线
Fig.1 Standard curves and melting curves of β-actin,TGF-β1and TβRⅠ

M.DNA标准DL 500 ;1、2.阴性对照;3、4.β-actin;5、6.TGF-β1;7、8.TβRⅠ
M.DNA Marker DL 500 ;1,2.Negative control;3,4.β-actin;5,6.TGF-β1;7,8.TβRⅠ
图2 β-actin、TGF-β1和TβRⅠ的RT-PCR扩增产物条带
Fig.2 RT-PCR products of β-actin,TGF-β1and TβRⅠ

*.P<0.05较对照组;**.P<0.01较对照组
*.P<0.05 compared with control;**.P<0.01 compared with control
图3在不同作用时间点用不同浓度的无乳链球菌对BMFB TGF-β1mRNA相对表达量的影响
Fig.3 Effects of different concentrations ofStreptococcusagalactiaeon mRNA expressions of TGF-β1at differents time points in BMFB

*.P<0.05较对照组;**.P<0.01较对照组
*.P<0.05 compared with control;**.P<0.01 compared with control
图4在不同作用时间点用不同浓度的无乳链球菌对BMFB TGF-β1蛋白表达的影响
Fig.4 Effects of different concentrations ofStreptococcusagalactiaeon protein expressions of TGF-β1at different time points in BMFB
3 讨论
无乳链球菌进入乳腺造成组织损伤,炎性细胞浸润,会引起炎性细胞因子(如TNF-α、IL-1β)表达量升高[12],这些因子会激活促纤维化的相关机制,导致ECM的积聚,最终引起纤维化。TGF-β1是炎症发生中的一种重要因子,与ECM的积聚紧密相关。毛忠懿等[13]在研究TGF-β1和整合素连接激酶(integrin-linked kinase,ILK)在大鼠肝纤维化中的表达试验中发现,随着肝纤维化的发展,TGF-β1表达程度随时间的延长呈明显递增趋势,表明大鼠肝组织纤维化与TGF-β1的表达相关。Tao Z[14]研究发现,TGF-β1与心肌梗死(myocardial infarction,MI)相关的心脏纤维化发展中起重要作用,通过葛根素抑制TGF-β1在心脏组织中的表达,从而显著的减弱心肌纤维化。本研究结果显示,热灭活无乳链球菌作用于体外培养的BMFB,TGF-β1mRNA和蛋白表达量都显著地升高。丁旭娜等[9]利用外源性 TGF-β1作用于BMFB,引起了乳腺成纤维细胞中α-SMA、CTGF和COLI α1 mRNA和蛋白的表达量升高,也表明了TGF-β1在奶牛乳腺纤维化中的重要性。

*.P<0.05较对照组;**.P<0.01较对照组
*.P<0.05 compared with control;**.P<0.01 compared with control
图5不同作用浓度无乳链球菌在不同作用时间对BMFB TβRⅠ mRNA表达的影响
Fig.5 Effects of different concentrations ofStreptococcusagalactiaeon mRNA expressions of TβRⅠ at different time points in BMF

*.P<0.05较对照组;**.P<0.01较对照组
*.P<0.05 compared with control;**.P<0.01 compared with control
图6不同作用浓度无乳链球菌在不同作用时间对BMFB TβRⅠ蛋白表达的影响
Fig.6 Effects of different concentrations ofStreptococcusagalactiaeon protein expressions of TβRⅠ at different time points in BMFB
TGF-β1的受体有Ⅰ、Ⅱ、Ⅲ型3种类型。TβRⅠ又称活化素受体样激酶(actin receptor-like kinase,ALK),它在纤维化中发挥着至关重要的作用。有研究显示,在大鼠心肌梗死模型中,利用阻断剂阻断TβRⅠ后,会明显减轻心肌梗死后的左心室重塑和心肌收缩功能障碍[15],TβRⅠ可能是心肌梗死后心肌重塑过程中的关键调节分子之一[16]。Wang B等[17]等研究证明,靶向抑制肾脏细胞TβRⅠ的表达可以有效抑制肾脏的纤维化。冀红等[18]的博来霉素致大鼠肺间质纤维化试验中,对TβRⅠ的3种亚型(ALK4、ALK5、ALK7)进行了研究,结果表明ALK4、ALK5和ALK7均在肺间质纤维化的发生发展过程中存在高表达。也有研究发现,TβRⅠ在mRNA和/或蛋白水平上的表达降低或缺失可能引起肿瘤的发生[19]。本研究结果显示,热灭活的无乳链球菌作用于体外培养的BMFB时,TβRⅠ mRNA和蛋白表达量都显著升高,说明无乳链球菌能促进BMFB TβRⅠ mRNA和蛋白的表达。
在自然情况下,合成和分泌的TGF-β1是没有生物活性的,只有与TβRⅠ和TβRⅡ结合后,激活TβRⅠ的丝氨酸/苏氨酸激酶活性,活化TβRⅠ,才能最终启动TGF-β/Smad通路。TβRⅠ磷酸化激活细胞内的Smad2、Smad3 蛋白,Smad2、Smad3 蛋白与Smad4 结合形成一个寡聚复合物进入核内,将信号从胞质转导到细胞核,调控下游基因的转录和表达[20]。Meng X M等[21]研究发现,在肾纤维发生过程中, Smad3和Smad7之间的平衡移动会导致肌成纤维细胞的积累和活化,ECM的过量产生和患病肾中ECM降解的减少。TGF-β/Smad信号通路可在膜受体、细胞内信号分子和核内基因水平等多个层次发生复杂的交互调节,调控纤维化的发生发展[22]。
在本课题组前期的研究结果中,吴建美[11]关于金黄色葡萄糖球菌对奶牛乳腺成纤维细胞TGF-β1表达和王一[23]关于大肠埃希菌对奶牛乳腺成纤维细胞TGF-β1表达都有明显的升高。Gao Y等[24]采用外源性TGF-β1作用乳腺成纤维细胞和小鼠乳腺基部注射外源性TGF-β1的方法,证实TGF-β1通过ERK1/2信号通路显著促进奶牛乳腺成纤维细胞外基质α-SMA和Collagen-I表达,在小鼠乳腺组织上进一步验证发现TGF-β1能显著促进乳腺组织纤维化的发生。杨彬等[25]等研究表明,BMFBs在热灭活金黄色葡萄球菌刺激下能够显著促进TGF-β1mRNA和α-SMA、Collagen-I、p-Smad2/3的蛋白质表达,提示金黄色葡萄球菌可能通过TGF-β1/Smad信号通路诱导奶牛乳腺成纤维细胞转分化为肌成纤维细胞。以上研究结果都表明了TGF-β1对乳腺纤维化的重要作用。本研究证明热灭活的无乳链球菌可以促进体外培养的成纤维细胞中TGFβ1和TβRⅠ的mRNA及蛋白的表达,对于无乳链球菌通过何种途径引起TGF-β1及其受体的表达,最终引起纤维化有待进一步研究。
[1] Keefe G P.Streptococcusagalactiaemastitis:A review [J].Can Vet J,1997,38:429-437.
[2] 刘 馨,周 琴,尚尔宁.新生儿无乳链球菌败血症患者的临床特点及其 抗菌治疗用药分析[J].抗感染药学,2015,12(6):835-837.
[3] Denga Z B,Zhanga Y W,Genga Y,et al.A new sequence type (ZST-1) of infectiousStreptococcusagalactiaefrom Chinese cyprinid fish,Schizopygopsispylzovi[J].Aquaculture,2017,468(1):496-500.
[4] 伦艳霞,王娜娜,王家鑫.BALB/c小鼠无乳链球菌性乳腺炎模型的建立[J].中国奶牛,2008(1):35-38.
[5] 李 才.器官纤维化基础与临床[M].北京:人民卫生出版社,2003.
[6] 熊智魁.TGF-β1和VEGF在大鼠乳腺癌组织中表达意义的研究[J].中国民康医学,2016,28(21):41-43.
[7] 邱 静,李万成.TGF-β1/Smad3在博来霉素肺纤维化大鼠内皮间质转化中的作用[J/OL].成都医学院学报,2017-2-22.
[8] 杨 静.TGF-β受体在肾纤维化/硬化发生过程中的作用及治疗展望[J].国外医学:泌尿系统分册,2003,23(6):705-708.
[9] 丁旭娜,王凤龙,丁玉林,等.奶牛乳腺上皮细胞和成纤维细胞的体外培养与鉴定[J].黑龙江畜牧兽医,2012(5):1-5.
[10] 丁月霞.内蒙古地区牛源致病链球菌的耐药性、毒力特征分析及其两者的相关性研究[D].内蒙古呼和浩特:内蒙古农业大学,2015.
[11] 吴建美.金黄色葡萄球菌对奶牛乳腺细胞几种生长因子表达及其信号机制作用的研究[D].内蒙古呼和浩特:内蒙古农业大学,2015.
[12] Bannerman D D,Paape M J,Goff J P,et al.Innate immune response to intramammary infection with Serratia marcescens andStreptococcusuberis[J].Vet Res,2004,35(6):681-700.
[13] 毛忠懿,吴雄健,陶立刚.ILK 和 TGF-β1在实验性大鼠肝纤维化中的表达和意义[J].安徽医药,2014,18(9):1630-1633.
[14] Tao Z.Puerarin inhibits cardiac fibrosis via monocyte chemoattractant protein (MCP)-1 and the transforming growth factor-β1(TGF-β1) pathway in myocardial infarction mice [J].Am J Transl Res,2016,8(10):4425-4433.
[15] Tan S M,Zhang Y,Connelly K A,et al.Targeted inhibition of activin receptor-like kinase 5 signaling attenuates cardiac dysfunction following myocardial infarction[J].Am J Physiol:Heart Circul Physiol,2010,67(5):1415-1425.
[16] 赵 欣. MicroRNA-101a通过靶向调控心脏成纤维细胞的表达抑制缺氧诱导的心肌纤维化[D].湖北武汉:华中科技大学,2015.
[17] Wang B,Jha J C,Hagiwara S,et al.Transforming growth factor-beta 1-mediated renal fibrosis is dependent on the regulation of transforming growth factor receptor 1 expression by let-7b[J].Kidney Int,2014,85(2):352-361.
[18] 冀 红.TGF-β受体亚型糖基化修饰对肺间质纤维化发生发展的影响[D].辽宁大连:大连医科大学,2012.
[19] Wang J,Han W,Zborowska E,et al.Reduced expression of transforming growth factor β type1 receptor contributes to the malignancy of human colon carcinoma cells[J].J Biol Chem,1996,271:17366-17371.
[20] Bai S,Cao X.A nuclear antagonistic mechanism of inhibitory Smads in transforming growth factor-beta signaling [J].J Biol Chem,2002,277(6):4176-4182.
[21] Meng X M,Tang P M,Li J,et al.TGF-β/Smad signaling in renal fibrosis[J]. Frontiers Physiol,2015(6):82.
[22] 段靳岚,尹 昭. TGF-β1/Smad信号通路与心肌纤维化的关系[J].世界最新医学信息文摘,2016,16(70):69-73.
[23] 王 一.大肠杆菌对奶牛乳腺成纤维细胞TGF-β1、bFGF和PDGF表达的影响[D].内蒙古呼和浩特:内蒙古农业大学,2015.
[24] Gao Y,Wang Y,Li Y,et al.TGF-β1 promotes bovine mammary fibroblast proliferation through the ERK 1/2 signalling pathway[J].Cell Biol Int,2016,40(7):750-760.
[25] 杨 彬,徐丹丹,孙志鹏,等.金黄色葡萄球菌对奶牛乳腺成纤维细胞TGF-β1/Smad信号通路及其转分化的影响[J].畜牧兽医学报,2016,47(7):1495-1501.
Abstract:In order to investigate the effects of different concentrations of heat-inactivatedStreptococcusagalactiaeon the expressions of transforming growth factor β1(TGF-β1) and its receptor TβRⅠ in bovine mammary fibroblasts (BMFB),6 or 7 generations of culturedinvitroBMFBs were exposed to the serum-free medium and the heat-inactivated GBS at different concentrations (105,106,108CFU/mL),respectively,and the total RNA and proteins were extracted from the cells after 6,12,24 and 48 hour,respectively.The mRNA expressions of TGF-β1and TβRⅠ were detected by real-time fluorescence quantitative PCR,The protein expressions of TGF-β1and TβRⅠ were detected by Western-blot.Compared with the control group,the mRNA expression of TGF-β1was significantly elevated when BMFB were exposed to GBS,and reached the maximal levels at 24 h(P<0.05).The protein expression of TGF-β1reached the maximal levels at 12 h,and then the expression went down at 24 h(P<0.05).The expression of TβRⅠ mRNA was higher than that of the control group,and reached the maximal levels at 48 h (P<0.05).The expression of TβRⅠ protein at 12 h was lower than that at 6 h,and reached the maximal levels at 48 h,and then the expression went down (P<0.05).The preliminary study confirmed that heat-inactivatedStreptococcusagalactiaecould promote the expressions of TGF-β1and TβRⅠ mRNA and protein in BMFBs.
Keywords: heat inactivated;Streptococcusagalactiae; bovine mammary fibroblasts; transforming growth factor β1; TβRⅠ
EffectofHeatInactivatedStreptococcusagalactiaeonexpressionsofTGF-β1andTβRⅠinBMFB
ZHANG Rui-jin,DING Yu-lin,BI Yan-nan,ZHAO Mi,GUO Yun-ze,WANG Feng-long
(CollegeofVeterinaryMedicine,InnerMongoliaAgriculturalUniversity,InnerHohhot,Mongolia,010018,China)
S852.611
A
1007-5038(2017)08-0007-07
2017-01-12
国家自然科学基金项目(31460642)
张芮今(1989-) ,男,内蒙古赤峰人,硕士研究生,主要从事动物传染病与免疫病理学研究。*

