废铁屑活化过硫酸盐降解偶氮染料RB5废水
王炳煌, 张倩, 汤须崇, 薛秀玲, 洪俊明
(1. 华侨大学 化工学院, 福建 厦门 361021;2. 厦门市工业废水生化处理工程技术研究中心, 福建 厦门 361021)

废铁屑活化过硫酸盐降解偶氮染料RB5废水
王炳煌1,2, 张倩1,2, 汤须崇1,2, 薛秀玲1,2, 洪俊明1,2
(1. 华侨大学 化工学院, 福建 厦门 361021;2. 厦门市工业废水生化处理工程技术研究中心, 福建 厦门 361021)
采用废铁屑活化过硫酸盐(PS)降解偶氮染料废水,研究铁屑投加量、过硫酸盐浓度和初始pH值对活性黑5(RB5)降解过程的影响及动力学模型.结果表明:初始pH值为6,PS浓度为0.5 mmol·L-1,废铁屑投加量为1 g·L-1条件为最优的反应条件;反应50 min后,活性黑5去除率可达到90.22%,180 min后去除率可达到96.97%,反应后溶液中总铁的溶出量为97.32 mg·L-1;RB5降解后,产生的副产物苯胺的质量浓度为0.13 mg·L-1,反应后出水的pH值从初始的6变为4.01,废铁屑/PS体系降解RB5的降解动力学符合一级动力学反应;采用废铁屑活化过硫酸盐工艺降解偶氮染料废水具有反应速度快,不需调整初始pH值、运行成本低等优势.
过硫酸盐; 废铁屑; 活性黑5; 染料废水
Abstract: This study revealed potassium persulfate (PS) activated by waste ferrous scurf to degrade Reactive Black 5 (RB5). Three variables (i. e. , pH, persulfate concentration, and ferrous concentration) were defined as significant factors for decolorization to investigate the influence on the degradation and dynamics. The results showed that the optimal efficiency could be achieved under the conditions of: pH=6, persulfate concentration=0.5 mmol·L-1, and ferrous concentration=1 g ·L-1. When the reaction time increasing from 50 min to 180 min, the decolorization rate of RB5 increased from 90.22% to 96.97% with the Fe release of 97.32 mg·L-1. After 180 min reaction, aniline, as the main intermediates of RB5 degradation, was accumulated to 0.13 mg·L-1, and the pH changed from 6 to 4.01. In addition, the rate constant fitted the first-order kinetics. Overall, the ferrous scurf activated PS system has the advantages of rapid reaction rate, less pH adjust and low cost.
Keywords: potassium persulfate; waste ferrous scurf; reactive black 5; dye wastewater

1 材料及方法
1.1实验材料
过硫酸钠(Na2S2O8)、硫酸(H2SO4)、氢氧化钠(NaOH)均为分析纯;废铁屑购自泰州市长浦化学试剂有限公司;实验室用水为去离子水;染料活性黑5购于Everlight化学公司,纯度>99%,最大吸收波长为600 nm,分子结构式如图1所示.

图1 活性黑5的分子结构式Fig.1 Molecular structure of Reactive Black 5
1.2实验方法
采用RB5配制不同质量浓度的染料废水,在常温下,用浓度为0.1 mol·L-1的NaOH和H2SO4调节初始的pH值,加入过硫酸盐,再加入废铁屑.将锥形瓶置于恒温的振荡器振荡,振荡的速度为120 r·min-1,每隔一定的时间取样测定.
1.3分析方法
实验过程中,总铁质量浓度采用邻菲罗啉分光光度法进行测定,苯胺采用N-(1萘基)乙二胺偶氮分光光度法,染料质量浓度测定采用TU-1900双光束紫外可见分光光度计,在600 nm波长下测定,并根据Langmuir-beer通过定律,浓度的计算公式为
式(1)中:A0为初始RB5的吸光度值;At为t时刻RB5的吸光度值;C0为溶液的初始浓度.
2 结果与讨论
2.1废铁屑投加量对RB5脱色的影响
在c(PS)=0.5 mmol·L-1,ρ(RB5)=50 mg·L-1,pH=6的条件下,废铁屑投加量对RB5脱色的影响,如图2所示.图2中:K为速率常数.
由图2(a)可知:单独投加过硫酸盐时,在180 min内,RB5的去除率仅为3.00%,几乎没有降解,这是由于过硫酸盐虽具有氧化性,过硫酸根的氧化反应速度慢[6];当投加1 g·L-1废铁屑时,反应50 min后活性黑5去除率可达到90.22%,180 min时,去除效率为92.78%,几乎完全降解;而当废铁屑的投加量增加到1.5 g·L-1时,反应时间为45 min时,RB5的去除效率为91.8%,反应速率较投加1 g·L-1废铁屑快,但是180 min时,去除率为89.53%,略有下降,主要原因是过多废铁屑的投加,在反应之初,铁屑慢慢的氧化产生Fe2+,并未出现抑制现象,随着反应的进行,溶液中的Fe2+不断增加,体系中会瞬间产生过量的硫酸根自由基发生自我淬灭的发应[15].因此,随着废铁屑的投加量增加,反应速度加快,但是最终染料的去除率下降,所以选择投加1 g·L-1的废铁屑较为合适.

(a) 剩余质量浓度和降解速率常数 (b) pH值变化情况 图2 废铁屑投加量对RB5脱色的影响Fig.2 Effect of waste ferrous scurf dosage on RB5 degradation
由图2(b)可知:在相同的初始条件下,随着废铁屑投加量的增加,系统的pH值下降到3.96~4.65之间.这是由于PS的分解过程中将会不断的产生氢离子,导致溶液pH值下降,这与 Zou等[16]研究成果相符.RB5脱色的降解速率常数,如表1所示.表1中:K0为零级动力学常数;K1为一级动力学常数;R为标准平方差.
由图2和表1可知:拟一级反应能够更好地模拟RB5的脱色过程,随着废铁屑投加量的增加,拟一级反应降解速率常数随之增大,原因在于铁屑的增加将释放出更多的Fe2+,活化过硫酸盐产生更多[17-18],因此,加快了RB5的降解.

表1 RB5脱色的降解速率常数Tab.1 Degradation rate constant of RB5 decolorization
2.2初始PS浓度对RB5脱色的影响
在c(废铁屑)=1 g·L-1,ρ(RB5)=50 mg·L-1,pH=6的条件下,初始PS的浓度对RB5脱色的影响,如图3所示.
由图3(a)可知:在仅投加废铁屑时,180 min后,溶液中RB5的去除率为18.05%,这是由于废铁屑具有还原性,在偏酸性的条件下能够直接将偶氮染料还原成色度较低的胺基物质[19];当初始的PS浓度为0.5 mmol·L-1时,180 min后,RB5的去除率为96.3%;随着初始PS浓度为1 mmol·L-1时,RB5的降解速率明显的增快,25 min去除率达到92.32%,但是最终的去除效果只有93.03%,原因在于过硫酸盐浓度的增加,体系产生过多的过硫酸根自由基,发生的自我的淬灭反应[15],最终处理效果变差.因此,选择初始PS的浓度为0.5 mmol·L-1为最佳条件.RB5脱色的降解速率常数,如表2所示.
由图3和表2可知:拟一级降解速率常数随PS浓度增加而增大,由于PS的增加,不断地分解产生氢离子,溶液的pH值下降,有助于废铁屑更快的产生Fe2+,加快活化过硫酸盐产生硫酸根自由基,提高染料RB5的脱色速率.

(a) 剩余质量浓度和降解速率常数 (b) pH值变化情况 图3 初始PS的浓度对RB5脱色的影响Fig.3 Effect of initial PS concentration on RB5 degradation

c(PS)/mmol·L-1pH 初始 结果零级动力学t/min K0/min-1 R2伪一级动力学t*/min-1 K1/min-1 R2 066.940~1800.04220.9720NANANA0.0564.890~900.19340.978390~1800.00870.94930.1064.830~750.25400.989075~1600.00940.96440.2064.510~25NANA25~1000.02450.98970.5064.010~10--10~750.04560.98981.0063.920--0~500.08230.9852
2.3初始pH值对RB5脱色的影响
在c(废铁屑)=0.5 mmol·L-1,ρ(RB5)=50 mg·L-1,c(PS)=0.5 mmol·L-1的条件下,初始pH值对RB5脱色的影响,如图4所示.

(a) 剩余质量浓度和降解速率常数 (b) pH值变化情况 图4 初始pH值对RB5脱色的影响Fig.4 Effect of initial pH value on degradation
由图4(a)可知:随着pH值得减小,RB5的脱色率增大,当初始pH值为7和10时,180 min后RB5的去除率分别为93.41%和41.44%,均低于初始pH值为3时(96.84%),说明了相对于中性和碱性的条件下,在酸性条件处理能力更强.主要原因是在酸性条件下,废铁屑更快的释放出Fe2+,活化过硫酸盐产生硫酸根自由基,提高RB5的脱色速率[20-21],而在碱性条件下,将不利于废铁屑释放出Fe2+,所以废铁屑/PS处理RB5时应控制好溶液中的pH值,以便达到更好的脱色效果.
由图4(b)可知:在不同初始pH值的条件下,随着反应的进行,pH值变小.RB5脱色的降解速率常数如表3所示.
由图4和表3可知:在酸性条件的拟一级降解速率常数大于在中性条件和碱性条件.

表3 RB5脱色的降解速率常数Tab.3 RB5 decolorization degradation rate constant
2.4脱色过程中总铁和苯胺的变化

(a) 染料的剩余质量浓度和pH值的变化
苯胺类化合物是偶氮染料的生产原料,其水溶性强,脱色难度大,对人体和微生物具有毒害作用,且长期接触有可能致癌[22].在c(PS)=0.5 mmol·L-1,ρ(废铁屑)=1 g·L-1,ρ(RB5)=50 mg·L-1,pH=6的条件下,研究在氧化脱色的过程中,溶液中总铁的释放情况和RB5脱色产物苯胺类的质量浓度.RB5的降解过程和pH的变化,如图5所示.

(b) 处理过程中总铁的质量浓度 (c) 处理过程中苯胺的质量浓度图5 RB5的降解过程和pH值的变化Fig.5 Degradation of RB5 and pH value changes
由图5(a)可知:随着反应的进行,RB5质量浓度不断下降,去除率可达96.97%,在此反应过程中溶液的pH值也随之下降,最终稳定在4左右.
由图5(b)可知:随着反应的继续进行,溶液中总铁离子的质量浓度不断的增加,最后达到97.32 mg·L-1.
由图5(c)可知:溶液中苯胺的质量浓度是先上升后下降,在30~40 min之间苯胺的质量浓度最大,之后,质量浓度不断地降低,随着RB5的不断脱色,苯胺的溶度上升,而后来反应过程产生的硫酸根自由基又进一步的降解了苯胺,常影等[23]研究二价铁活化过硫酸盐除去水中苯胺也有相似的结果.
3 结论
1) 采用废铁屑活化过硫酸盐,可以有效处理废水中的RB5染料,当投加废铁屑量大于0.5 g·L-1时,在70 min内去除率达到90%以上.
2) RB5的降解过程中,在ρ(PS)=0.5 mmol·L-1,ρ(废铁屑)=1 g·L-1,ρ(RB5)=50 mg·L-1,pH=6的条件下,在30~40 min之间降解中间产物苯胺的质量浓度达到最大,在180 min时检测到苯胺最终质量浓度为0.13 mg·L-1.
[1] 邱丽娟,陈亮,黄满红,等.3种污泥对活性黑KN-B的生物吸附及降解研究[J].环境工程学报,2010,4(1):96-100.
[2] GHONEIM M M,El-DESOKY H S,ZIDAN N M.Electro-fenton oxidation of sunset yellow FCF azo-dye in aqueous solutions[J].Desalination,2011,274(1/2/3):22-30.
[3] LI Aaiun,XIONG Zhongduo,DAI Xibin,etal.The effect of perspiration on photo induced chemical reaction of azo dyes and the determination of aromatic amine products[J].Dyes and Pigments,2012,94(1):55-59.
[4] CHEN Juliang,WANG Zihsin,MOHANTYY N.Influences of carbonate and chloride ions on persulfate oxidation of trichloroethylene at 20 °C[J].Science of the Total Environment,2006,370(2/3):271-277.
[5] KHAN N E,ADEWUYI Y G.Absorption and oxidation of nitric oxide (NO) by aqueous solutions of sodium persulfate in a bubble column reactor[J].Industrial and Engineering Chemistry Research,2010,49(18):8749-8759.
[6] WALDEMER R H,TRATNYEK P G,JOHNSON R L,etal.Oxidation of chlorinated ethenes by heat-activated persulfate: Kinetics and products[J].Environmental Science and Technology,2007,41(3):1010-1015.
[7] TSITONAKI A,PETRI B,CRIMI M,etal.In situ chemical oxidation of contaminated soil and groundwater using persulfate: A review Critical Reviews in Environmental Science and Technology[J].2010,40(1):55-91.
[8] ANIPSITAKIS G P,DIONYSIOU D D.Transition metal/UV-based advanced oxidation technologies for water decontamination[J].Applied Catalysis B: Environmental,2004,54(3):155-163.
[9] HUTSON A,KO S,HULING S G.Persulfate oxidation regeneration of granular activated carbon: Reversible impacts on sorption behavio[J].Chemosphere,2012,89(10):1218-1223.
[10] LI Bingzhi,LI Lin,LIN Kuangfei,etal.Removal of 1,1,1-trichloroethane from aqueous solution by a sono-activated persulfate process[J].Ultrasonics Sonochemistry,2013,284(1):855-863.
[11] 杨世迎,杨鑫,梁婷,等.零价铁还原和过硫酸盐氧化联合降解水中硝基苯[J].环境化学,2012,31(5):682-686.
[12] RUIZ N,SEAL S,REINHART D.Surface chemical reactivity in selected zero-valent iron samplesused in groundwater remediatio[J].Journal of Hazardous Materials,2000,38(80):107-117.
[13] WU Xiaoliang,GU Xiaogang,LU Shuguang,etal.Degradation of trichloroethylene in aqueous solution by persulfate activated with citric acid chelated ferrous ion[J].Chemical Engineering Journal,2014,255(9):585-592.
[14] WENG Chihuang,LIN Yaotung,YUAN Homien.Rapid decoloration of Reactive Black 5 by an advanced Fenton process in conjunction with ultrasound[J].Separation and Purification Technology,2013,117(9):75-82.
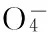
[16] ZOU Xiaoli,ZHOU Tao,MAO Juan.Synergistic degradation of antibiotic sulfadiazine in a heterogeneous ultrasound-enhanced Fe0/persulfate Fenton-like system[J].Chemical Engineering Journal,2014,257(12):36-44.
[17] HUSSAIN I,ZHANG Yongqian,HUANG Shaobin,etal.Degradation of p-chloroaniline by persulfate activated with zero-valent iron[J].Chemical Engineering Journal,2012,203(9):269-276.
[18] ROMERO A,SANTOS A,VICENTE S,etal.Diuron abatement using activated persulphate: Effect of pH, Fe(Ⅱ) and oxidant dosage[J].Chemical Engineering Journal,2010,162(1):257-265.
[19] 陈郁,全燮.零价铁处理污水的机理及应用[J].环境科学研究,2000,13(5):24-26.
[20] WEI Xingya,GAO Naiyun,LI Changjun,etal.Zero-valent iron (ZVI) activation of persulfate (PS) for oxidation of bentazon in water[J].Chemical Engineering Journal,2016,285(1):660-670.
[21] HUSSAINA I,ZHANG Yongqing,HUANG Shaobin,etal.Degradation of p-chloroaniline by persulfate activated with zero-valent iron[J].Chemical Engineering Journal,2013,203(9):269-276.
[22] HIDALGO A M,LEON G,GOMEZ M,etal.Modeling of aniline removal by reverse osmosis using different membranes[J].Chemical Engineering and Technology,2011,34(10):1753-1759.
[23] 常影,姜宁,雷抗,等.二价铁活化过硫酸盐除去水中苯胺[J].世界地质,2014,33(3):702-707.
(责任编辑: 陈志贤英文审校: 刘源岗)
DegradationofAzoDyeRB5UsingPersulfateActivatedWithIronChips
WANG Binghuang1,2, ZHANG Qian1,2, TANG Xuchong1,2, XUE Xiuling1,2, HONG Junming1,2
(1. College of Chemical Engineering, Huaqiao University, Xiamen 361021, China;2. Xiamen Engineering Research Center of Industrial Wastewater Biochemical Treatment, Xiamen 361021, China)
10.11830/ISSN.1000-5013.201607002
2016-08-21
洪俊明(1974-),男,教授,博士,主要从事水污染控制工程、清洁生产的研究.E-mail:jmhong@hqu.edu.cn.
福建省厦门市科技计划项目(3502Z20140057, 3502Z20153025, 3502Z20151256); 福建省高校重大产学研项目(2014Y4006)
X 703
A
1000-5013(2017)05-0653-06

