超声处理大豆分离蛋白-壳聚糖复合物结构性质研究
丁 俭 齐宝坤 姜 楠 隋晓楠 王中江 李 杨
(东北农业大学食品学院, 哈尔滨 150030)
超声处理大豆分离蛋白-壳聚糖复合物结构性质研究
丁 俭 齐宝坤 姜 楠 隋晓楠 王中江 李 杨
(东北农业大学食品学院, 哈尔滨 150030)
为研究超声处理大豆分离蛋白与壳聚糖相互作用及其对复合物结构性质的影响,利用紫外-可见吸收光谱和荧光光谱研究超声处理大豆分离蛋白与壳聚糖的相互作用,通过SDS-PAGE电泳(十二烷基硫酸钠聚丙烯酰胺凝胶电泳)、复合物动态光散射粒度分析、表面电荷和浊度等测定,解析了超声处理对大豆分离蛋白-壳聚糖复合物结构变化与功能性质之间的关系。结果表明,随着超声功率的增加,复合物的紫外-可见吸收光谱的最大吸收峰逐渐升高且发生红移;荧光强度先降低后增加,超声600 W处理时内源荧光强度最大;超声处理影响了大豆分离蛋白亚基组成,主要促进了7S亚基与壳聚糖的相互作用;复合物的粒径先降低后增大;300~500 W处理的复合物ζ-电位表面电荷密度较大,浊度明显降低且溶液分散均匀、性质稳定。说明相对低功率时复合物形成得较为稳定,但超声处理进一步增大后,蛋白质发生不溶性聚集和重排,影响了大豆分离蛋白与壳聚糖之间的相互作用,不同复合物中蛋白质与壳聚糖的相互作用影响了氨基酸残基的微环境、蛋白质的三级结构和分子柔性,进而影响复合物结构和功能特性。
大豆分离蛋白; 壳聚糖; 复合物; 相互作用; 超声处理
引言
大豆分离蛋白作为天然大分子,具有较高的营养价值和功能特性,在食品工业中广泛应用[1]。但是,由于天然大豆分离蛋白分子结构是一种球状模型,分子之间的相互作用可能仅是一些球形亚基之间的摩擦力,其分子结构的柔韧性较差,很难满足作为功能性乳化剂和具有较好凝胶特性的加工要求。因此,对大豆分离蛋白进行改性和功能特性修饰尤为重要[2]。目前,许多研究利用物理方法(如加热、超声、微波和超高压等技术)改变蛋白质的空间结构和分子排布,进而改善蛋白质的功能特性[3-5]。近年来,伴随着超声技术在食品工业中的广泛应用,利用超声处理过程中产生的动态剪切、空化等作用,可以改变大豆蛋白的柔性空间结构,促进蛋白质与其他功能性物质及小分子物质的结合[6-8]。
壳聚糖是天然生物材料中少有的碱性多糖,具有长链糖分子特性,其分子链上的游离氨基可以在较温和的条件下发生化学反应[9]。壳聚糖溶于酸后,糖链上的氨基发生质子化,可形成强大的正电荷阳离子基团,具有良好的生物相容性、可降解性和无毒等特性,现已应用在多种领域[10-11]。
近年来,对于蛋白和多糖的相互作用已有较多的研究,多糖作为一种天然的生物大分子,与蛋白质的相互作用对蛋白质的结构、功能、界面性质和乳化性质等都有较大影响[11]。其相互作用可形成可溶性复合物、不可溶性复合物、凝聚物、静电凝胶等作用模式[12]。蛋白-多糖复合物的结构类型主要通过蛋白与多糖的绑定亲和力,分子构型、链的长度、链的柔韧性和分子量及环境的pH值、离子强度、温度等因素决定蛋白与多糖的电荷密度[13-17];蛋白质和多糖相互作用主要驱动力是静电相互作用和部分氢键,两者之间的排斥和吸引就会形成生物大分子的可溶物、不相溶物和络合等状态[18]。LE等[19]研究发现蛋白和多糖可以通过静电作用形成复合物,其结构的稳定性由静电相互作用所决定。ELMER等[20]研究表明在很多情况下,其复合物的形成不仅依赖于电荷密度和相互作用分子的柔韧性,其外部环境和离子强度也会对其有所影响。同时,多糖类物质的加入也会改善蛋白质的相关性质,ZHANG等[21-22]研究表明复合物的相互作用可以提升蛋白的热稳定性。同时,蛋白的部分展开与多糖结合的特殊位点都会影响复合物的结构,多糖的加入会抑制其蛋白的聚集现象[23]。
蛋白和多糖都作为聚电解质,两者之间不同的相互作用,会形成不同的功能特性,构建不同的食品体系,这种生物大分子可溶性复合物常被用作包埋载体,具有特殊的生物活性。但关于超声处理大豆蛋白-壳聚糖相互作用及复合物结构性质的影响研究目前仍然有限,而且大多研究集中在蛋白与阴离子多糖的相互作用。因此,本文利用超声处理作用控制大豆蛋白与壳聚糖所形成的复合物结构,构建蛋白质与多糖的相互作用体系,解析超声处理对大豆蛋白与壳聚糖交互作用的影响。以不同超声处理的复合物为研究对象,采用凝胶电泳分析超声处理蛋白的分子量,并对复合物的粒径、电位和浊度进行研究,运用紫外-可见吸收光谱和荧光光谱法,研究超声处理大豆蛋白与壳聚糖之间的相互作用。
1 材料与方法
1.1 原料与试剂
大豆分离蛋白,实验室自制;食品级壳聚糖(平均分子量150~500 kDa,脱乙酰度90%以上,含水率8.0%),郑州优然食品配料有限公司;氢氧化钠,天津市光复精细化工研究所;盐酸,北京新光化工试剂厂;乙酸磷酸二氢钠,天津市东丽区天大化学试剂厂;磷酸氢二钠,天津市东丽区天大化学试剂厂;其他试剂为国产分析纯。
1.2 主要仪器设备
超声波细胞破碎仪,宁波新芝生物科技股份有限公司;AL204型分析天平,梅勒特-托利多仪器(上海)有限公司;Labconco FreeZone 6 L型落地式冻干机,上海汇分电子科技有限公司;pHSJ-4A 型实验室pH计,中国上海雷磁公司;GL-20G-II 型高速冷冻离心机,上海安亭科学仪器厂;凝胶成像分析系统,美国伯乐北京赛百奥科技有限公司;Master-sizer 2000 型激光粒度仪,英国马尔文仪器有限公司;UV-2600型紫外可见分光光度计,岛津(中国)有限公司;F-4500 型荧光分光光度计,日本 HITACHI 公司。
1.3 试验方法
1.3.1大豆分离蛋白的制备
采用PETRUCCELLI等[24]的方法,将大豆粉碎后用正己烷萃取,得脱脂豆粕。脱脂豆粕与水混合(料液比20 mL/g),用2 mol/L的NaOH调节pH值至8.0,25℃下搅拌2 h,进行离心(10 000g,30 min,4℃),离心后的上清液用2 mol/L的HCl调节pH值至4.5。静置后再次离心(6 000g,20 min,4℃),将下层沉淀再溶解到5倍的蒸馏水洗涤3次,最后用水溶解沉淀,用2 mol/L的NaOH调节溶液pH值为7.0后离心(10 000g,30 min,4℃),取上清液在4℃下用去离子水透析48 h脱盐,后进行冷冻干燥处理,即为大豆分离蛋白,其蛋白质量分数为90.11%, 粗脂肪质量分数为1.43%,灰分质量分数为4.51%。
1.3.2大豆分离蛋白的超声处理
将大豆分离蛋白溶解在去离子水中,在室温(20℃)下搅拌2 h ,得到的蛋白质溶液在不同的超声功率(0、200、300、400、500、600 W)下处理15 min,超声处理方法和条件参照文献[25]。将超声处理器的钛探头(直径0.636 cm)插入液面,超声时间4 s,间隔时间2 s,在此条件下300 W超声处理12 min时蛋白的乳化活性和乳化稳定性最好,而450 W超声处理24 min时,过高功率和长时间处理会造成蛋白性质的下降。因此对此方法进行修改,选择在20 kHz下,输出功率为 200、300、400、500、600 W 超声处理 15 min,然后得到大豆分离蛋白溶液。
1.3.3SDS-PAGE电泳
参考LAEMMLI[26]方法,SDS-PAGE电泳的分离胶质量分数为15%,浓缩胶质量分数为5%。将不同超声功率处理后的大豆分离蛋白溶于水,质量浓度为3 mg/mL,取样品加上样缓冲液煮沸5 min(上样量为15 μL),凝胶电泳浓缩胶80 V条件下运行30 min,进入分离胶后增至120 V。采用考马斯亮蓝R250溶液进行染色,脱色后利用凝胶成像系统进行分析。
1.3.4大豆分离蛋白-壳聚糖复合物制备
准确称取一定质量的不同超声处理大豆分离蛋白样品溶于去离子水中,使蛋白质量浓度为20 mg/mL,准确称取一定质量的壳聚糖样品溶于100 mol/L的乙酸缓冲液中(pH 值3.0),在室温下搅拌3 h 后放入冰箱中水化静置12 h,制备出壳聚糖质量浓度为10 mg/mL的储液。将蛋白与壳聚糖按照质量比1∶10在pH值2.0~5.0进行复合,确定可溶性复合物最佳的复合条件为pH值3.0,在复合物中添加 0.02%的叠氮化钠防止微生物生长。
1.3.5复合物粒径分布测定
利用Mastersizer 2000型激光粒度仪研究复合物粒径分布。将待测样品用去离子水配置相同浓度溶液进行稀释,避免多重光散射,每个样品重复测量3次。
1.3.6复合物ζ-电位测定
利用ZetaPALS-Zeta型电位仪测定复合物样品的ζ-电位,复合物胶体溶液中带电粒子的双电层产生的电势即为ζ-电位,可以反映复合物胶体粒子分散溶液的稳定性。将待测复合物样品用0.01 mol/L pH值7.0的磷酸盐缓冲液,稀释至蛋白质质量浓度为2 mg/mL,测定温度25℃,平衡时间1 min,每个样品重复测量3次。
1.3.7复合物浊度测定
浊度分析参考MARTINI等[27]方法,通过将待测样品倒入石英比色皿中并利用分光光度计在600 nm处对样品进行测定,浊度测定时所有样品的蛋白质量浓度为5 mg/mL,在25℃下测量,每个样品平行测定3次,取平均值。
1.3.8复合物溶液紫外光谱分析
试验参照牛付阁[28]的方法,将不同超声处理大豆分离蛋白-壳聚糖复合物分别溶于0.01 mol/L pH值7.0 磷酸盐缓冲液使蛋白质量浓度为1 mg/mL,用紫外光谱进行分析,波长范围在220~400 nm之间,分辨率为0.5 nm,扫描速率为50 nm/min。利用缓冲溶液作为空白,用二阶导数紫外光谱(dA2/dλ2)由紫外扫描仪经Origin 8.5软件微分化获得。
1.3.9复合物溶液荧光光谱分析
不同超声处理大豆分离蛋白-壳聚糖复合物溶液(质量分数0.03%)样品适度稀释后含蛋白质量浓度为0.15 mg/mL。参照BONOMI等[29]方法采用F-4500型荧光光谱仪进行内源荧光测定,试验在280 nm下激发,扫描范围为300~450 nm,扫描速度为12 000 nm/min,激发和发射狭缝宽均为5 nm,扫描电压为450 mV。试验值为3次扫描的平均值。
1.3.10数据分析
试验数据通过数据分析系统软件对数值进行差异显著性分析(P≤0.01 表示极显著,P≤0.05 表示显著,P>0.05 表示不显著)。每个试验重复3次,采用Origin 8.5软件作图。
2 结果与分析
2.1复合物和大豆分离蛋白在SDS-PAGE电泳图谱的亚基变化
经不同功率超声处理的大豆分离蛋白-壳聚糖复合物和不同功率超声处理的大豆分离蛋白的SDS-PAGE电泳图谱如图1所示。其中泳道M为标准分子量;泳道1为未经处理的大豆分离蛋白-壳聚糖复合物;泳道2、3、4、5、6分别为200、300、400、500、600 W处理的大豆分离蛋白-壳聚糖复合物;泳道7为未经处理的大豆分离蛋白;泳道8、9、10、11、12分别为200、300、400、500、600 W处理的大豆分离蛋白;从图中可以看出,经超声处理的大豆分离蛋白SDS-PAGE电泳图谱基本相似,都清晰地显示出大豆分离蛋白各亚基的条带分别为大豆蛋白7S 和11S酸性亚基与碱性亚基[30]。经超声处理的大豆分离蛋白分子量相比于未处理的蛋白,在高于66.4 kDa的条带都有所变浅,说明超声处理对大豆分离蛋白的亚基组成有所影响,大豆7S球蛋白α、α′亚基发生改变,但对β亚基影响较小。而未经超声处理的大豆分离蛋白相对分子质量分布较广,蛋白质亚基组分较多。朱建华等[31]研究中也有类似的结论,指出低频率超声场作用主要影响大豆蛋白的7S组分,不同超声处理功率在相同时间内对蛋白亚基组分部分有所影响,但变化并不显著。通过复合物的电泳可知,在β亚基及β亚基条带以上,谱带的颜色明显加深,证明蛋白亚基分子量有所增加,说明超声处理促进了大豆蛋白7S亚基与壳聚糖相互作用。

图1 不同超声处理条件下大豆分离蛋白SDS-PAGE图谱Fig.1 SDS-PAGE analysis of untreated and ultrasonication-treated soybean isolate protein
2.2 复合物粒径分布
粒径分布是表征溶液理化特性和功能特性的重要参数之一。图2显示不同超声功率处理对复合物粒径大小的影响。由图可知未经超声处理的蛋白与壳聚糖复合物体积平均粒径D[4,3]为135.68 μm,且主要分布在100 μm以上。经600 W超声处理后的蛋白与壳聚糖复合物粒径与未经超声处理的复合粒径分布相似,可能长时间的高功率处理使蛋白发生重聚集现象,复合物的粒径有所增大,这与KENTISH等[32]研究结果相一致。随着超声功率的降低,在低于400 W时平均粒径较低,复合物体系中粒径分布较窄,平均粒径D[4,3]在50 μm左右,说明此时复合物溶液较为稳定。随着超声功率的增加,超过500 W后,复合物的粒径增大,分布范围较宽。超声处理会影响蛋白不同基团的暴露和蛋白的聚集[33],进而影响蛋白与壳聚糖的相互作用。这说明相对低功率时复合物形成得较为稳定,粒径较小,当超声功率增大时复合物形成之后就会进一步聚集和重排,导致出现不同粒径的复合物。较高的超声功率可以促使蛋白聚集体形成,掩盖了蛋白表面活性基团[34],可能会促进蛋白首先通过共价键和非共价键的相互作用重新聚集成更大的不溶性蛋白聚集体,影响了大豆分离蛋白质与壳聚糖之间的相互作用,造成复合物粒径上的差别。
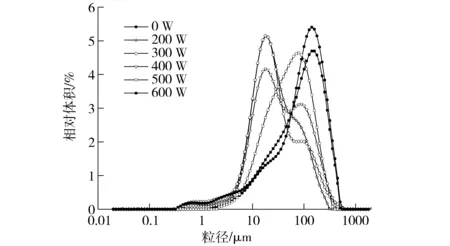
图2 不同超声处理条件下大豆分离蛋白-壳聚糖复合物粒度分布Fig.2 Particle size distribution of untreated and ultrasonication-treated soybean isolate protein-chitosan complex
2.3 复合物ζ-电位变化
复合物溶液体系的稳定性可以通过ζ-电位即复合物表面电荷的多少进行判断。复合物表面所带的电荷数越多,其分散粒子之间的排斥力越大,体系呈现得越稳定。大豆分离蛋白-壳聚糖复合物的形成是通过大豆分离蛋白带负电荷的羧基基团与壳聚糖带正点的氨基基团相互作用结合成稳定的复合物。通过考察体系的ζ-电位可以分析蛋白质和多糖复合的静电斥力。不同超声功率处理的大豆分离蛋白-壳聚糖复合物溶液电位变化如图3所示,在pH 值7.0的缓冲溶液中不同超声处理的大豆分离蛋白-壳聚糖复合物ζ-电位从14.16 mV变化到16.13 mV,结果表明随着超声功率的增加电位先升高后降低,经超声处理的大豆分离蛋白与壳聚糖复合物电位在400 W时为16.13 mV,表面电荷密度最大,说明在此超声功率处理下,复合物颗粒间的静电斥力较大。由于复合物主要通过静电相互作用形成,其复合物的特性取决于复合分子的构型、分子量、电荷密度和复合比,而蛋白结合多糖的数量是由链长、分子柔韧性、相互作用力、多糖及蛋白的尺寸等条件决定[35]。试验中随着超声功率的进一步增加,复合物的电位下降,而且在粒径的分布上也有所不同。说明超声处理影响了复合物的表面电荷,可能是由于适当的超声处理强度会改变大豆蛋白空间结构,使复合物结合得更加紧密,形成较高的电荷密度,促进静电作用。而表面电荷的不同可能是超声处理使蛋白分子的部分展开,柔性的增加会促进与壳聚糖更强的结合,进而影响复合物的电荷分布[36]。
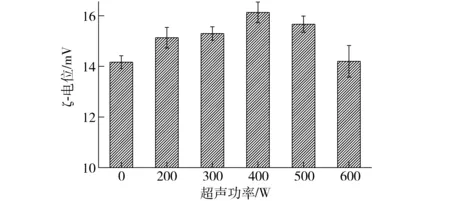
图3 不同超声处理条件下大豆分离蛋白-壳聚糖复合物电位变化Fig.3 Change of ζ-potential of untreated and ultrasonication-treated soybean isolate protein-chitosan complex
2.4 复合物溶液的浊度变化

图4 不同超声处理条件下大豆分离蛋白-壳聚糖复合物的浊度变化Fig.4 Change of turbidity of untreated and ultrasonication-treated soybean isolate protein-chitosan complex
复合物浊度的变化可以反映溶液状态下的分散度,为了确定不同超声功率处理对大豆分离蛋白与壳聚糖复合物形成的影响,反映复合物凝聚状态的分散度,以复合物质量分数为0.05%时的浊度变化进行研究。由图4可知,未经处理的大豆分离蛋白浊度较高是由于此时蛋白与壳聚糖相互作用较为微弱,产生了蛋白的自聚集现象,没有形成稳定的复合物。随着超声功率的增加,复合物的浊度先降低后升高,超声功率从200 W增大到400 W时,最大浊度从0.34降到0.29。然而,继续增加超声功率,复合物的浊度有所增加,这进一步证明了复合物的聚集、溶解的形成与超声强度具有一定相关性。WEINBRECK等[36]也证明了蛋白质和多糖复合凝聚物是由于静电相互作用形成的,蛋白质和多糖的聚集对复合凝聚物的形成及浊度产生影响。超声处理会使蛋白的颗粒减小,复合壳聚糖就会使溶液的漫散射程度降低,浊度减小,另外超声处理后会使蛋白的疏水基团暴露,影响蛋白质表面电荷和氢键的作用,也会影响复合物的形成和稳定[37],进而影响复合物溶液的浊度变化。
2.5 复合物溶液的紫外-可见吸收光谱
大豆分离蛋白-壳聚糖复合溶液中由于大豆分离蛋白侧链含有不同的色氨酸、酪氨酸和苯丙氨酸残基,会产生不同的紫外吸收峰,分析氨基酸残基的相对移动可以反映出蛋白质三级构象的变化。为探讨不同超声功率处理的大豆分离蛋白-壳聚糖复合物相互作用,通过对紫外光谱进行二阶导数光谱分析可以获得更多关于蛋白质结构的信息[38]。吸收光谱的波长范围选择在260~340 nm之间,不同超声功率处理的大豆分离蛋白-壳聚糖复合物溶液紫外吸收光谱和紫外二阶导数光谱分别如图5a、5b所示。随着超声功率的增加,紫外吸收光谱最大吸收峰发生了轻微的红移,说明蛋白质的构象发生了变化。超声处理使蛋白的芳杂环疏水基团暴露,使得吸光度增强。由二阶导数光谱可以更加清晰地看出复合物在260~300 nm范围内有2个波峰(275 nm和295 nm)和2个波谷(265 nm和282 nm)。275 nm 处的吸收峰归属于色氨酸和酪氨酸残基的贡献,而295 nm处的波峰则由酪氨酸残基单独贡献[39-40]。通过波峰波谷的变化可以说明蛋白质中氨基酸残基所处的环境不同,超过400 W的大豆分离蛋白-壳聚糖复合物溶液在275 nm和295 nm 下的吸收峰发生了红移,说明氨基酸残基向更加疏水的环境中迁移,导致蛋白质构象的改变。同时,在未处理的大豆分离蛋白质-壳聚糖复合溶液和200 W处理的大豆分离蛋白质-壳聚糖复合的二阶导数光谱没有发生明显的变化。通过计算波峰与波谷距离的比值来判断酪氨酸的变化[41]。如图5b所示,400 W以上超声处理的复合物相对于低功率处理的大豆分离蛋白壳聚糖复合物混合体系波峰与波谷距离的比值相对较大。这一现象说明蛋白质的三级构象改变,这可能是由于蛋白质和多糖的相互作用影响了蛋白质分子的微环境,使更多的酪氨酸残基从疏水环境中暴露于更加亲水的环境中,进而导致不同超声处理大豆分离蛋白-壳聚糖复合物结构的不同。

图5 不同超声处理条件下大豆分离蛋白-壳聚糖复合物溶液的紫外吸收光谱和二阶导数光谱Fig.5 Zero-order and second-derivative UV spectra of untreated and ultrasonication-treated soybean isolate protein-chitosan complex
2.6 复合物相互作用的荧光光谱
内源性荧光对蛋白质的色氨酸残基所处微环境变化和蛋白质三级结构变化具有较高的灵敏度,因此常作为检测蛋白质空间结构变化的手段[42]。不同超声功率处理大豆分离蛋白-壳聚糖复合物的荧光光谱如图6所示,超声处理和壳聚糖的加入都会影响大豆分离蛋白与壳聚糖之间的相互作用,可以诱导扰动或改变色氨酸的荧光参数,如荧光强度、量子产率或寿命等。因此,分析复合物的荧光光谱可以解析复合物之间相互作用关系。本试验采用280 nm作为复合物的激发波长,结果表明复合物溶液体系的荧光强度随着超声的处理有规律地降低,最大吸收峰的荧光强度也发生了轻微的蓝移。超声处理和壳聚糖的加入使大豆蛋白的构象发生了改变,是由于色氨酸残基移向更加疏水的环境中。这一结果与紫外二阶导数光谱所得到的信息是一致的。在超声功率小于500 W的条件下,超声使蛋白质结构打开、氨基酸暴露,使蛋白质表面电荷与其壳聚糖之间相互作用增强,当超声功率600 W时,可能是蛋白质发生了自聚集与壳聚糖相互作用后使发色基团被包裹在其他大分子侧链内,使荧光强度增加。另外,由于大豆蛋白与壳聚糖通过静电相互作用形成复合物,大分子之间的相互排斥作用力扰乱了蛋白质分子中氨基酸的微环境[43]。一些色氨酸残基由于蛋白质三级构象的改变移向更加疏水的环境中,影响了荧光强度。

图6 不同超声处理条件下大豆分离蛋白-壳聚糖复合物溶液的荧光光谱Fig.6 Intrinsic fluorescence spectroscopy of untreated and ultrasonication-treated soybean isolate protein-chitosan complex
3 结论
(1)利用不同超声功率处理的大豆分离蛋白与壳聚糖形成复合物,并研究不同复合物表面电荷、粒径大小和浊度等特性,发现相同处理时间下相对低功率400 W时形成的复合物粒径较小、表面电荷密度最大、浊度较低。由于大豆分离蛋白与壳聚糖之间主要通过静电相互作用结合,超声处理使蛋白的疏水基团暴露,影响了蛋白质表面电荷,进而影响复合物的形成和稳定。
(2)不同超声功率处理的大豆分离蛋白与壳聚糖形成复合物的稳定性取决于超声处理大豆分离蛋白的强度,适当的超声处理会使蛋白分子结构部分展开,柔性增加会促进与壳聚糖更强的结合,提高复合物的稳定性。当超声功率超过500 W时,较高的超声功率可以促使蛋白聚集体形成,掩盖了蛋白表面活性基团,影响了大豆分离蛋白质与壳聚糖之间的相互作用。
(3)通过紫外-可见吸收光谱法和荧光光谱法分析了大豆分离蛋白-壳聚糖复合物的结构性质的不同,超声使存在复合物中的蛋白质的三级结构和氨基酸微环境发生变化,从而影响复合物溶液的相关性质,结果说明不同超声处理影响了大豆分离蛋白-壳聚糖复合物的分子结构和相互作用。
1 迟玉杰,朱秀清,李文斌,等.大豆蛋白加工新技术[M].北京:科学出版社,2008.
2 李海萍, 易菊珍. 大豆分离蛋白改性的研究进展[J]. 高分子通报,2009(2):58-63. LI Haiping,YI Juzhen. Modification study of soybean protein isolate[J]. Polymer Bulletin, 2009(2):58-63. (in Chinese)
3 LAMACCHIA C, LANDRISCINA L, D’AGNELLO P. Changes in wheat kernel proteins induced by microwave treatment[J]. Food Chemistry, 2016, 197:634-640.
4 YOON H H, JEON E J. Functional properties of soy protein isolate from heat treated soybean[J]. Korean Journal of Food Science & Technology, 2004, 36(1):38-43.
5 KNORR D, HEINZ V, BUCKOW R. High pressure application for food biopolymers[J]. Biochimica et Biophysica Acta Proteins & Proteomics, 2006, 1764(3):619-631.
6 SORIA A C, VILLAMIEL M. Effect of ultrasound on the technological properties and bioactivity of food: a review[J]. Trends in Food Science & Technology, 2010, 21(7):323-331.
7 JAMBRAK A R, MASON T J, LELAS V, et al. Effect of ultrasound treatment on solubility and foaming properties of whey protein suspensions[J]. Journal of Food Engineering, 2008, 86(2):281-287.
8 徐轲轲. 大豆蛋白与多糖复合物乳化性质的研究[D]. 上海:复旦大学, 2009. XU Keke.Study on the emusifying properties of soy protein-polysaccharide complexes[D]. Shanghai: Fudan University, 2009. (in Chinese)
9 SINHA V R, SINGLA A K, WADHAWAN S, et al. Chitosan microspheres as a potential carrier for drugs[J]. International Journal of Pharmaceutics, 2004, 274(2):1-33.
10 HARISH PRASHANTH K V, THARANATHAN R N. Chitin/chitosan: modifications and their unlimited application potential—an overview[J]. Trends in Food Science & Technology, 2007, 18(3):117-131.
11 TERAMOTO A, TAKAGI Y, HACHIMORI A, et al. Interaction of albumin with polysaccharides containing ionic groups[J]. Polymers for Advanced Technologies, 1999, 10(12):681-686.
12 SCHMITT C, TURGEON S L. Protein/polysaccharide complexes and coacervates in food systems[J]. Current Opinion in Colloid & Interface Science, 2007, 12(4-5):166-178.
13 LIU S, LOW N H, NICKERSON M T. Effect of pH, salt, and biopolymer ratio on the formation of pea protein isolate-gum arabic complexes[J]. Journal of Agricultural & Food Chemistry, 2009, 57(4):1521-1526.
14 HARNSILAWAT T, PONGSAWATMANIT R, MCCLEMENTS D J. Characterization of β-lactoglobulin-sodium alginate interactions in aqueous solutions: a calorimetry, light scattering, electrophoretic mobility and solubility study[J]. Food Hydrocolloids, 2006, 20(1):124-131.
15 GULAO E S, DE SOUZA C J, ANDRADE C T, et al. Complex coacervates obtained from peptide leucine and gum arabic: formation and characterization[J]. Food Chemistry, 2016, 194:680-686.
16 SARIKA P R, PAVITHRAN A, JAMES N R. Cationized gelatin/gum arabic polyelectrolyte complex: study of electrostatic interactions[J]. Food Hydrocolloids, 2015, 49:176-182.
17 LI C, ZHU W, XUE H, et al. Physical and structural properties of peanut protein isolate-gum Arabic films prepared by various glycation time[J]. Food Hydrocolloids, 2015, 43:322-328.
18 LANEUVILLE S I. Protein-polysaccharide coacervates and complexes: from scientific background to their application as functional ingredients in food products[M]. KASAPIS S. Modern biopolymer science. New York: Academic Press,2009:327-363.
19 LE X T, TURGEON S L. Rheological and structural study of electrostatic cross-linked xanthan gum hydrogels induced by β-lactoglobulin[J]. Soft Matter, 2013, 9(11):3063-3073.
20 ELMER C, KARACA A C, LOW N H, et al. Complex coacervation in pea protein isolate-chitosan mixtures[J]. Food Research International, 2011, 44(5):1441-1446.
21 ZHANG G, FOEGEDING E A, HARDIN C C. Effect of sulfated polysaccharides on heat-induced structural changes in beta-lactoglobulin[J]. Journal of Agricultural & Food Chemistry, 2004, 52(12):3975-3981.
22 CHUNG K, KIM J, CHO B K, et al. How does dextran sulfate prevent heat induced aggregation of protein? The mechanism and its limitation as aggregation inhibitor[J]. Biochimica et Biophysica Acta, 2007, 1774(2):249-257.
23 ESPINOSAANDREWS H, LOBATOCALLEROS C, VERNONCARTER J. Interrelationship between the zeta potential and viscoelastic properties in coacervates complexes[J]. Carbohydrate Polymers, 2013, 95(1):161-166.
24 PETRUCCELLI S, ANON M C. Relationship between the method of obtention and structural and functional properties of soy protein isolates. 2. Surface properties[J]. Journal of Agricultural & Food Chemistry, 1994, 42(10):2170-2176.
25 HU H, WU J, LI-CHAN E C Y, et al. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions[J]. Food Hydrocolloids, 2013, 30(2):647-655.
26 LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227(52): 680-685.
27 MARTINI S, POTTER R, WALSH M K. Optimizing the use of power ultrasound to decrease turbidity in whey protein suspensions[J]. Food Research International, 2010, 43(10):2444-2451.
28 牛付阁. 卵白蛋白-阿拉伯胶相互作用及其在油水界面的吸附特性[D]. 无锡:江南大学, 2015. NIU Fuge. Ovalbumin-gum arabic interactions and the adsorption properties at the oil-water interface[D]. Wuxi: Jiangnan University, 2015. (in Chinese)
29 BONOMI F, MORA G, PAGANI M A, et al. Probing structural features of water-insoluble proteins by front-face fluorescence[J]. Analytical Biochemistry, 2004, 329(1):104-111.
30 江连洲. 植物蛋白工艺学[M]. 北京:科学出版社, 2011.
31 朱建华, 杨晓泉. 超声处理对大豆蛋白分子结构的影响[J]. 粮油加工, 2010(7):39-42. ZHU Jianhua, YANG Xiaoquan. Effects of ultrasonic treatment on molecular structure of soybean protein[J]. Grain and Oil Processing, 2010(7):39-42.(in Chinese)
32 KENTISH S, WOOSTER T J, ASHOKKUMAR M, et al. The use of ultrasonics for nanoemulsion preparation[J]. Innovative Food Science & Emerging Technologies, 2008, 9(2):170-175.
33 KARKI B, LAMSAL B P, GREWELL D, et al. Functional properties of soy protein isolates produced from ultrasonicated defatted soy flakes[J]. Journal of the American Oil Chemists Society, 2009, 86(10):1021-1028.
34 HAYAKAWA S, NAKAI S. Relationships of hydrophobicity and net charge to the solubility of milk and soy proteins[J]. Journal of Food Science, 1985, 50(2):486-491.
35 DUBIN P L, MURRELL J M. Size distribution of complexes formed between poly (dimethyldiallylammonium chloride) and bovine serum albumin[J]. Macromolecules, 1988, 21(7):2291-2293.
36 WEINBRECK F, DE V R, SCHROOYEN P, et al. Complex coacervation of whey proteins and gum arabic[J]. Biomacro Molecules, 2003, 4(2):293-303.
37 XU Y T, LIU L. Structural and functional properties of soy protein isolates modified by soy soluble polysaccharides[J]. Journal of Agricultural & Food Chemistry, 2016, 64(38):7275-7284.
38 WANG L J, YIN Y C, YIN S W, et al. Development of novel zein-sodium caseinate nanoparticle (ZP)-stabilized emulsion films for improved water barrier properties via emulsion/solvent evaporation[J]. Journal of Agricultural & Food Chemistry, 2013, 61(46):11089-11097.
39 LANGE R, BALNY C. UV-visible derivative spectroscopy under high pressure[J]. Biochimica et Biophysica Acta, 2002, 1595(1):80-93.
40 PADROS E, MORROS A, MANOSA J, et al. The state of tyrosine and phenylalanine residues in proteins analyzed by fourth-derivative spectrophotometry. Histone H1 and ribonuclease A[J]. European Journal of Biochemistry, 1982, 127(1):117-122.
41 DCF L, DELVIVO F M, MPC S. Use of activated carbon for removing phenylalanine from reconstituted skim milk powder hydrolysates[J]. LWT—Food Science and Technology, 2005, 38(5):447-453.
42 WALSTRA P. Physical chemistry of foods [M]. Boca Raton: CRC Press, 2002: 158-163.
43 ZHANG Q T, TU Z C, XIAO H, et al. Influence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J]. Food & Bioproducts Processing, 2014, 92(1): 30-37.
StructuralPropertiesofSoybeanProteinIsolate-ChitosanComplexTreatedbyUltrasonic
DING Jian QI Baokun JIANG Nan SUI Xiaonan WANG Zhongjiang LI Yang
(CollegeofFoodScience,NortheastAgriculturalUniversity,Harbin150030,China)
The objective was to evaluate the interaction between ultrasonic treatment soybean protein isolate and chitosan, and the structural properties of the complexes. The interaction was studied by UV-Vis absorption and fluorescence spectroscopy. The relationships between structure changes and functional properties of soybean protein-chitosan complexes through SDS-PAGE, dynamic light scattering particle size analysis, surface charge and turbidity measurement were investigated. The results showed that with the increase of ultrasonic power, the maximum absorption peak of UV-Vis absorption spectrum was gradually increased and occurred red-shifted; the fluorescence intensity was firstly decreased and then increased. The intensity of the endogenous fluorescence was the highest at 600 W. Ultrasonic treatment affected soybean protein isolate subunit composition and mainly promoted the interaction between 7S subunits and chitosan. The particle size of the complex was firstly decreased and then increased. The charge potential of the complexes was larger under 300~500 W than those under others. The turbidity was also decreased, which was beneficial to homogeneous distribution and stability of the solution. The results showed that the formation of the complex was relatively stable at low power, but the interaction between soy protein isolate and chitosan was affected by the insoluble aggregation and rearrangement of the protein after high power ultrasonic treatment. The interaction of different complexes affected the microenvironment of amino acid residues, the tertiary structure and molecular flexibility of soybean protein isolate, and then impacted the structure and functional properties of the complexes.
soybean protein isolate; chitosan; complex; interaction; ultrasonic treatment
TS214.2
A
1000-1298(2017)09-0352-07
10.6041/j.issn.1000-1298.2017.09.045
2017-02-20
2017-03-13
国家自然科学基金面上项目(31571876)和国家重点研发计划项目(2016YFD0400700、2016YFD0400402)
丁俭(1989—),男,博士生,主要从事粮食、油脂及植物蛋白工程研究,E-mail: 18845619206@163.com
李杨(1981—),男,副教授,博士,主要从事粮食、油脂及植物蛋白工程研究,E-mail: liyanghuangyu@163.com

