头孢噻呋及去呋喃甲酰基头孢噻呋的四极杆轨道阱串联质谱分析及其在肉鸡体内的残留规律研究
洪云鹤,刘 艳,崔凤云,许秀丽,方恩华,张经华,张 峰,张宝善
(1.陕西师范大学,陕西 西安 710119;2.中国检验检疫科学研究院,北京 100176;3.北京市理化分析测试中心,北京市食品安全分析测试工程技术研究中心,北京 100089;4.北京出入境检验检疫局检验检疫技术中心,北京 100026;5.厦门市出入境检验检疫局检验检疫技术中心,福建 厦门 361026)
头孢噻呋及去呋喃甲酰基头孢噻呋的四极杆轨道阱串联质谱分析及其在肉鸡体内的残留规律研究
洪云鹤1,2,刘 艳3,崔凤云4,许秀丽2,方恩华5,张经华3,张 峰2,张宝善1
(1.陕西师范大学,陕西 西安 710119;2.中国检验检疫科学研究院,北京 100176;3.北京市理化分析测试中心,北京市食品安全分析测试工程技术研究中心,北京 100089;4.北京出入境检验检疫局检验检疫技术中心,北京 100026;5.厦门市出入境检验检疫局检验检疫技术中心,福建 厦门 361026)
建立了头孢噻呋及其主要代谢物去呋喃甲酰基头孢噻呋残留的超高效液相色谱-四极杆轨道阱串联质谱(UHPLC-Q-Orbitrap MS)分析方法。选用Kinetex F5 100A色谱柱(50 mm×3.0 mm×2.6 μm)分离,在Q-Exactive高分辨质谱Full MS/dd-MS2扫描模式下采集数据进行定性定量分析。两种目标物在3种基质中相应浓度范围内的线性关系良好,相关系数r2均大于0.990,回收率为83.2%~129.7%,RSD均小于15%。通过对鸡体内头孢噻呋及其代谢物残留规律的分析表明,给药后,鸡胸肉中头孢噻呋和去呋喃甲酰基头孢噻呋均可检出,且消除时间均为12~24 h;鸡肝、鸡肾中头孢噻呋可在0.5 h内迅速代谢为去呋喃甲酰基头孢噻呋,鸡肝和鸡肾中去呋喃甲酰基头孢噻呋的消除时间分别为48~72 h和72~120 h。本研究可为保障动物源性食品安全以及鸡体内头孢噻呋最大残留限量标准和休药期的制订提供理论和实践依据。
四极杆轨道阱串联质谱(Q-Orbitrap MS);头孢噻呋;鸡肉;食品安全
Abstract: A method of liquid chromatography quadrupole-Orbitrap hybrid mass spectrometry was developed and validated for the determination of ceftiofur and desfuroylceftiofur in chicken. The Kinetex F5 100A column (50 mm×3.0 mm×2.6 μm) was used during the separation of ceftiofur and desfuroylceftiofur. Full MS/dd-MS2mode was chosen for data acquisition, which showed good form in sample qualitative and quantitative analysis. The fragmentation pathways of ceftiofur and desfuroylceftiofur were clarified based on the results of high-accuracy mass spectrometry. During analysis of three types of matrixes (chicken, liver and kidney), correlation coefficients of linear calibration curves of ceftiofur and desfuroylceftiofur are over 0.990 at the corresponding concentration ranges of 2-200 μg/kg. The average recoveries of ceftiofur and desfuroylceftiofur range from 83.2% to 129.7% with the inter-day relative standard deviation (RSD) less than 15% in spiked samples at three levels. Besides, the elimination of ceftiofur in hens was studied. Ceftiofur was injected in hens’ muscle once a day for three consecutive days. The residue can not be detected in chicken breast after 12 h, while ceftiofur and desfuroylceftiofur can be detected in chicken breast simultaneously during 12 h. The metabolism of ceftiofur in hens’ liver and kidney is fast. It can totally metabolize to desfuroylceftiofur during less than 0.5 h. The residue of desfuroylceftiofur in hens’ liver can not be detected after 48 h, while the residue in kidney can not be detected after 72 h. This research can provide a basis for reference for the future development of long plagued quality and safety issues.
Keywords: quadrupole-Orbitrap hybrid mass spectrometry (Q-Orbitrap MS); ceftiofur; chicken; food security
头孢噻呋(Ceftiofur, EFT)又名赛德福,是Bernard等[1-2]于1984年研发的一种广谱半合成抗生素。作为第三代头孢菌素中的一种[3],头孢噻呋是现有50余种头孢菌素中唯一被美国、日本及欧洲一些国家批准使用的动物专用头孢菌素[4],它因具有抗菌谱广、抑菌活性强、药物半衰期长、药效持久等特点,在动物养殖过程中被广泛使用。但是,头孢噻呋在动物饲养过程中的不规范使用会导致药物残留于动物源性食品中[5],带来一系列的食品安全问题,还可能导致细菌产生耐药性,生成“超级细菌”,给人类的健康带来隐患。
EFT进入动物体内后,会在短时间内被吸收,并代谢成同样具有抗菌活性的去呋喃甲酰基头孢噻呋[6](DFC)。我国农业部235号文件[7]及欧盟EU/37/2010[8]中均指出,对头孢噻呋进行定量分析时应充分考虑去呋喃甲酰基头孢噻呋的含量。目前,对头孢噻呋及其代谢物的残留分析主要有高效液相色谱(HPLC)法[9-11]和高效液相色谱-串联质谱(LC-MS/MS)法[12-14]。其中,HPLC法大多存在灵敏度和定性准确性低,现已逐步被质谱分析方法所取代。而动物源性食品基质复杂,使用低分辨质谱对头孢噻呋进行分析时常有杂质峰干扰[15],影响其定量和定性准确性。
本研究拟采用超高效液相色谱-四极杆轨道阱质谱(UHPLC-Q-Orbitrap MS)法同时测定鸡肉中头孢噻呋及去呋喃甲酰基头孢噻呋的残留量,并应用二级碎片离子的精确质量数对两者的裂解规律进行分析,推测其二级特征碎片离子可能的结构式。本研究还将探讨头孢噻呋在鸡胸肉中的残留情况,希望能对鸡血浆中头孢噻呋药代动力学的相关研究[16]进行补充,填补国内头孢噻呋及代谢物在鸡肉、鸡肝、鸡肾中代谢及消除研究的空白,为保障动物源性食品安全以及鸡体内头孢噻呋最大残留限量标准的制订提供理论和实践依据。
1 实验部分
1.1 仪器与材料
Thermo Scientific Q Exactive四极杆-静电场轨道阱高分辨质谱仪,Dionex UltiMate 3000快速高效液相色谱系统:美国Thermo Fisher公司产品;涡旋振荡器:美国Scientific Industries公司产品;超声清洗仪:昆山市超声仪器有限公司产品;高速冷冻离心机:美国Beckman Coulter公司产品;纯水仪:美国Millipore公司产品;分析天平:瑞士Mettler Toledo公司产品。
头孢噻呋-EFT标准品(纯度98%):德国Dr. Ehrenstorfer公司产品;去呋喃甲酰基头孢噻呋-DFC标准品(纯度61%):加拿大TRC公司产品;乙腈、正己烷:色谱纯,美国Fisher Scientific公司产品;甲酸(纯度99%):北京百灵威公司产品。
动物实验注射用头孢噻呋(速克,1 g/瓶,批号:20151102): 普莱柯生物工程股份有限公司产品;注射工具:2.5 mL注射器,精确度0.1 mL。
1.2 标准溶液的配制
准确称取0.01 g(精确至0.000 1 g)EFT标准品,以乙腈-水溶液(4∶1,V/V)定容至50 mL,称取0.01 g(精确至0.000 1 g)DFC标准品,以乙腈-水溶液(4∶1,V/V)定容至30 mL,分别配制成200 mg/kg的标准储备溶液,于-40 ℃贮存,备用。
混合标准溶液的配制:分别移取0.1 mL各标准品,定容至1 mL,即得20 mg/kg混合标准溶液,于-40 ℃贮存,使用时每周配制1次。
速克(动物用头孢噻呋针剂)每瓶均溶于10 mL生理盐水中,即得到100 g/L注射液。
1.3 实验条件
1.3.1色谱条件 Phenomenex Kinetex F5 100A柱(50 mm×3.0 mm×2.6 μm);流动相:A为水相(含0.1%甲酸),B为乙腈(含0.1%甲酸);梯度洗脱程序:0~0.2 min(5%B),0.2~0.8 min(5%~95%B),0.8~1.2 min(95%B),1.2~2 min(95%~5%B),2~3.5 min(5%B);流速0.7 mL/min;进样体积5 μL;柱温30 ℃;样品盘温度8 ℃。
1.3.2质谱参数 HESI离子源,鞘气压力2.07×105Pa,辅助气流速10 arb,喷雾电压3.5 kV,S-lens电压60 V,毛细管温度300 ℃,辅助气加热温度350 ℃,正离子采集模式。
1.4 实验动物
实验动物为北京油鸡母鸡,33周龄(231日龄)。实验前注射2.5 mL生理盐水,观察24 h吸收良好,药物注射前1天鸡禁食。将实验鸡分为9组,1组为空白对照组,另外8组为给药组,按其质量(60 mg/kg)腿部肌肉注射给药,连续给药3天后进行样品采集。
样品采集:停药后按0.5、4、8、12、24、48、72、120 h随机取鸡,每个时间点取3只,剖杀后取胸肌肉、肝脏、肾脏,待测。
1.5 样品前处理
称取(5.0±0.05) g鸡肉样品,(2.5±0.05) g鸡肝和鸡肾样品于50 mL离心管中,加入10 mL乙腈-水溶液(4∶1,V/V),涡旋1 min,超声提取20 min后,于4 ℃以10 000 r/min离心10 min;取2 mL上清液,过PRiME HLB固相萃取柱,再以2 mL含0.1%甲酸的乙腈-水溶液(5∶1,V/V)洗脱1次,收集2次流出液,于常温氮气吹至不足1 mL,乙腈定容至1 mL,过0.22 μm滤膜,待UHPLC-Q-Orbitrap上机检测。
2 结果与讨论
2.1 仪器条件
选用Full MS/dd-MS2和Target-SIM/dd-MS2两种扫描模式。Target-SIM/dd-MS2扫描模式下通过四极杆筛选出一级离子,进入高能碰撞池发生裂解,从而可以得到二级离子的碎片信息,提高目标物的定性准确性,但该扫描模式在对目标物的定量上稍显不足。Full MS/dd-MS2扫描模式以一级离子和二级碎片离子的精确质量数定性、一级离子的色谱峰面积定量,可达到对目标物的筛查及定量的目的。研究初期查找二级特征子离子时使用Target-SIM/dd-MS2模式,而Full MS/dd-MS2模式则用于后期目标物的定性及定量筛查。
为得到EFT和DFC的二级特征碎片子离子,采用Target-SIM/dd-MS2模式对2种目标物的二级碎片离子进行监控,选用Full MS/dd-MS2模式进行检测方法开发和目标物筛查。在Full MS分辨率70 000,dd-MS2分辨率17 500时可得到最佳的监测结果,结果列于表1。
通过二级离子的精确质量数,研究EFT和DFC在该仪器条件下的裂解规律。EFT的特征碎片离子为m/z126.012 08、241.038 6、285.010 80,DFC的特征碎片离子为m/z126.012 12、227.005 28、386.040 10。两种物质均存在m/z126.012特征碎片离子,针对这一离子推断出的两种可能结构式示于图1和图2,进一步验证了m/z126.012可作为EFT及DFC共有的特征碎片离子。在裂解规律推断过程中发现,两种物质的裂解规律大多为简单的α裂解,部分裂解步骤中可能涉及到π键断裂,本研究对两种物质各选出响应较高的3个特征碎片离子进行分析,其裂解过程中未涉及结构重排。

表1 EFT和DFC的离子化模式、精确质量数和二级特征碎片离子Table 1 Formulas, ionization modes, parent ions and product ions of EFT and DFC
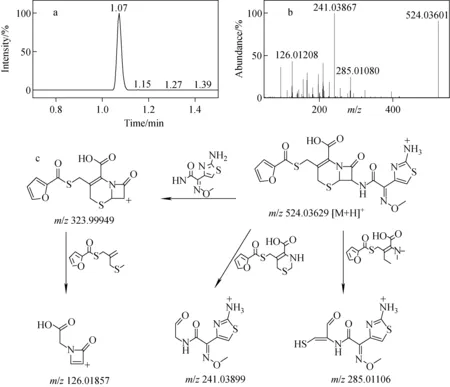
图1 EFT的提取离子流图(a),子离子质谱图(b)和裂解规律(c)Fig.1 Extracted ion chromatogram (a), MS2 (b) and main fragmentation pathways (c) of ceftiofur

图2 DFC的提取离子流图(a),子离子质谱图(b)和裂解规律(c)Fig.2 Extracted ion chromatogram (a), MS2 (b) and main fragmentation pathways (c) of desfuroylceftiofur
2.2 样品前处理
本研究对比了液-液萃取(LLE)、固相萃取(SPE)和直接提取后离心处理三种前处理方法。其中,液-液萃取提取过程中选用乙腈-水溶液,考虑到水与正己烷互不相溶,但乙腈微溶于正己烷,因此选用乙腈饱和的正己烷溶液作为萃取液除去提取液中的脂类杂质。固相萃取考虑到提取溶液中有机相比例较高,因此使用PRiME HLB杂质吸附型固相萃取柱进行前处理净化,除去磷脂等杂质。
称取(5.0±0.05) g空白鸡肉,(2.5±0.05) g空白鸡肝和鸡肾,加入10 mL乙腈-水溶液(4∶1,V/V) 作为提取液,涡旋混合,80 W超声提取20 min,以10 000 r/min离心10 min,取上清液。液-液萃取:加入乙腈饱和正己烷溶液,振摇约3 min,取下层清液过0.22 μm滤膜,待分析;固相萃取:取2 mL上清液,过PRiME HLB固相萃取柱,待样品溶液全部流出后,再以2 mL含0.1%甲酸的乙腈-水溶液(5∶1,V/V)洗脱1次,收集2次流出液,氮吹浓缩至不足1 mL,乙腈定容至1 mL,过0.22 μm滤膜,待分析;直接提取-低温离心:上清液直接过0.22 μm滤膜,上机检测。使用3种前处理方式净化后的样品回收率示于图3。
使用LLE方法时,乙腈饱和正己烷溶液虽然可除去鸡肉、鸡肝和鸡肾提取液中脂类和非极性杂质的干扰,但同时也可能造成两种低极性待测物在前处理过程中的损失,导致回收率偏低。
对于鸡肉样品而言,使用PRiME HLB固相萃取柱和提取-离心两种前处理方式处理后的样品回收率均可满足检测要求;肝脏、肾脏样品经提取-离心处理后,基质效应明显,而使用PRiME HLB固相萃取柱可有效减小鸡肝、鸡肾样品的基质效应。
2.3 基质效应
Q-Orbitrap的质谱响应信号可能会被基质效应所影响,软电离过程中的质谱响应可能会因基质效应而增强或减弱。为了减少检测过程中的基质效应干扰,使用基质加标法绘制标准曲线。采用峰面积法考察基质效应:向空白鸡肉、鸡肝和鸡肾样品中加入50 μg/kg混合标准溶液进行样品前处理,另取50 μg/kg混合标准溶液上机检测,结果列于表2。

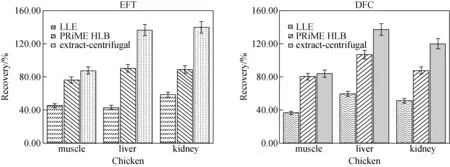
图3 净化方式对回收率的影响Fig.3 Effect of recoveries in different purify procedures

目标物Analyte线性方程Calibrationequations相关系数Correlationcoefficients(r2)确定限CCα/(μg/kg)检测容量CCβ/(μg/kg)基质效应Matrixeffect/%回收率(相对标准偏差)Recoveries/%(RSDs)5μg/kg100μg/kg500μg/kg鸡肉EFTy=-16813.3+13066.1x0.99901.222.08107.78120.04(12.88)94.94(5.15)83.20(9.56)DFCy=21333.7+23306.5x0.99981.402.39110.3297.37(2.13)92.86(7.07)104.50(8.63)鸡肝EFTy=-2805140+1586040x0.99982.434.1395.53101.87(7.96)99.88(12.22)103.41(1.55)DFCy=-228083+42067.5x0.99664.427.5381.41104.68(11.80)100.37(6.29)129.07(4.80)鸡肾EFTy=-5775550+1925740x0.99912.404.0985.9999.67(7.54)93.04(1.44)127.69(2.00)DFCy=-958132+50225.1x0.99383.636.1982.6198.75(12.22)101.68(7.18)118.50(2.37)
注:*n=6,即平行测定6组,取平均值
经前处理后的鸡肉样品基质效应较小,鸡胸肉中EFT基质效应为107.78%、DFC基质效应为110.32%,鸡肝中EFT基质效应为95.53%、DFC基质效应为81.41%,鸡肾中EFT基质效应为85.99%、DFC基质效应为82.61%,均满足鸡肉中EFT和DFC残留的日常检测需求。
2.4 方法验证
方法验证参照欧盟2002/657/EC和美国食品药监局生物分析检测指导手册。
空白基质做等浓度梯度混合标准品添加处理,绘制标准曲线,计算CCα(α=1%)和CCβ(β=5%)。
采用基质匹配加标法在5~500 μg/kg范围内分别绘制EFT和DFC的标准曲线;考察回收率指标时,回收率取各物质标准曲线上的高、中、低三个浓度,在空白基质中添加标准溶液(5、100和500 μg/kg),其回收率列于表2。
在5~500 μg/L浓度范围内,EFT和DFC在鸡肉、鸡肝和鸡肾基质中均呈现良好的线性关系,线性相关系数大于0.993 8,CCα为1.22~4.42 μg/kg,CCβ为2.08~7.53 μg/kg。取高(500 μg/kg)、中(100 μg/kg)、低(5 μg/kg)3个浓度点进行基质加标处理,各浓度点平行测量6个样品,平均回收率为83.2%~129.7%,RSD(日内精密度)为1.44%~12.88%。
2.5 EFT及DFC在鸡体内的残留规律
以60 mg/kg腿部肌肉连续注射3天药物后,对鸡胸肉、鸡肝、鸡肾样品中EFT和DFC浓度进行测定,对照组均未检出EFT和DFC残留,给药组鸡胸肉、鸡肝、鸡肾中EFT和DFC浓度随时间的变化示于图4。

图4 鸡胸肉(a),鸡肝(b)和鸡肾(c)中EFT和DFC含量变化趋势图Fig.4 Residual rule of ceftiofur and desfuroylceftiofur in chicken muscle (a), liver (b) and kidney (c)
鸡胸肉中DFC的浓度变化小于EFT,可能是由于EFT除了自身降解消除外,还会代谢为DFC,样品中检测到的DFC全部是由EFT转化而来。实验采样的8个时间点中并未出现DFC浓度升高的情况,说明DFC消除速度较EFT代谢成DFC的速度快。
在鸡肝、鸡肾中均未检出EFT,但检出的DFC浓度较高。此现象可能是因为EFT进入实验鸡肝脏中0.5 h就全部代谢为DFC,因此肝脏和肾脏中未检出EFT原药残留。而鸡胸肉中检出的EFT均为残留在血液和鸡肉组织中的药物,代谢速度较肝脏慢。
停药后0.5~4 h内,鸡胸肉中EFT和DFC的浓度均迅速下降,EFT由427.26 μg/kg下降至29.46 μg/kg,DFC由315.86 μg/kg下降至11.50 μg/kg;停药后12 h样品组中可检测到EFT为3.56 μg/kg,DFC为2.03 μg/kg;停药后24 h鸡胸肉取样检测不到EFT和DFC。
停药后0.5 h鸡肝鸡肾中DFC含量最高;随后在停药后0.5~4 h内,鸡肝中DFC由2 695 μg/kg下降至581 μg/kg,鸡肾中DFC由1 802 μg/kg下降至509 μg/kg;停药后48 h可检测到鸡肝中DFC含量为15 μg/kg;停药后72 h鸡肝中检测不到DFC;停药后72 h鸡肾中可检测到DFC含量为6 μg/kg;停药后120 h鸡肾中检测不到DFC。
3 结论
本研究建立了头孢噻呋及去呋喃甲酰基头孢噻呋残留的UHPLC-Q-Orbitrap快速筛查方法。目标物经苯基柱分离,色谱峰形尖锐、对称性好,可于5 min内完成头孢噻呋和去呋喃甲酰基头孢噻呋的分离检测。鸡肉、鸡肝和鸡肾中头孢噻呋的检出限分别为1.22、2.43、2.40 μg/kg;鸡肉、鸡肝和鸡肾中去呋喃甲酰基头孢噻呋的检出限分别为1.40、4.42、3.63 μg/kg。该方法分析速度快、抗干扰能力强、定性准确度高、灵敏度高,可作为鸡肉、鸡肝、鸡肾中头孢噻呋及去呋喃甲酰基头孢噻呋残留的分析确证方法。
本研究同时探索了头孢噻呋及去呋喃甲酰基头孢噻呋在鸡体内的残留规律,结果表明,头孢噻呋进入实验鸡肝脏、肾脏后可在0.5 h内迅速转化为去呋喃甲酰基头孢噻呋,肝、肾中的去呋喃甲酰基头孢噻呋在3日内可消除。而在鸡肉中,头孢噻呋和去呋喃甲酰基头孢噻呋同时存在,且均可在24 h内消除。因此,在制定鸡体内头孢噻呋残留相关标准时,应充分考虑鸡肉中头孢噻呋及去呋喃甲酰基头孢噻呋消除时间相同,以两者总和计算残留量。头孢噻呋在鸡肝脏和肾脏中代谢较快,作为原药不易检出,但可通过检测其主要代谢物去呋喃甲酰基头孢噻呋达到检测头孢噻呋的目的。
[1] Jr Y R, KINNEY M L, ROBERTS B J, et al. Ceftiofur sodium, a broad-spectrum cephalosporin: evaluation in vitro and in vivo in mice[J]. American Journal of Veterinary Research, 1987, 48(7): 1 050-1 053.
[2] 王慧,陈小军,刘伟,等. 动物专用头孢噻呋[J]. 动物医学进展,2009,30(1):104-108.
WANG Hui, CHEN Xiaojun, LIU Wei, et al. Advance in animal-specific cephalosporin-ceftiofur[J]. Progress in Veterinary Medicine, 2009, 30(1): 104-108(in Chinese).
[3] 王付民,胡功政,苑丽. 新的第三代头孢菌素——头孢噻呋[J]. 信阳农业高等专科学校学报,2001,11(4):1-5.
WANG Fumin, HU Gongzheng, YUAN Li. A new and third generation cephalosporin: ceftiofur[J]. Journal of Xinyang Agricultural College, 2001, 11(4): 1-5(in Chinese).
[4] BROWN S A, CHESTER S T, SPEEDY A K, et al. Comparison of plasma pharmacokinetics and bioequivalence of ceftiofur sodium in cattle after a single intramuscular or subcutaneous injection[J]. Journal of Veterinary Pharmacology & Therapeutics, 2000, 23(5): 273-280.
[5] 曹国弟,张孝清,赵恒寿. 头孢噻呋钠体外对畜禽致病菌的敏感性测定[J]. 黑龙江畜牧兽医,2015,(12):120-121.
CAI Guodi, ZHANG Xiaoqing, ZHAO Hengshou. Susceptibility of pathogens isolated from livestock and poultry in ceftiofur sodium[J]. Heilongjiang Animal Science and Veterinary Medicine, 2015, (12): 120-121(in Chinese).
[6] 赵静,刘鹏,钱镭. UPLC-MS/MS检测原料奶中兑呋喃甲酰基头孢噻呋残留方法的建立[J]. 食品工业科技,2014,35(16):92-95.
ZHAO Jing, LIU Peng, QIAN Lei. Establishment on UPLC-MS/MS detection methods for desfuroylceftiofur in raw milk[J]. Chinese Journal of Science and Technology of Food Industry, 2014, 35(16): 92-95(in Chinese).
[7] 中华人民共和国农业部第235号公告. 动物食品中兽药最高残留限量[EB/OL]. (2002-12-24)[2016-10-01]. http:∥jckspaqj.aqsiq.gov.cn/dwyxspjyjy/gnxgbz/200610/t20061027_9809.htm.
[8] The European Union. Commission Regulation (EU) No 37/2010[S]. 2010.
[9] JACOBSON G A, MARTINOD S, CUNNINGHAM C P. Determination of ceftiofur in bovine plasma by HPLC-DAD[J]. Journal of Pharmaceutical & Biomedical Analysis, 2006, 40(5): 1 249-1 252.
[10] 昌莉丽,张春辉,肖传斌,等. RP-HPLC法测定头孢噻呋混悬注射液含量[J]. 西北农业学报,2010,19(6):44-47.
CHANG Lili, ZHANG Chunhui, XIAO Chuanbin, et al. Determination of ceftiofur suspension injection by RP-HPLC[J]. Acta Agriculture Boreali-occidentalis Sinica, 2010, 19(6): 44-47(in Chinese).
[11] 李长流,俞道进,马玉芳,等. 猪血浆中去呋喃甲酰基头孢噻呋浓度的HPLC测定[J]. 福建农林大学学报:自然科学版,2010,39(1):58-62.
LI Changliu, YU Daojin, MA Yufang, et al. Determination of desfuroylceftiofur in pig plasma by HPLC[J]. Journal of Fujian Agriculture and Forestry University, 2010, 39(1): 58-62(in Chinese).
[12] 卜明楠,石志红,康健,等. QuEChERS结合LC-MS/MS同时测定虾肉中72种兽药残留[J]. 分析测试学报,2012,31(5):552-558.
BU Mingnan, SHI Zhihong, KANG Jian, et al. Simultaneous determination of 72 veterinary drugs in shrimp by modified QuEChERS and high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Instrumental Analysis, 2012, 31(5): 552-558(in Chinese).
[13] FENG S, CHATTOPADHAYA C, KIJAK P, et al. A determinative and confirmatory method for ceftiofur metabolite desfuroylceftiofur cysteine disulfide in bovine kidney by LC-MS/MS[J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences, 2012, 898(6): 62-68.
[14] JANK L, MARTINS M T, ARSAND J B, et al. High-throughput method for the determination of residues ofβ-lactam antibiotics in bovine milk by LC-MS/MS[J]. Food Additives & Contaminants Part A Chemistry Analysis Control Exposure & Risk Assessment, 2015, 32(12): 1 992-2 001.
[15] LI W, SHEN H, HONG Y, et al. Simultaneous determination of 22 cephalosporins drug residues in pork muscle using liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences, 2016, (1 022): 298-307.
[16] 申红春. 盐酸头孢噻呋在肉鸡体内的药物动力学研究[D]. 武汉:华中农业大学,2009.
Determination of Ceftiofur & Desfuroyl Ceftiofur Residue and the Elimination Analysis in Chicken Using Liquid Chromatography Quadrupole-Orbitrap Hybrid Mass Spectrometry
HONG Yun-he1,2, LIU Yan3, CUI Feng-yun4, XU Xiu-li2, FANG En-hua5, ZHANG Jing-hua3, ZHANG Feng2, ZHANG Bao-shan1
(1.ShanxiNormalUniversity,Xi’an710119,China;2.ChineseAcademyofInspectionandQuarantine,Beijing100176,China;3.BeijingEngineeringResearchCenterofFoodSafetyAnalysis,BeijingCenterforPhysical&ChemicalAnalysis,Beijing100089,China;4.TechnologyCenterofBeijingEntry-ExitInspectionandQuarantineBureau,Beijing100026,China;5.XiamenEntry-ExitInspectionandQuarantineBureauofthePeople’sRepublicofChina,InspectionandQuarantineTechnologyCenter,Xiamen361026,China)
O657.63
A
1004-2997(2017)05-0526-08
10.7538/zpxb.2016.0168
2016-10-19;
2016-12-05
国家重大仪器开发专项(2012YQ14000806);北京市科技计划项目(Z141100002614020)资助
洪云鹤(1992—),女(满族),河北遵化人,硕士研究生,农产品加工及贮藏工程专业。E-mail: hong_yunhe@163.com
张宝善(1968—),男(汉族),甘肃张掖人,教授,从事食品发酵原理与技术研究。E-mail: baoshan2@snnu.edu.cn 张 峰(1974—),男(汉族),山东枣庄人,研究员,从事食品安全检测分析技术研究。E-mail: fengzhang@126.com
时间:2017-04-13;网络出版地址:http:∥www.cnki.net/kcms/detail/11.2979.TH.20170413.0916.006.html

