接受抗病毒治疗的代偿期乙肝肝硬化患者进展为肝癌的危险因素分析
林春蕾,王岩,李涛,曲云东,王磊,杨保华
(山东大学第二医院,济南250033)
接受抗病毒治疗的代偿期乙肝肝硬化患者进展为肝癌的危险因素分析
林春蕾,王岩,李涛,曲云东,王磊,杨保华
(山东大学第二医院,济南250033)
目的探讨接受抗病毒治疗的代偿期乙肝肝硬化患者进展为肝细胞癌(肝癌)的危险因素。方法收集抗病毒治疗至少12个月的代偿期乙肝肝硬化患者95例,根据其是否进展为肝癌分为肝癌组16例和非肝癌组79例。收集并比较两组临床资料,包括性别、年龄、肝癌家族史、病毒学应答(抗病毒治疗6个月时HBV DNA测不出)情况、核苷(酸)类似物耐药情况,以及抗病毒治疗前HBeAg定性检查结果、血清HBV DNA的log10、血清天门冬氨酸氨基转移酶(AST)、血清白蛋白、血小板计数。以两组间比较差异有统计学意义的资料为自变量,以进展为肝癌为因变量,对自变量分别赋值进行COX回归模型分析,确定进展为肝癌的危险因素。结果两组抗病毒治疗前血清AST水平、抗病毒治疗前血清白蛋白水平、肝癌家族史、核苷(酸)类似物耐药构成比比较P均<0.05,两组年龄及性别男、抗病毒治疗前HBeAg阳性、病毒学应答构成比、抗病毒治疗前血清HBV DNA的log10、抗病毒治疗前血小板计数比较P均>0.05。上述4项有意义的指标纳入多因素COX回归分析结果显示,抗病毒治疗前血清AST水平的HR为12.05,95%CI为2.65~55.56,P=0.001;抗病毒治疗前血清白蛋白水平的HR为1.10,95%CI为0.95~1.27,P=0.201;肝癌家族史的HR为3.51,95%CI为0.80~15.41,P=0.096;核苷(酸)类似物耐药的HR为5.71,95%CI为1.31~24.83,P=0.020。结论抗病毒治疗前血清AST水平升高和核苷(酸)类似物耐药是接受抗病毒治疗的代偿期乙肝肝硬化患者进展为肝癌的危险因素。
乙型病毒性肝炎;肝硬化;肝细胞癌;天门冬氨酸氨基转移酶;核苷(酸)类似物耐药
在近30年里,抗病毒药物尤其是核苷(酸)类似物已被广泛应用于临床,并在长期抑制HBV复制、延缓和减少乙肝相关事件的发生、发展方面具有显著效果[1~3]。临床研究表明,即便慢性乙型病毒性肝炎(乙型肝炎)患者病情已进展至肝硬化阶段,抗病毒治疗仍可显著减少肝细胞癌(肝癌)的发生[4]。但抗病毒治疗并不能完全阻断慢性乙型肝炎向肝癌进展[4~6]。本研究分析接受抗病毒治疗的代偿期乙肝肝硬化患者进展为肝癌的危险因素。
1 临床资料
1.1 基本资料 选择2008年10月~2015年10月就诊于山东大学第二医院的乙肝肝硬化代偿期患者95例,男59例、女36例,年龄(47.8±10.9)岁。纳入标准:①连续应用核苷(酸)类似物(包括拉米夫定、阿德福韦、替比夫定、恩替卡韦及替诺福韦)抗病毒至少12个月。②临床资料齐全。③肝硬化代偿期定义为组织病理学证实肝硬化的存在(METAVIR F4)或肝脏影像学(超声/CT/MRI)检查发现存在肝硬化的相关证据(脾脏直径>12 cm,门静脉直径>16 mm),且不存在大量腹水、食管或胃底静脉曲张破裂出血和(或)肝性脑病等并发症。排除标准:①同时合并丙型病毒性肝炎、丁型病毒性肝炎、人类免疫缺陷等。②同时合并自身免疫性肝炎及药物性肝炎。③抗病毒治疗前或治疗开始12个月内发生肝癌。患者每3~6个月进行一次门诊随访,随访13~96个月,16例进展为肝癌(肝癌组),79例未进展为肝癌(非肝癌组)。
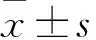
以进展为肝癌为因变量,以抗病毒治疗前血清AST水平、抗病毒治疗前血清白蛋白水平和肝癌家族史、核苷(酸)类似物耐药情况为自变量,采用SPSS17.0统计软件进行多因素COX回归分析。计量资料以实际数值进行COX回归,其他资料赋值:肝癌家族史有为1无为0,核苷(酸)类似物耐药有为1无为0。多因素分析结果见表1。
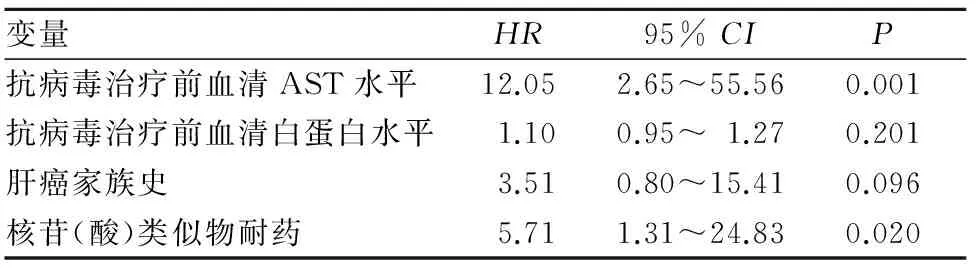
表1 接受抗病毒治疗的代偿期乙肝肝硬化患者进展为肝癌的多因素分析结果
2 讨论
本研究回顾了95例接受抗病毒治疗的代偿期乙肝肝硬化患者的临床资料,发现在长期抗病毒治疗过程中,即使患者获得病毒学应答,仍有可能进展为肝癌。本组接受抗病毒治疗的代偿期乙肝肝硬化患者进展为肝癌的5年累积发生率为23.9%,与Papatheodoridis等[7]的研究结果一致,但高于来自欧洲的几项研究[8,9]。首先,这可能与大多数患者的基因型为C型有关,与其他基因型相比,基因型为C型者更容易发生肝癌[5]。其次,部分患者存在核苷(酸)类似物耐药,而本研究结果证实核苷(酸)类似物抗病毒治疗耐药是接受抗病毒治疗的代偿期乙肝肝硬化患者进展为肝癌的独立危险因素。再次,纳入研究的大多数患者通过肝脏影像学被诊断为肝硬化,敏感性相对较低,也可能与纳入本研究的患者多为晚期肝硬化患者有关。肝癌的高发病率提示肝硬化患者的不良预后,因此即使其通过抗病毒治疗获得了病毒学应答,仍需定期进行随访。
本研究多因素分析结果显示,抗病毒治疗前血清AST水平的HR为12.05,95%CI为2.65~55.56,P=0.001;抗病毒治疗前血清白蛋白水平的HR为1.10,95%CI为0.95~1.27,P=0.201;肝癌家族史的HR为3.51,95%CI为0.80~15.41,P=0.096;核苷(酸)类似物耐药的HR为5.71,95%CI为1.31~24.83,P=0.020。说明抗病毒治疗前血清AST水平高和核苷(酸)类似物耐药是进展为肝癌的独立危险因素。AST存在于肝细胞线粒体中,正常人血清AST水平极低。乙肝患者血清AST升高说明肝功能受损,是乙肝患者需进行治疗的标志[10,11]。乙肝患者血清AST升高的程度与肝细胞受损和炎症反应程度一致[12]。本研究结果显示,抗病毒治疗前血清AST水平升高是肝癌发生的一个重要的独立危险因素,表明炎症在肝硬化患者进展为肝癌的过程中发挥了重要作用。但是肝细胞损伤及肝脏炎症反应在代偿期乙肝肝硬化患者进展为肝癌中发挥作用的具体机制还需要进一步研究。
代偿期乙肝肝硬化患者在接受抗病毒治疗后仍然有可能进展为肝癌,说明乙肝病毒感染并不是乙肝肝硬化患者进展为肝癌的惟一因素。但抗病毒治疗核苷(酸)类似物耐药是接受抗病毒治疗的代偿期乙肝肝硬化患者进展为肝癌的危险因素,反证了乙肝病毒感染是代偿期乙肝肝硬化患者进展为肝癌的重要原因,进一步强调对代偿期乙肝肝硬化患者进行抗病毒治疗的重要意义。
[1] Lee WM. Hepatitis B virus infection[J]. N Engl J Med, 1997,337(45):1733-1745.
[2] Lok ASF, McMahon BJ. Chronic hepatitis B: update 2009[J]. Hepatology, 2009,50(4):661-662.
[3] Singal AK, Salameh H, Kuo YF, et al. Meta-analysis: the impact of oral anti-viral agents on the incidence of hepatocellular carcinoma in chronic hepatitis B[J]. Aliment Pharmacol Ther, 2013,38(2):98-106.
[4] HB ES. Hepatocellular carcinoma[J]. N Engl J Med, 2011,365(7):1118-1127.
[5] Papatheodoridis GV, Lampertico P, Manolakopoulos S, et al. Incidence of hepatocellular carcinoma in chronic hepatitis B patients receiving nucleos(t)ide therapy: a systematic review[J]. J Hepatol, 2010,53(2):348-356.
[6] Kim SS, Hwang JC, Lim SG, et al. Effect of virological response to entecavir on the development of hepatocellular carcinoma in hepatitis B viral cirrhotic patients: comparison between compensated and decompensated cirrhosis[J]. Am J Gastroenterol, 2014,109(8):1223-1233.
[7] Papatheodoridis GV, Dalekos GN, Yurdaydin C, et al. Incidence and predictors of hepatocellular carcinoma in Caucasian chronic hepatitis B patients receiving entecavir or tenofovir[J]. J Hepatol, 2015,62(2):363-370.
[8] Zoutendijk R, Reijnders JGP, Zoulim F, et al. Virological response to entecavir is associated with a better clinical outcome in chronic hepatitis B patients with cirrhosis[J]. Gut, 2013,62(5):760-765.
[9] Gordon SC, Lamerato LE, Rupp LB, et al. Antiviral therapy for chronic hepatitis B virus infection and development of hepatocellular carcinoma in a US population[J]. Clin Gastroenterol Hepatol, 2014,12(5):885-893.
[10] Arends P, Sonneveld MJ, Zoutendijk R, et al. Entecavir treatment does not eliminate the risk of hepatocellular carcinoma in chronic hepatitis B: limited role for risk scores in Caucasians[J]. Gut, 2015,64(8):1289-1295.
[11] Papatheodoridis GV, Manolakopoulos S, Touloumi G, et al. Virological suppression does not prevent the development of hepatocellular carcinoma in HBeAg-negative chronic hepatitis B patients with cirrhosis receiving oral antiviral(s) starting with lamivudine monotherapy: results of the nationwide HEPNET. Greece cohort study[J]. Gut, 2011,60(8):1109-1116.
[12] Lim YS, Han S, Heo NY, et al. Mortality, liver transplantation, and hepatocellular carcinoma among patients with chronic hepatitis B treated with entecavir vs lamivudine[J]. Gastroenterology, 2014,147(1):152-161.
山东省科技发展计划项目(2016031710)。
杨保华(E-mail: bhy_sdey@163.com)
10.3969/j.issn.1002-266X.2017.32.026
R575.1
B
1002-266X(2017)32-0081-03
2017-04-13)

