3,3′-(苯亚甲基)双吲哚的合成及其抗真菌活性
王雪莉,刘飞,王奇志,徐曙,罗金岳*
(1.南京林业大学化学工程学院,南京 210037; 2.江苏省中国科学院植物研究所,南京 210014)
3,3′-(苯亚甲基)双吲哚的合成及其抗真菌活性
王雪莉1,刘飞2,王奇志2,徐曙2,罗金岳1*
(1.南京林业大学化学工程学院,南京 210037; 2.江苏省中国科学院植物研究所,南京 210014)
为研究双吲哚甲烷类化合物的高效合成方法及生物活性,以吲哚和苯甲醛为原料,以NiCl2为催化剂,合成了化合物3,3′-(苯亚甲基)双吲哚,分析了溶剂种类、原料配比、反应温度、反应时间、催化剂用量等对产物收率的影响,并确定了适宜的合成条件。结果表明,3,3′-(苯亚甲基)双吲哚合成的适宜条件为以乙醇为溶剂,n(吲哚)∶n(苯甲醛)= 2∶1.1,催化剂用量是苯甲醛物质的量的5%,40℃下反应5h,产物收率达到82.6%。采用红外、高分辨率质谱和NMR等分析手段对产物结构进行了表征,分析了化合物对两种植物病原菌的抗真菌活性,发现3,3′-(苯亚甲基)双吲哚(10 μg/mL)对油菜菌核病菌(Sclerotiniasclerotiorum(Lib.) de Bary)和黄瓜灰霉病菌(BotrytiscinereaPers.ex Fr.)具有明显抑制作用,其抑制率分别为61.1%和60.8%。研究的双吲哚甲烷类化合物合成方法反应条件温和,后处理环保,对新型抗植物病原真菌药研究和开发具有借鉴意义。
双吲哚甲烷;氯化镍;催化;抗真菌活性
双吲哚类生物碱在自然界中广泛存在,主要为陆生和海洋生物的代谢产物,是一类具有重要生物活性的化合物[1]。双吲哚甲烷是双吲哚类生物碱中的一种重要物质,1977年,Porter等[2]首次从真菌中发现双吲哚甲烷类生物碱,随之,双吲哚类生物碱的生物活性和药理活性逐渐被人们发现。研究表明,双吲哚甲烷类化合物具有显著的抗肿瘤活性[3],例如,3,3′-双吲哚甲烷对多种肿瘤细胞具有明显的体外抑制活性,可抑制多种肿瘤细胞生长,并能够诱导细胞死亡及抑制血管新生等。也有研究表明,双吲哚甲烷类生物碱Vibrindole A,具有良好的抗菌活性[4]。由于双吲哚甲烷及其衍生物的突出生物活性和独特的骨架结构,该类化合物受到较多关注。
1963年,Kama等[5]首次使用吲哚和醛类化合物合成了双吲哚类生物碱。近年来,双吲哚甲烷及其衍生物的合成方法相关报道较多,研究人员致力于寻找产率高、反应条件温和、操作简便的合成方法。目前较具代表性的合成路线为醛/酮与吲哚、醚与吲哚、胺与吲哚,其中,以醛/酮与吲哚为底物的合成方法最具代表性,以醛/酮与吲哚为底物合成双吲哚甲烷常用的催化剂有:质子酸(H3PW12O40)[6-7]、路易斯酸(ZrCl4[8]、LiClO4[9]、ZnCl2[10]等)、固体酸(蒙脱石K10[11]、蒙脱石K10-ZnCl2[12]、蒙脱石K10-BiCl3[13]、HY沸石[14])、离子液体[15]、金属配合物[16]等。这些合成方法存在溶剂有毒、催化剂昂贵、反应条件苛刻、时间长等不足,因此,近年来绿色的催化剂、温和的反应条件、后处理简单及环保的合成路线成为双吲哚甲烷研究的热点。对于路易斯酸催化体系,由于吲哚中N原子的配位作用,存在催化剂容易失活、催化剂用量较多等问题,同时,反应后处理复杂、副反应产物难以除去也是目前需解决的问题。笔者在前期研究吲哚、硝基甲烷及醛的不对称傅克-亨利反应(F-C-H反应)中发现,在包括氯化镍在内的镍盐催化下,以异丙醇为溶剂,体系中会发生吲哚与醛的反应,生成双吲哚甲烷产物,通过简单后处理即可获得产物。因此,本研究拟以价格低廉的NiCl2为催化剂,研究双吲哚甲烷代表性化合物3,3′-(苯亚甲基)双吲哚的合成方法。在此基础上,鉴于研究发现双吲哚甲烷化合物具有抗菌活性,分析了3,3′-(苯亚甲基)双吲哚对植物病原菌——油菜菌核病菌(Sclerotiniasclerotiorum(Lib.) de Bary)及黄瓜灰霉病菌(BotrytiscinereaPers.ex Fr.)的抗真菌活性,为其进一步开发利用提供借鉴。
1 材料与方法
1.1 实验仪器与试剂
马弗炉(沈阳市节能电炉厂,8-10),红外光谱仪(美国热电公司,FTIR 380),液质联用仪(美国安捷伦公司,1260 UPLC-DAD-6530 ESI-QTOF MS),核磁共振波谱仪(德国Brucker公司,300 MHz)。所用溶剂均为分析纯,吲哚纯度(质量分数)99%,苯甲醛为分析纯(使用前重蒸),NiCl2·6H2O纯度(质量分数)98%。
1.2 NiCl2催化剂的制备
取坩埚盛取适量的蓝色NiCl2·6H2O结晶,放入马弗炉中,200℃加热1h,得到土黄色块状NiCl2,置于干燥器中,自然冷却至室温,简单研磨备用。
1.3 3,3′-(苯亚甲基)双吲哚的合成
以吲哚和苯甲醛为原料合成3,3′-(苯亚甲基)双吲哚。将一定量吲哚、苯甲醛(1 mmol)加入10 mL具塞试管中,以 1 mL溶剂溶解,加入制备好的催化剂NiCl2,一定温度下反应,其反应方程式如图1所示。薄层色谱(TLC)监测反应。反应结束后,旋转蒸发除去反应溶剂,柱层析分离,洗脱剂为石油醚(PE)和乙酸乙酯(AcOEt),体积比为8∶1~6∶1,经真空干燥得到产物3,3′-(苯亚甲基)双吲哚。产物收率根据以下公式计算:
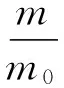
式中:m为产物3,3′-(苯亚甲基)双吲哚的质量,g;m0为理论产量(以吲哚为基准计算,吲哚的量为2mmol时,理论产物质量为0.322 g(1 mmol)。),g。
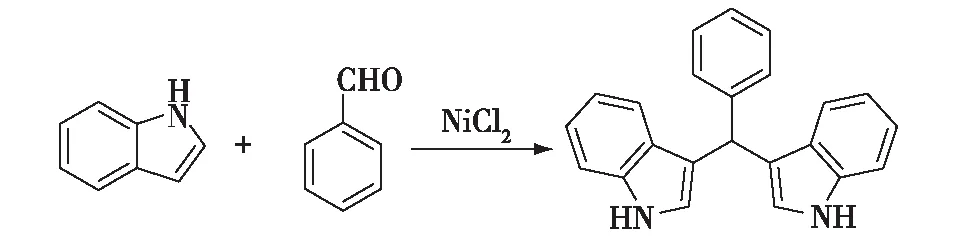
图1 3,3′-(苯亚甲基)双吲哚的合成反应式Fig.1 Synthesis of 3,3′-(phenylmethylene)bis(1H-indole)
1.4 3,3′-(苯亚甲基)双吲哚的分析
对经柱层析纯化得到的产物3,3′-(苯亚甲基)双吲哚进行分析及结构鉴定。使用液质联用仪(二极管阵列检测器DAD190~400 nm;色谱柱:Zorbax SB-C18柱,4.6 mm×100mm,1.8μm;0.1%甲酸 H2O为流动相A,CH3OH为流动相B;洗脱条件0~15 min,流动相B由70%增加至100%,15~30 min,流动相B100%,流速0.3mL/min,柱温35℃;色谱柱流出组分进入电喷雾质谱仪的流速为10μL/min;正离子质谱(ESI+/MS)条件:毛细管电压4.0kV,干燥气温度350℃,雾化器压力3.52 kg/cm2),IR(溴化钾压片),核磁共振氢谱及碳谱(氘代氯仿为溶剂,四甲基硅烷TMS做内标)分析其结构。
1.5 抗植物病原菌活性试验
称取一定量的供试样品3,3′-(苯亚甲基)双吲哚,使用二甲基亚砜(DMSO)溶解,加入灭菌后的马铃薯葡萄糖琼脂培养基(PDA)(DMSO终质量分数为0.1%),混合摇匀,最后加到无菌培养皿中,制成PDA含药平板为10μg/mL(样品终质量浓度),用只含 DMSO的PDA平板作为溶剂对照,不含溶剂和样品的PDA平板作为空白对照。使用内径为5mm的打孔器从已活化的菌落边缘取菌碟,放至PDA平板上,25℃恒温培养箱中培养。当空白对照组菌落长满时,采用十字交叉法测量菌落生长直径(cm),记录并计算抑制率。其中抑制率的计算方法为:
菌落直径=菌落生长直径平均值-0.5(菌碟直径);
菌丝生长抑制率=(对照菌落生长直径-处理菌落生长直径)/对照菌落生长直径×100%。
2 结果与分析
2.1 3,3′-(苯亚甲基)双吲哚的合成方法
2.1.1 不同溶剂对产物收率的影响
不同溶剂对产物收率的影响如表1所示。试验条件为:吲哚、苯甲醛及催化剂NiCl2的物质的量之比为2.0∶1.0∶1.0,反应温度60℃,反应时间5 h。所用溶剂为异丙醇、乙醇、乙腈、乙酸、氯仿、甲苯和四氢呋喃。由表1结果可知,溶剂对产物收率具有一定影响。其中,以乙腈及乙酸为溶剂时产物收率较低,且TLC检测发现副产物也较多;以异丙醇及四氢呋喃为溶剂时,产物收率略有升高;当以氯仿和甲苯为溶剂时,产物收率均为71.4%; 以乙醇为溶剂的产物收率最高,为72.6%,同时,副产物也较少。因此根据试验结果,最适反应溶剂为乙醇。
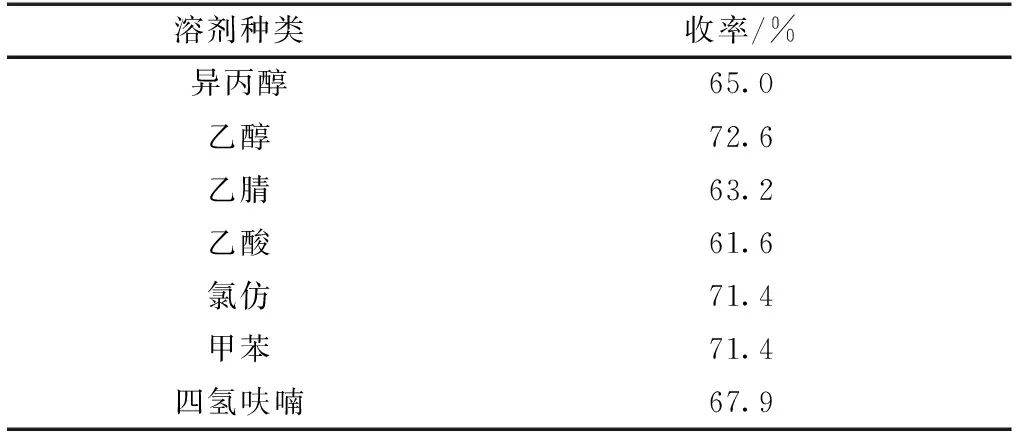
表1 溶剂种类对产物收率的影响Table 1 Effect of solvent type on yield
2.1.2 反应温度对产物收率的影响
反应温度对产物收率的影响结果如图2所示。反应条件为:以乙醇为溶剂,吲哚、苯甲醛及催化剂NiCl2的物质的量之比为2.0∶1.0∶1.0,反应时间5 h。从图2结果可知,随温度升高,产物收率逐渐升高,然后趋于平稳,产物收率为47.1%~75.8%。反应温度为40℃时,产物收率较高,为74.7%。温度继续升高后,产物收率变化不大,但副反应增加,副产物种类增多,给分离带来较大不便。综合试验结果,适宜反应温度为40℃。
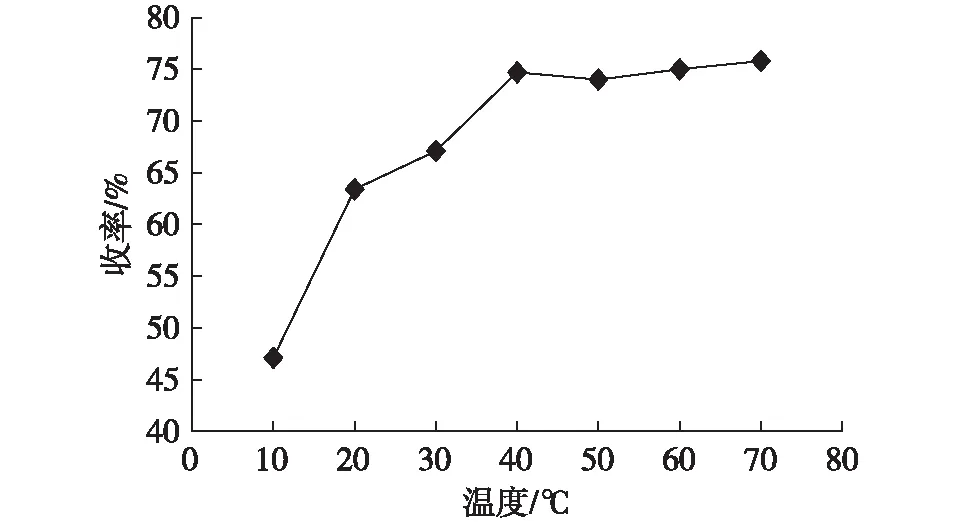
图2 反应温度对产物收率的影响Fig.2 Effect of reaction temperature on yield
2.1.3 反应时间对产物收率的影响
对于吲哚与醛/酮的反应,反应时间对产物收率具有重要影响。在已获得反应的适宜溶剂和温度基础上,进一步研究反应时间对产物收率的影响,进行6个反应,每个反应的时间分别为1,3,4,5,6和8 h,反应结果如表2所示。反应进行1h时,产物收率为53.7%;随反应时间的延长,在1~5h内,产物收率逐渐增加,在5 h时,产物收率达到74.7%;进一步延长反应时间,产物收率略有降低,反应8 h时,产物收率为72.1%。TLC检测结果显示,反应进行5 h时,反应体系中苯甲醛已较少,而吲哚尚有剩余;反应8 h时,未检测到苯甲醛,吲哚仍有剩余。因此,继续延长反应时间,产物收率并不会继续提高,这是因为底物之一苯甲醛已经发生了副反应,进一步延长反应时间,不仅不能提高收率,还增加了后处理的分离难度。综合试验结果,较为合适的反应时间为5h。
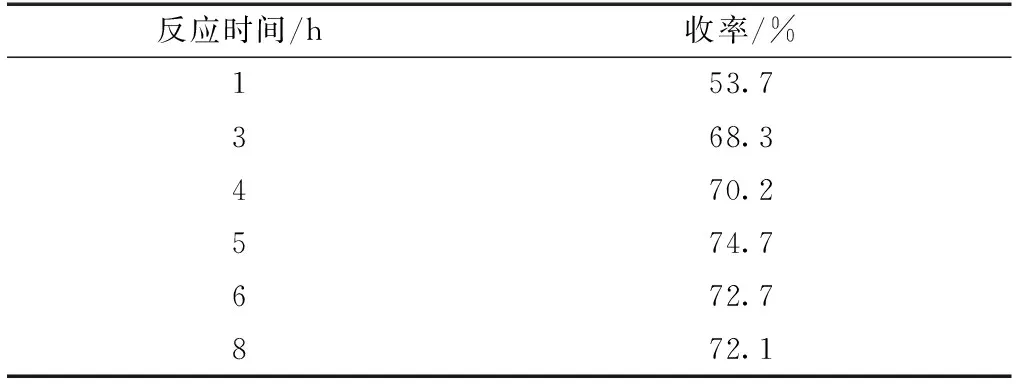
表2 反应时间对产物收率的影响Table 2 Effect of reaction time on yield
2.1.4 反应物料比对产物收率的影响
前述研究反应时间对产物收率的影响时,发现当反应底物吲哚与苯甲醛的物质的量之比为2∶1时,反应8 h后TLC检测结果显示吲哚仍有剩余,但未检测到苯甲醛。因此,通过增加苯甲醛的量,可能提高吲哚转化率,研究原料物料比n(吲哚)∶n(苯甲醛)分别为2∶1.0,2∶1.1,2∶1.2,2∶1.3和2∶1.5条件下的产物收率,结果见表3。当苯甲醛的量增加10%时,产物收率明显提高,收率达到80.0%,TLC检测可见吲哚有剩余。随苯甲醛用量升高,产物收率略有降低,TLC检测结果显示,提高苯甲醛用量,不能有效改变参与反应的吲哚量。在物料比n(吲哚)∶n(苯甲醛)为2∶1.1时,产物收率最高,因此,适宜的反应物料比为n(吲哚)∶n(苯甲醛)=2∶1.1。

表3 原料物料比对产物收率的影响Table 3 Effect of ratio of indole to benzaldehyde on yield
2.1.5 催化剂NiCl2用量对产物收率的影响
选取催化剂NiCl2用量分别为苯甲醛用量(物质的量)的2%,5%,10%,50%和100%,反应结果如图3所示。降低催化剂NiCl2的量,产物收率变化不大,当催化剂量降至5%时,产物收率为82.1%,进一步降低催化剂量至2%时,产物收率明显降低为79.8%。试验结果显示,当催化剂量降到1%时,仅可观察到少量产物生成。因此,较为合适的催化剂量为苯甲醛用量的5%。
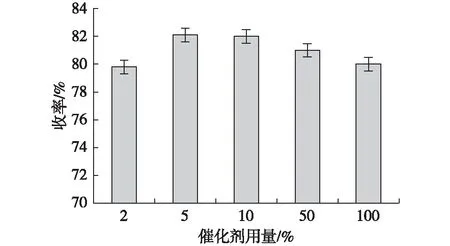
图3 催化剂用量对产物收率的影响Fig.3 Effect of amount of catalyst on yield
2.1.6 适宜合成条件
综合各单因素试验结果,合成3,3′-(苯亚甲基)双吲哚的适宜条件:乙醇为溶剂,反应温度为40℃,吲哚与苯甲醛物质的量之比为n(吲哚)∶n(苯甲醛)=2∶1.1,催化剂NiCl2用量为苯甲醛用量的5%,反应时间为5 h。在此条件下,重复反应3次,产物收率分别为82.3%,83.1%和82.5%,反应稳定性较好,产物平均收率为82.6%。
2.2 化合物结构确证
合成所得产物3,3′-(苯亚甲基)双吲哚为红褐色固体,质谱图见图4,红外图见图5,核磁共振氢谱(1H NMR)图及核磁共振碳谱(13C NMR)图分别见图6和图7。确证产物为目标产物。结构解析如下:
高分辨率质谱(HRMS):C23H17N2[M-H]+理论值:321.138 6,实际值:321.139 2;FT-IR:3 393(νNH),3 051(υNH,PhCH),1 597(δNH),1 491(υC=C),1 455(δCH,CH),747(δCH,ArH);1H NMR(300 MHz,DMSO-d6),δ=5.83(s,1H,ArCH),6.85~6.82(m,4H,ArH),7.03(s,2H,NHCH),7.16~7.18(m,3H,ArH),7.26~7.35(m,8H,ArH),10.80(s,2H,NH);13C NMR (75MHz,DMSO-d6),δ=39.6(C8和C8′),111.3(C7和C7′),118.0(C3和C3′),118.1(C4和C4′),119.0(C5和C5′),120.7(C6和C6′),123.4(C2和C2′),125.6(C12),126.5(C3a和C3a′),127.9(C10和C14′),136.5(C1a和C1a′),144.9(C9)。

图4 3,3′-(苯亚甲基)双吲哚质谱图Fig.4 High resolution mass sepcturm (HRMS) of 3,3′-(phenylmethylene)bis(1H-indole)
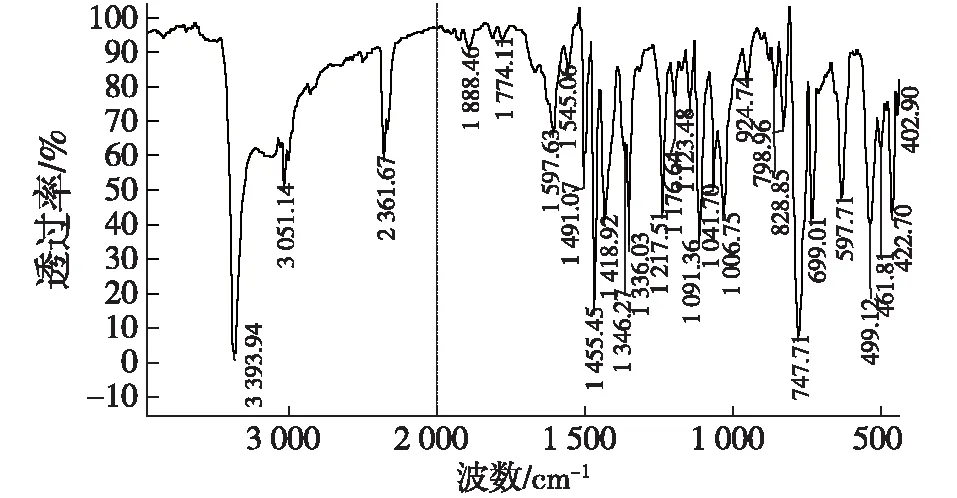
图5 3,3′-(苯亚甲基)双吲哚红外谱图Fig.5 Infrared spectrogram (FT-IR) of 3,3′- (phenylmethylene)bis(1H-indole)
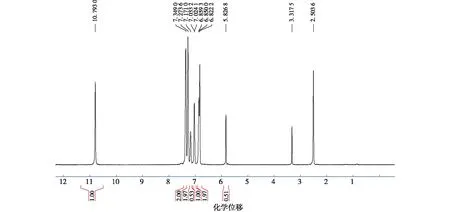
图6 3,3′-(苯亚甲基)双吲哚氢谱图Fig.6 The 1H NMR of 3,3′-(phenylmethylene)bis(1H-indole)
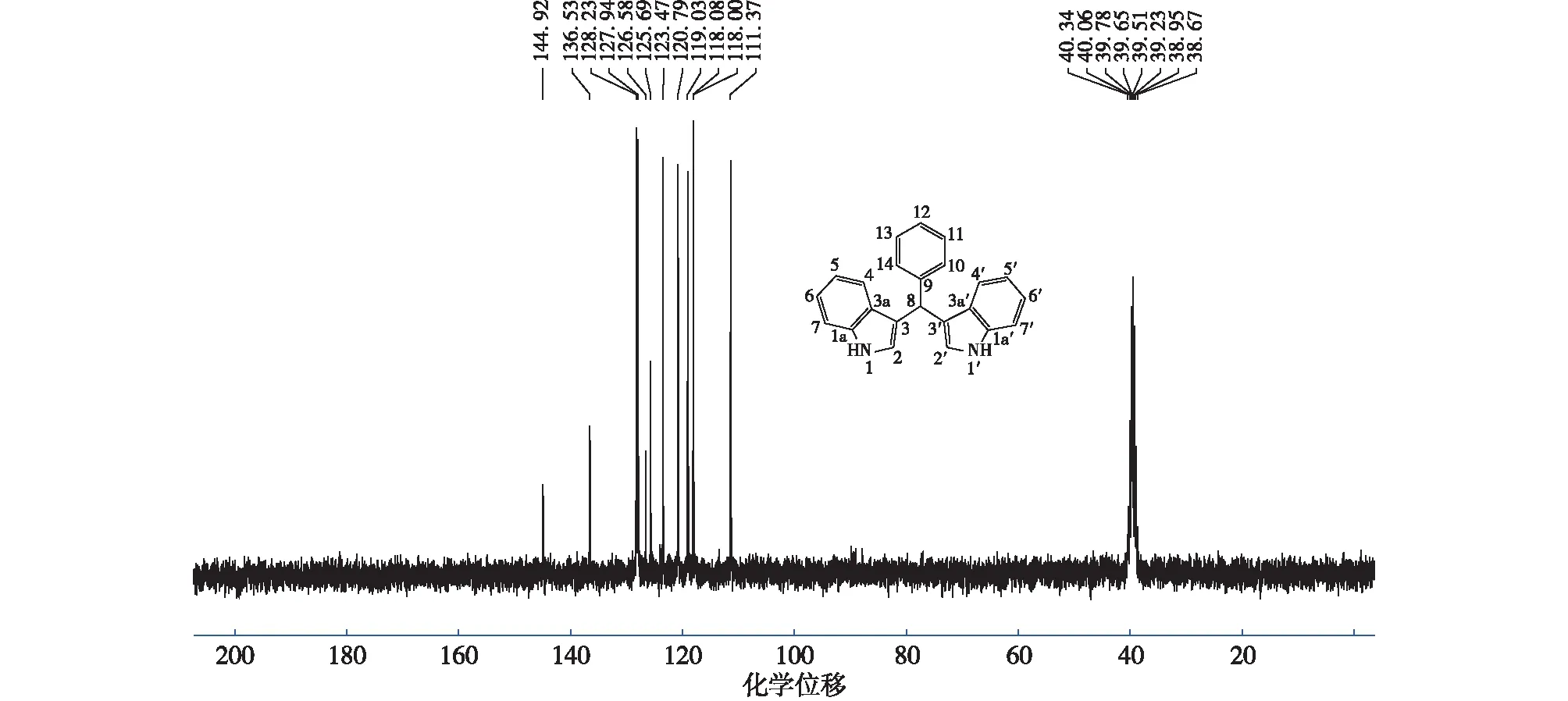
图7 3,3′-(苯亚甲基)双吲哚碳谱图Fig.7 The 13C NMR of 3,3′-(phenylmethylene)bis(1H-indole)
2.3 抗植物病原菌活性
本文测定了3,3′-(苯亚甲基)双吲哚的抗植物病原菌活性,植物病原菌为油菜菌核病菌和黄瓜灰霉病菌。试验条件下,对于油菜菌核病菌,对照菌落生长直径为7.2 cm,处理菌落生长直径为2.8 cm,3,3′-(苯亚甲基)双吲哚对油菜菌核病菌的抑制率为61.1%(图8a);对于黄瓜灰霉病菌,对照菌落生长直径为7.4 cm,处理菌落生长直径为2.9 cm,3,3′-(苯亚甲基)双吲哚对黄瓜灰霉病菌的抑制率为60.8%(图8b)。测试结果显示,3,3′-(苯亚甲基)双吲哚对植物病原菌具有较突出的抑制活性。
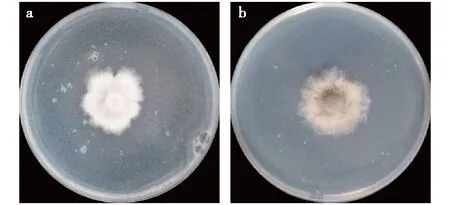
图8 3,3′-(苯亚甲基)双吲哚的抗植物病原菌活性Fig.8 Anti-phytopathogenic activity of 3,3′- (phenylmethylene)bis(1H-indole)
3 结 论
本研究得到以廉价镍盐为催化剂,反应条件温和,后处理环保的双吲哚甲烷类化合物3,3′-(苯亚甲基)双吲哚的合成方法:即以乙醇为溶剂,吲哚与苯甲醛物质的量比为2∶1.1,催化剂NiCl2用量为苯甲醛用量的5%,40℃条件下反应5 h,产物3,3′-(苯亚甲基)双吲哚收率达到82.6%。该合成方法具有催化剂制备简单、价格低廉、反应条件温和、后处理容易、产物收率较高等优点。该方法催化体系与已经报道的路易斯酸催化剂相比,反应收率相当,而反应条件更温和(反应温度为40℃),催化剂用量相对较少(5%),反应溶剂为更环保的乙醇。双吲哚甲烷类化合物对植物病原菌,如油菜菌核病菌和黄瓜灰霉病菌具有抑制作用,在质量浓度为10μg/mL条件下,对油菜菌核病菌和黄瓜灰霉病菌的抑制率分别为61.1%和60.8%。研究结果对双吲哚甲烷的利用具有一定的参考价值,可作为潜在的抗植物病原菌药物进一步开发利用。
[1]OSAWA T,NAMIKI M.Structure of streptindole,a novel genotoxic metabolite isolated from intestinal bacteria[J].Tetrahedron Letters,1983,24(43):4719-4722.
[2]PORTER J K,BACON C W,ROBBINS J D,et al.Indole alkaloids fromBalansiaepichlo⊇ (Weese)[J].Journal of Agricultural and Food Chemistry,1977,25(1):88-93.
[3]于良民,王利,李霞,等.二吲哚基甲烷及其衍生物的合成与表征[J].精细化工,2006,23(5):483-486.YU L M,WANG L,LI X,et al.Synthesis of di(1h-indol-3-yl)methane and its derivatives[J].Fine Chemicals,2006,23(5):483-486.
[4]SCOTT J L,RASTON C L.Solvent-free synthesis of 3-carboxycoumarins[J].Green Chemistry,2000,2(5):245-247.
[5]KAMA L A,QURESHI A A.Aynthesis of some substituted di-indolymehtanes in aqueous medium at room temperature[J].Tetrahedron,1963,19(4):513-520.
[6]FIROUZABADI H,IRANPOOR N,JAFARI A A.Facile preparation of symmetrical and unsymmetrical ethers from their corresponding alcohols catalyzed by aluminumdodecatangstophosphate(ALPW12O40),as a versatile and a highly water tolerant Lewis acid[J].Journal of Molecular Catalysis a—Chemical,2005,227(1/2):97-100.
[7]邢烨,解正峰,刘方明.磷钨酸催化合成双吲哚甲烷衍生物[J].应用化学,2009,26(3):352-354.XING Y,XIE Z F,LIU F M.Synthesis of bis(indolyl)methane catalyzed by phosphotungstic acid[J].Chinese Journal of Applied Chemistry,2009,26(3):352-354.
[8]KHAIRNAR B J,CHAUDHARI B R.Microwave-promoted Zirconium (IV)Chloride as an efficient,environmentally benign and recyclable homogeneous catalytic system to synthesis of bis(indolyl)methanes,in PEG as a solvent[J].Journal of Chemical and Pharmaceutical Research,2015,7(5):241-245.
[9]YADAV J S,SUBBA R V,MURT C R,et al.Lithium perchlorate cataly zed reactions of indoles:an expeditious synthesis of Bis(indolyl)methanes[J].Synthesis,2001(5):783-787.
[10]SOLIMAN H A,MUBARAK A Y,ELMORSY S S.An efficient synthesis of bis(indolyl)methanes and N,N′-alkylidenebisamides by silzic under solvent free conditions[J].Chinese Chemical Letters,2016,27(3):353-356.
[11]CHAKRABARTY M,SARKAR S.Novel clay-mediated,tandem addition-elimination-(Michael) addition reactions of indoles with 3-formylindole:an eco-friendly route to symmetrical and unsymmetrical triidolylmethanes[J].Tetrahedron Letters,2002,43(7):1351-1353.
[12]李记太,蔺志平.蒙脱土K10-ZnCl2催化下研磨法合成二吲哚甲烷衍生物[J].有机化学,2008,28(7):1238-1242.LI J T,LIN Z P.Synthesis of bis(indol-3-yl)methanes catalyzed by montmorillonite K10-ZnCl2by grinding[J].Chinese Journal of Organic Chemistry,2008,28(7):1238-1242.
[13]RAVI K,KRISHNAKUMAR B,SWAMINATHAN M.BiCl3-loaded montmorillonite K10:a new solid acid catalyst for solvent-free synthesis of bis(indolyl)methanes[J].Research on Chemical Intermediates,2015,41(8):5353-5364.
[14]KARTHIK M,MAGESH C J,MURUGESAN V,et al.Zeolite-catalyzed ecofriendly stnthesis of vibrindole A and bis(indolyl)methanes[J].Applied Catalysis A—General,2005,286(1):137-141.
[15]MAGESH C J,NAGARAJANR,KARTHIK M,et al.Synthesis and characterization of bis(indolyl)methanes,tris(indolyl)methanes and newdiindolylcarbazolylmethanes mediatedby Zeokarb-225,a novel,recyclable,eco-benign heterogenous catalyst[J].Applied Catalysis A—General,2004,266(1):1-10.
[16]BAIG N,SHELKE G M,KUMAR A,et al.Selective synthesis of bis(indolyl)methanes under solvent free condition using glucopyranosylamine derived cis-Dioxo Mo (VI) complex as an efficient catalyst[J].Catalysis Letters,2016,146(2):333-337.
Study on synthesis of3,3′-(phenylmethylene)-bis(1H-indole) and its antifungal activity
WANG Xueli1,LIU Fei2,WANG Qizhi2,XU Shu2,LUO Jinyue1*
(1.College of Chemical Engineering,Nanjing Forestry University,Nanjing 210037,China; 2.Institute of Botany,Jiangsu Province and Chinese Academy of Sciences,Nanjing 210014,China)
Bis(indolyl)methanes are a kind of alkaloids with important biological activity,and many bis(indolyl)-methanes have been isolated from a variety of terrestrial and marine natural sources.We found that 3,3′-(phenylmethylene)bis(1H-indole) can be gained in the asymmetric Friedel-Crafts Henry Reaction (F-C-H reaction) in the presence of NiCl2.Therefore,we took the use of NiCl2as a cheap catalyst for the synthesis of bis(indolyl)methanes based on indole and benzaldehyde.By using the catalyst NiCl2,the reaction was optimized in terms of the solvent,reaction temperature,reaction time,the mole ratio of indole to benzaldehyde,and the mass fraction of catalyst.The suitable conditions for the synthesis of 3,3′-(phenylmethylene)bis(1H-indole) are as follows: when indole is 2.0 mmol,n(indole):n(benzaldehyde) = 2∶1.1;the amount of catalyst (NiCl2) is 5% of the amount of benzaldehyde;reaction time is 5 h and the reaction temperature is 40℃.The reaction was repeatedly performed three times under the suitable conditions and the average yield of 3,3′-(phenylmethylene)bis(1H-indole) was 82.6% (the yields are 82.3%,83.1% and 82.5%,respectively).The catalyst (NiCl2) can be easily prepared from hydrate (NiCl2·6H2O) with low cost in the reaction system.Meanwhile,the reaction condition is mild and the post-processing is simple in this process.The structure of the 3,3′-(phenylmethylene)bis(1H-indole) purified by column chromatography (eluent:petroleum ether and ethyl acetate,from 8∶1 to 6∶1) was identified by infrared spectra,HRMS (high resolution mass spectrometer),1H NMR (proton nuclear magnetic resonance spectroscopy),and13C NMR (carbon-13 nuclear magnetic resonance),and then the antifungal activity of 3,3′-(phenylmethylene)bis(1H-indole) was studied by using the cross method.Compared with the control group,the inhibition ratio of the compound is 61.1% (Sclerotiniasclerotiorum(Lib.) de Bary) and 60.8%(BotrytiscinereaPers.ex Fr.),respectively.The study on antifungal activity of 3,3′-(phenylmethylene)bis(1H-indole) expands the application fields of bis(indolyl)methanes,and it suggests that bis(indolyl)methane would play a more important role in plant disease control.
diindolylmethane;nickel chloride;catalysis;antifungal activity
TQ 351.3
A
2096-1359(2017)05-0070-06
2016-12-27
2017-03-07
国家自然科学基金(31470425);江苏省科技计划项目(BM2015019);江苏省中国科学院植物研究所青年基金(SQ201402);江苏省2015年度普通高校研究生实践创新计划项目(SJLX15_0404)。
王雪莉,女,研究方向为有机合成化学。
罗金岳,男,教授。E-mail:luojinyue@njfu.com.cn

