壳聚糖对白芍水提液的絮凝效果及絮体的分形特性
张建伟, 王新文, 冯颖, 苏辰长
(沈阳化工大学 能源与动力工程学院, 辽宁 沈阳 110142)
壳聚糖对白芍水提液的絮凝效果及絮体的分形特性
张建伟, 王新文, 冯颖, 苏辰长
(沈阳化工大学 能源与动力工程学院, 辽宁 沈阳 110142)
分形维数是壳聚糖絮凝中药水提液絮体的重要参数,采用图像法测定絮体的分形维数,并应用Zeta电位仪测定了絮凝体系的ζ电位,对絮凝机理和絮凝效果进行了研究.选用壳聚糖作为絮凝剂,对白芍水提液进行净化除杂,通过改变絮凝剂投加量、絮凝温度、絮凝pH值等操作条件,探究这些因素对絮凝效果的影响,分析不同条件下絮体分形维数的变化规律:随着絮凝剂投加量的增加,絮体分形维数呈下降趋势;絮体分形维数随温度或pH值的升高出现先增大后降低的情况.通过正交实验确定白芍水提液的最佳工艺条件为絮凝剂投加量0.310 g·L-1,絮凝温度30 ℃,絮凝pH值3,絮凝率达到94.32%,此时的分形维数为1.430.
壳聚糖;白芍水提液;絮凝;分形;电泳;胶体
0 引 言
中药絮凝技术作为净化中药提取液的一种方法,相较于中药醇沉技术具有设备投资少、处理效果彻底、处理过程简便以及成本低廉[1]等优势,该技术在很大程度上加快了中药现代化进程.众多研究表明,采用壳聚糖絮凝中药水提液具有无毒、原料易获取、有效成分损失少等优势[1-3].影响中药絮凝过程的因素很多,如温度、投加量、pH值以及搅拌强度等;国内外在中药絮凝方面已有较多基础性研究,这些研究主要集中于混凝剂的投入以及混凝效果的输出,实验结果难于与“球形”理论的推导结果一致[4],且表征絮凝效果的指标单一,缺乏对絮体结构的研究.分形理论的引入,对絮凝机理的研究、絮凝工艺的优化、絮体形态对沉降性能的影响等具有重要的理论价值和应用前景[5].
1919年HAUSDORFF(拓扑学开创者)和BESICOVITCH研究了几何学中的“病态”结构,将维数的定义从整数维推广到分数维,但并未得到传统数学家的普遍关注.直到1975年MANDELBROT首次提出“分形”这一名词,并揭示了其与物理学的关系,方才得到科学界的公认.分形维数是对具有分型特征的对象的定量描述,是揭示复杂系统基本特征的重要参数,分形维数的准确描述对絮凝动力学过程的模拟具有重要作用[6-7],同时对絮体分型特征的研究有助于絮凝过程的优化[8-9].目前,分形理论已广泛应用于地质、材料科学、城市规划、废水处理等领域[10-12].絮凝过程中絮体的成长过程是随机、无序的,具有非线性的特点;絮凝过程是由初始粒子之间相互碰撞凝聚成小的絮团,小絮团与小絮团间碰撞形成更大的絮团,这一过程使絮体在一定范围内具有自相似性和标度不变性,这是分形的2个重要特征[13-15],因此,将分形应用于中药絮凝研究在理论上是可行的.絮体分形维数可用来评价絮体的质量以及絮凝效果[4,16],已有众多工作关注聚合氯化铝等无机絮凝剂净化污水絮体以及活性污泥絮体的分形维数在不同条件下的变化规律,但以壳聚糖为代表的天然有机高分子絮凝剂的絮体分形维数在不同条件下的变化规律尚未见报道.
应用壳聚糖对白芍水提液进行絮凝处理,通过实验考察温度、pH值、絮凝剂投加量对絮凝效果的影响,并计算其相应的分形维数,得到了以上因素与分形维数之间的规律;并通过正交实验,得到最佳的絮凝条件及在最佳条件下的分形维数.
1 实验仪器与指标测定
1.1 实验仪器
电煎密闭煎药机(YFY13B型),北京东华原医疗设备有限责任公司;数显六联电动升降搅拌器,JJ-4C型,巩义予华仪器;精密电子天平(精度0.1 mg),Sartorius BS224S型,德国;紫外/可见分光光度计(U-2800型),日本日立公司;数字照相生物显微镜(BK3300型),重庆光电;数显恒温水浴锅(HH-1型),江苏荣华仪器;微电泳仪(J94S-H型),上海中晨科技有限公司; 精密pH计(精度0.01)PHS-3C型,上海精密科学仪器.
1.2 白芍水提液的制备
制取生药浓度为0.1 g·mL-1的白芍水提液4 000 mL(2付),其制取的经验公式为[17]:
W=200+1.08×Wy+N×1.8×(1/2×Wc),
(1)
其中,W为加水量;Wy为饮片总质量;N为一次煎药的付数;Wc为每包药液量(2 000 mL)
精密称取白芍饮片200 g,加足量蒸馏水浸泡40 min,用式(1)计算,向煎药机内加入蒸馏水2 216 mL,将浸泡好的白芍饮片加入煎药机,设定温度110 ℃,煎煮60 min.
1.3 壳聚糖絮凝剂的制备
用移液管量取1 mL的冰醋酸(上海沪试,AR),加蒸馏水配置1%的乙酸溶液100 mL.精密称取1 g壳聚糖(上海伯奥生物有限公司,脱乙酰度≥90%,黏度<100 mpa·S),溶于100 mL 1%的乙酸溶液,配置质量浓度为0.01 g·mL-1的壳聚糖溶液,溶胀24 h后使用.
1.4 实验指标的测定
1.4.1 分形维数的测定及其计算
采用图像法[18]计算絮体的分形维数,将絮凝过程生成的絮体置于表面皿中,用显微镜(目镜10×,物镜4×)观察并对不同位置进行多次拍照,图1为某一位置絮体的照片.使用Image-Pro软件对采集的图像进行处理和计算,可得到絮体的周长和面积等数据.利用絮体投影面积和周长的关系,计算分形维数,数学关系式为[19]
P∝AD,
(2)
其中,P为颗粒的周长,A为面积,D为絮体的分形维数.通过测量不同的P和A的值,在双对数坐标系下作图,拟合成直线,直线的斜率即为D值,如图2所示,絮体的分形维数为1.399.
1.4.2 上清液透光值的测定
取5 mL原药液注入石英比色皿(光程1 cm)中,以蒸馏水为对照,对原药液进行全波段扫描(190~1 100 nm),测得波峰值在531 nm处.取5 mL待测样品的上清液,以蒸馏水为对照,在531 nm波长下测其透光值.
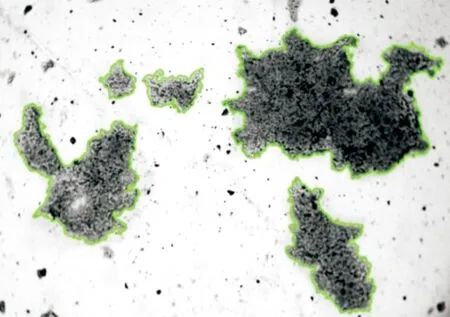
图1 絮体处理后照片(40×)Fig.1 The photo of floc after treatment
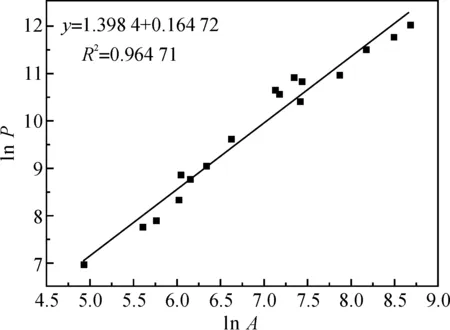
图2 絮体的分形维数Fig.2 The fractal dimension of flocs
1.4.3 絮凝率的计算
絮凝率是评价絮凝效果的重要依据,药液絮凝前后透光值的变化程度反映了絮凝效果,絮凝率(flocculation rate,FR)的计算公式为:
FR = (β-α)/α×100%,
(3)
其中,α为絮凝前药液的透光度,β为絮凝后上清液的透光度.
1.4.4 ζ电位的测定
在微电泳仪上进行ζ电位的测定.取适量待测样品上清液,注入微电泳杯并插入铂电极对,通过微电泳仪的显微摄像系统观测颗粒在电场中的运动情况,选取6组颗粒计算带电颗粒的运动距离与方向,得到其ζ电位值,测量3次后取平均值.
2 实验结果与分析
2.1 投加量对絮凝效果的影响及其分形特性
絮凝剂投加量是絮凝效果的重要影响因素.实验在原药液pH值为4.6室温下进行.分别向50 mL的白芍水提液中投入1.2,1.4,1.6,1.8,2.0,2.2,2.4 mL的壳聚糖絮凝剂进行试验.试验采用二段式搅拌方式,其中,快速搅拌(70 r·min-1)1 min,慢速搅拌(30 r·min-1)10 min,静沉40 min后测量上清液透光值、ζ电位等指标.
图3的结果表明,絮凝率随着絮凝剂投加量的增加呈现先升高后降低的趋势,在絮凝剂投加量为3.2 mL(0.385 g·L-1)时絮凝率达到最大值;在絮凝剂投加量不超过3.2 mL时,ζ电位的绝对值随着投加量的增加而减小,当投加量为3.2 mL时,ζ电位值最接近零电位(-1.1682 mV);当絮凝剂投加量超过3.2 mL时,胶体颗粒的表面电性转变为正电,继续增大投加量,ζ电位的绝对值增大.由于原药液中胶粒颗粒表面呈负电性(-5.9708 mV),投加壳聚糖絮凝剂后,氨基离子化呈正电性[20],中和了药液中胶粒表面的负电荷,压缩双电层,当絮凝剂投加量不超过3.2 mL时,随着絮凝剂投加量的增加,更多带正电的官能团参与絮凝过程,胶体颗粒表面的负电位的绝对值减小,分散体系的稳定性降低,导致药液中更多的胶体颗粒失稳,被壳聚糖絮凝剂的高分子支链桥联,宏观上表现为上清液透光值升高,絮凝率上升;当絮凝剂投加量超过3.2 mL时,带正电官能团的数目进一步增加,过多的正电荷导致胶体颗粒表面电性发生反转变为正电,胶体分散体系重新变得稳定;另一方面,颗粒表面的絮凝剂分子呈饱和状态不再有吸附空位,多余的絮凝剂有溶胶作用,使颗粒稳定分散,宏观上表现为上清液透光值降低,絮凝率下降.当絮凝剂投加量为3.2 mL时,絮凝效果最佳,絮凝率达到80.88%.
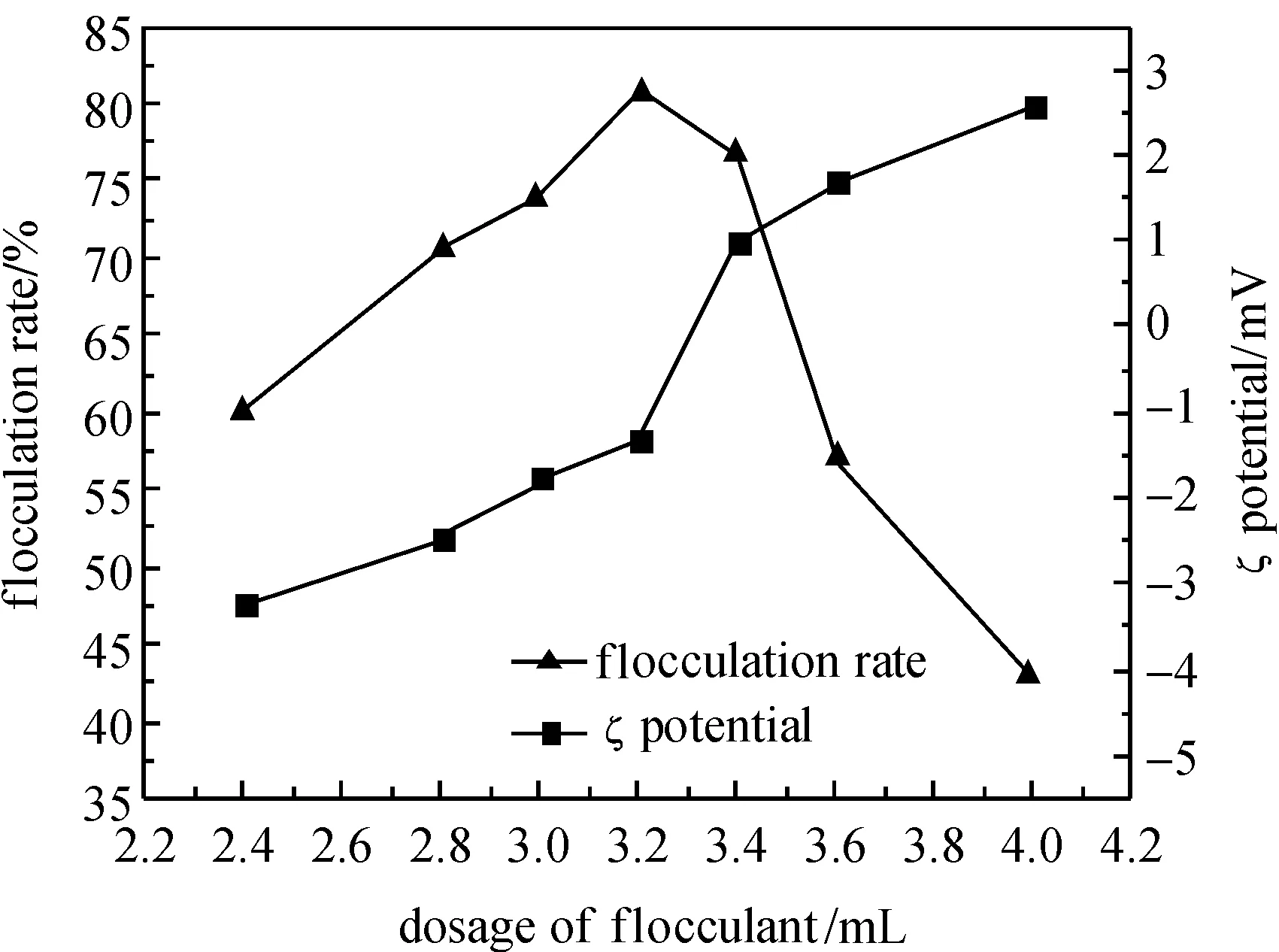
图3 絮凝剂投加量对絮凝率和ζ电位的影响Fig.3 The influence of dosage of flocculant on flocculation rate and ζ potential
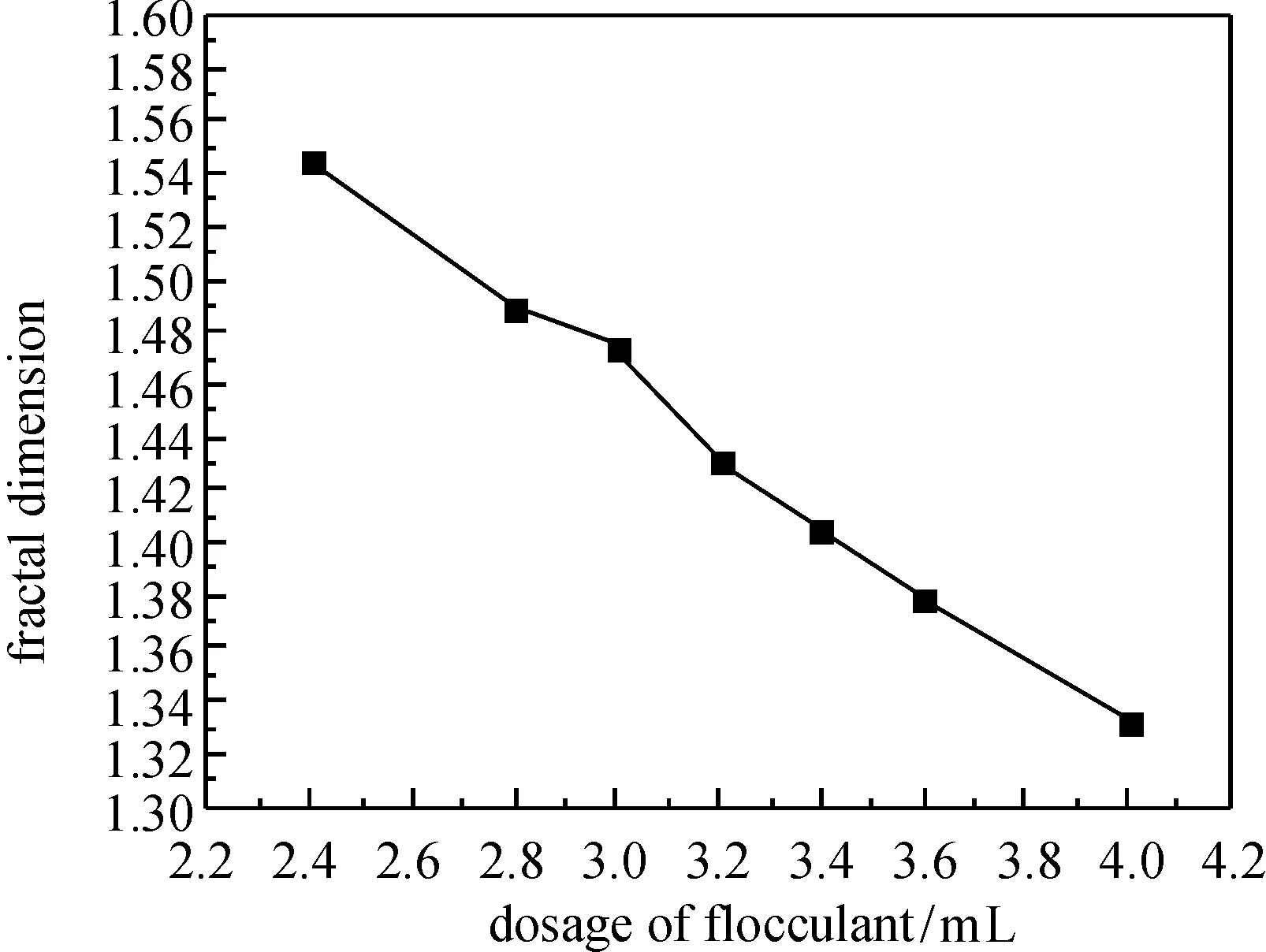
图4 絮凝剂投加量对絮体分形维数的影响Fig.4 The influence of dosage of flocculant on the fractal dimension of flocs
絮体分形维数随絮凝剂投加量增加的变化情况如图4所示.随着絮凝剂投加量的增加,分形维数整体呈下降趋势.分析原因为:壳聚糖絮凝中药水提液的絮凝过程主要依靠吸附架桥作用,随着絮凝剂投加量的增加,固定含量的悬浮液中会出现胶体颗粒被多个高分子支链桥联的情况,絮团粒径增大且絮团内聚合物增多,导致絮团平均密度变小[21],絮体的分形维数与密度呈正相关,即絮团有效密度越大,分形维数越大[22-23];另一方面,絮体粒径的增大也会导致絮体包含的初始微粒数目增多,结构松散,絮体分形维数随之减小[24-25].所测分形维数为1.332~1.545,药液絮凝效果最好时,絮体的分形维数为1.463.
2.2 温度对絮凝效果的影响及其分形特性
温度是影响絮凝效果的重要因素,属于絮凝过程的重要控制指标.实验在原药液pH值为4.6、絮凝剂投加量为3.2 mL(质量浓度为0.310 g·L-1)下进行.将原药液置于恒温水浴锅,分别在温度为20,30,40,50,60 ℃下进行实验,水力条件同2.1节,静沉40 min,取其上清液测量透光值等指标.
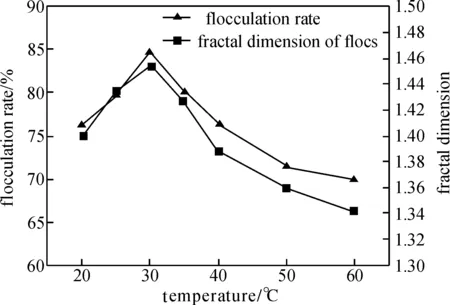
图5 温度对絮凝率和絮体分形维数的影响Fig.5 Effect of temperature on the flocculation rate and fractal dimension of flocs
如图5所示,絮凝率和絮体分形维数都随着温度的升高先升高后降低,且都在30 ℃时达到最大值.这是因为在水温较低时,一方面影响了絮凝剂在水中的水解,电离程度被削弱,导致反离子总数减少,压缩双电层的作用被削弱,絮凝效果降低;另一方面,较低的温度导致布朗运动减慢,不利于胶体颗粒间的碰撞,同时增大了药液的黏度,在絮团碰撞聚集和沉降过程中,增大了药液对絮团的剪切程度,导致絮团变松散、细小,一部分细小的絮团无法沉降,宏观上表现为分形维数的降低和絮凝率的下降.提高温度使絮凝过程中化学反应加快,布朗运动加速,则有利于絮体间的随机碰撞,促进絮体生长.但过高的温度会增强水合作用,已形成的絮体可能会再次破损或破碎,宏观上表现为絮团细小,含水量较高,计算的分形维数和絮凝率降低.图5的结果表明,在30 ℃时药液的絮凝效果最好,絮凝率为84.71%,此时其分形维数为1.455,所测分形维数为1.341~1.455.
2.3 pH值对絮凝效果的影响及其分形特性
通过向白芍水提液中加入NaOH(2 mol·L-1)或HCl(1 mol·L-1)溶液.分别调节原药液pH值至3.0,4.0,5.0,6.0,7.0,8.0(误差±0.1)进行实验,在室温下向50 mL的白芍水提液中加入3.2 mL(质量浓度0.310 g·L-1)壳聚糖絮凝剂,水力条件同2.1节,静沉40 min,取其上清液测量透光值和ζ电位值等指标.

图6 pH值对ζ电位和絮凝率的影响Fig.6 Effect of pH value on flocculation rate and ζ potential
图6和7的结果表明,ζ电位随pH值的增大在数值上呈减小的趋势,絮凝率及絮体分形维数随pH值的增大呈先升高后降低的趋势,在pH=2.0时,絮凝率与分形维数达到最大值.这是由于pH值的改变会引起胶体颗粒表面ζ电位和电荷密度的改变,同时,还会对絮凝剂的性质和作用产生较大影响.壳聚糖絮凝剂在药液中水解为带正离子的聚电解质,可以和胶体颗粒表面的负电发生电中和.pH值为2.0~3.0时,溶液中H+浓度较大,改变了胶体颗粒表面的电性,ζ电位呈正值,影响了壳聚糖絮凝剂与胶体颗粒的电中和作用,胶体颗粒与絮凝剂之间的桥联作用减弱,絮凝剂很难与胶体颗粒或微粒形成絮团,或已形成的絮团较为脆弱导致破碎.宏观上表现为絮团较为松散、分形维数较小、絮凝率较低.pH值≥3时,ζ 电位绝对值呈增加趋势.pH值继续增大,H+浓度逐渐降低,胶体颗粒表面的负电荷密度增大,削弱了壳聚糖絮凝剂与胶体颗粒的电中和作用,导致了絮凝率和分形维数的降低.
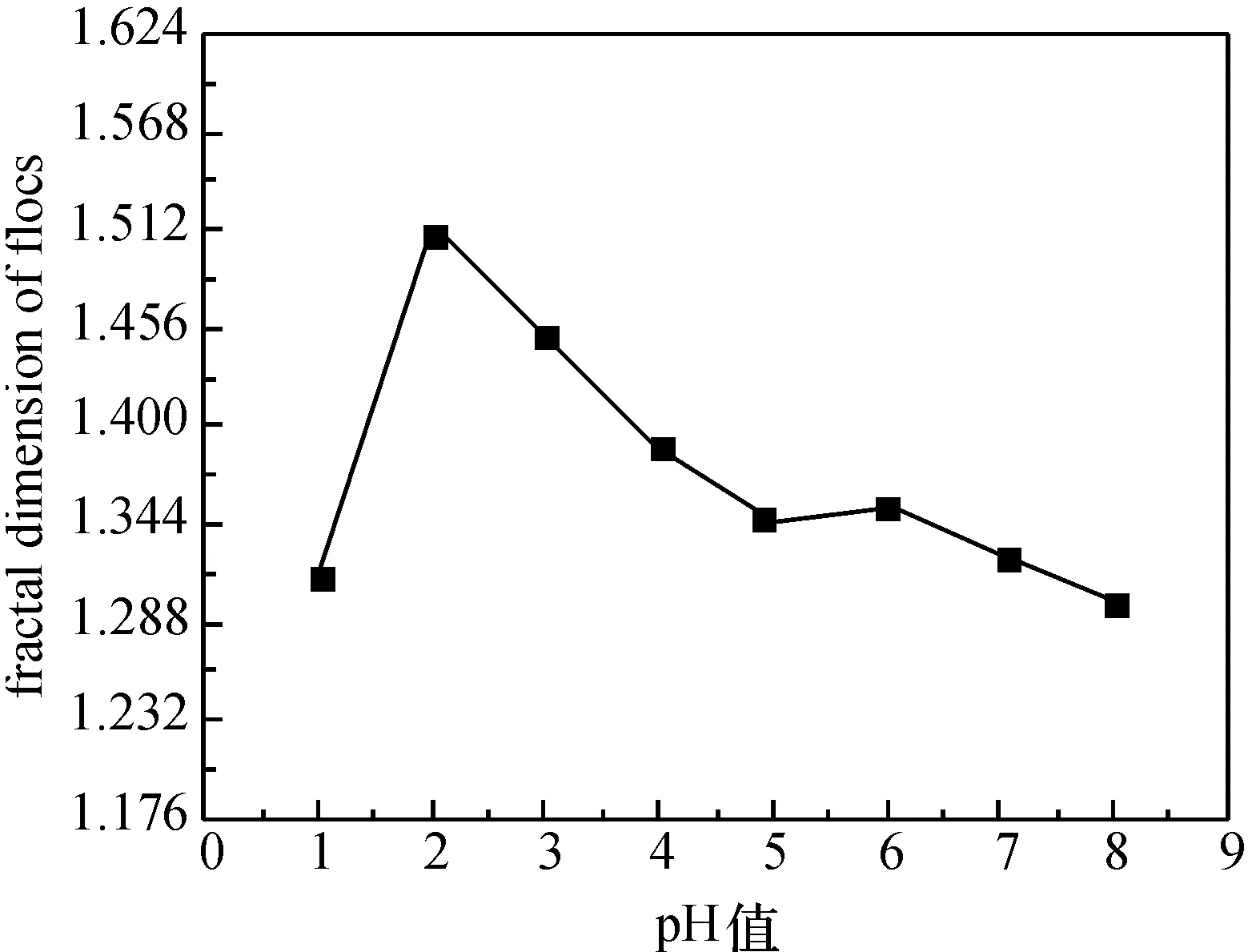
图7 pH值对絮体分形维数的影响Fig.7 Effect of pH value on fractal dimension of flocs
当pH值增大至8.0时,ζ 电位绝对值急剧增大.这是因为药液中OH-浓度逐渐高于H+浓度,胶体颗粒表面的电荷浓度继续增大,使絮凝剂与胶体颗粒的絮凝作用变得困难,分形维数和絮凝率也急剧下降,说明壳聚糖絮凝白芍水提液不宜在碱性环境中进行.
实验结果表明,在pH=2.0时,絮凝效果最为理想,絮凝率达到91.71%,此时的絮体分形维数为1.421,所测分形维数为1.301~1.515.
2.4 最佳絮凝工艺条件
为了寻找最佳絮凝条件和絮凝效果最佳时絮体的分形维数,进行了正交实验,分析实难结果,得到影响絮凝效果因素的强弱顺序以及最佳絮凝条件和此时絮体的分形维数.正交实验:选用絮凝剂投加量(A)、絮凝温度(B)、絮凝pH值(C)3个因素,每个因素下选取3个水平(单因素实验中絮凝效果最好的3个水平),选取L9(34)正交表进行实验,因素与水平表见表1.按照以下因素与水平,将壳聚糖絮凝剂投入50 mL的白芍水提液中,水力条件同2.1节,静沉40 min,取其上清液测量透光值,并对絮体拍照,计算不同条件下絮体的分形维数.正交实验结果与分析见表2.
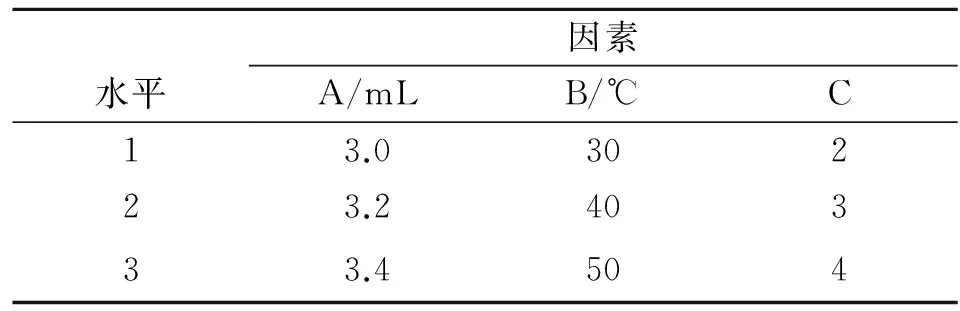
表1 正交实验因素与水平表
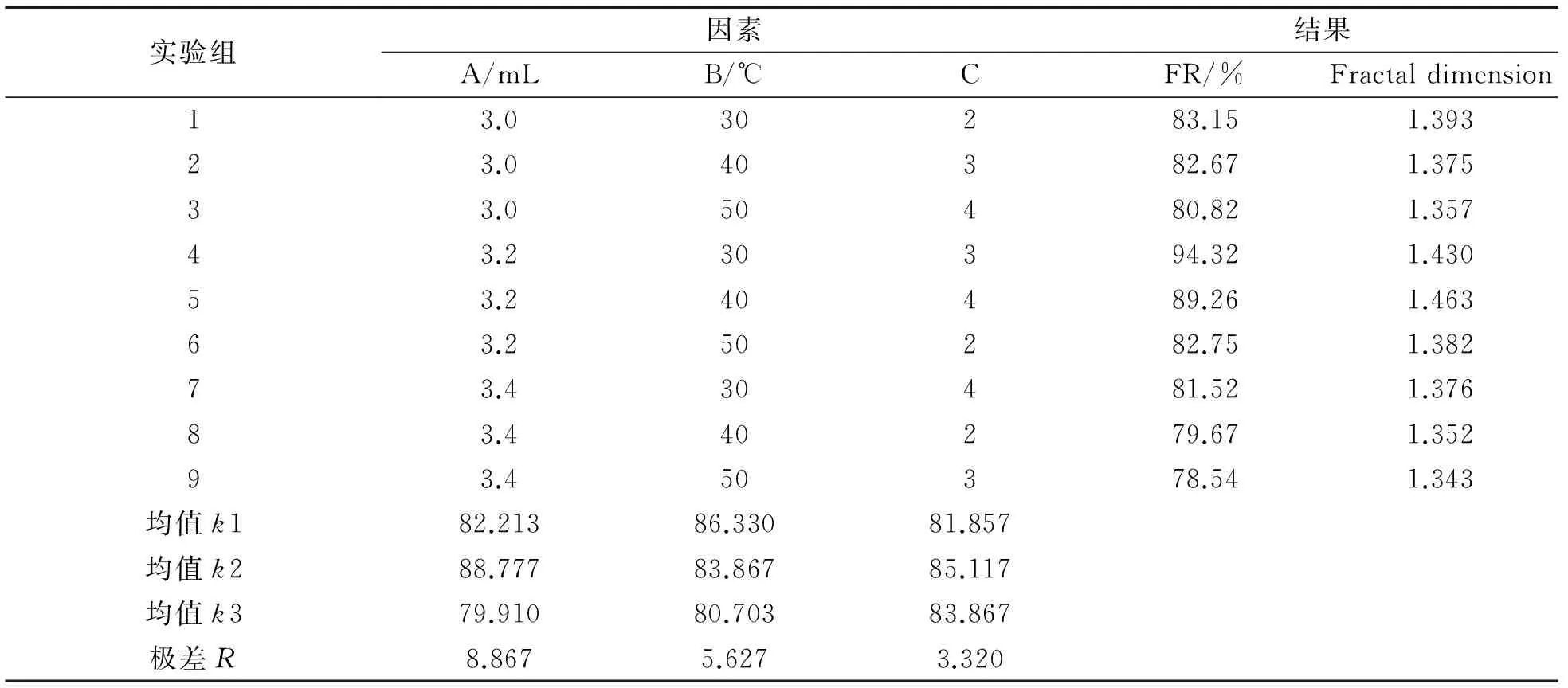
表2 正交实验结果与分析
表2的结果表明,最优水平为A2B1C2,此时絮凝率达到最高,分形维数也达到最大值.由极差分析可知,3个因素对絮凝效果的影响由强及弱为A>B>C,即絮凝剂投加量>絮凝温度>絮凝pH值.絮凝效果最佳工艺条件为絮凝剂投加量3.2 mL(0.310 g·L-1),絮凝温度30 ℃,pH=3,该环境下絮凝率为94.32%,絮体的分形维数为1.430.该组实验测得分形维数为1.341~1.430.
3 结 论
采用壳聚糖絮凝白芍水提液,通过改变絮凝剂投加量、温度、pH值等条件,探究这些因素对絮凝效果和絮体分形维数的影响,并通过正交实验确定壳聚糖絮凝白芍水提液的最佳工艺条件,得到以下结论:
3.1实验计算的壳聚糖絮凝白芍水提液絮体的分形维数为1.32~1.545.当絮凝剂投加量确定时,絮体的分形维数越大,絮凝效果越好,因此,絮体分形维数作为絮体质量的重要参数,可作为絮凝过程中的控制指标以表征絮凝效果,具有重要价值.
3.2在pH值及温度等条件相同的环境下,随着絮凝剂投加量的增加,絮凝率先升高后降低,而分形维数呈整体下降的趋势.当投加量为3.2 mL(0.385 g·L-1)时,絮凝率达到最大值80.88%,此时絮体的分形维数为1.463.
3.3在pH值相同,以最佳投加量投加絮凝剂的条件下,絮凝率及絮体的分形维数都随着温度的升高呈先升高后降低的趋势,在30 ℃时,絮凝率达到最大值为84.71%,此时絮体的分形维数为1.455.
3.4在温度、絮凝剂投加量相同的条件下,絮凝率及絮体的分形维数都随着pH值的升高呈先升高后降低的趋势,在pH=2时,絮凝率达到最大值为91.71%,此时的絮体分形维数为1.421.
3.5通过正交实验得出壳聚糖絮凝白芍水提液的最佳絮凝工艺条件为:絮凝剂投加量3.2 mL(0.310 g·L-1),絮凝温度30 ℃,pH=3;此时絮凝率为94.32%,絮体的分形维数为1.430;3个因素影响絮凝效果由强及弱依次为絮凝剂投加量>絮凝温度>絮凝pH值.
[1] 张建伟,范红伟.壳聚糖对银杏水提液的絮凝工艺研究[J].化学工程,2008,36(2):71-74. ZHANG J W,FAN H W.Study on flocculation of water-extraction solution of ginkgo leaves with chitosan[J].ChemicalEngineering,2008,36(2):71-74.
[2] 张建伟,袁园,王春雨.壳聚糖对桑白皮水提液净化除杂的研究[J].高校化学工程学报,2010,24(2):346-349. ZHANG J W,YUAN Y,WANG C Y.Purification of water-extraction solution of mulberry root bark with chitosan[J].JournalofChemicalEngineeringofChineseUniversities,2010,24(2):346-349.
[3] 张建伟,于婧超,冯颖.2种天然絮凝剂对薄荷水提液的絮凝研究和比较[J].浙江大学学报:理学版,2012,39(4):428-433. ZHANG J W,YU J C,FENG Y.Comparison and study of the flocculation effect of peppermint water-extraction solution by two natural flocculants[J].JournalofZhejiangUniversity:ScienceEdition,2012,39(4):428-433.
[4] 温海龙,董瑞斌,朱升干.分形维数作为废水絮凝处理效果的表征指标及其影响因素[J].南昌大学学报:工科版,2011,33(1):17-21. WEN H L,DONG R B,ZHU S G.Fractal dimension as a characteristic index of flocculation[J].JournalofNanchangUniversity:EngineeringTechnology,2011,33(1):17-21.
[5] 郑典模,朱升干,蒋文天,等.基于DLCA模型的絮凝过程模拟及应用[J].南昌大学学报:工科版,2011,33(2):129-133. ZHENG D M,ZHU S G,JIANG W T,et al.Simulation on flocculation process based on DLCA model and its application[J].JournalofNanchangUniversity:EngineeringTechnology,2011,33(2):129-133.
[6] MAGGI F,MIETTA F,WINTERWERP J C.Effect of variable fractal dimension on the floc size distribution of suspended cohesive sediment[J].JournalofHydrology,2007,343(1/2):43-55.
[7] MAERZ J,VERNEY R,WIRTZ K,et al.Modeling flocculation processes:Intercomparison of a size class-based model and a distribution-based model[J].ContinentalShelfResearch,2011,31(10):84-93.
[8] 李春梅,施周,梅胜,等.絮凝条件对絮体分型结构的影响[J].环境科学,2006,27(3):489-492. LI C M,SHI Z,MEI S,et al.Effects of flocculation conditions on aggregates fractal structures[J].EnvironmentalScience,2006,27(3):489-492.
[9] 钟润生,张锡辉,肖峰,等.絮体分型结构对沉淀速度影响研究[J].环境科学,2009,30(8):2353-2357. ZHONG R S,ZHANG X H,XIAO F,et al.Effects of fractal structure on settling velocities of flocs[J].EnvironmentalScience,2009,30(8):2353-2357.
[10] 韦伟,杜茂安,朱佳,等.絮凝过程中絮体生长的多重分形行为[J].环境科学学报,2014,34(4):79-84. WEI W,DU M A,ZHU J,et al.Multifractal behavior of flocs growth in flocculation processes[J].ActaScientiaeCircumstantiae,2014,34(4):79-84.
[11] 王慧,曾令可.分形理论及其在材料科学中的应用[J].材料开发与应用,2010,15(5):39-43. WANG H,ZENG L K.Fractal theory and its application in materials science[J].DevelopmentandApplicationofMaterials,2010,15(5):39-43.
[12] 成秋明.多重分形与地质统计学方法用于勘查地球化学异常空间结构和奇异性分析[J].地球科学,2001,26(2):161-166. CHENG Q M.Multifractal and geostatistical methods for characterizing local structure and singularity properties of exploration geochemical anomalies[J].EarthScience,2001,26(2):161-166.
[13] MEAKIN P.Fractal aggregates[J].AdvancesinColloidandInterfaceScience,1988,28:249-331.
[14] LOGAN B E,KILPS J R.Fractal dimensions of aggregates formed in different fluid mechanical environments[J].WaterResearch,1995,29(3):443-453. [15] 王晓昌,丹保宪仁.絮凝体形态学和密度的探讨-Ⅰ.从絮凝体分型构造谈起[J].环境科学学报,2000,20(3):257-262. WANG X C,NORIHITO T.A study on the morphology and density of flocsⅠ.The fractal structure of floc[J].ActaScientiaeCircumstantiae,2000,20(3):257-262.
[16] 李警阳,张忠国,孙春宝,等.基于分形学的絮凝理论研究进展[J].化工进展,2012,31(12):2609-2614. LI J Y,ZHANG Z G,SUN C B,et al.A review of flocculation theories incorporating fractal geometry[J].ChemicalIndustryandEngineeringProgress,2012,31(12):2609-2614.
[17] 于婧超.薄荷水提液的絮凝工艺研究[D].沈阳:沈阳化工大学,2012. YU J C.StudyonFlocculationofWater-ExtractionSolutionofPeppermint[D].Shenyang:Shenyang University of Chemical Technology,2012.
[18] CHAKRABORTI R K,ATKINSON J F,BENSCHOTEN J E V,et al.Characterization of alum floc by image analysis[J].EnvironmentalScienceandTechnology,2000,34(18):3969-3976.
[19] 卢佳,王毅力,杜白雨,等.聚合氯化铁腐殖酸(PFC-HA)絮体的粒度和分形维数的动态变化[J].环境科学学报,2008,28(4):624-633. LU J,WANG Y L,DU B Y,et al.Dynamic change of particle size and fractal dimensions of polyferric chloride-humic acid (PFC-HA) flocs[J].ActaScientiaeCircumstantiae,2008,28(4):624-633.
[20] 孙姣,秦莉,李桂水,等.壳聚糖对小儿咳喘灵原药提取液絮凝除杂效果研究[J].中草药,2013,44(2):174-179. SUN J, QIN L, LI G S, et al. Effect of chitosan on flocculation impurity removal of extract from Xiao’er Kechuanling oral liquid[J].ChineseTraditionalHerbalDrugs,2013,44(2):174-179.
[21] 郑丽娜.复合型生物絮凝剂絮凝特性及絮凝絮体分形特性研究[D].哈尔滨:哈尔滨工业大学,2007. ZHENG L N.EvaluationoftheFlocculatingandFractalCharacteristicsofCompoundBiologicalFlocculants[D]. Harbin:Harbin Institute of Technology,2007.
[22] 王晓昌,丹保宪仁.絮凝体形态学和密度的探讨-Ⅱ.致密性絮凝体形成操作模式[J].环境科学学报,2000,20(4):385-390. WANG X C, NORIHITO T. A study on the morphology and density of flocsⅡ. Operation modes for compact floc formation[J].ActaScientiaeCircumstantiae,2000,20(4):385-390.
[23] KRANENBURG C. The fractal structure of cohesive sediment aggregates[J].EstuarineCoastalandShelfScience,1994,39(6):451-460.
[24] XIA X M, LI Y, YANG H, et al. Observations on the size and settling velocity distributions of suspended sediments in the Pearl River Estuary, China[J].ContinentalShelfResearch,2004,24(16):1809-1826.
[25] FOX J M, HILL P S, MILLIGAN T G, et al. Floc fraction in the waters of the Po River prodelta[J].ContinentalShelfResearch,2004,24(15):1699-1715.
ZHANG Jianwei, WANG Xinwen, FENG Ying, SU Chenchang
(School of Energy and Power Engineering,Shenyang University of Chemical Technology,Shenyang 110142,China)
The fractal dimension is an important parameter of flocculation of traditional Chinese Medicine’s water-extraction with chitosan. In this paper, Flocs’ fractal dimension is determined by image method, and Zeta potential instrument is applied to determine the ζ potential of flocculation system, so as to explore the mechanism and effect of the flocculation. Chitosan is selected as a flocculant to purify the impurity of water-extract of peony, the flocculation’s operating conditions, such as the dosage of flocculant, flocculation temperature, pH value and so on, are adjusted to explore the impact of these factors on the flocculation and the variation of flocs’ fractal dimension. When the dosage is increased, the fractal dimension of flocs shows a downward trend. When the temperature or pH value is increased, the fractal dimension of flocs shows a situation that it increases firstly, then decreases. The optimum conditions of peony’s water-extract is acknowledged by orthogonal experiment: flocculant dosage is 0.310 g·L-1, flocculation temperature is 30 ℃, pH value is 3. In this case, the flocculation flocculation rate is 94.32% when the fractal dimension is 1.430.
chitosan; peony’s water-extract; flocculation; fractal; electrophoresis; colloid

10.3785/j.issn.1008-9497.2017.05.011
TQ 028
:A
:1008-9497(2017)05-561-07
2016-12-06.
国家自然科学基金资助项目(21406142).
张建伟(1964-),ORCID:http://orcid.org/0000-0002-2898-8108,男,教授,博士,主要从事非均相固液分离、混合技术等研究,E-mail:zhangjianwei@syuct.edu.cn.
Flocculationeffectandflocs’fractalcharacteristicsofpeony’swater-extractionwithchitosan.Journal of Zhejiang University (Science Edition),2017,44(5):561-567

