LGR5在宫颈癌发生中的作用及机制初探
陈 庆, 李向红, 赵金燕, 卢晓宁, 薛 翔
(西安交通大学第二附属医院妇产科, 陕西 西安 710004)
LGR5在宫颈癌发生中的作用及机制初探
陈 庆, 李向红, 赵金燕, 卢晓宁, 薛 翔
(西安交通大学第二附属医院妇产科, 陕西 西安710004)
目的研究富含亮氨酸重复序列的G蛋白偶联受体5(LGR5)在宫颈癌发生中的作用及机制。方法分别采用免疫组化、Western blot检测LGR5、β-链蛋白(β-catenin)在正常宫颈、宫颈上皮内瘤变及宫颈癌组织中的表达,分析LGR5与宫颈癌临床病理特征、β-catenin的关系;通过肿瘤球形成试验观察LGR5对宫颈癌发生的影响。结果LGR5、β-catenin在正常宫颈、宫颈上皮内瘤变及宫颈癌中的阳性率分别为17%(5/30),65%(11/17),84%(54/64)以及13%(4/30),53%(9/17),92%(59/64),差异均具有统计意义(P<0.01)。LGR5表达与宫颈癌病理分级相关,而与患者年龄、临床分期及淋巴转移无相关性。宫颈癌组织中β-catenin与LGR5的表达呈显著正相关(r=0.69,P<0.01)。LGR5过表达的人宫颈鳞癌细胞(SiHa细胞)肿瘤球形成率高于绿色荧光蛋白(GFP)对照组(P<0.01),差异具有统计学意义。结论LGR5促进宫颈癌的发生,其机制可能与β-catenin高表达相关。
LGR5; 宫颈癌; β-catenin; 免疫组化; Western blot
宫颈癌是一种严重威胁女性健康的生殖系统恶性疾病,也是导致妇女癌症死亡的主要病因之一。据报道,每年大约有27万人死于宫颈癌[1],尤其近年来,宫颈癌的发病呈现出低龄化趋势。肿瘤的发生与一些干细胞相关蛋白的异常表达密切相关,富亮氨酸重复序列G蛋白偶联受体5(leucine-rich-repeat-containing G-protein-coupled receptor 5, LGR5)是小肠及毛囊成体干细胞的一种新型标志物[2]。据报道,LGR5在结直肠癌[3]、肝癌[4]、基底细胞癌[5]等多种类型的肿瘤组织中出现表达升高。目前在宫颈癌组织中尚未见报道,为探讨LGR5在宫颈癌中的表达及意义,本研究通过免疫组化、Western blot等技术分析了LGR5及β-catenin在宫颈癌组织中的表达及相关性。
1 材料及方法
1.1主要试剂与材料:LGR5蛋白抗体(Abnova,台北);β-catenin(santa cruz,美国),β-actin单抗(santa cruz,美国);DMEM(高糖)培养基(Sigma,美国);SiHa细胞株(ATCC,美国);羊抗鼠/兔SP试剂盒(博士德公司,武汉);LGR5过表达及GFP对照载体
1.2临床资料:64例宫颈癌,17例宫颈上皮内瘤变及30例正常宫颈组织标本分别收集于2009年1月至2012年12月期间于西安交通大学第一、二附属医院妇产科住院及门诊患者,患者年龄31~71岁,平均年龄48.5岁。肿瘤患者术前经活检确诊,且术前均未接受放疗及化疗,手术行全子宫及双侧附件切除+盆腔淋巴结清扫术。其中正常宫颈来自于子宫肌瘤子宫全切患者。均为宫颈鳞癌,其中病理分级Ⅰ/Ⅱ为45人,Ⅲ为19人,浸润深度为浅间质浸润39人,深间质浸润25人;宫颈上皮内瘤变为CINⅠ/Ⅱ为9人,CINⅢ为8人。
1.3免疫组化检测LGR5、β-catenin蛋白:采用免疫组织化学染色法检测正常宫颈、宫颈上皮内瘤变及宫颈癌组织中LGR5、β-catenin的表达。具体操作步骤参照Fan等[6]描述的方法进行。阳性结果判定:随机观察5个视野,将阳性细胞百分率分为5个等级,分别评分为:<5%(0);5%~25%(1);25%~50%(2);50%~75%(3);>75%(4);按染色强度分为4个等级,分别评分为:阴性:背景色相同或不染色(0),弱:染色呈淡黄色(1),中:染色呈黄或棕黄色(2),强:染色呈黄褐色(3)。最终评分按下列公式计算:
免疫反应评分(IRS)=阳性细胞百分率评分×染色强度评分。
IRS>3定义为阳性染色,其中IRS≤3为弱,3
1.4SiHa细胞培养与转染:SiHa细胞置于含10%胎牛血清的DMEM培养液,5% CO2培养箱中,37℃常规培养。采用脂质法转染LGR5过表达及GFP对照质粒(本实验室构建)至SiHa细胞,其操作步骤严格按照Lipofectamine 2000说明书进行。阳性克隆在荧光显微镜下可见绿色荧光表达。
1.5Western blot检测LGR5、β-catenin蛋白:宫颈癌组织和细胞分别于蛋白裂解液中,在冰上裂解30min,4℃12000 rpm离心15min,提取蛋白。通过BCA法进行蛋白定量,按照Wang等[7]描述的方法进行western blot检测。
1.6肿瘤球形成试验:调整细胞密度为1×104个/mL,在24孔板中,提前加好0.5mL DMEM/F12干细胞培养基。在24孔板每孔加入10μL细胞悬液(即100个细胞),十字晃动24孔板使细胞分散均匀,重新放置于37℃、含5%CO2的培养箱中培养。悬浮培养2周,每隔3d滴加0.2mL DMEM/F12干细胞培养基,在倒置显微镜下观察肿瘤球的形成情况,并计算肿瘤球形成率。

2 结 果
2.1LGR5与β-catenin的表达:LGR5、β-catenin在宫颈癌组织(Squamous cervical carcinoma,SCC)中的表达均高于正常宫颈(Normal cervix,NC)及宫颈上皮内瘤变(Cervical intraepithelial neoplasias,CIN),见图1,且LGR5与β-catenin在NC、CIN及SCC的阳性率分别为17%(5/30),65%(11/17),84%(54/64)以及13%(4/30),53%(9/17),92%(59/64),差异均具有统计意义(P<0.01),表1。
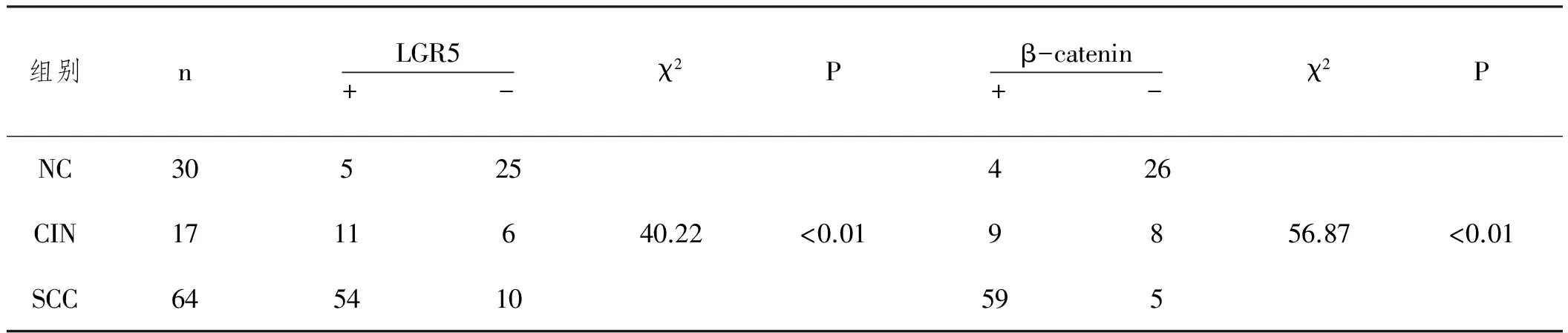
表1 LGR5、β-catenin在正常宫颈、宫颈上皮内瘤变及宫颈癌组织的阳性表达
2.2临床病理学特征分析:LGR5蛋白表达与宫颈癌病理分级相关(P=0.035),与患者年龄、临床分期及淋巴转移无关,差异具有统计学意义(P>0.05),见表2。
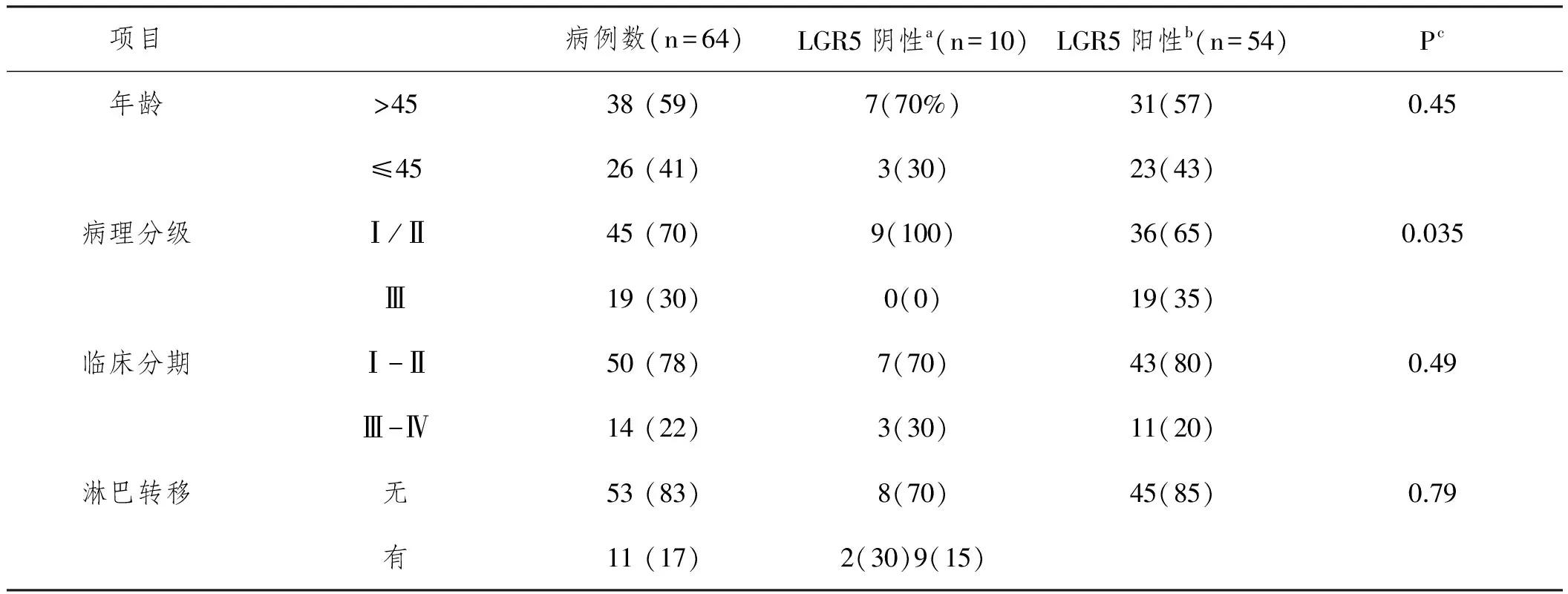
表2 LGR5表达与宫颈癌组织临床病理特征的关系n(%)
注:a score ≤3, b score>3, c Chi-square test
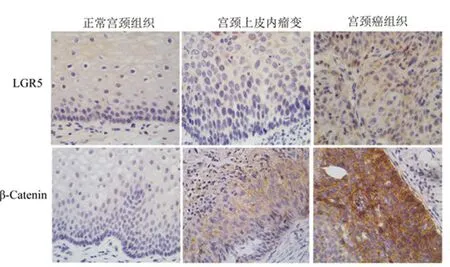
图1 LGR5、β-catenin在正常宫颈、宫颈上皮内瘤变及宫颈癌组织中的表达
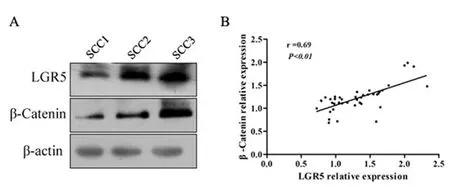
图2 宫颈癌中LGR5与β-catenin表达的相关性
A:Western blot检测LGR5、β-catenin在宫颈癌组织中的表达;B:LGR5、β-catenin表达的相关性分析
2.3宫颈癌组织中LGR5与β-catenin的相关分析:Western blot结果显示,宫颈癌组织中β-catenin表达有随LGR5表达升高而升高的趋势,见图2A,通过定量分析发现,β-catenin与LGR5蛋白表达呈显著正相关(r=0.69,P<0.01)见图2B。
2.4肿瘤球形成试验:LGR5过表达载体转染至SiHa细胞,24h后,荧光显微镜下阳性克隆显绿色荧光,经G418筛选,Western blot鉴定,获得稳定过表达LGR5蛋白的SiHa(SiHa-LGR5)细胞株,见图3。与对照组(SiHa-GFP)相比,SiHa-LGR5组肿瘤球形成时间早,生长速度快,见图4A。培养12d后,SiHa-LGR5组肿瘤球形成率明显高于SiHa-GFP组,经χ2检验,差异具有统计学意义(P<0.05),见图4 B,C。
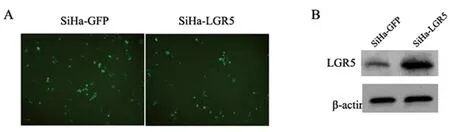
图3 LGR5过表达宫颈癌细胞系构建
A,LGR5过表达载体转染SiHa细胞,GFP为绿色荧光蛋白;B,Western blot鉴定LGR5在转染细胞的表达。
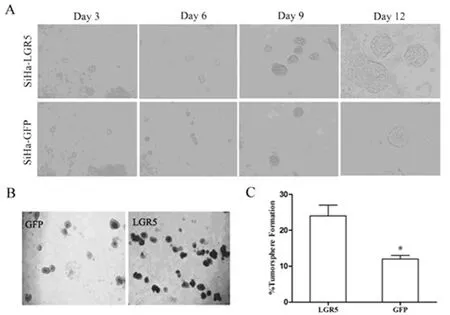
图4 LGR5对SiHa细胞体外肿瘤球形成的影响
A,SiHa细胞肿瘤球的生长,200×;B-C,LGR5对SiHa细胞肿瘤球形成率的影响,100×;*P<0.05。
2.5β-catenin在LGR5过表达细胞中的表达:Western blot检测显示,β-catenin在SiHa-LGR5及SiHa-GFP细胞中的表达与LGR5的表达相一致,见图5。
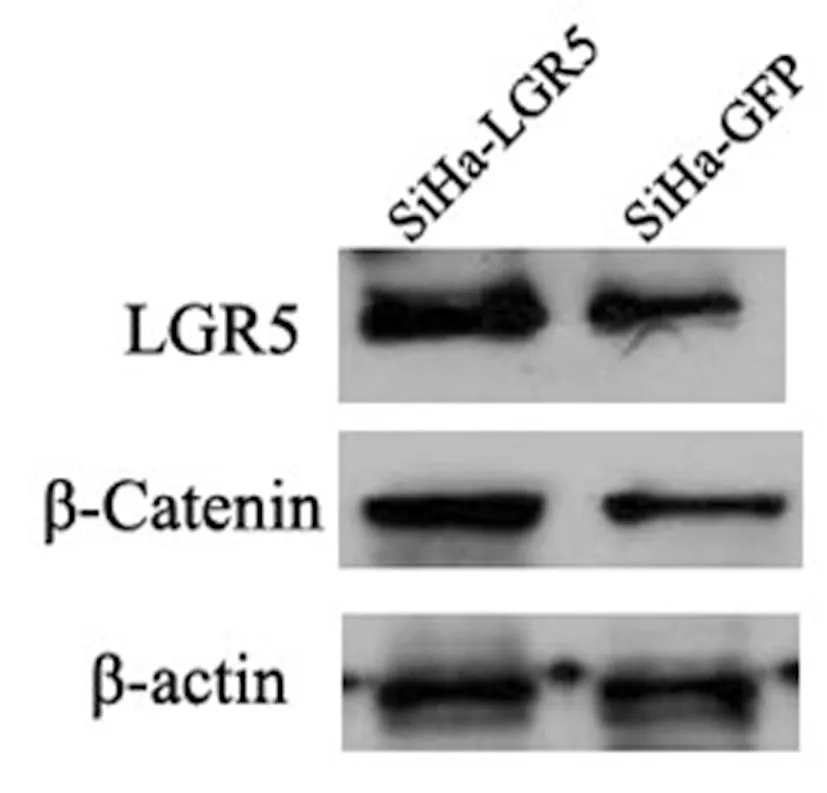
图5 LGR5、β-catenin在SiHa细胞中的表达
3 讨 论
LGR5是一种具有七次跨膜结构的G蛋白偶联受体,属于G蛋白偶联受体超家族成员,在胚胎和器官的发育以及体内细胞信号转导、代谢调节方面具有重要功能[8],现已被确认为人类小肠及毛囊成体干细胞的重要分子标志。近年来,研究表明,LGR5与肿瘤的发生、发展存在密切关联[3]。宫颈癌作为世界上严重威胁女性健康的第三大恶性肿瘤[9],在全世界每年新发病例约有50万左右,其中绝大部分发生在发展中国家,而我国宫颈癌的发病率则位居女性恶性肿瘤之首[10]。然而,目前关于宫颈癌的发病机制尚为完全阐明。
本研究发现,LGR5在正常宫颈、宫颈上皮内瘤变及鳞状上皮宫颈癌组织中的表达是逐渐升高的;这提示LGR5可能参与宫颈癌的发生与发展。据文献报道,LGR5在结直肠癌、胃癌[4]以及基底性小细胞肺癌[5]等肿瘤组织中均呈现表达增高,这与本研究结果相一致。临床病理特征分析发现,LGR5表达与宫颈癌病理分级之间存在显著正相关,而与患者年龄、临床分期及淋巴转移等临床特征无明显相关,这表明LGR5可能是一个促进宫颈癌发生、发展的癌基因。体外细胞培养试验表明,LGR5-SiHa细胞的肿瘤球形成率明显高于对照组,并且肿瘤球形成时间早,生长速度快,这表明LGR5促进宫颈癌的发生。
为探讨LGR5促进宫颈癌发展的机制,本研究又分析了β-catenin在宫颈癌的表达。β-catenin是Wnt/β-catenin信号通路的关键信号分子,其表达高低与Wnt/β-catenin信号通路活性密切相关。Wnt/β-catenin信号通路不仅在肿瘤的发生发展方面发挥着重要作用[11],而且与LGR5也密切相关。有报道,LGR5是Wnt/β-catenin通路的重要靶基因[12],Wnt/β-catenin信号通路激活,可引起LGR5表达的上调或下调[13]。然而,近年来也有研究报道LGR5是Wnt/β-catenin信号通路的激活剂,可增强Wnt/β-catenin信号通路的活性[14]。本研究发现,β-catenin在正常宫颈、宫颈上皮内瘤变以及宫颈癌组织中的表达也呈升高趋势,并且在宫颈癌组织中与LGR5的表达呈明显正相关,这表明LGR5的促癌作用可能与β-catenin的表达相关。此外,本研究还发现,β-catenin在LGR5-SiHa细胞中的表达高于对照组,与LGR5在细胞中的表达相一致,进一步说明LGR5促癌作用与Wnt/β-catenin信号通路激活有关。
综上所述,本研究发现LGR5在宫颈癌组织中是高表达的,并能促进宫颈癌的发生,其机制可能与Wnt/β-catenin信号通路激活有关。这为探讨LGR5在宫颈癌发生发展中的分子机制提供了线索,但宫颈癌中LGR5表达与Wnt/β-catenin信号通路激活的具体机制,尚需进一步深入研究。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA: a cancer journal for clinicians, 2011, 61 (2): 69~90.
[2] Barker N, Clevers H. Leucine-rich repeat-containing G-protein-coupled receptors as markers of adult stem cells[J].Gastroenterology, 2010, 138 (5): 1681~1696.
[3] He S, Zhou H, Zhu X, et al. Expression of Lgr5, a marker of intestinal stem cells, in colorectal cancer and its clinicopathological significance[J].Biomed Pharmacother, 2014, 68 (5): 507~513.
[4] Zheng ZX, Sun Y, Bu ZD, et al. Intestinal stem cell marker LGR5 expression during gastric carcinogenesis[J].World Gastroenterol, 2013, 19 (46): 8714~8721.
[5] Tanese K, Fukuma M, Yamada T, et al. G-protein-coupled receptor GPR49 is up-regulated in basal cell carcinoma and promotes cell proliferation and tumor formation[J].Am Pathol, 2008, 173: 835~843.
[6] Fan X-S, Wu H-Y, Yu H-P, et al. Expression of Lgr5 in human colorectal carcinogenesis and its potential correlation with beta-catenin[J].Int Colorectal Dis, 2010, 25: 583~590.
[7] Wang Y, Cai N, Wu X, et al. OCT4 promotes tumorigenesis and inhibits apoptosis of cervical cancer cells by miR-125b/BAK1 pathway[J].Cell Death Dis, 2013, 4 (8): e760.
[8] Schepers AG, Snippert HJ, Stange DE, et al. Lineage tracing reveals Lgr5+ stem cell activity in mouse intestinal adenomas[J].Science, 2012, 337 (6095): 730~735.
[9] Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J].International journal of cancer, 2010, 127 (12): 2893~2917.
[10] Saavedra KP, Brebi PM, Roa JCS. Epigenetic alterations in preneoplastic and neoplastic lesions of the cervix[J].Clinical Epigenetics, 2012, 4 (1): 1~7.
[11] Yang L, Tang H, Kong Y, et al. LGR5 Promotes Breast Cancer Progression And Maintains Stem-like Cells Through Activation Of Wnt/β-Catenin Signaling[J].Stem Cells, 2015, 33 (10): 2913~2924.
[12] Haegebarth A, Clevers H. Wnt signaling, lgr5, and stem cells in the intestine and skin[J].Am Pathol, 2009, 174 (3): 715~721.
[13] Chai R, Xia A, Wang T, et al. Dynamic expression of Lgr5, a Wnt target gene, in the developing and mature mouse cochlea[J].Assoc Res Otolaryngol, 2011, 12 (4): 455~469.
[14] Carmon KS, Lin Q, Gong X, et al. LGR5 interacts and cointernalizes with Wnt receptors to modulate Wnt/beta-catenin signaling[J].Mol Cell Biol, 2012, 32 (11): 2054~2064.
TheRoleandMechanismofLGR5inCervicalCarcinogenesis
CHENQing,LIXianghong,ZHAOJinyan,etal
(TheSecondAffiliatedHospitalofXi'anJiaotongUniversity,ShannxiXi'an710004,China)
Objective:To investigate the role and mechanism of LGR5 in cervical carcinogenesis.MethodsThe expression of LGR5 and β-catenin in normal cervix, cervical intraepithelial neoplasias and squamous cervical cancer were determined by immunohistochemistry and western blot, and analyze the relationship between LGR5 and clinical pathological features of cervical cancer and β-catenin expression. The effect of LGR5 on cervical carcinogenesis was examined using tumorsphere formation.ResultsThe positive rate of LGR5 and β-catenin in normal cervix, cervical intraepithelial neoplasias and cervical cancer were 17% (5/30), 65% (11/17), 84% (54/64) and 13%(4/30),53%(9/17),92%(59/64),respectively. The difference was statistically significant (P<0.01). The expression of LGR5 was associated with pathological grade of cervical cancer, but not with patient's age, clinical stage and lymph node metastasis. β-catenin expression in cervical cancer was positively related to LGR5 expression(r=0.69, P<0.01). Moreover, the rate of tumorsphere formation of LGR5 overexpression SiHa cell was significantly higher than the GFP control group (P<0.01).ConclusionLGR5 and promoted cervical carcinogenesis and its mechanismmay be associated with high expressio0n of β--catenin
LGR5; Cervical cancer; β-catenin; Immunohistochemistry; Western blot
1006-6233(2017)09-1455-05
A
10.3969/j.issn.1006-6233.2017.09.014
陕西省自然科学基金,(编号:2016JM8067)

