过表达MRP8提高酿酒酵母乙酸耐性及乙醇发酵效率
万 春,万青青,熊 亮,赵心清,白凤武
(1.上海交通大学 生命科学技术学院 微生物代谢国家重点实验室,上海 200240;2.大连理工大学 生命科学与技术学院,辽宁 大连 116024)
过表达MRP8提高酿酒酵母乙酸耐性及乙醇发酵效率
万 春1,2,万青青1,熊 亮2,赵心清1,白凤武1
(1.上海交通大学 生命科学技术学院 微生物代谢国家重点实验室,上海 200240;2.大连理工大学 生命科学与技术学院,辽宁 大连 116024)
乙酸是木质纤维素水解液中含量较多的抑制物,因此提高酿酒酵母菌株对乙酸的耐受性有助于提高纤维素乙醇生产效率。本文中,笔者利用基于CRISPR/Cas9系统的基因组编辑技术过表达了酿酒酵母(Saccharomyces cerevisiae)S288c线粒体核糖体蛋白编码基因MRP8,并比较了过表达MRP8的菌株与对照菌株的生长和发酵特性。平板耐性检测发现,MRP8过表达明显提高了菌株的乙酸胁迫耐受性;乙醇发酵结果表明,在4.8 g/L乙酸胁迫条件下,过表达菌株MRP8-3在51 h消耗全部的葡萄糖,发酵时间缩短了25 h,显著优于相同时间的对照菌株。本研究结果为构建高效纤维素乙醇发酵的酿酒酵母菌株提供了新思路。
酿酒酵母;MRP8;乙酸胁迫耐受性;乙醇发酵;CRISPR/Cas9;基因组编辑
纤维素乙醇作为清洁可再生能源,是重要的传统化石燃料替代品,具有良好的应用前景;然而纤维素原料预处理过程产生弱酸类、酚类和醛类等抑制物,显著影响微生物的生长和发酵特性[1]。在纤维素预处理过程中产生的抑制物中,乙酸的量最高,可达15 g/L[2]。高浓度的乙酸能引起细胞内线粒体的损伤以及胞内活性氧(reactive oxygen species,ROS)积累,从而降低酿酒酵母生产纤维素乙醇的效率[3]。虽然可通过调节pH缓解乙酸对酿酒酵母细胞的抑制,但是碱液的使用会提高生产成本。如果酿酒酵母可以在高浓度乙酸抑制条件下正常生长和发酵,能更有利于工业化应用[4]。因此,提高酵母细胞对乙酸胁迫的耐受性成为亟需解决的问题。
近年来,基于CRISPR/Cas9的基因组编辑技术在酿酒酵母中得到快速发展[5-6]。利用基因组编辑技术可实现快速多基因同时操作,可避免在工业酿酒酵母基因组中留下抗性标记,因此具有广泛的应用前景。
笔者所在课题组前期利用过表达ARO7、GRX5、PPR1和SET5,或者敲除ADY2,构建了乙酸耐性以及乙醇发酵效率提高的酿酒酵母菌株[7-10]。近期蛋白组分析发现,在乙酸耐性提高的菌株中,Mrp8p表达量显著上调(未发表结果)。Mrp8p属于线粒体核糖体蛋白家族,其编码基因MRP8位于酿酒酵母XI染色体上[11],当细胞壁出现损伤时,该基因上调1.2~1.6 倍[12],但是,MRP8 过表达对酿酒酵母乙酸耐性的影响目前还不清楚。因此,本文中,笔者利用基于CRISPR/Cas9的基因组编辑技术,在酿酒酵母S288c中过表达MRP8,研究它对乙酸耐性和乙醇发酵性能的影响,以期为进一步高效纤维素乙醇生产菌株的选育提供理论参考。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
酿酒酵母S.cerevisiae S288c和DNA克隆宿主Escherichia coli DH5α保存于微生物代谢国家重点实验室;Cas9表达质粒为具有诺尔丝菌素抗性的Cas9-NAT[13],gRNA表达质粒为具有潮霉素 B抗性的pRS42H_gRNA_20以及含有MRP8基因的载体pRS42H-Ppgk1-MRP8-Tcyc1,均为笔者所在实验室构建保存。其中pRS42H_gRNA_20靶向基因间隔区YPRCdelta15位点,其23碱基靶向序列为GGAATATTGGGTCAGATGAATGG。
1.1.2 主要试剂和培养基
诺尔丝菌素,北京中生瑞泰科技有限公司;基因组和质粒提取试剂盒、酵母粉蛋白胨等试剂及其他抗生素等,上海生工生物工程股份有限公司;实时定量PCR试剂盒,日本TaKaRa公司;PCR试剂,北京擎科新业生物技术有限公司;RT-qPCR仪器,美国Bio-Rad公司;引物委托北京擎科新业生物技术有限公司合成。
YPD培养基(g/L):蛋白胨20,葡萄糖20,酵母粉10;
乙醇发酵培养基(g/L):蛋白胨 3,葡萄糖 100,酵母粉4。
1.2 MRP8过表达菌株构建
用20_Ppgk-F(CTTAAGATGCTCTTCTTATTCTATTAAAAATAGAAAATGAAGGCATTTGCAAGAATTACTCGTG)和20_Tcyc1-R(GTTTGTTTGCGAAACCCTATGCTCTGTTGTTCGGATTTGATCATGTAATTAGTTATGTCACG)引物从pRS42H-Ppgk1-MRP8-Tcyc1载体上扩增转化元件,其中包含酿酒酵母S288c染色体XVI上整合位点(YPRCdelta15)的上游同源臂、PGK1启动子、MRP8基因、CYC1终止子以及整合位点的下游同源臂。
通过醋酸锂方法[14]将Cas9-NAT质粒转入酿酒酵母S288c后,用100 mg/L诺尔丝菌素筛选得到转化子。将pRS42H_gRNA_20质粒和含有MRP8基因纯化后的PCR产物以相同方法同时转化到含有Cas9-NAT质粒的转化子中;然后用100 mg/L诺尔丝菌素和300 mg/L潮霉素B筛选转化子。随机挑选单克隆转化子命名为MRP81-5,并提取基因组,用Ppgk-F和Tcyc1-R引物通过PCR扩增转化元件,验证获得正确的转化子;然后将MRP8-1~4在无抗性的YPD培养基中连续转接5次(每24 h转接1次),丢失Cas9-NAT和pRS42H_gRNA_20质粒;然后保存于-80℃冰箱中。
1.3 菌种活化、耐性测试和发酵实验
1.3.1 菌种活化
从-80℃冰箱中取出保存的转化子MRP8-1~4在液体YPD培养基中,在30℃、150 r/min过夜培养至对数期进行下一步实验。
1.3.2 耐性试验
将对数期的转化子培养液OD调为一致(OD600为1.0),按照10倍梯度稀释,取 2 μL分别点样于无胁迫条件的5 g/L乙酸和5 mmol/L H2O2的YPD平板,在菌株充分生长后照相记录。
1.3.3 发酵实验
将转化子MRP8-3活化后转接到50 mL YPD液体培养基中继续培养过夜,然后收集菌体,接种于含100 mL发酵培养基的250 mL摇瓶中,初始OD600均调节为0.05左右;在30℃、150 r/min条件下培养。发酵培养基中不添加或者添加4.8 g/L乙酸。发酵过程中每3~10 h定时取样测OD600、葡萄糖和乙醇含量;当葡萄糖低于1.0 g/L时认为发酵结束。实验设置2个平行,重复2次。根据实验室已建立的方法分析发酵液中的代谢物[9]。
1.4 RNA提取及实时定量(RT-qPCR)分析
利用RNA提取试剂盒提取对数期菌株的细胞总RNA,根据实验室已有的方法进行RT-qPCR分析[9]。由于MSN2和SOD1均和乙酸胁迫响应相关,因此也做了分析;所用引物序列分别为rtMSN2-F(TATCACCATTTCCCACAGCA)和rtMSN2-R(CACCATTGCCAGTTGAGTTG)、rtSOD1-F(TGTCTCTGCTGGTCCTCACTTC)和rtSOD1-R(CACACCATTTTCGTCCGTCTT)、rtMRP8-F(CTGGAAGGTAAGGTGGAAGC)和
rtMRP8-R(AGATAGCGGGCAACATCATT)。以ALG9为内参基因[15],所用引物为rtALG9-F(ATCGTGAAATTGCAGGCAGCTTGG)和rtALG9-R(CATGGCAACGGCAGAAGGCAATAA),以 2-ΔΔCt方法计算基因相对表达量[15]。
2 结果与讨论
2.1 基因MRP8过表达对酵母细胞耐受性影响的检测
利用基于CRISPR/Cas9的基因组编辑技术将含有MRP8基因的转化元件定点整合到酿酒酵母S288c染色体XVI的YPRCdelta15位点,并且通过Ppgk-F(GTCGTACGACTGTAATTGCTTTTAG)和Tcyc1-R(GCAAATTAAAGCCTTCGAGCGT)引物进行验证,表明得到了正确的转化子;然后通过点板实验初步评价了随机挑选的4个转化子的生长性能。图1为酿酒酵母S288c中过表达MRP8对生长性能的影响。由图1可知:在无胁迫条件下,过表达菌株MRP8-1~4的生长性能和对照相差不大;但是当培养基中添加5 g/L乙酸时(图1(b)),过表达菌株生长状态明显优于对照,其中MRP8-2、3和4提高了约1 000倍,MRP8-1提高了约100倍。但是在含有5 mmol/L H2O2的平板上过表达菌株与对照相差不大。
文献[16]指出,在YPRCdelta15号位点整合基因具有较高的绿色荧光蛋白表达量,因此本实验在此强整合位点实现了MRP8的过表达。随机选择了转化子MRP8-3进行发酵实验,研究对乙酸胁迫条件下乙醇发酵的影响。

图1 基因MRP8过表达对酿酒酵母细胞生长性能的影响Fig.1 Effects of overexpressing MRP8 on S.cerevisiae S288c growth ability
2.2 基因MRP8过表达对酿酒酵母发酵性能的影响
考察不同浓度乙酸对酿酒酵母菌株的影响,发现2.4和3.6 g/L乙酸添加条件下,不同菌株的发酵性能差别不大,推测在这两个浓度下对酿酒酵母未产生明显胁迫抑制。而添加5 g/L乙酸导致菌株生长非常缓慢,所以选择4.8 g/L乙酸胁迫进行液体发酵实验比较,先考察无乙酸胁迫条件下酿酒酵母菌株及过表达菌株的生长及发酵性能,结果见图2。由图2可知:在无乙酸胁迫条件下,过表达菌株MRP8-3在培养6~27 h时的OD稍微高于对照组,二者的最大OD600分别为2.98和2.76,但是葡萄糖消耗和乙醇产量差别不大。其中,选取对数期(9 h)的酵母细胞进行RT-qPCR分析,过表达菌株MRP8-3和对照菌株的 OD600分别为 1.38 和 1.00。
考察在4.8 g/L乙酸胁迫条件下,过表达菌株与对照菌株的发酵性能,结果如图3所示。由图3可知:过表达菌株MRP8-3的延滞期比对照菌株缩短24 h;选取对数期的酵母细胞用于RT-qPCR分析,其中过表达菌株MRP8-3和对照菌株的取样时间点分别为29 和 54 h,对应的 OD600值分别为1.11 和 1.01,尽量选择OD值相近的酵母细胞进行RT-qPCR,以降低不同生长状态对实验结果的影响。由于发酵后期酵母细胞在乙酸胁迫条件下出现了聚集现象,导致OD值误差较大。但是从葡萄糖和乙醇含量变化亦能观察到过表达菌株MRP8-3的发酵性能明显优于对照菌株,并且在51 h消耗完所有葡萄糖。过表达菌株MRP8-3在54 h达到最高乙醇质量浓度43.59 g/L,略低于对照菌株在76 h的44.73 g/L,但对照菌株在76 h仍残留中仍剩余约5 g/L葡萄糖。
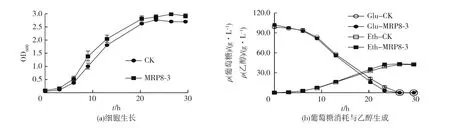
图2 过表达菌株与对照菌株在无乙酸条件下的发酵性能比较Fig.2 Comparison of fermentation performances between overexpression strains and control strain without acetic acid

图3 过表达菌株与对照菌株在4.8 g/L乙酸条件下的发酵性能比较Fig.3 Comparison of fermentation performances between overexpression strains and control strain with 4.8 g/L acetic acid
表1为过表达菌株和对照菌株在含有4.8 g/L乙酸的培养基中乙醇发酵的各指标。由表1可以看出:过表达MRP8基因可明显缩短发酵时间,提高乙醇生产强度,且对乙醇得率影响不大。细胞通过合成分泌甘油来抵抗外界胁迫[17],因此在过表达菌株和对照菌株的发酵液中均检测到甘油;此外,对照菌株中的甘油含量比过表达菌株高出了约86%,表明MRP8基因的过表达能提高细胞对乙酸的耐性,无需合成较多的甘油作为保护剂。由此也说明Mrp8p可能在酵母细胞抵抗乙酸胁迫中发挥重要作用。
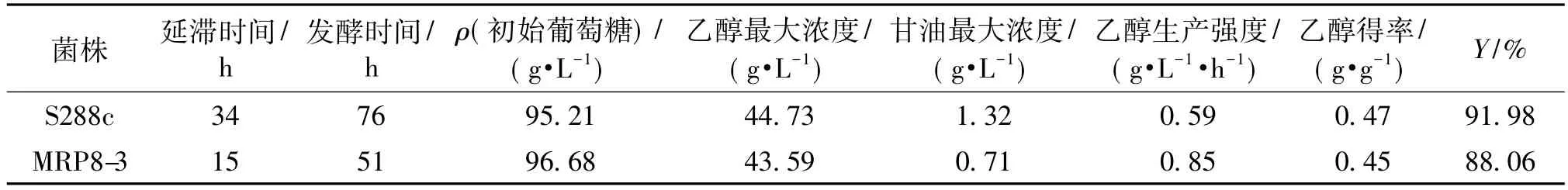
表1 在4.8 g/L乙酸胁迫条件下MRP8过表达菌株和对照菌株的发酵性能汇总Table 1 Summary of fermentation performance between MRP8 overexpressing strains and control strain with 4.8 g/L acetic acid
2.3 RT-qPCR分析
图4为RT-qPCR分析过表达MRP8菌株中基因表达量结果。由图4可知:在无乙酸胁迫条件下,过表达菌株MRP8-3中MRP8相对表达量稍微提高,在4.8 g/L乙酸胁迫条件下,MRP8相对表达量在过表达菌株MRP8-3中提高了约11倍,这揭示该基因转录受到乙酸胁迫的诱导。过表达菌株MRP8-3中SOD1表达量在无胁迫条件下没有太大变化,而在乙酸胁迫条件下明显下调。高浓度乙酸会引起细胞器损伤,胁迫DNA复制而加速细胞衰老[3,18],同时高浓度乙酸会导致胞内活性氧自由基(ROS)积累[19],而与胞内氧化胁迫有关的SOD1的相对表达量明显下调,表明Mrp8p过表达有利于清除胞内ROS,因此不需要过表达SOD1。过表达菌株MRP8-3中MSN2基因在非胁迫条件下显著上调,但在乙酸胁迫条件下 MSN2变化不明显。Msn2p是胁迫响应相关的转录调控因子[20],推测MSN2在MRP8过表达菌株胁迫条件下的耐性提高没有起到关键的调控作用。此外,MRP8表达量与Bur6p、Cst6p、Gcn5p 和 Sua7p 调节因子有关[21-22],这些调节因子也是以后进一步研究该基因调控机理的重要内容。
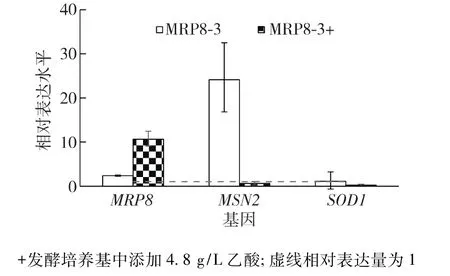
图4 RT-qPCR分析过表达MRP8菌株中基因表达量Fig.4 Analysis of genes expression level in the overexpressing MRP8 strains via RT-qPCR
3 结论
本研究首次报道了过表达MRP8基因能提高酿酒酵母的乙酸耐受性,同时提高了乙酸胁迫条件下的乙醇发酵水平。在4.8 g/L乙酸胁迫条件下,过表达菌株乙醇强度最高达到0.85 g/(L·h),比对照菌株提高了44%。本实验室已发现了多种提高乙酸耐性的基因操作靶点,本研究结果进一步丰富了酵母细胞乙酸耐性机理,对MRP8的深入研究有望进一步完善酿酒酵母的乙酸耐性机理,构建稳定高效的纤维素乙醇发酵菌株。
[1] ZHAO X,XIONG L,ZHANG M,etal.Towardsefficient bioethanol production from agricultural and forestry residues:exploration of unique natural microorganisms in combination with advanced strain engineering[J].Bioresour Technol,2016,215:84-91.
[2] WEI N,QUARTERMAN J,KIM S R,et al.Enhanced biofuel production through coupled acetic acid and xylose consumption by engineered yeast[J].Nat Commun,2013,4:2580.
[3] 赵心清,张明明,徐桂红,等.酿酒酵母乙酸耐性分子机制的功能基因组进展[J].生物工程学报,2014,30(3):368-380.
[4] GRAVES T,NARENDRANATH N V,DAWSON K,et al.Effect of pH and lactic oracetic acid on ethanolproductivity by Saccharomyces cerevisiae in corn mash[J].J Ind Microbiol Biotechnol,2006,33(6):469-474.
[5] APEL A R,D'ESPAUX L,WEHRS M,et al.A Cas9-based toolkit to program gene expression in Saccharomyces cerevisiae[J].Nucleic Acids Res,2017,45(1):496-508.
[6] 谢泽雄,李炳志,沈玥,等.酵母基因组工程[J].中国科学:生命科学,2015,45(10):985-992.
[7] ZHANG M M,ZHAO X Q,CHENG C,et al.Improved growth and ethanol fermentation of Saccharomyces cerevisiae in the presence of acetic acid by overexpression of SET5 and PPR1[J].Biotechnol J,2015,10(12):1903-1911.
[8] ZHANG M,ZHANG K,MEHMOOD M A,et al.Deletion of acetate transporter gene ADY2 improved tolerance of Saccharomyces cerevisiae against multiple stresses and enhanced ethanol production in the presence of acetic acid[J].Bioresour Technol,2017,doi:10.1016/j.biortech.2017.05.191.
[9] 张明明,万青青,张克俞,等.过表达分支酸歧化酶编码基因ARO7对酿酒酵母抑制物耐受性的影响[J].应用与环境生物学报,2016,22(2):201-205.
[10] 方青,张明明,陈洪奇,等.过表达谷氧还蛋白基因GRX5提高酿酒酵母乙酸耐性[J].化工学报,2015,66(4):1434-1439.
[11] ABRAHAM P R,MULDER A,VAN'T RIET J,et al.Molecular cloning and physicalanalysisofan 8.2 kb segmentof chromosome XI of Saccharomyces cerevisiae reveals five tightly linked genes[J].Yeast,1992,8(3):227-238.
[12] BOORSMA A,DE NOBEL H,TER RIET B,etal.Characterization of the transcriptional response to cell wall stress in Saccharomyces cerevisiae[J].Yeast,2004,21(5):413-427.
[13] ZHANG G C,KONG I I,KIM H,et al.Construction of a quadruple auxotrophic mutant of an industrial polyploid Saccharomycescerevisiaestrain byusingRNA-guided Cas9 nuclease[J].Appl Environ Microbiol,2014,80(24):7694-7701.
[14] GIETZ R D,SCHIESTL R H.High-efficiency yeast transformation using the LiAc/SS carrier DNA/PEG method[J].Nat Protoc,2007,2(1):31-34.
[15] TESTE M A,DUQUENNE M,FRANCOIS J M,et al.Validation of reference genes for quantitative expression analysis by real-time RT-PCR in Saccharomyces cerevisiae[J].BMC Mol Biol,2009,10:99.
[16] FLAGFELDT D,SIEWERS V,HUANG L,et al.Characterization of chromosomal integration sites for heterologous gene expression in Sacchromyces cerevisiae[J].Yeast,2009,26:545-551.
[17] MEDINA V G,ALMERING M J,VAN MARIS A J,et al.Elimination of glycerol production in anaerobic cultures of a Saccharomyces cerevisiae strain engineered to use acetic acid as an electron acceptor[J].Appl Environ Microbiol,2010,76(1):190-195.
[18] MURAKAMI C,DELANEY J R,CHOU,A et al.pH neutralization protectsagainstreduction in replicative lifespan following chronological aging in yeast[J].Cell Cycle,2012,11(16):3087-3096.
[19] WAN C,ZHAO X,ZHANG M,et al.Impact of zinc sulfate addition on dynamic metabolic profiling ofSaccharomyces cerevisiae subjected to long term acetic acid stress treatment and identification of key metabolites involved in antioxidant effect of zinc[J].Metallomics,2015,7(2):322-332.
[20] SCHMITT A P,MCENTEE K.Msn2p,a zinc finger DNA-binding protein,is the transcriptional activator of the multistress response in Saccharomyces cerevisiae[J].Proc Natl Acad Sci USA,1996,93(12):5777-5782.
[21] HU Z,KILLION P J,IYER V R.Genetic reconstruction of a functional transcriptional regulatory network[J].Nat Genet,2007,39(5):683-687.
[22] VENTERSBJ,WACHIS,MAVRICH TN,etal.A comprehensive genomic binding map of gene and chromatin regulatory proteins in Saccharomyces[J].Mol Cell,2011,41(4):480-492.
(责任编辑 荀志金)
Improvement of acetic acid tolerance of Saccharomyces cerevisiae by overexpression of mitochondrial ribosomal protein encoding gene MRP8 for efficient lignocellulosic ethanol production
WAN Chun1,2,WAN Qingqing1,XIONG Liang2,ZHAO Xinqing1,BAI Fengwu1
(1.State Key Laboratory of Microbial Metabolism,School of Life Sciences and Biotechnology,Shanghai Jiao Tong University,Shanghai 200240,China;2.School of Life Science and Biotechnology,Dalian University of Technology,Dalian 116024,China)
Acetic acid is one of the major inhibitors derived from the hydrolysis of lignocellulosic biomass,and enhancing the tolerance of Saccharomyces cerevisiae to acetic acid is of great importance for improving the lignocellulosic ethanol production.Here,we overexpressed mitochondrial ribosomal protein encoding gene MRP8 via CRISPR/Cas9-based genome editing in S.cerevisiae S288c,and compared the growth and fermentation performance between the mutants with MRP8 and the wild type.The tolerance to acetic acid was increased by overexpression MRP8 on agar plates.Also,mutant MRP8-3 consumed all glucose within 51 h in the presence of 4.8 g/L acetic acid,and the fermentation time was shortened by 25 h,indicating the mutant was superior to the wild type.Our findings provide a novel strategy for constructing robust yeast strains for efficient lignocellulosic ethanol fermentation.
Saccharomyces cerevisiae;MRP8;acetic acid tolerance;ethanol fermentation;CRISPR/Cas9;genome editing
TQ920.1
A
1672-3678(2017)05-0080-06
10.3969/j.issn.1672-3678.2017.05.010
2017-07-14
国家自然科学基金(21376043、31461143029);国家高技术研究发展计划(863计划)(2012AA021205、2012AA101805)
万 春(1989—),男,河南信阳人,博士,研究方向:生物化工;赵心清(联系人),教授,E-mail:xqzhao@sjtu.edu.cn

