发酵法生产糖胺聚糖的研究进展
张 权,陈修来,刘 佳,罗秋玲,刘立明
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;3.江南大学 食品微生物制造工程实验室,江苏 无锡 214122)
发酵法生产糖胺聚糖的研究进展
张 权1,2,3,陈修来1,2,3,刘 佳1,2,3,罗秋玲1,2,3,刘立明1,2,3
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;3.江南大学 食品微生物制造工程实验室,江苏 无锡 214122)
糖胺聚糖是一种具有多种生理功能的直链酸性黏多糖,广泛应用于化妆品、保健品和药品等行业。为了满足环境友好、生产安全和可持续发展的社会要求,利用微生物发酵法生产糖胺聚糖越来越受到人们的关注。本文中,笔者在总结糖胺聚糖生物合成路径的基础上,分析归纳了发酵法生产糖胺聚糖的生化工程和代谢工程策略,并展望了糖胺聚糖进一步高效生产的发展方向。
糖胺聚糖;代谢路径;生化工程;代谢工程
1 糖胺聚糖概述
糖胺聚糖(glycosaminoglycans,简称GAGs)是由重复的二糖单元反复交联而形成的具有多种生理功能的直链酸性黏多糖。基于二糖种类、连接方式、硫酸化位点的差异,糖胺聚糖可以分为肝素、透明质酸、硫酸软骨素、皮肤软骨素和硫酸角质素。糖胺聚糖具有抗凝血、抗血栓和抗肿瘤等多种药理活性,是构成关节软骨和滑液的主要成分[1-2]。此外,在护肤化妆品领域具有保湿保水作用,还可作为美容保健食品补充体内的多糖[3-4]。
目前,糖胺聚糖的生产技术主要可以分为动物组织提取法、人工合成法和发酵法3种。提取法是最早用于生产糖胺聚糖的方法,材料来源于动物组织,如鸡冠、狗的肝脏和牛肺,鲨鱼软骨等,工业过程包括提取、除杂、沉淀干燥得到产品。但是原料来源局限性大,生产周期长,产品纯化率低,生产成本高,并且动物病原的交叉感染事件频发受到卫生部门高度关注[5]。人工合成法是指某些特定高分子物质在体外经过一系列的化学反应得到目标产物,化学合成磺达肝素需要进行25步反应,生物高分子“玻璃酸氧氮杂环戊烯衍生物”合成透明质酸还处于实验室研究阶段,可见合成过程的复杂性[6-7]。发酵法指利用性能优良的微生物菌株进行发酵培养,然后从发酵液中分离纯化得到目标产物。发酵法与其他方法相比有着独特的优势,微生物利用廉价的培养基生产高价值的糖胺聚糖,能够显著降低成本,增加经济效益;发酵液提取与纯化工艺过程较其他方法简单,得到的产品质量安全稳定;此外,发酵法具有环境友好、低污染等优势。
近年来,发酵法生产糖胺聚糖已经成为国内外研究热点(表1),本综述以透明质酸、肝素及硫酸软骨素为对象,糖胺聚糖的生物合成途径为基础,从生化工程和代谢工程策略两个方面详细论述糖胺聚糖的生物合成现状,并从代谢工程技术角度为未来糖胺聚糖高产菌株的构建进行展望。
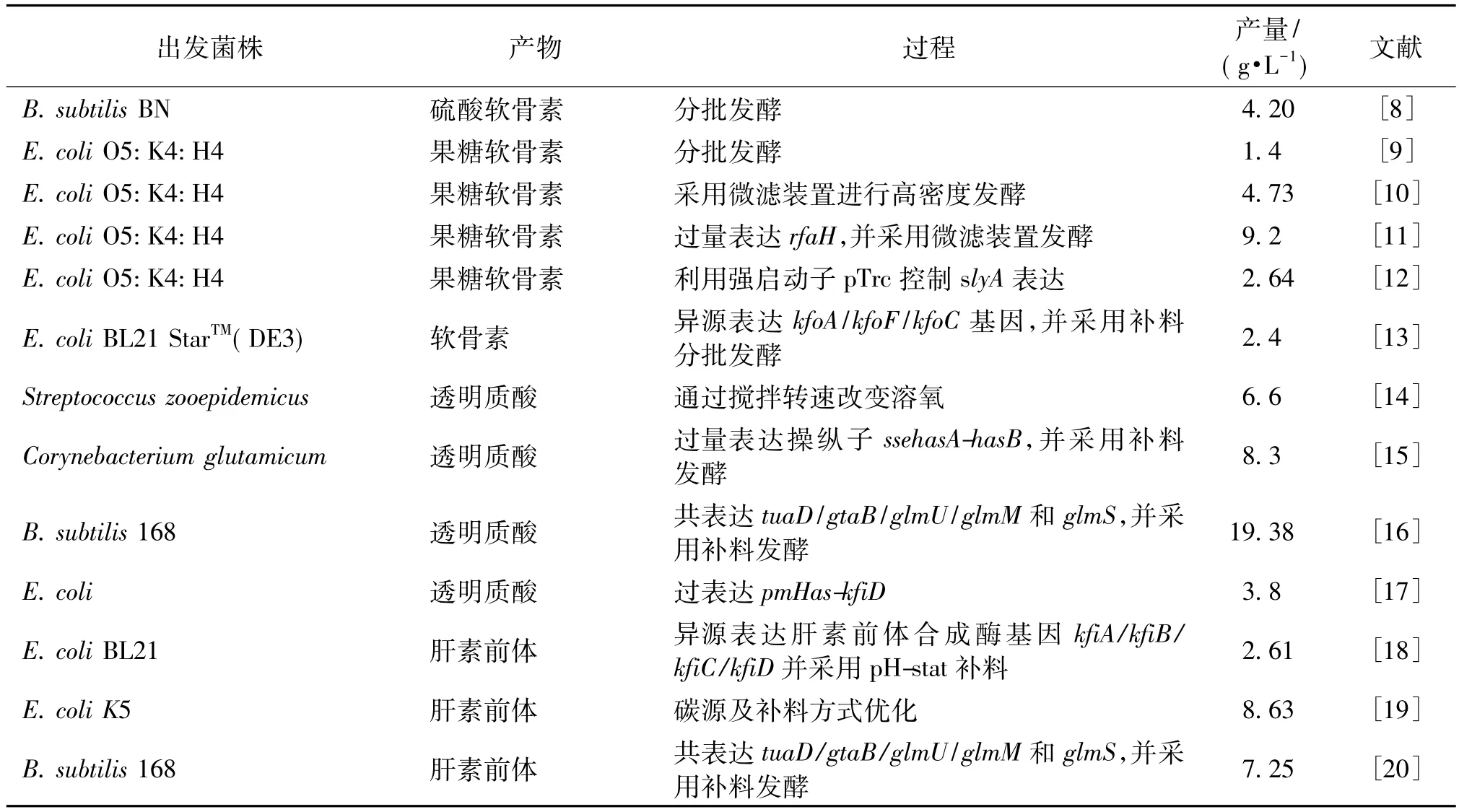
表1 发酵法生产糖胺聚糖研究策略Table 1 Strategies for GAGs production by microbial fermentation
2 糖胺聚糖的合成途径
糖胺聚糖作为一种荚膜多糖,首先在细胞质中合成多糖链,然后经周质空间定位至细胞外膜形成一圈黏液层,整个过程由细胞外膜和周质空间内多种复合蛋白完成,并且这些复合结构在时间和空间上需要紧密配合。合成过程主要可以分为3个部分:1)单糖前体的合成;2)糖胺聚糖的聚合与延伸;3)糖胺聚糖的修饰与转运。
2.1 单糖前体的合成
肝素、透明质酸和软骨素的合成途径如图1所示。由图1可知:葡萄糖通过PEP-PTS转运系统、ABC转运子和质子泵等方式进入细胞内,被葡萄糖激酶(EC 2.7.1.2) 转化成 6-磷酸-葡萄糖(Glc-6-P),然后进入3条不同代谢路径:1)直接进入戊糖磷酸途径;2)在磷酸葡萄糖异构酶(EC 5.3.1.9)的作用下转化成6-磷酸-果糖(Fru-6-P);3)在磷酸葡萄糖变位酶(EC 5.4.2.2)的作用下转化成 1-磷酸-葡萄糖(Glu-1-P)。其中,2)、3)分别为前体UDP-N-乙酰氨基葡萄糖(UDP-GlcNAc)和UDP-N-乙酰半乳糖胺(UDP-GalNAc)、UDP-葡萄糖醛酸(UDP-GlcA)的合成路径。
UDP-GlcA的合成:Glc-6-P在磷酸葡萄糖变位酶(EC 5.4.2.2)的作用下转化为 Glc-1-P,随后在 UDP-葡萄糖焦磷酸化酶(EC 2.7.7.9)的作用下转化为UDP-葡萄糖(UDP-Glc),最后在UDP-葡萄糖脱氢酶(EC 1.1.1.22)的作用下转化为 UDP-GlcA。
UDP-GlcNAc的合成:经 Glc-6-P转化而来的Fru-6-P 在葡萄糖胺合酶(EC 2.6.1.16)、磷酸葡糖胺变位酶(EC 5.4.2.10)、1-磷酸-N-乙酰葡糖胺焦磷酸化酶(EC 2.7.7.23) 的依次作用下转化为UDP-GlcNAc。
UDP-GalNAc的合成:UDP-GlcNAc在差向异构酶(EC 5.1.3.2)的作用下转化为 UDP-GalNAc。
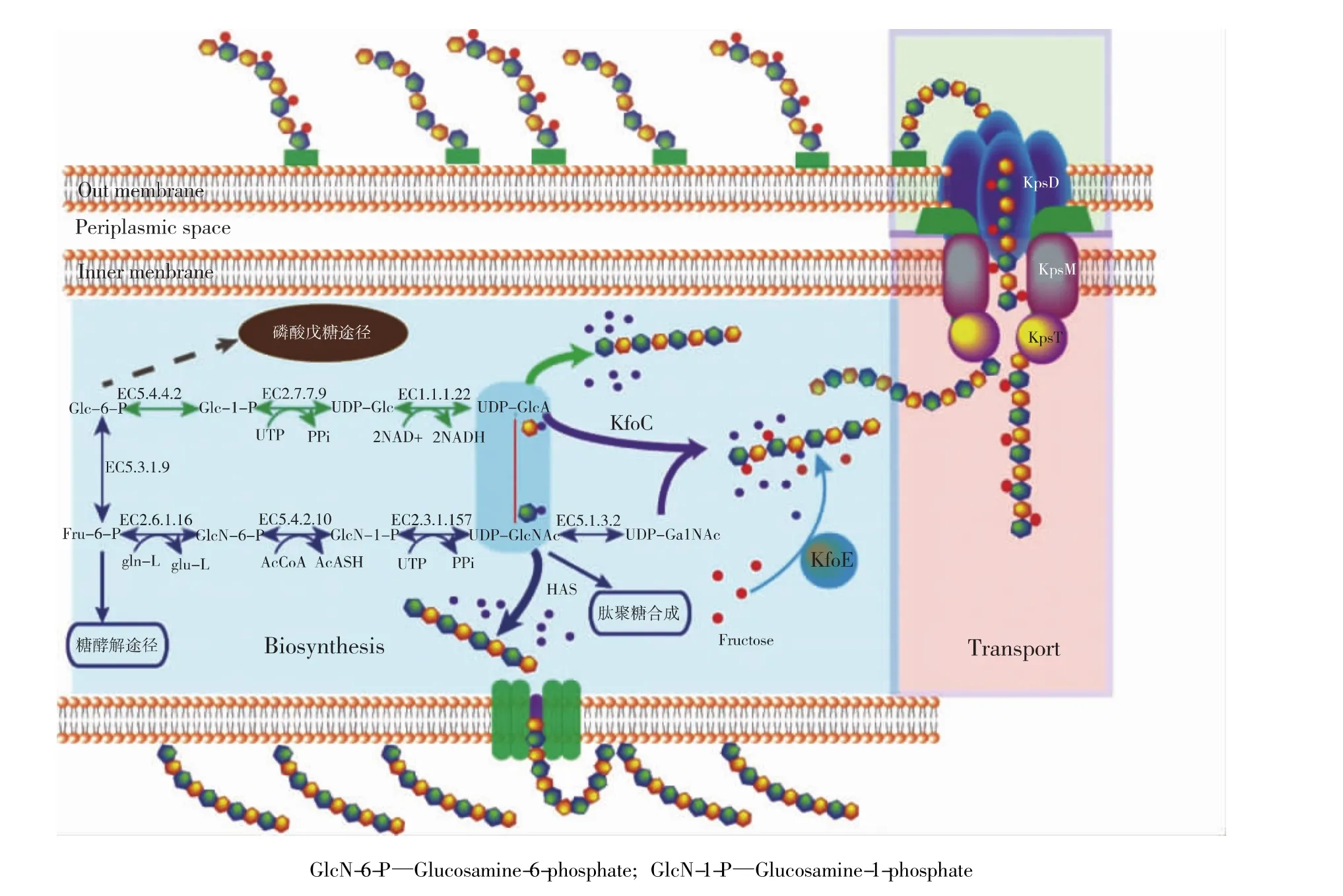
图1 糖胺聚糖的生物合成途径Fig.1 Biosynthesis pathway of glycosaminoglycans
2.2 糖胺聚糖的聚合与延伸
根据大肠杆菌(Escherichia coli)荚膜的基因型、生物合成方式和调控方式的差异将其分为group 1、group 2、group 3 和 group 4 四个类型[21]。硫酸软骨素和肝素的生产菌株 E.coli K4、E.coli K5均属于group 2,涉及荚膜多糖合成和转运的基因成簇分布于染色体上,并且不同的K抗原基因簇有自身保守基因结构,分别为region 1、region 2和region 3三个功能区,如图2所示。其中,region 1和region 3负责荚膜多糖的修饰和跨膜运输,而region 2位于region 1和region 3之间,主要负责荚膜多糖前体的合成和多糖链的聚合延伸,region 2的大小决定了K抗原的复杂程度[22]。
E.coli K4中 region 2总长度为 14 kb,包括kfoA~kfoG 7个基因和1个1.331 kb的转座原件IS2。其中,kfoA、kfoF分别编码前体 UDP-GlcA、UDP-GalNAc的差向异构酶和 UDP-葡萄糖脱氢酶[23];kfoC编码软骨素合成酶,具有双功能糖基转移酶活性,N端和C端分别具有UDP-GlcA和UDPGalNAc的转移酶活性位点,可以交替转移单糖前体至多糖链的非还原末端,从而不断延伸多糖链[24]。
E.coli K5 的 region 2 总长度为 8.0 kb,包括kfiA~kfiD 4个基因,kfiA、kfiB和kfiC基因之间分别有一段插入序列。Northern blotting和转录实验显示region 2具有3个启动子,这些启动子不仅能使各自的基因进行转录,还能使整个region 2进行转录,包括基因之间的插入序列,表明了整个转录过程的复杂性[25]。肝素前体合成的4个基因具有各自的功能,kfiA、kfiD和kfiC分别编码乙酰氨基葡萄糖转移酶、UDP-葡萄糖脱氢酶和糖基转移酶,可催化UDPGlcNAc和UDP-GlcA转化为GlcNAc和GlcA,后二者为合成肝素的重要前体[25];kfiB编码的酶在多糖链的延伸过程中具有蛋白支架的作用,可防止糖链延长的复合酶脱落,从而加强了肝素前体的合成[26]。

图2 荚膜多糖合成基因簇Fig.2 The gene cluster for CPS biosynthesis
2.3 糖胺聚糖的修饰与转运
Group 2荚膜多糖的生物合成大致可以分为4个阶段,分别为多糖修饰基团 CMP-kdo的合成、CMP-kdo转运修饰多糖链、ATP结合盒转运载体(ATP binding cassette)转运多糖至周质空间、多糖链转运至细胞外膜。过程中涉及修饰和转运糖胺聚糖的酶位于功能区region 1和region 3。Region 1负责多糖修饰基团CMP-kdo的合成以及多糖链从周质空间向细胞外膜的转运,region 3通过ATP结合盒转运载体将多糖运出细胞内膜[27]。
在透明质酸的生物合成过程中,hasA、hasB和hasC基因分别编码透明质酸合成酶、UDP-葡萄糖脱氢酶、UDP-葡萄糖焦磷酸化酶,均位于HAS操纵子上[28]。链球菌(Streptococci)(A群)合成透明质酸荚膜与HAS操纵子的表达息息相关。微生物合成透明质酸不是前体在酶简单催化作用下完成的,而是微生物细胞形成一个与原生质膜相关的蛋白复合物来催化透明质酸的合成和运输。在Mg2+存在的条件下,A群链球菌以UDP-GlcA和UDP-GlcNAc为底物从内源透明质酸的非还原端合成透明质酸分子链,合成过程中UDP-GlcNAc和UDP-GlcA交替连接在透明质酸链上,以每分钟约100个糖单位的速度进行[29-30]。
3 糖胺聚糖的生化工程策略
微生物的生产性能是由微生物固有的遗传特性和生存环境共同作用的结果。野生型菌株通过物理、化学方法诱变或者代谢工程方法改造后,已经成为具有发酵潜力的菌种,其潜在的优异生产性能,还需要在人为精心设计的有利于目的产物或所需特性表现的优化环境中才能表现出来。所以糖胺聚糖生化工程的研究是必须进行的重要步骤。优化的环境条件,主要包括营养条件,如培养基组分、特殊的营养物质和诱导剂的种类;培养条件,如温度、酸碱度、溶解氧浓度、培养模式和诱导策略等。
培养基的选择与优化处于营养条件的核心地位。培养基不仅影响微生物生长,为微生物提供碳源、氮源、能源、生长因子、无机盐和水这六类营养要素,其组分还会影响目标产物的产量、产率以及生产强度。此外,培养基的成本会直接影响发酵过程的经济效益和下游产品分离纯化提取的难易程度。Cimini等[31]以野生型E.coli K4为出发菌株进行培养基的优化,首先选择葡萄糖和甘油作为碳源,酪蛋白和大豆蛋白胨作为氮源进行摇瓶实验,最终选择甘油和大豆蛋白胨,使得果糖软骨素产量达到了1.4 g/L,另外,Restaino等[32]通过向培养基中添加特殊营养物质,分别是K4荚膜多糖的前体物质葡萄糖醛酸和氨基半乳糖、果糖,最终果糖软骨素产量分别提高了68%和57%,其原因可能是葡萄糖醛酸和氨基半乳糖作为前体物质被利用,而果糖作为碳源物质增加了UDP-氨基半乳糖路径的碳流。
高浓度的营养物质可能会抑制微生物细胞的生长,但是为了达到高细胞密度,往往又必须向生物反应器中流加经过浓缩的营养物质。其中,补料形式多种多样,可以是最简单的恒速补料,也可以是经过数学模型计算而来的指数补料。E.coli高细胞密度发酵可以提高产品的产量,但是此过程产生的副产物乙酸不仅仅会影响细胞的生长,还会影响产物的合成,因此所采用的补料策略必须符合菌株的生理特性。Restaino等[10]采用三阶段控制策略来实现E.coli K4高密度发酵,从而提高了果糖软骨素的产量,第一阶段采用分批发酵,维持7 h,第二阶段采用恒速补料策略保证甘油质量浓度超过0.3 g/L,维持5 h,第三阶段在发酵过程中启动微滤装置排除低分子量的副产物,维持35 h,使得E.coli K4荚膜多糖(K4 capsular polysaccharide,K4CPS)的产量达到了4.73 g/L,分别是分批发酵和补料分批发酵的16倍和 3.3倍。Derosa等[11]以 EcK4r3为研究对象,采用上述三阶段发酵策略,使得K4CPS的产量达到最高,为 9.2 g/L[11]。Zhang 等[18]以生产肝素前体最优重组菌sABCD为出发菌株,考察了分批培养模式和补料分批培养模式(pH-stat补料、Do-stat补料、恒速补料、拟指数补料)对肝素前体合成的影响,最终在pH-stat补料模式下肝素前体产量达到了2.61 g/L。
温度和pH能够影响微生物体内酶的活性,从而影响细胞内生物化学反应的进行,对糖胺聚糖的合成以及微生物生长都会产生巨大影响。E.coli K4在20℃下几乎不合成荚膜多糖,随着培养温度升高至37℃,荚膜多糖的量呈现线性关系[31]。吴明霞等[33]将兽疫链球菌发酵过程分为两阶段,在36℃的最佳温度下培养28 h后转入38℃培养至发酵结束,透明质酸的产量得到了显著提高。
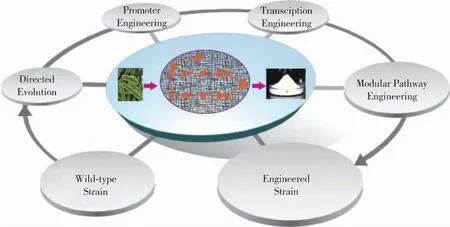
图3 糖胺聚糖生产的代谢工程改造策略Fig.3 Strategies of metabolic engineering are used to produce glycosaminoglycan
4 糖胺聚糖的代谢工程策略
代谢工程技术作为一种成熟的改造策略,能够有效地调控细胞代谢网络,改善细胞性能,在纤维素乙醇生产、氨基酸等发酵行业取得了巨大成功。糖胺聚糖生产过程中代谢工程策略也发挥了不可替代的作用(图3):1)定向进化,作为蛋白质改造的重要手段之一,能够筛选出性能优良的工程菌株;2)启动子工程,调控关键基因的表达以实现路径中碳流平衡;3)转录工程,控制基因的转录水平;4)模块途径工程,对糖胺聚糖合成代谢网络进行全局优化。
4.1 定向进化
定向进化技术作为蛋白质改造的重要手段之一,主要由两个关键步骤组成,一是通过人为引发的随机突变获得突变体库,二是采用有效的高通量筛选技术得到性能优良的突变菌株。该技术已经应用于透明质酸的生产过程并且取得了较好的效果。透明质酸酶(hyaluronidase,HAase)家族可以分为3个大类,是降解透明质酸的酶的总称,透明质酸酶不仅影响透明质酸产量,而且还影响其分子量大小。Jin等[16]选择了对水蛭透明质酸酶基因LHyal的核糖体结合位点进行改造。首先以pSKIZH质粒为模板进行反向全质粒PCR获得了库容为104个克隆的突变体库,然后进行高通量培养,根据平板上透明圈直径的大小来筛选不同表达强度的水蛭透明质酸酶的突变株,筛选得到的最优重组菌株在3-L罐水平下采用补料分批发酵,产量和分子量分别为19.38 g/L和6.62×103。上述案例说明了借助定向进化技术,可以实现基因在翻译水平上的精准调控,从而提高糖胺聚糖的产量。
4.2 启动子工程
糖胺聚糖合成路径复杂而且涉及的基因较多,因此如何平衡基因的表达是提高糖胺聚糖产率与得率的关键。启动子工程广泛用于路径优化,能够调控基因的精细化表达,常用的基因表达调控策略包括:改造启动子强度、核心区域、基因间隔区以及核糖体结合位点等[34-35]。果糖软骨素的生产已经运用了启动子工程策略,为了提高E.coli K4生产果糖软骨素的能力,将合成基因簇pR3启动子3'端非编码区(untranslated region)进行缺失突变,结果表明:当ops(operon polarity suppressor)序列(RfaH蛋白结合位点)存在时,UTR的长度变化与否不影响pR3启动子强度和K4CPS产量;但当ops序列缺失时,UTR的延长,pR3启动子的强度和K4CPS产量均低于对照菌株;反之,UTR的缩短能显著提高pR3启动子的强度,进而使K4CPS产量比原菌增加了46%,达到了751 mg/L[12]。另一个启动子工程应用的实例也与果糖软骨素的合成有关。Cimini等[36]通过采用不同强度的启动子pTrc和T7来过量表达软骨素合成酶基因 kfoC,结果表明,工程菌株BK4061、BK4062、BK4063生产果糖软骨素的能力均高于野生型E.coli K4,最高产量为250 mg/L,较原菌提高了113%。Zhang等[18]利用双启动子共表达质粒pETDeut-1和pRSFDeut-1表达来自E.coli K5的肝素前体合成酶基因簇kfiA、kfiB、kfiC和kfiD,构建了重组质粒 pKfiA、pKfiB、pKfiC、pKfiD、pKfiAC 和pKfiBD,然后将这些质粒转入表达菌株E.coli BL21(DE3)中,成功获得工程菌株 sA、sC、sAC、sABC、sACD和sABCD,经过发酵优化,工程菌株sABCD的产量达到了2.61 g/L,该研究为肝素的工业化生产提供了优良的生产菌株,并且为采用其他类型宿主构建肝素高产工程菌株提供了依据。综上所述,启动子工程策略可以通过调控糖胺聚糖合成路径中基因的表达水平,来实现代谢路径碳流平衡,进而提高糖胺聚糖的产量。
4.3 转录工程
转录因子也称反式作用因子,是一类具有特殊结构、行使调控基因表达功能的DNA结合蛋白。从蛋白结构分析,转录因子一般由DNA结合区、转录调控区(包括激活区或抑制区)、寡聚化位点和核定位信号这四个功能区组成,转录因子可通过这些功能区域与启动子顺式元件作用或与其他转录因子的功能区相互作用来调控基因的转录过程[37]。研究表明,全局转录调控因子slyA和rfaH在果糖软骨素生物合成中起重要的调控作用。吴秋林等[12]分别利用诱导型表达载体pTrcHisA和组成型表达载体pBluscript SK II(+)来过量表达slyA基因,成功构建了工程菌株 E.coli THslyA和 E.coli BLpslyA。诱导型重组菌株E.coli THslyA中的slyA受强启动子pTrc控制表达,slyA经诱导剂IPTG诱导表达后,果糖软骨素合成能力显著增强,在摇瓶和5-L发酵罐水平下分别为1 g/L和 2.64 g/L,较原菌提高了82%和25%;组成型重组菌株 E.coli BLpslyA中的slyA基因由自身启动子p10、p13和p14控制表达,菌体生长受到严重抑制,甘油消耗速率降低,果糖软骨素的产量较原菌降低了 31%,为 0.37 g/L。RfaH是荚膜合成的决定性因子,在转录过程中与kpsM 5’端的非翻译区的ops序列结合,与RNA聚合酶复合物相互作用调节region 2功能区的转录,ops序列和rfaH基因的缺失均导致荚膜合成缺陷[38-39]。Cimini等[40]分别通过利用质粒和表达盒在 E.coli K4中过量表达 rfaH基因,构建了菌株E.coli K4-pTrcrfaH和EcK4r3重组菌株,发酵结果与野生型E.coli K4相比,果糖软骨素产量提高了40%~140%,最高产量达到了5.3 g/L。上述案例均说明了转录因子通过参与基因的表达调控,从而提高工程菌株生产糖胺聚糖的能力。
4.4 模块途径工程
传统代谢工程通常是找出代谢节点,然后选择合适的代谢改造方法例如基因敲除、过表达限速步骤基因、解除调控等来改变代谢流的分布,但是这些手段在解决代谢瓶颈的时候往往会给代谢路径引入新的瓶颈。因此代谢路径之间需要更优的策略进行平衡,模块途径工程可以将代谢路径分为不同模块,然后构建不同强度的模块、组装,最后对不同模块进行表达优化,进而得到最优工程菌株。GlcNAc作为糖胺聚糖的前体物质之一,它的多少与糖胺聚糖的产量息息相关。Liu等[41]利用模块途径工程策略生产GlcNAc可为糖胺聚糖的生产提供方向。通过将枯草芽孢杆菌(Bacillus subtilis)168胞内代谢路径分为GlcNAc合成模块、糖酵解模块和肽聚糖合成模块:1)首先,通过双启动子策略优化GlcNAc合成路径中 GlcN-1-P-变位酶(GlmS)和GlcN-6-P-乙酰化酶(Gnal)的表达,敲除编码副产物乳酸和乙酸的基因ldh和pta,得到最佳GlcNAc合成模块;2)通过过表达不同sRNA和Hfq蛋白的组合,调控磷酸果糖激酶(Pfk)和 GlcN-1-P-变位酶(GlmM)表达,得到不同活性的糖酵解模块和肽聚糖合成模块;3)对3个模块进行组装。通过筛选,当GlcNAc合成模块、糖酵解模块和肽聚糖合成模块表达水平分别为高、低、低时,重组菌株单位细胞生产生产GlcNAc能力最强,达到了2.00 g/g,是对照菌株的4.3倍。利用 E.coli BL21 StarTM(DE3)异源表达生产软骨素这一案例也运用了模块路径工程策略。基因kfoA、kfoF和kfoC编码的酶直接影响UDP-GlcA合成模块、UDP-GalNAc合成模块、软骨素聚合模块,He等[13]首次将这3个基因以不同的顺序组合到仿操纵子体系中,并对3个基因的表达强度进行了优化,结果显示,当kfoA、kfoC和kfoF的表达强度分别为高、中、低时,采用补料分批培养模式,最优工程菌株软骨素产量达到了2.4 g/L,与野生型E.coli K4生产水平相当。综上两个实例表明,利用模块途径工程策略,能够有效地平衡代谢路径上碳流的分布,解决代谢路径瓶颈,从而使糖胺聚糖产量达到最大化。
5 结语与展望
近年来,国内外研究人员已经将生化工程和代谢工程策略应用到糖胺聚糖的生产过程中,并且取得了不错的成绩。特别是利用代谢工程策略构建的生产菌株,分别包括:定向进化技术、启动子工程、转录工程和模块途径工程等,为糖胺聚糖工业化生产奠定了坚实基础。然而,由于微生物自身代谢的经济学本能、工业环境与自然环境的巨大差异造成了糖胺聚糖产量、产率和生产强度低。因此,如何协调代谢工程新策略和生化工程手段来获得高性能的生产菌株并且实现糖胺聚糖的高效生产是未来的研究热点和重点,包括:1)糖胺聚糖的合成与细胞生长所需的代谢途径相互竞争,可以通过开关工程来实现产物合成与细胞生长相分离,从而提高糖胺聚糖的得率;2)糖胺聚糖代谢网络比较简单,但是相关代谢十分复杂,涉及的基因较多,可采用模块路径工程策略优化糖胺聚糖合成与转运路径上基因的表达;3)重组质粒的不稳定性以及对宿主菌的代谢负担,可利用定向进化技术对基因组进行改造,实现糖胺聚糖合成途径关键酶的整合表达;4)研究高密度培养细胞与高强度产物合成的两阶段发酵策略,实现糖胺聚糖发酵法生产的高产量、高产率和高生产强度的统一,为工业化生产奠定基础。
[1] BOECKEL C A A V,PETITOU M.The unique antithrombin III binding domain of heparin:a lead to new synthetic antithrombotics[J].Angew Chem Int Ed,2010,32(12):1671-1690.
[2] LEBEAU B,CHASTANG C,BRECHOT J M,et al.Subcutaneous heparin treatment increases survival in small cell lung cancer[J].Cancer,1994,74(1):38-45.
[3] 郭学平,刘爱华,凌沛学.透明质酸在化妆品、健康食品和软组织填充剂中的应用[J].食品与药品,2005,7(1):20-23.
[4] 凌沛学,贺艳丽,张青.透明质酸对骨关节炎的治疗作用[J].食品与药品,2005,7(1):1-3.
[5] LAURENCIN C T,NAIR L.The FDA and safety-beyond the heparin crisis[J].Nat Biotechnol,2008,26(6):621-623.
[6] PETITOU M,VAN B C A.A synthetic antithrombin III binding pentasaccharide is now a drug!What comes next? [J].Angew Chem Int Ed,2004,43(24):3118-3133.
[7] 凌沛学.玻璃酸研究与应用[M].北京:人民卫生出版社,2010:1-6.
[8] LIU L M,WU Q L,LIU J,et al.Screening method for producing chondroitin sulfate bacterial strain and application of bacterial strain fermentation method in production of chondroitin sulfate:102220270A[P].2011-10-19.
[9] CIMINI D,RESTAINO O F,CATAPANO A,et al.Production of capsular polysaccharide from Escherichia coli K4 for biotechnological applications[J].Appl Microbiol Biotechnol,2010,85(6):1779-1787.
[10] RESTAINO O F,CIMINI D,DEROSA M,et al.High cell density cultivation of Escherichia coli K4 in a microfiltration bioreactor:a step towards improvement of chondroitin precursor production[J].Microb Cell Fact,2011,10(1):1-10.
[11] DEROSA M,SCHIRALDIC,CIMINID.Biotechnological production of chondroitin:WO,2010136435A1[P].2009-05-25.
[12] 吴秋林,刘佳,杨爱华,等.启动子工程改造大肠杆菌K4生产果糖软骨素[J].生物加工过程,2014,12(3):19-25.
[13] HE W Q,FU L,LI G,et al.Production of chondroitin in metabolically engineered E.coli[J].Metab Eng,2015,27:92-100.
[14] LIU L,DU G C,CHEN J,et al.Comparative study on the influence of dissolved oxygen control approaches on the microbial hyaluronic acid production of Streptococcus zooepidemicus[J].Bioproc Biosyst Eng,2009,32(6):755-763.
[15] CHENG F,GONG Q Y,YU H M,et al.High-titer biosynthesis of hyaluronic acid by recombinant Corynebacterium glutamicum[J].Biotech J,2016,11(4):574-584.
[16] JIN P,KANG Z,YUAN P H,et al.Production of specificmolecular-weight hyaluronan by metabolically engineered Bacillus subtilis 168[J].Metab Eng,2016,35:21-30.
[17] MAO Z C,SHIN H D,CHEN R.A recombinant E.coli bioprocess for hyaluronan synthesis[J].Appl Microbiol Biotechnol,2009,84(1):63-69.
[18] ZHANG C Y,LIU L,TENG L P,et al.Metabolic engineering of Escherichia coli BL21 for biosynthesis of heparosan,a bioengineered heparin precursor[J].Metab Eng,2012,14(5):521-527.
[19] LIU Y F,LIU L,CHEN J,et al.Effects of carbon sources and feeding strategies on heparosan production by Escherichia coli K5[J].Bioproc Biosyst Eng,2012,35(7):1209-1218.
[20] 张琳培,王浩,周正雄,等.途径优化强化枯草芽孢杆菌合成肝素前体[J].生物工程学报,2017,33(6):936-945.
[21] WHITFIELD C,ROBERTS I S.Structure,assembly and regulation of expression of capsules in Escherichia coli[J].Mol Microbiol,1999,31(5):1307-1319.
[22] WILLIS L M,WHITFIELD C.Structure,biosynthesis,and function ofbacterialcapsular polysaccharides synthesized by ABC transporter-dependent pathways[J].Carbohydr Res,2013,378(2):35-44.
[23] LIDHOLT K,FJELSTAD M.Biosynthesis of the Escherichia coli K4 capsule polysaccharide[J].J Biol Chem,1997,272(5):2682-2687.
[24] SOBHANY M,KAKUTA Y,SUGIURA N,et al.The chondroitin polymerase K4CP and the molecular mechanism of selective bindings of donor substrates to two active sites[J].J Biol Chem,2008,283(47):32328-32333.
[25] PETIT C,RIGG G P,PAZZANI C,et al.Region 2 of the Escherichia coli K5 capsule gene cluster encoding proteins for the biosynthesis of the K5 polysaccharide[J].Mol Microbiol,1995,17(4):611-620.
[26] SILVER R P,PRIOR K,NSAHLAI C,et al.ABC transporters and the export of capsular polysaccharides from gram-negative bacteria[J].Res Microbiol,2001,152(3/4):357-364.
[27] WHITFIELD C.Biosynthesis and assembly of capsular polysaccharides in Escherichia coli[J].Annu Rev Biochem,2006,75(75):39-68.
[28] CRATER D L,RIJN I V D.Hyaluronic acid synthesis operon(has)expression in group a Streptococci[J].J Biol Chem,1995,270(31):18452-18458.
[29] NG K F,SCHWARTZ N B.Solubilization and partial purification of hyaluronate synthetase from oligodendroglioma cells[J].J Biol Chem,1989,264(20):11776-11783.
[30] SUGAHARA K,SCHWARTZ N B,Dorfman A.Biosynthesis of hyaluronic acid by Streptococcus[J].J Biol Chem,1979,254(14):6252-6261.
[31] CIMINI D,RESTAINO O F,CATPANO A,et al.Production of capsular polysaccharide from Escherichia coli K4 for biotechnological applications[J].Appl Microbiol Biotechnol,2010,85(6):1779-1787.
[32] RESTAINO O F,LAURO I D.Monosaccharide precursors for boosting chondroitin-like capsular polysaccharide production[J].Appl Microbiol Biotechnol,2013,97(4):1699-1709.
[33] 吴明霞,邓静,吴华昌.温度对发酵生产透明质酸的影响[J].氨基酸和生物资源,2010,32(1):1-4.
[34] SALIS H M,MIRSKY E A,VOIGT C A.Automated design of synthetic ribosome binding sites to precisely control protein expression[J].Nat Biotechnol,2009,27(10):946-950.
[35] PFLEGER B F,PITERA D J,SMOLKE C D,et al.Combinatorial engineering of intergenic regions in operons tunes expression of multiple genes[J].Nat Biotechnol,2006,24(8):1027-1032.
[36] CIMINI D,RESTAINO M,VIGGIANIA,etal.Improved fructosylated chondroitin production by kfoC overexpression in E.coli K4[J].J Biotechnol,2010,150(3):324-331.
[37] GUO G Y,BAI F,LIU W,et al.Advances in research of the regulation of transcription factors of lignin biosynthesis[J].Sci Agric Sin,2015,48(7):1277-1287.
[38] STEVENS M P,CLARKE B R,ROBERTS I S.Regulation of the Escherichia coliK5 capsule gene clusterby transcription antitermination[J].Mol Microbiol,1997,24(5):1001-1012.
[39] SIMPSOND A,HAMMARTON TC,ROBERTSIS.Transcriptional organization and regulation of expression of region 1 of the Escherichia coli K5 capsule gene cluster[J].J Bacteriol,1996,178(22):6466-6474.
[40] CIMINI D,RESTAINO M,CARLINO E,et al.Homologous overexpression of rfaH in E.coli K4 improves the production of chondroitin-like capsular polysaccharide[J].Microb Cell Fact,2013,12(1):46-58.
[41] LIU Y F,ZHU Y Q,CHEN J,et al.Modular pathway engineering of Bacillus subtilis for improved N-acetylglucosamine production[J].Metab Eng,2014,23(5):42-52.
(责任编辑 管珺)
Recent advances in microbial production of glycosaminoglycans
ZHANG Quan1,2,3,CHEN Xiulai1,2,3,LIU Jia1,2,3,LUO Qiuling1,2,3,LIU Liming1,2,3(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;
2.Key Laboratory of Industrial Biotechnology of the Ministry of Education,Jiangnan University,Wuxi 214122,China;3.Laboratory of Food Microbial-Manufacturing Engineering,Jiangnan University,Wuxi 214122,China)
Glycosaminoglycans is a class of linear chain acidic polysaccharide with many physiological functions,and widely applied in the industries of cosmetics,health products and pharmaceuticals.Based on the demand of eco-friendly process,production safety and sustainable development,microbial production of glycosaminoglycans has been paid more and more attention.In this article,we reviewed the biosynthetic pathway of glycosaminoglycans.Then,we discussed the detailed strategies to improve the production of glycosaminoglycans through biochemical engineering and metabolic engineering.Finally,we predicted future directions for further improving glycosaminoglycans production.
glycosaminoglycans;metabolic pathway;biochemical engineering;metabolic engineering
TQ929;Q78
A
1672-3678(2017)05-0040-08
10.3969/j.issn.1672-3678.2017.05.005
2017-06-07
国家自然科学基金(21676118);江南大学自主科研计划重点项目(JUSRP51611A)
张 权(1991—),男,安徽安庆人,研究方向:代谢工程;刘立明(联系人),教授,E-mail:mingll@jiangnan.edu.cn

