代谢工程改造微生物生产芳香族化合物的研究进展
吴凤礼,彭彦峰,徐毅诚,曹 鹏,陈五九,王钦宏
(中国科学院 天津工业生物技术研究所 中国科学院系统微生物工程重点实验室,天津 300308)
代谢工程改造微生物生产芳香族化合物的研究进展
吴凤礼,彭彦峰,徐毅诚,曹 鹏,陈五九,王钦宏
(中国科学院 天津工业生物技术研究所 中国科学院系统微生物工程重点实验室,天津 300308)
芳香族化合物广泛应用于化学工业。利用代谢工程改造微生物生产各种芳香族化合物越来越受到人们的关注。通过理性改造,微生物可以定向地大量积累人们需要的各种芳香族化合物。此外,通过设计新的反应途径并引入外源基因,可以拓宽微生物生物合成的产物谱,获得某些具有重要应用价值的新的芳香族化合物。这些研究成果对解决化石能源危机和环境可持续发展问题具有积极意义。本文中,笔者主要对近年来微生物生产各种芳香族化合物的最新研究进展及相应的代谢工程改造策略进行综述,为开展相关研究提供参考。
合成生物学;代谢工程;莽草酸途径;芳香族化合物;微生物发酵
芳香族化合物(aromatic chemicals)广泛用于医药、化工、食品和饲料等领域,其主要来自化石能源产物“三苯”的衍生转化。近年来,随着化石能源储量的减少、人类生存环境的逐渐恶化和人们环境保护意识的增强,使得利用生物合成技术,构建绿色高效的细胞工厂生产目标芳香族化合物的替代合成途径逐渐成为合成生物学研究的热点和前沿。改良的微生物细胞工厂利用葡萄糖、甘油等可再生生物质资源,在合适的营养、温度、pH和溶氧等发酵培养条件下,大量积累目标芳香族化合物,然后通过分离纯化获得目的产物。
莽草酸途径(shikimate pathway)是生物体合成芳香族化合物的基础,是一种广泛存在于植物、藻类、真菌和细菌等生命体中的生物合成途径[1]。但是,芳香族化合物在生物体中的含量较低,难以满足生产需求。通过代谢工程手段,对微生物中心代谢途径和莽草酸途径进行优化,同时导入外源所需生化反应酶的编码基因,使微生物具有更强的积累芳香族化合物的能力。近些年来,通过微生物代谢工程方法生产芳香族化合物的研究取得了较大进展,获得了一系列积累各种芳香族化合物的基因工程菌[1-3],这些研究为今后的工业化生产应用奠定了良好的工作基础。本文中,笔者主要对近年来微生物生产各种芳香族化合物的最新研究进展及相应的代谢工程改造策略进行综述,以期为开展工业菌种的优化改造研究提供参考。
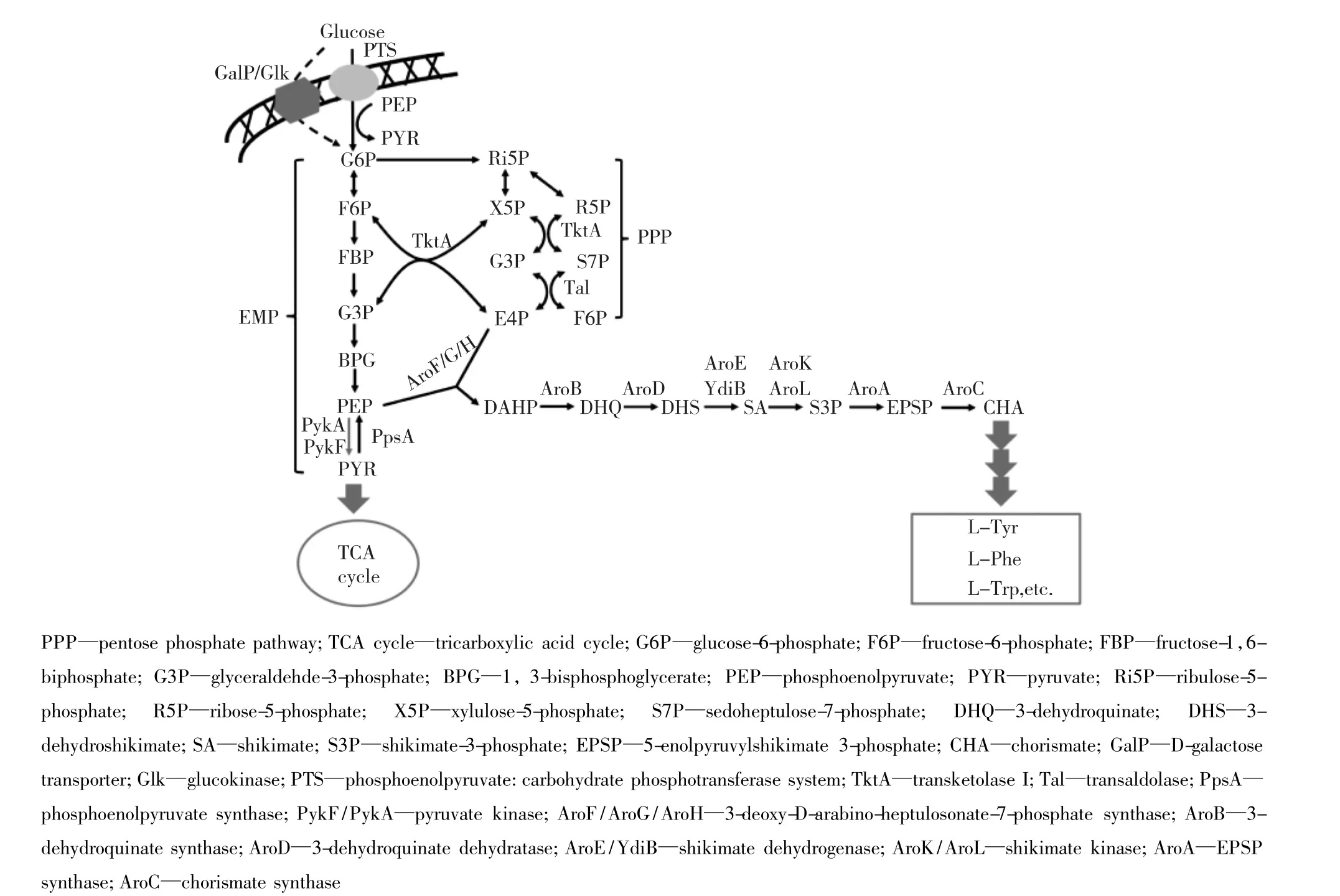
图1 莽草酸途径代谢流程Fig.1 Schematic diagram of shikimate pathway
1 莽草酸途径
莽草酸途径由7个酶催化反应步骤组成(图1),将糖酵解途径(glycolytic pathway或EMP)产生的磷酸烯醇式丙酮酸(PEP)和磷酸戊糖途径(pentose phosphate pathway)产生的赤藓糖-4-磷酸(E4P)缩合生成 3-脱氧-D-阿拉伯庚酮糖-7-磷酸(DAHP),DAHP再经过6步催化反应生成分支酸(chorismate)[1]。在分支酸之后,反应分为两条途径,一条途径转化为L-苯丙氨酸(L-Phe)或L-酪氨酸(L-Tyr),另一条生成 L-色氨酸(L-Trp)[4-5]。莽草酸途径的重要功能是为微生物细胞内芳香族氨基酸的生物合成提供必需的前体物质。莽草酸途径中间产物(如,3-脱氢莽草酸和分支酸等)以及L-苯丙氨酸、L-酪氨酸和L-色氨酸在相关酶的作用下可以进一步衍生为其他芳香族化合物[3-4,6]。
莽草酸途径是微生物合成芳香族化合物的主要途径。因此,构建高产莽草酸途径中间代谢产物的工程菌株可以为芳香族化合物的生物合成提供良好的底盘细胞。Li等[7]以缺失aroE的大肠杆菌(Escherichia coli)AB2834菌株作为出发菌株,通过紫外诱变获得 aroFFBR突变体(FBR:feedbackinhibition resistant),解除了DAHP合成酶的酪氨酸反馈抑制;在染色体serA位点插入aroB,加快DAHP向DHQ的转变速率;通过质粒同时引入aroFFBR、serA和tktA这3个基因,最终菌株以葡萄糖为碳源进行分批补料发酵48 h,在上清液中积累69 g/L的3-脱氢莽草酸。笔者所在课题组正通过对E.coli进行染色体改造的方式,在染色体上过表达aroFFBR、tktA,弱化 aroE、pykA、pykA 和 pgi,敲除 tyrR,用GalP/Glk葡萄糖转运系统替换葡萄糖转移酶转运(PTS)系统,最终菌株不含任何质粒且遗传特性稳定,利用葡萄糖进行分批补料发酵52 h积累94.4 g/L的3-脱氢莽草酸(数据未发表)。Kogure等[8]以谷氨酸棒状杆菌(Corynebacterium glutamicum)ACX-araE菌株作为出发菌株,通过敲除莽草酸激酶基因aroK,葡萄糖转运系统基因pts和代谢副产物编码基因qsuB、qsuD、hdpA和ldhA,在染色体上过表达非PTS葡萄糖转运系统相关基因iolT1、glk和ppgk以及前体物质合成基因tkt、tal和gapA,通过质粒过表达莽草酸途径基因 aroGFBR、aroB、aroD和aroE,最终获得莽草酸高产菌株,该菌株利用葡萄糖进行分批补料发酵48 h积累141 g/L的莽草酸。在上述底盘细胞的基础上,通过进一步的代谢工程改造,可以快捷地获得高产目标芳香族化合物的微生物细胞工厂。
2 莽草酸途径芳香族化合物的生物合成
3-脱氢莽草酸和分支酸是莽草酸途径中的重要代谢产物。这两种物质可以直接在相关生物酶的催化作用下生成相应的芳香族化合物(图2,表1),从而避开过长的芳香族氨基酸合成途径。
2.1 3-脱氢莽草酸衍生物
3-脱氢莽草酸在3-脱氢莽草酸脱水酶(AroZ)作用下转化为原儿茶酸(protocatechuic acid),原儿茶酸在原儿茶酸脱羧酶(AroY)作用下生成儿茶酚(catechol),儿茶酚在儿茶酚1,2-双氧化酶(CatA)作用下生成顺,顺-粘康酸(cis,cis-muconic acid)(图2),顺,顺-粘康酸是合成高值化学品——己二酸的前体物质。Niu等[9]在E.coli染色体上整合2个拷贝的aroZ,并通过质粒过表达aroY、catA和aroFFBR,最终菌株WN1/pWN2.248以葡萄糖为碳源通过分批补料发酵48 h产生36.8 g/L顺,顺-粘康酸,摩尔转化率达到22%。Curran等[10]将带有密码子优化过的aroZ、aroY和catA 3个基因的质粒转入酿酒酵母(Saccharomyces cerevisiae),同时敲除aro3和zwf1,过表达aro4K229I和tkl,最终菌株仅仅产生141 mg/L的顺,顺-粘康酸,产量远远低于E.coli工程菌。
3-脱氢莽草酸可以通过两条途径转化为没食子酸(gallic acid),一条途径通过莽草酸脱氢酶(SDH,AroE的同工酶)作用生成没食子酸,另一条通过3-脱氢莽草酸脱水酶作用生成原儿茶酸,然后在对-羟基苯甲酸羟化酶突变体(pobAY385F)催化作用下生成没食子酸(图 2)[11-12]。Kambourakis 等[11]在 E.coli KL7菌株中以质粒的形式过表达 pobAY385F和aroFFBR,获得 E.coli KL7/pSK6.161 菌株,该菌株在葡萄糖和氮源丰富的培养基中通过分批补料发酵48 h产生20 g/L没食子酸。在微生物细胞内,莽草酸脱氢酶更倾向于催化3-脱氢莽草酸生成莽草酸的反应;体外检测该酶的酶活力较低,并且只在弱碱性条件下才有利于合成没食子酸[13]。
2.2 分支酸衍生物
莽草酸途径的代谢终产物分支酸可以在不同生物酶的催化作用下衍生为相应的芳香族化合物,如对氨基苯甲酸(para-aminobenzoate)、对羟基苯甲酸(para-hydroxybenzoic acid)、儿茶酚和水杨酸(salicylic acid)等等。分支酸先后在氨基脱氧分支酸合酶复合体(PabAB)和氨基脱氧分支酸裂解酶(PabC)作用下生成对氨基苯甲酸(图2)。Kubota等[14]在 C.glutamicum 染色体上过表达 E.coli莽草酸途径的6个aro基因和aroGFBR,敲除ldhA,通过质粒过表达pabAB和pabC,最终菌株ABA239以葡萄糖为碳源进行分批补料发酵48 h产生43 g/L的对氨基苯甲酸,转化率达到 20%。Averesch等[15]在S.cerevisiae中采用相似的改造策略,通过质粒过表达葡萄酒酵母的氨基脱氧分支酸合酶基因ABZ1和氨基脱氧分支酸裂解酶基因ABZ2,最终菌株在甘油-乙醇混合碳源条件下进行分批补料发酵105 h积累215 mg/L的对氨基苯甲酸,碳源转化率为2.64%。此外,Satoh等[16]通过功能互补的方式发现在阻断分支酸合成的E.coli△pabABC△aroB菌株中表达Nitrosomonas europaea中的NE1434基因或Chlamydia trachomatis的CT610基因,仍然能够生成对氨基苯甲酸,表明这两个基因编码的酶的作用底物不是分支酸,但是作者并未找到该酶的作用底物。
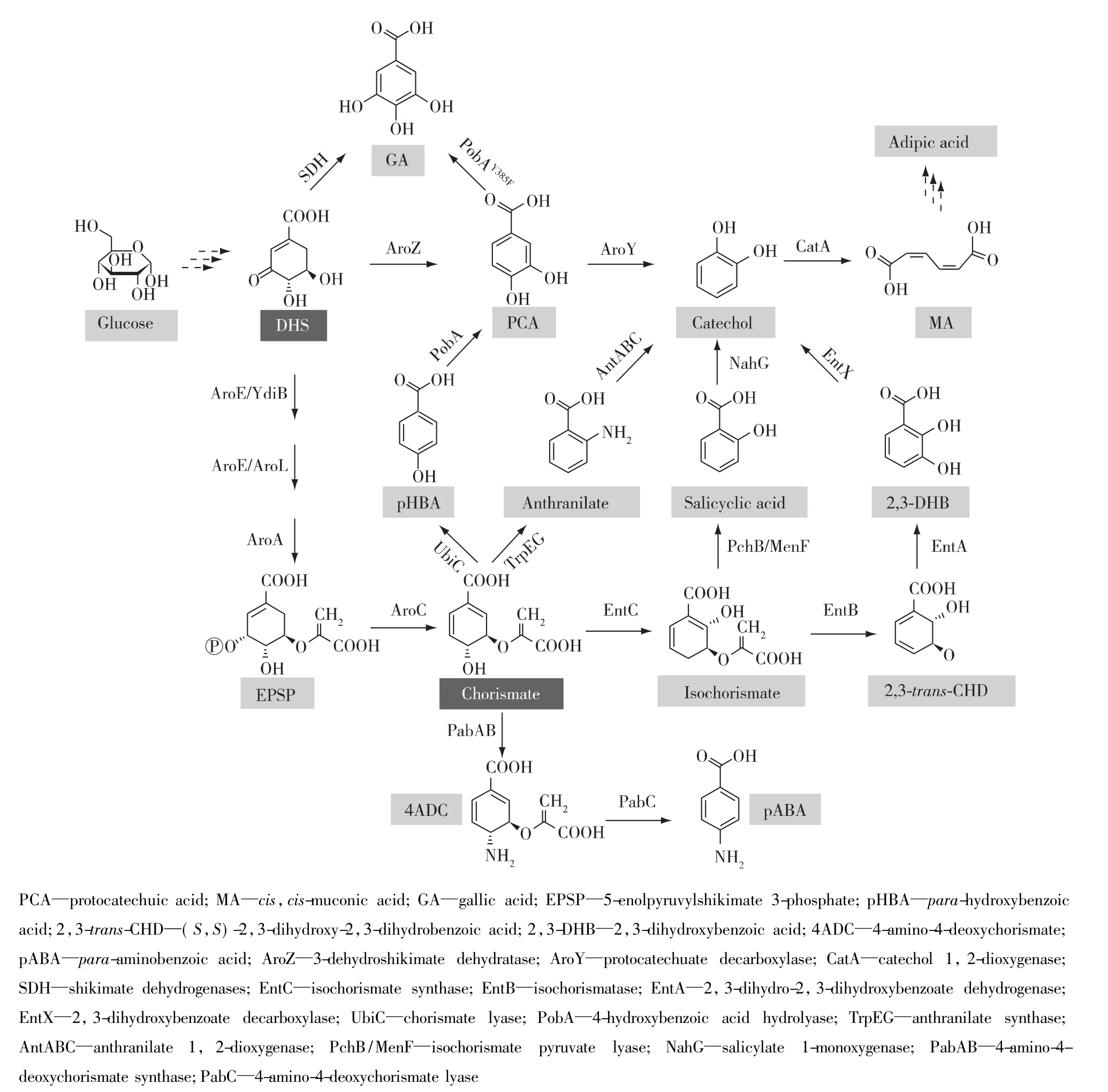
图2 3-脱氢莽草酸和分支酸芳香族衍生物的生物合成途径Fig.2 Biosynthetic pathways of 3-dehydroshikimate and chorismate derivatives
分支酸在分支酸裂解酶(UbiC)作用下生成对羟基苯甲酸(图2)。Barker等[17]在过表达莽草酸途径相关基因的E.coli中,通过质粒过表达ubiC,目标菌株以葡萄糖为碳源通过分批补料发酵72 h产生12 g/L的对羟基苯甲酸,摩尔转化率达到13%。Yu等[18]将含有 ubiC和aroGD146N的表达载体转入Pseudomonas putida KT2440,同时敲除 pobA、pheA、trpE和hexR,通过分批补料发酵,对羟基苯甲酸的最高产量达到1.73 g/L。在S.cerevisiae中通过质粒过表达ubiC,通过分批补料发酵,对羟基苯甲酸产量达到 2.9 g/L[19]。
据报道,由分支酸生成儿茶酚有4条合成途径,而儿茶酚是合成顺,顺-粘康酸的底物(图2)。下面列举了由4条不同的途径均实现了由分支酸到儿茶酚生物合成。1)Sengupta等[20]在E.coli中通过质粒过表达外源的顺,顺-粘康酸合成基因pobA、aroY和catA,通过另一个载体过表达内源的ubiC、aroFFBR、aroE 和 aroL,同时敲除 ptsH、ptsI、crr和 pykF,最终菌株通过摇瓶发酵72 h产生170 mg/L的顺,顺-粘康酸。2)Noda 等[2]在 高 产 L-苯 丙 氨 酸 的 E.coli ATCC31882菌株中通过质粒过表达外源的menF,用Galp/Glk系统替换本身的PTS系统,敲除竞争性途径基因pheA和tyrA,获得CF51菌株通过分批补料发酵48 h产生11.5 g/L的水杨酸;然后在CF51菌株中通过质粒过表达nahG和catA,最终菌株CFT511通过摇瓶发酵96 h产生约3.1 g/L的顺,顺-粘康酸。3)Wang等[21]在E.coli中通过质粒过表达外源的entC、entA、entB、entX和catA,并对莽草酸途径基因进行改造,最终菌株通过摇瓶发酵48 h产生约605.18 mg/L的顺,顺-粘康酸。4)Balderas-Hernandez等[22]在高产邻氨基苯甲酸的E.coli中通过质粒过量表达邻氨基苯甲酸1,2-双加氧酶复合体基因antABC、aroGFBR和tktA,最终菌株以葡萄糖为碳源进行分批补料发酵72 h产生4.47 g/L儿茶酚。这些研究表明微生物可以利用莽草酸途径的代谢产物直接合成芳香族化合物,避开后续的氨基酸合成途径过长的催化反应步骤,从而提高生物质转化效率。
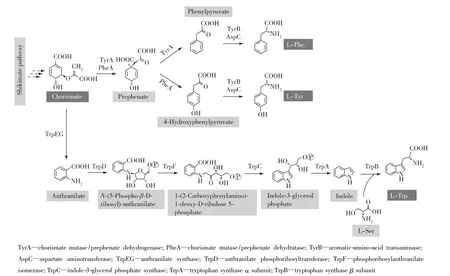
图3 芳香族氨基酸生物合成途径Fig.3 Biosynthetic pathways of aromatic amino acids
3 苯丙氨酸及其衍生物的生物合成
分支酸在分支酸变位酶作用下生成预苯酸,预苯酸经预苯酸脱水酶催化生成苯丙酮酸,苯丙酮酸经氨基酸转氨酶催化得到L-苯丙氨酸(图3)。L-苯丙氨酸是人体必需氨基酸之一,作为重要的原材料被广泛应用于医药、食品、化工等领域。L-苯丙氨酸和其前体物质苯丙酮酸在不同生物酶的作用下可以生成多种芳香族衍生物(图4,表1)。因此,构建高产L-苯丙氨酸的底盘细胞是生产苯丙氨酸衍生物需要解决的首要问题。
3.1 苯丙氨酸的生物合成
微生物发酵法逐渐成为L-苯丙氨酸的主流生产工艺,而微生物发酵法离不开高效的细胞工厂。构建L-苯丙氨酸高产菌株需要提高中心代谢途径碳流量,消除代谢产物抑制和代谢副产物积累。Zhou等[23]在对 β-2-噻吩丙氨酸具有抗性的 E.coli K12菌株中通过质粒过表达 pheAFBR和aroF,获得WSH-Z06(pAP-B03)菌株,该菌株通过分批补料发酵葡萄糖产生35.38 g/L L-苯丙氨酸。噬菌体污染是微生物发酵过程中遇到的非常棘手的问题。Zhou等[24]对 E.coli WSH-Z06(pAP-B03)菌株进行亚硝基胍(NTG)诱变,获得对噬菌体BP-1具有显著抗性的菌株BR-42,并对分批补料发酵条件进行优化,最终菌株L-苯丙氨酸的产量达57.63 g/L。高产L-苯丙氨酸菌株可以作为构建L-苯丙氨酸衍生物基因工程菌的底盘细胞。
3.2 苯丙氨酸衍生物的生物合成
苯丙酮酸和L-苯丙氨酸可以衍生为多种芳香族化合物,例如肉桂酸(cinnamic acid)、肉桂醛(cinnamaldehyde)、肉桂醇(cinnamyl alcohol)、苯乙烯(styrene)、苯乳酸(phenyllactic acid)、苯乙醇(2-phenylethanol)、苯乙酸(2-phenylacetic acid)、扁桃酸(mandelate)、D/L-苯甘氨酸(D/L-phenylglycine)和D-苯丙氨酸(D-phenylalanine)等(图 4,表 1),这些芳香族化合物具有重要的应用价值。
L-苯丙氨酸在苯丙氨酸解氨酶(PAL)作用下生成肉桂酸,肉桂酸可进一步转化为肉桂醛、肉桂醇和苯乙烯(图4)。肉桂酸、肉桂醇和肉桂醛广泛应用于食品、香料及有机合成等领域。Bang等[25]在构建的 L-苯丙氨酸高产 E.coli菌株中转入含有SmPAL、ScCCL和AtCCR这3个外源基因的高拷贝质粒,工程菌YHP05(pHB-CA&pYHP)菌株通过摇瓶发酵积累287 mg/L肉桂酸,YHP05(pHB-CAD& pYHP)菌株积累75 mg/L肉桂醛。Gottardi等[26]在 S.cerevisiae中表达 AtPal2、acar和 entD 3个外源基因,利用自身的醇脱氢酶,能够将外源添加的肉桂酸转化为肉桂醇,也可以从头合成并积累27.8 mg/L肉桂醇。

图4 L-苯丙氨酸衍生物的生物合成途径Fig.4 Biosynthetic pathways of L-phenylalanine derivatives
苯乙烯是合成树脂、塑料等高分子聚合物材料的重要单体,但是苯乙烯对微生物细胞有很强的毒性[27],所以微生物合成苯乙烯的产量较低。McKenna 等[27]在 L-苯丙氨酸高产 E.coli菌株中过表达拟南芥(Arabidopsis thaliana)的L-苯丙氨酸氨解酶基因PAL2和来自于S.cerevisiae的阿魏酸脱羧酶基因FDC1,最终菌株通过摇瓶发酵产量达到260 mg/L,接近对苯乙烯的耐受性极限。该研究组采用相同的合成途径在S.cerevisiae中同样实现了苯乙烯的从头合成,但是苯乙烯产量只有29 mg/L[28]。
苯乳酸可以抑制食品腐败菌和人类的某些致病菌,有望成为一种新型的防腐剂和药物制剂。苯丙酮酸在乳酸脱氢酶(LdhA)作用下生成苯乳酸(图4)。Koma等[29]将两个拷贝的乳酸脱氢酶基因ldhA整合到L-苯丙氨酸高产E.coli菌株的染色体上获得PAR-58菌株,该菌株以葡萄糖为碳源,在摇瓶发酵条件下积累6 mmol/L(约1 g/L)苯乳酸。
苯乙醇具有特殊的玫瑰花香,广泛应用于食品和化妆品;苯乙酸是医药、农药、香料等有机合成的中间体。苯丙酮酸在苯丙酮酸脱羧酶作用下生成苯乙醛,苯乙醛分别在醛还原酶和苯乙醛脱氢酶作用下转化为苯乙醇和苯乙酸(图4)。Koma等在苯丙氨酸高产E.coli菌株的染色体上过表达ipdC和yahK,敲除feaB获得PAR-84菌株,该菌株在摇瓶发酵条件下积累 7.7 mmol/L(约 0.94 g/L)苯乙醇。该研究组采用类似的方式过表达ipdC和feaB,同时敲除tyrA,PAR-100工程菌株积累 8.8 mmol/L(约1.2 g/L)苯乙酸。Chen 等[30]在 S.cerevisiae中通过质粒分别过表达氨基酸透性酶基因GAP1和调控GAP1表达的转录因子基因GLN3和GAT1以及共表达GLN3/GAT1或GLN3/GAP1,均能明显提高苯乙醇产量,其中GLN3过表达菌株效果最明显,摇瓶发酵苯乙醇产量达到 3.59 g/L。Etschmann 等[31]利用马克思克鲁维酵母(Kluyveromyces marxianus)CBS600菌株,通过分批补料发酵的方式,以聚丙二醇作为细胞原位发酵提取剂和前体物质积累26.5 g/L苯乙醇和6.1 g/L苯乙酸。
D-苯丙氨酸是一种手性分子,可以作为许多药物合成的前体物质。苯丙酮酸在D-氨基酸氨基转移酶作用下,以D-丙氨酸作为氨基供体生成D-苯丙氨酸(图4)。构建D-苯丙氨酸高产菌株,需要阻断苯丙酮酸到D-苯丙氨酸反应步骤或将D-苯丙氨酸逆向催化生成苯丙酮酸,同时保证细胞内有足够的氨基供体 D-丙氨酸。Liu等[32]将 Bacillus subtilis的D-氨基酸氨基转移酶基因dat通过质粒在苯丙氨酸高产E.coli菌株中过表达,获得的工程菌株通过分批补料发酵葡萄糖产生1.72 g/L D-苯丙氨酸。
L-扁桃酸、D-苯甘氨酸和L-苯甘氨酸均是药物合成的重要前体物质。苯丙酮酸在4-羟基扁桃酸合酶(HmaS)作用下生成L-扁桃酸,L-扁桃酸可以进一步转化为D-苯甘氨酸或L-苯甘氨酸(图4)。Sun等[33]在 E.coli中通过质粒过表达 hmaS、aroFFBR和pheAFBR,敲除竞争性途径基因tyrB、aspC和tyrA,最终菌株以葡萄糖为碳源进行摇瓶发酵84 h 产生 1.02 g/L L-扁桃酸。Muller等[34]在苯丙酮酸高产 E.coli菌株中通过质粒过表达 hmaS、hmo和hpgAT,最终菌株以葡萄糖为碳源通过分批补料发酵产生(102±6)mg D-苯甘氨酸(以1 g干细胞计)。Liu等[35]在 E.coli中通过质粒过表达hmaS、hmo和hpgT,并对苯丙氨酸合成途径进行改造,敲除转氨酶基因tyrB、aspC和ilvE,最终菌株通过分批补料发酵积累51.6 mg L-苯甘氨酸。4-羟基扁桃酸合酶催化的反应是该途径的限速步骤,过表达hmaS能够进一步提高D/L-苯甘氨酸的产量。
4 酪氨酸及其衍生物的生物合成
分支酸在分支酸变位酶作用下生成预苯酸,预苯酸经预苯酸脱氢酶催化得到4-羟基苯丙酮酸,4-羟基苯丙酮酸经过转氨酶催化得到L-酪氨酸(图3)。L-酪氨酸在人和动物的生长发育和新陈代谢过程中发挥重要作用,也是有机合成工业的重要前体物质,可以转化为多种芳香族化合物。通过代谢工程手段构建高产L-酪氨酸的工程菌株,为代谢工程改造微生物生产L-酪氨酸衍生物提供优良的底盘细胞。
4.1 酪氨酸的生物合成
L-酪氨酸的制备主要是采取动物蛋白(如毛发和羽毛等)水解提取法,但是L-酪氨酸收率不高。微生物发酵法具有环境友好、提取工艺简单、反应条件温和以及可实现连续大批量生产等优点,具有广阔的应用前景。目前,构建高产L-酪氨酸菌株的策略多采用代谢工程改造L-苯丙氨酸高产菌株,使其积累L-酪氨酸。Patnaik等[36]通过敲除L-苯丙氨酸高产E.coli菌株的pheA和pheL,将tyrA本身启动子替换为强启动子Ptrc,最终菌株在200 L发酵罐中通过分批补料发酵48 h积累55 g/L的L-酪氨酸。Huang等[37]设计了一个绕开酪氨酸反馈抑制的新合成途径,在E.coli中通过质粒过表达苯丙氨酸4-羟化酶基因P4H和循环系统酶基因MH4,并对莽草酸途径进行改造,最终菌株通过摇瓶发酵积累401 mg/L 的 L-酪氨酸。Gold 等[38]通过解除 S.cerevisiae DAHP(Aro4K229L)和酪氨酸代谢反馈抑制(Aro7G141S),过表达 Aro1和 Tyr1,敲除 Aro10和ZWF1,最终菌株在细胞内积累520 μmol的 L-酪氨酸(以1 g干细胞计)。
4.2 酪氨酸衍生物的生物合成
雪,以最纯粹的色彩,带给我们最纯粹的快乐。这份快乐,人类与动物共享。《雪天的礼物》中,一心盼着下雪的睡鼠兄弟再也熬不住,去冬眠了,他们梦见了打雪仗、滑雪橇,把积雪踩出“咯吱咯吱”的声响;把雪捧在手上感受“白砂糖”般的质感。而妈妈绣了点点雪花的围巾就静静地躺在他们身边,饱藏着妈妈的疼爱,等他们醒来后,礼物还会陪着他们慢慢长大。
4-羟基苯丙酮酸和L-酪氨酸可以衍生为多种具有重要经济价值的芳香族化合物,例如4-羟基苯乳酸(4-hydroxyphenyllactic acid)、4-羟基苯乙醇(4-hydroxyphenylethanol)、 4-羟 基 苯 乙 酸 (4-hydroxyphenylacetic acid)、丹参素(salvianic acid A)、苯酚(phenol)、对羟基香豆酸(p-coumaric acid)、4-羟基苯乙烯(4-hydroxystyrene)、左旋多巴(L-DOPA)和咖啡酸(caffeic acid)等(图5,表1)。

图5 L-酪氨酸衍生物的生物合成途径Fig.5 Biosynthetic pathways of L-tyrosine derivatives
4-羟基苯乳酸、4-羟基苯乙醇(俗称酪醇tyrosol)和4-羟基苯乙酸均是重要的有机合成中间体,被广泛应用于医药、香料合成等领域。这3种物质的生物合成与苯丙氨酸衍生物苯乳酸、苯乙醇和苯乙酸的生物合成途径所需的酶相同。Koma等[29]采用与构建苯乳酸、苯乙醇和苯乙酸高产菌株相同的策略,以 L-酪氨酸高产E.coli菌株作为出发菌株,分别在染色体上过表达ldhA,获得4-羟苯基乳酸摇瓶发酵产量达到8.1 mmol/L的菌株;过表达ipdC和yahK,同时敲除feaB和pheA获得4-羟基苯乙醇产量达到8.3 mmol/L的菌株;过表达ipdC和feaB,同时敲除yahK和pheA,获得4-羟基苯乙酸产量达到 6.1 mmol/L 的菌株。Xue 等[39]将 S.cerevisiae的芳香族氨基酸氨基转移酶基因ARO8和苯丙酮酸脱羧酶基因ARO10通过质粒在E.coli中过表达,获得4-羟基苯乙醇摇瓶发酵产量达到8.71 mmol/L的菌株。
丹参素是从药用植物丹参中提取的主要药用成分之一。Yao等[40]通过质粒模块化手段过表达莽草酸途径和L-酪氨酸合成途径中的多个关键基因,获得高产L-酪氨酸E.coli菌株,然后通过质粒过表达 D-乳酸脱氢酶突变体基因 d-ldhY52A和hpaBC,实现丹参素的从头合成,分批补料发酵72 h,产量达到7.1 g/L,相对于葡萄糖的转化率达到0.47 mol/mol。随后,该研究组敲除 E.coli BAK5 的ptsG、pykF、pykA、pheA和 tyrR 获得 BAK11菌株,通过模块化的方式将3个模块(PlacUV5-aroGFBR-tyrAFBR-aroE,Ptrc-glk-tktA-ppsA和P5tacs-hpaBC-d-ldhY52A)整合到染色体上,最终菌株BKD13以葡萄糖为碳源通过分批补料发酵60 h积累5.6 g/L丹参素[41]。
苯酚是生产树脂、杀菌剂和防腐剂以及药物的重要原料。Kim 等[42]在 E.coli BL21中利用 RNA干扰技术抑制负调控基因,过表达酪氨酸酚裂解酶基因tpl,并对酪氨酸合成途径进行改造,最终菌株利用葡萄糖通过分批补料发酵的方式,苯酚产量达1.69 g/L。由于苯酚对微生物具有毒性,限制了其发酵积累,通过两相分批补料发酵21 h配合甘油三丁酸酯萃取的方法,使苯酚产量提高至3.79 g/L。
对-羟基香豆酸,又称对-羟基肉桂酸,被广泛应用于食品、化工和医药等行业,是合成许多重要化合物的前体或中间体。Vargas-Tah等[43]在 E.coli W3110中通过质粒过表达Rhodotorula glutinis的苯丙氨酸解氨酶基因PAL和自身的tktA,解除DAHP代谢反馈抑制(aroGFBR),工程菌株W(pheA-)Rg通过摇瓶发酵 16 h 积累 355.87 μmol/L(49.85 mg/L)对-羟基香豆酸。Rodriguez等[44]在 Δpdc5Δaro10 背景的 S.cerevisiae中过表达自身的 ARO4K229L和ARO7G141S、E.coli 中 的 aroL 以 及 Flavobacterium johnsoniaeu的PAL,通过分批补料发酵的方式,对-羟基香豆酸的产量最高达1.93 g/L。Nijkamp等[45]将恶臭假单胞菌(Pseudomonas putida)的对-羟基香豆酸降解酶基因fcs敲除,通过载体过表达pal,并对L-酪氨酸代谢途径进行优化,工程菌通过分批补料发酵的方式积累1.7 g/L对-羟基香豆酸。
对-羟基香豆酸在脱羧酶作用下生成4-羟基苯乙烯。4-羟基苯乙烯是合成许多高聚物的单体。Qi等[46]在高产L-酪氨酸 E.coli菌株中通过质粒过表达Rhodotorulaglutinis的 PAL和 Lactobacillus plantarum的对-羟基香豆酸脱羧酶基因pdc,最终菌株通过分批补料发酵产生0.4 g/L的4-羟基苯乙烯。Kang等[47]同样在高产 L-酪氨酸 E.coli菌株中过表达外源的酪氨酸解氨酶基因tal和酚酸脱羧酶基因pad,工程菌株通过摇瓶发酵产生355 mg/L的4-羟基苯乙烯。
左旋多巴(L-多巴)是生物体内重要的生物活性物质,是治疗帕金森病的主要药物之一。Munoz等[48]在 E.coli中过表达 tktA、aroFFBR和 tyrA 以及来自于Zymomonas mobilis的环己二烯脱氢酶基因tyrC,得到高产L-酪氨酸菌株,进一步过表达4-羟基苯乙酸3-羟化酶基因hpaBC,实现L-酪氨酸向L-多巴转化,分批补料发酵50 h产生1.51 g/L的 L-多巴。
咖啡酸是许多医药合成的重要原料和中间体。对-羟基香豆酸和L-多巴分别在4-羟基苯乙酸3-羟化酶(HpaBC)和酪氨酸解氨酶(Tal/FevV)的催化下生成咖啡酸(图5)。Zhang等[49]在高产L-酪氨酸E.coli中分别通过低拷贝和高拷贝质粒过表达tal和hpaBC,最终菌株在2 L发酵罐中以葡萄糖为碳源发酵4 d产生 106 mg/L咖啡酸。Kawaguchi等[50]同样在高产 L-酪氨酸 E.coli菌株中过表达铜绿色假单胞菌(P.aeruginosa)的酪氨酸解氨酶基因fevV和链霉菌(Streptomyces sp.)的hpaBC,工程菌采用同步糖化发酵的方式产生233 mg/L的咖啡酸,并证明限制葡萄糖供应是提高咖啡酸产量的关键因素。Huang等[51]在过表达 hpaBC 的 E.coli培养液中添加总计4 g/L对-羟基香豆酸进行全细胞转化,获得3.82 g/L的咖啡酸;随后采用高产L-酪氨酸菌株进行从头合成,通过摇瓶发酵产生766.68 mg/L的咖啡酸。
除了上述的衍生物以外,L-酪氨酸还可以衍生为酪胺(tyramine)、阿魏酸(ferulic acid)和黑色素(melanin)等其他多种芳香族衍生物。
5 色氨酸及其衍生物的生物合成
5.1 色氨酸的生物合成
提高莽草酸途径的前体物质PEP和E4P,过表达莽草酸和色氨酸合成途径中的关键基因,解除代谢反馈抑制,敲除色氨酸合成途径转录调控抑制基因trpR,过表达丝氨酸合成基因serA,这些策略可以显著提高 L-色氨酸的产量。Shen 等[52]在 E.coli K12(ΔtrpRΔtna)菌株中通过高拷贝质粒过表达aroGFBR、trpEFBR和serA,分批补料发酵40 h 生成35.9 g/L的L-色氨酸;然后,通过低拷贝质粒过表达tktA和ppsA,L-色氨酸产量进一步提高至40.2 g/L。敲除色氨酸内吞转运蛋白相关基因(mtr、tnaB和aroP),过表达色氨酸外排蛋白基因yddG,可以进一步提高色氨酸产量。Liu等[53]在色氨酸高产E.coli菌株中通过质粒过表达yddG,最终菌株TRTH-Y通过分批补料发酵36 h产生36.3 g/L的L-色氨酸,比对照菌株产量提高 12.6%。Wang等[54]在 E.coli MG1655中敲除pta-mtr,通过质粒表达yddG,同时对色氨酸合成途径进行改造,最终菌株以葡萄糖为碳源,在30 L的发酵罐中发酵38 h积累48.68 g/L的L-色氨酸,比对照菌株产量提高15.96%。
5.2 色氨酸衍生物的生物合成
L-色氨酸可以衍生为多种芳香族化合物,例如紫色杆菌素(violacein)、脱氧紫色杆菌素(deoxyviolacein)、生 长 素 (auxin)、血 清 素(serotonin)、靛红(indirubin)、靛蓝(indigo)和卤化色氨酸等(图6,表1),但是衍生途径较为复杂,导致衍生物产量一般比较低。如何进一步提高L-色氨酸衍生物产量是色氨酸领域研究需要解决的关键问题。
紫色杆菌素和脱氧紫色杆菌素是微生物产生的非水溶性的蓝黑色色素,具有广谱抗菌、抗病毒、抗肿瘤和抗氧化等生理活性[55]。Rodrigues等[56]将含有脱氧紫色杆菌素合成基因vioABCE的质粒转入高产L-色氨酸E.coli菌株中获得dVio-6菌株,该菌株在摇瓶发酵条件下产生324.1 mg/L的脱氧紫色杆菌素;随后在染色体上过表达vioD,最终菌株Vio-4通过分批补料发酵产生710 mg/L紫色杆菌素。Fang等[57]敲除 E.coli BL21(DE3)的 trpR、tnaA 和pheA,通过 2个质粒分别过表达 trpEFBR-trpD和VioABCDE 2个模块,最终菌株以葡萄糖为碳源,通过分批补料发酵产生1.75 g/L的紫色杆菌素。Sun等[55]以 C.glutamicum ATCC 21850 作为出发菌株,将带有本身强核糖体结合位点(RBS)的PtrcvioABCDE基因簇通过质粒转入出发菌株,最终菌株利用优化后的分批补料发酵条件最高产生5.436 g/L紫色杆菌素。
生长素,学名吲哚-3-乙酸(indole-3-acetic acid),是最早发现的促进植物生长的植物激素,广泛应用于农业生产领域。Romasi等[58]在 E.coli DH5α中通过质粒过表达本身的氨基转移酶基因aspC、Enterobacter cloacae的吲哚-3-丙酮酸脱羧酶基因ipdC和Ustilago maydis的吲哚-3-乙酸脱氢酶基因iad1,敲除抑制L-色氨酸分解酶基因tnaA,最终菌株IAA68在4 g/L L-色氨酸的LB培养基中培养24 h,吲哚-3-乙酸产量达3 g/L。
血清素,学名5-羟基色胺(5-hydroxytryptamine),是一种植物源的生物碱,具有潜在的药理作用。L-色氨酸先后在色氨酸脱羧酶(TDC)和色胺5-羟化酶(T5H)作用下生成血清素(图 6)。Park 等[59]在E.coli将GST标签蛋白与N末端缺失的色胺5-羟化酶基因进行融合表达,并表达色氨酸脱羧酶,然后在20℃低温条件下诱导蛋白表达产生24 mg/L的血清素。
靛红和靛蓝是天然的药物和还原性染料,被广泛用于食品、医药和化妆品等领域。Han等[60]在E.coli DH5α 中表达 Methylophaga aminisulfidivorans
的黄素单加氧酶基因fmo,首先催化生成2-羟基吲哚或3-羟基吲哚,然后通过自发二聚化生成靛蓝或靛红(图6)。向5 L发酵罐中添加2 g/L的L-色氨酸底物进行发酵,产生920 mg/L靛蓝和5.0 mg/L靛红;向培养基中添加0.36 g/L的半胱氨酸,利用半胱氨酸影响黄素单加氧酶的区域选择性,增加靛红前体2-羟基吲哚的合成,优化培养基后,靛红的发酵产量达到223.6 mg/L。
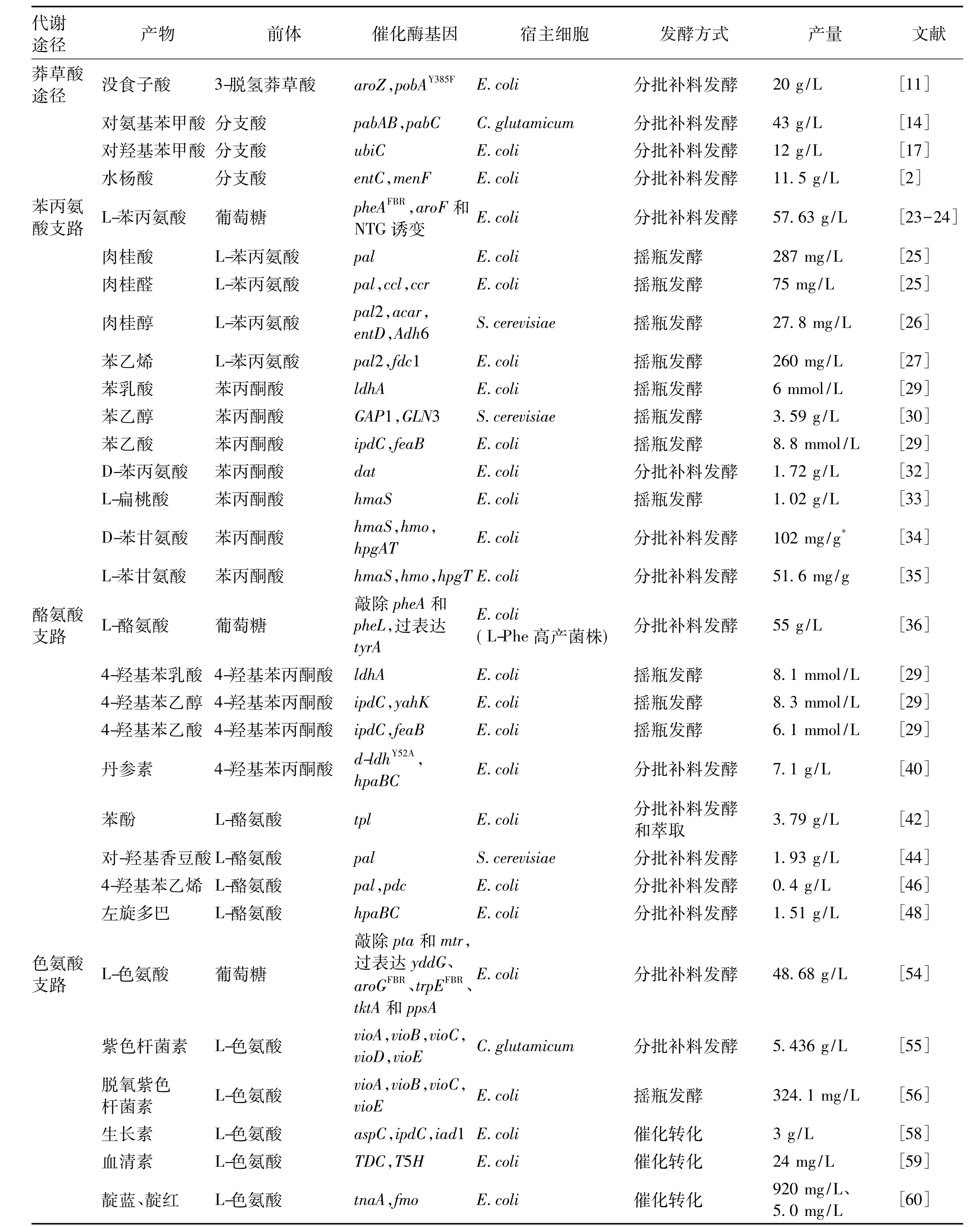
表1 微生物生产芳香族化合物汇总Table 1 Production of aromatic chemicals by engineered microbes
有机卤化物是一类具有特殊生理活性的化合物,已经广泛用于医药、杀菌剂和有机合成等多个领域。卤化色氨酸是含卤抗生素的重要前体物质。L-色氨酸分别在FADH2依赖型色氨酸5-卤化酶[61]、色氨酸 6-卤化酶[62]和色氨酸 7-卤化酶[63]作用下生成相应的5、6或7位卤化色氨酸(图6)。蝴蝶霉素(rebeccamycin)分子结构式中含有两个7-氯色氨酸结构。Hyun等[64]将 Saccharothrix aerocolonigenes中蝴蝶霉素生物合成基因簇(约35 kb)通过质粒转入E.coli中,该基因簇包含色氨酸7-卤化酶基因rebH,在工程菌株的代谢产物中能够检测到蝴蝶霉素的生成,表明色氨酸7-卤化酶能够在E.coli中正常表达并发挥催化活性。
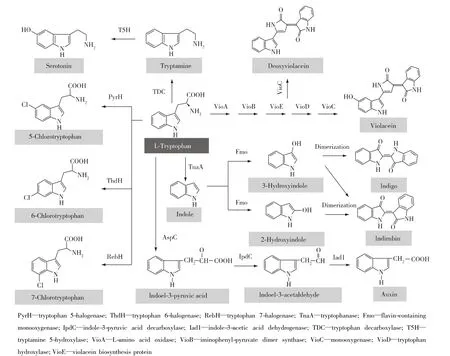
图6 L-色氨基酸衍生物的生物合成途径Fig.6 Biosynthetic pathways of L-tryptophan derivatives
6 结论与展望
芳香族化合物广泛用于医药、化工、食品、饲料和农业等多个领域,市场需求量很大。随着化石能源储量的急剧减少和人类生存环境的逐渐恶化,芳香族化合物依赖于化石能源产物“三苯”衍生转化的传统生产方式已经不符合新经济形势下的可持续绿色发展要求。通过理性设计和定向改造微生物的代谢途径来实现芳香族化合物的微生物合成的方式具有传统的诱变育种无可比拟的优势。因此,通过代谢工程手段构建绿色高效的细胞工厂来生产目标芳香族化合物的替代合成途径逐渐受到人们的广泛关注,并取得了一系列重大的研究成果。近些年来,随着各种组学研究的发展,人们对于不同生物体的基因组、转录组、蛋白质组、代谢组以及细胞信号调控机理的研究越来越清晰,更加方便地从生物学原件、模块及系统等不同层次设计具有特定功能的细胞工厂,从而满足人们对发酵产品多样化的生产需求。
芳香族化合物在生物体中的含量较低,难以满足生产需求。本篇综述在整体代谢途径水平上概要地介绍了利用微生物代谢工程手段,以莽草酸途径和芳香族氨基酸途径产物为底物合成不同芳香族化合物的研究进展。通过理性设计,对微生物中心代谢途径、莽草酸途径以及芳香族氨基酸合成途径进行优化,同时导入外源所需生化反应的酶的编码基因,敲除代谢副产物途径基因和产物负调控相关基因,使微生物具有更强的积累芳香族化合物的能力。
此外,大部分芳香族化合物对微生物具有不同程度的生理毒性,导致目标产物积累量很低。可以通过菌株驯化提高其耐受性,利用耐受性强的宿主菌株,提高代谢产物分泌能力,使目标产物以沉淀形式析出或膜过滤去除等多个方式降低目标产物毒性。尽管困难重重,相信在广大科研工作者不遗余力的努力下,利用微生物细胞工厂来替代传统化学合成途径生产芳香族化合物的愿望一定能够实现,从而促进经济社会的可持续发展。
[1] JIANG M,ZHANG H.Engineering the shikimate pathway for biosynthesis of molecules with pharmaceutical activities in E.coli[J].Curr Opin Biotechnol,2016,42:1-6.
[2] NODA S,SHIRAI T,OYAMA S,et al.Metabolic design of a platform Escherichia coli strain producing various chorismate derivatives[J].Metab Eng,2016,33:119-129.
[3] THOMPSON B,MACHAS M,NIELSEN D R.Creating pathways towards aromatic building blocks and fine chemicals[J].Curr Opin Biotechnol,2015,36:1-7.
[4] RODRIGUEZ A,MARTINEZ J A,FLORES N,et al.Engineering Escherichia coli to overproduce aromatic amino acids and derived compounds[J].Microb Cell Fact,2014,13:126.
[5] MAEDA H,DUDAREVA N.The shikimate pathway and aromatic amino acid biosynthesis in plants[J].Annu Rev Plant Biol,2012,63:73-105.
[6] HAN L,LIU P,SUN J,et al.Engineering catechol 1,2-dioxygenase by design for improving the performance of the cis,cis-muconic acid synthetic pathway in Escherichia coli[J].Sci Rep,2015,5:13435.
[7] LI K,MIKOLA M R,DRATHS K M,et al.Fed-batch fermentor synthesis of 3-dehydroshikimic acid using recombinant Escherichia coli[J].Biotechnol Bioeng,1999,64:61-73.
[8] KOGURE T,KUBOTA T,SUDA M,et al.Metabolic engineering of Corynebacterium glutamicum for shikimate overproduction by growth-arrested cell reaction[J].Metab Eng,2016,38:204-216.
[9] NIU W,DRATHS K M,FROST J W.Benzene-free synthesis of adipic acid[J].Biotechnol Prog,2002,18:201-211.
[10] CURRAN K A,LEAVITT J M,KARIM A S,et al.Metabolic engineering ofmuconic acid production in Saccharomyces cerevisiae[J].Metab Eng,2013,15:55-66.
[11] KAMBOURAKIS S,DRATHS K M,FROST J W.Synthesis of gallic acid and pyrogallol from glucose:replacing natural product isolation with microbial catalysis[J].J Am Chem Soc,2000,122:9042-9043.
[12] MUIR R M,IBANEZ A M,URATSU S L,et al.Mechanism of gallic acid biosynthesis in bacteria(Escherichia coli)and walnut(Juglans regia)[J].Plant Mol Biol,2011,75:555-565.
[13] BONTPART T,MARLIN T,VIALET S,et al.Two shikimate dehydrogenases,VvSDH3 and VvSDH4,are involved in gallic acid biosynthesis in grapevine[J].J Exp Bot,2016,67:3537-3550.
[14] KUBOTA T,WATANABE A,SUDA M,et al.Production of paraaminobenzoate by genetically engineered Corynebacterium glutamicum and non-biologicalformation ofan N-glucosyl byproduct[J].Metab Eng,2016,38:322-330.
[15] AVERESCH N J,WINTER G,KROMER J O.Production of paraaminobenzoic acid from different carbon-sources in engineered Saccharomyces cerevisiae[J].Microb Cell Fact,2016,15:89.
[16] SATOH Y,KURATSU M,KOBAYASHI D,et al.New gene responsible for para-aminobenzoate biosynthesis[J].J Biosci Bioeng,2014,117:178-183.
[17] BARKER JL,FROST JW.Microbialsynthesisofphydroxybenzoic acid from glucose[J].Biotechnol Bioeng,2001,76:376-390.
[18] YU S,PLAN M R,WINTER G,et al.Metabolic engineering of Pseudomonas putida KT2440 for the production of para-hydroxybenzoic acid[J].Front Bioeng Biotechnol,2016,4:90.
[19] AVERESCH N J H,PRIMA A,KROMER J O.Enhanced production of para-hydroxybenzoic acid by genetically engineered Saccharomyces cerevisiae[J].Bioprocess Biosyst Eng,2017,DOI:10.1007/s00449-017-1785-z.
[20] SENGUPTA S,JONNALAGADDA S,GOONEWARDENA L,et al.Metabolic engineering of a novel muconic acid biosynthesis pathway via 4-hydroxybenzoic acid in Escherichia coli[J].Appl Environ Microbiol,2015,81:8037-8043.
[21] WANG J,ZHENG P.Muconic acid production from glucose using enterobactin precursors in Escherichia coli[J].J Ind Microbiol Biotechnol,2015,42:701-709.
[22] BALDERAS-HERNANDEZ V E,TREVINO-QUINTANILLA L G,HERNANDEZ-CHAVEZ G,et al.Catechol biosynthesis from glucose in Escherichia coli anthranilate-overproducer strains by heterologous expression of anthranilate 1,2-dioxygenase from Pseudomonas aeruginosa PAO1[J].Microb Cell Fact,2014,13:136.
[23] ZHOU H,LIAO X,WANG T,et al.Enhanced L-phenylalanine biosynthesis by co-expression of pheAfbrand aroFwt[J].Bioresour Technol,2010,101:4151-4156.
[24] ZHOU H,LIAO X,LIU L,et al.Enhanced L-phenylalanine production by recombinant Escherichia coli BR-42(pAP-B03)resistant to bacteriophage BP-1 via a two-stage feeding approach[J].J Ind Microbiol Biotechnol,2011,38:1219-1227.
[25] BANG H B,LEE Y H,KIM S C,et al.Metabolic engineering of Escherichia coli for the production of cinnamaldehyde[J].Microb Cell Fact,2016,15:16.
[26] GOTTARDI M,KNUDSEN J D,PRADO L,et al.De novo biosynthesis of trans-cinnamic acid derivatives in Saccharomyces cerevisiae[J].Appl Microbiol Biotechnol,2017,101:4883-4893.
[27] MCKENNA R,NIELSEN D R.Styrene biosynthesis from glucose by engineered E.coli[J].Metab Eng,2011,13:544-554.
[28] MCKENNA R,THOMPSON B,PUGH S,et al.Rational and combinatorial approaches to engineering styrene production by Saccharomyces cerevisiae[J].Microb Cell Fact,2014,13:123.
[29] KOMA D,YAMANAKA H,MORIYOSHI K,et al.Production of aromatic compounds by metabolically engineered Escherichia coli with an expanded shikimate pathway[J].Appl Environ Microbiol,2012,78:6203-6216.
[30] CHEN X,WANG Z,GUO X,et al.Regulation of general amino acid permeases Gap1p,GATA transcription factors Gln3p and Gat1p on 2-phenylethanol biosynthesis via Ehrlich pathway[J].J Biotechnol,2017,242:83-91.
[31] ETSCHMANN M M W,SCHRADER J.An aqueous-organic twophase bioprocess for efficient production of the natural aroma chemicals α-phenylethanol and α-phenylethylacetabe with yeast[J].Appl Microbiol Biotechnol,2006,71:440-443.
[32] LIU R X,LIU S P,CHENG S,et al.Screening,characterization and utilization of D-amino acid aminotransferase to obtain D-phenylalanine[J].Appl Biochem Microbiol,2015,51:695-703.
[33] SUN Z,NING Y,LIU L,et al.Metabolic engineering of the L-phenylalanine pathway in Escherichia coli for the production of S-or R-mandelic acid[J].Microb Cell Fact,2011,10:71.
[34] MULLER U,ASSEMA F V,GUNSOR M,et al.Metabolic engineering of the E.coli L-phenylalanine pathway for the production of D-phenylglycine(D-Phg)[J].Metab Eng,2006,8:196-208.
[35] LIU S P,LIU R X,EL-ROTAIL A A,et al.Heterologous pathway for the production of L-phenylglycine from glucose by E.coli[J].J Biotechnol,2014,186:91-97.
[36] PATNAIK R,ZOLANDZ R R,GREEN D A,et al.L-tyrosine production by recombinant Escherichia coli:fermentation optimization and recovery[J].Biotechnol Bioeng,2008,99:741-752.
[37] HUANG J,LIN Y,YUAN Q,et al.Production of tyrosine through phenylalanine hydroxylation bypassesthe intrinsic feedback inhibition in Escherichia coli[J].J Ind Microbiol Biotechnol,2015,42:655-659.
[38] GOLD N D,GOWEN C M,LUSSIER F X,et al.Metabolic engineering of a tyrosine-overproducing yeast platform using targeted metabolomics[J].Microb Cell Fact,2015,14:73.
[39] XUE Y,CHEN X,YANG C,et al.Engineering Eschericha coli for enhanced tyrosol production[J].J Agric Food Chem,2017,DOI:10.1021/acs.jafc.7b01369.
[40] YAO Y F,WANG C S,QIAO J,et al.Metabolic engineering of Escherichia coli for production of salvianic acid A via an artificial biosynthetic pathway[J].Metab Eng,2013,19:79-87.
[41] ZHOU L,DING Q,JIANG G Z,et al.Chromosome engineering of Escherichia coli for constitutive production of salvianic acid A[J].Microb Cell Fact,2017,16:84.
[42] KIM B,PARK H,NA D,et al.Metabolic engineering of Escherichia coli for the production of phenol from glucose[J].Biotechnol J,2014,9:621-629.
[43] VARGAS-TAH A,MARTINEZ L M,HERNANDEZ-CHAVEZ G,et al.Production of cinnamic and p-hydroxycinnamic acid from sugar mixtures with engineered Escherichia coli[J].Microb Cell Fact,2015,14:6.
[44] RODRIGUEZ A,KILDEGAARD K R,LI M,et al.Establishment of a yeast platform strain for production of p-coumaric acid through metabolic engineering of aromatic amino acid biosynthesis[J].Metab Eng,2015,31:181-188.
[45] NIJKAMP K,WESTERHOF R G,BALLERSTEDT H,et al.Optimization of the solvent-tolerant Pseudomonas putida S12 as host for the production of p-coumarate from glucose[J].Appl Microbiol Biotechnol,2007,74:617-624.
[46] QI W W,VANNELLI T,BREINIG S,et al.Functional expression of prokaryotic and eukaryotic genes in Escherichia coli forconversion of glucose to p-hydroxystyrene[J].Metab Eng,2007,9:268-276.
[47] KANG S Y,CHOI O,LEE J K,et al.Artificial de novo biosynthesis of hydroxystyrene derivatives in a tyrosine overproducing Escherichia coli strain[J].Microb Cell Fact,2015,14:78.
[48] MUNOZ A J,HERNANDEZ-CHAVEZ G,ANDA R D,et al.Metabolic engineering of Escherichia coli for improving L-3,4-dihydroxyphenylalanine(L-DOPA)synthesis from glucose[J].J Ind Microbiol Biotechnol,2011,38:1845-1852.
[49] ZHANG H,STEPHANOPOULOS G.Engineering E.coli for caffeic acid biosynthesis from renewable sugars[J].Appl Microbiol Biotechnol,2013,97:3333-3341.
[50] KAWAGUCHI H,KATSUYAMA Y,DANYAO D,et al.Caffeic acid production by simultaneous saccharification and fermentation of kraft pulp using recombinant Escherichia coli[J].Appl Microbiol Biotechnol,2017,DOI:10.1007/s00253-017-8270-0.
[51] HUANG Q,LIN Y,YAN Y.Caffeic acid production enhancement by engineering a phenylalanine over-producing Escherichia coli strain[J].Biotechnol Bioeng,2013,110:3188-3196.
[52] SHEN T,LIU Q,XIE X,et al.Improved production of tryptophan in genetically engineered Escherichia coli with TktA and PpsA overexpression[J].J Biomed Biotechnol,2012,doi:10.1155/2012/605219.
[53] LIU Q,CHENG Y,XIE X,et al.Modification of tryptophan transport system and its impact on production of L-tryptophan in Escherichia coli[J].Bioresour Technol 2012,114:549-554.
[54] WANG J,CHENG L K,WANG J,et al.Genetic engineering of Escherichia coli to enhance production of L-tryptophan[J].Appl Microbiol Biotechnol,2013,97:7587-7596.
[55] SUN H,ZHAO D,XIONG B,et al.Engineering Corynebacterium glutamicum for violacein hyper production[J].Microb Cell Fact,2016,15:148.
[56] RODRIGUES A L,TRACHTMANN N,BECKER J,et al.Systems metabolic engineering of Escherichia coli for production of the antitumor drugs violacein and deoxyviolacein[J].Metab Eng,2013,20:29-41.
[57] FANG M Y,ZHANG C,YANG S,et al.High crude violacein production from glucose by Escherichia coli engineered with interactive control of tryptophan pathway and violacein biosynthetic pathway[J].Microb Cell Fact,2015,14:8.
[58] ROMASI E F,LEE J.Development of indole-3-acetic acidproducing Escherichia coli by functional expression of IpdC,AspC,and Iad1[J].J Microbiol Biotechnol,2013,23:1726-1736.
[59] PARK S,KANG K,LEE S W,et al.Production of serotonin by dual expression of tryptophan decarboxylase and tryptamine 5-hydroxylase in Escherichia coli[J].Appl Microbiol Biotechnol,2011,89:1387-1394.
[60] HAN G H,GIM G H,KIM W,et al.Enhanced indirubin production in recombinant Escherichia coli harboring a flavincontaining monooxygenase gene by cysteine supplementation[J].J Biotechnol,2012,164:179-187.
[61] ZEHNER S,KOTZSCH A,BISTER B,et al.A regioselective tryptophan 5-halogenase is involved in pyrroindomycin biosynthesis in Streptomyces rugosporus LL-42D005[J].Chem Biol,2005,12:445-452.
[62] MILBREDT D,PATALLO E P,PEE K H.A tryptophan 6-halogenase and an amidotransferase are involved in thienodolin biosynthesis[J].ChemBioChem,2014,15:1011-1020.
[63] BITTO E,HUANG Y,BINGMAN C A,et al.The structure of flavin-dependent tryptophan 7-halogenase RebH[J].Proteins,2008,70:289-293.
[64] HYUN C G,BILILIGN T,LIAO J,et al.The biosynthesis of indolocarbazoles in a heterologous E.coli host[J].ChemBioChem,2003,4(1):114-117.
(责任编辑 荀志金)
Advances in microbial metabolic engineering for producing aromatic chemicals
WU Fengli,PENG Yanfeng,XU Yicheng,CAO Peng,CHEN Wujiu,WANG Qinhong
(CAS Key Laboratory of Systems Microbial Biotechnology,Tianjin Institute of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308,China)
Aromatic chemicals are a large number of industrially important products with a range of applications in chemical industry.Recently,an increasing array of aromatic chemicals are produced via many engineered microbes directly from renewable feedstocks.The engineered microbes based on rational design can significantly overproduce a large variety of aromatic chemicals with wide applications.In addition,we can broaden the product spectrum via de novo biosynthetic pathways and obtain some valuable and novel aromatic chemicals.Microbial production of aromatic chemicals would greatly contribute to solving the problems to fossil energy crisis and environment sustainable development.In this review,the latest research progress on microbial production of various aromatic chemicals and the strategies for metabolic engineering were summarized,to provide basis for further research and development.
synthetic biology;metabolic engineering;shikimate pathway;aromatic chemicals;microbial production
Q939.97;TQ92
A
1672-3678(2017)05-0009-15
10.3969/j.issn.1672-3678.2017.05.002
2017-06-14
国家重点基础研究发展计划(973计划)(2011CBA00800);天津市科技计划(14ZCZDSY00066)
吴凤礼(1986—),男,河北迁西人,博士后,研究方向:生物化工;王钦宏(联系人),研究员,E-mail:wang_qh@tib.cas.cn

