胰腺腺鳞癌的动态增强CT表现分析
付 怡,肖遥星,张 汐
1. 复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032;2. 复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032
胰腺腺鳞癌的动态增强CT表现分析
付 怡1,肖遥星2,张 汐1
1. 复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032;2. 复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032
目的:分析胰腺腺鳞癌的CT和临床表现,旨在提高对该病的认识。方法:回顾性分析复旦大学附属肿瘤医院9例经病理证实的胰腺腺鳞癌患者的临床及动态增强CT资料,重点观察病灶部位、大小、边缘、强化方式、胰周及胰腺外改变等。结果:9例患者中,男性6例、女性3例,平均年龄为58.7岁。3例位于胰头、6例位于胰体尾部。肿瘤大小2.0 cm×2.0 cm 至10.0 cm×6.6 cm不等,平均为3.7 cm×4.8 cm。9例肿块均呈浸润性生长,5例侵及胰周组织。2例发生肝、脾转移。8例肿瘤瘤体内发生坏死囊变,仅1例为实性组织。9例肿瘤均未见出血、钙化。肿瘤实性成分在平扫期、动脉期和门静脉期的平均CT值分别为(30.7±4.7) Hu、(60.2±14.5) Hu和(71.2±21.4) Hu。在发生中心坏死的8例肿瘤中,瘤体均呈环形渐进性轻度强化。仅1例实性瘤体呈不均匀中度渐进性强化,未见中心坏死。位于胰头部的2例肿瘤引起胆、胰管轻度扩张,远端胰腺未见明显萎缩。结论:胰腺腺鳞癌常发生瘤体内坏死囊变,实性成分在CT中表现为环形渐进性轻度强化,对该病的诊断具有提示意义。
胰腺肿瘤;计算机断层扫描;胰腺癌
胰腺腺鳞癌为罕见的外分泌胰腺原发上皮肿瘤。其病理学表现为腺癌细胞群内混杂着不同数量的鳞癌细胞,诊断标准为鳞癌成分至少占肿瘤细胞的30%[1-2]。胰腺导管腺癌与胰腺腺鳞癌具有共同的临床症状,如腹痛、梗阻性黄疸,缺乏特异性临床表现。虽然手术切除是最主要的治疗手段,但仅少部分患者在术后生存期超过1年,预后较胰腺导管腺癌更差。目前有关胰腺腺鳞癌影像学表现的报道较少,本研究分析9例胰腺腺鳞癌的动态增强CT资料,旨在提高对该病的认识。
1 资料和方法
1.1 一般资料
回顾性分析复旦大学附属肿瘤医院2010—2015年经病理证实的9例胰腺腺鳞癌患者资料,其中男性6例、女性3例,平均年龄为58.7岁。临床症状:7例为上腹疼痛,2例发生黄疸,仅1例后背部疼痛。肿瘤标记检查发现,4例患者糖类抗原19-9 (carbohydrate antigen 19-9,CA19-9)明显升高,3例轻度升高;2例患者CA12-5轻度升高;仅1例患者癌胚抗原(carcinoembryonic antigen,CEA)升高。所有患者甲胎蛋白(α fetal protein,AFP)均正常。3例患者行胰十二指肠切除术,3例患者行远端胰腺切除术,3例患者行化疗方案(表1)。
1.2 影像学检查方法
所有患者均采用SIEMENS Somatom Sensation 64层螺旋CT进行平扫及动态增强扫描,管电压120 kV,管电流250~300 mA,层厚、层距为3 mm。增强扫描采用非离子型对比剂碘海醇(300 mg I/mL) 80~100 mL,注射速率2~3 mL/s,注射对比剂后35 s和70 s进行动脉期、门静脉期扫描。
2 结 果
2.1 CT表现
2.1.1 病灶位置、大小及形态改变
9例患者中,3例位于胰头部、6例位于胰体尾部。肿瘤大小从2.0 cm×2.0 cm 至10.0 cm×6.6 cm不等,平均为3.7 cm×4.8 cm。所有肿块均呈浸润性生长,边界模糊。5例肿块侵及胰周组织,4例呈小肿块位于胰腺内部。
2.1.2 胰腺腺鳞癌密度及强化方式
CT平扫胰腺腺鳞癌病灶呈相对等低密度。1例病灶为实性低密度肿块,8例肿块内部可见更低水样密度区,实性成分平均CT值为(30.7±4.7) Hu,<3 cm病灶内亦可见肿瘤内部坏死区。动态增强后8例病灶为环形强化,外周实性成分呈渐进性轻度不均匀强化,动脉期实性成分CT值为(60.2±14.5) Hu,门静脉期CT值为(71.2±21.4)Hu (图1、2)。肿瘤中心坏死区域强化不明显。仅1例病灶呈不均匀中等程度强化,未见中心坏死。
2.1.3 肿瘤继发表现
2例患者出现轻度胰管扩张,胰管平均直径为3 mm。2例胰头部病灶压迫胆总管致胆管轻度扩张。十二指肠、脾脏、脾血管、肾上腺可见肿瘤侵犯。出血、钙化、假包膜及远端胰腺萎缩均未见显示。6例患者出现腹膜后、胰周多发淋巴结肿大。2例患者可见肝、脾转移。
2.2 组织病理学
胰腺腺鳞癌病理结果显示镜下胰腺导管腺癌细胞内混杂鳞癌细胞,鳞癌细胞呈实体巢状排列,癌巢中心可见同心圆状角化珠。部分腺癌细胞有分化为鳞癌的趋势。非病灶胰腺组织可见胰腺小叶萎缩,其周纤维组织增生,可见多量炎性细胞浸润(图1D)。

表1 9例胰腺腺鳞癌的临床和影像学资料
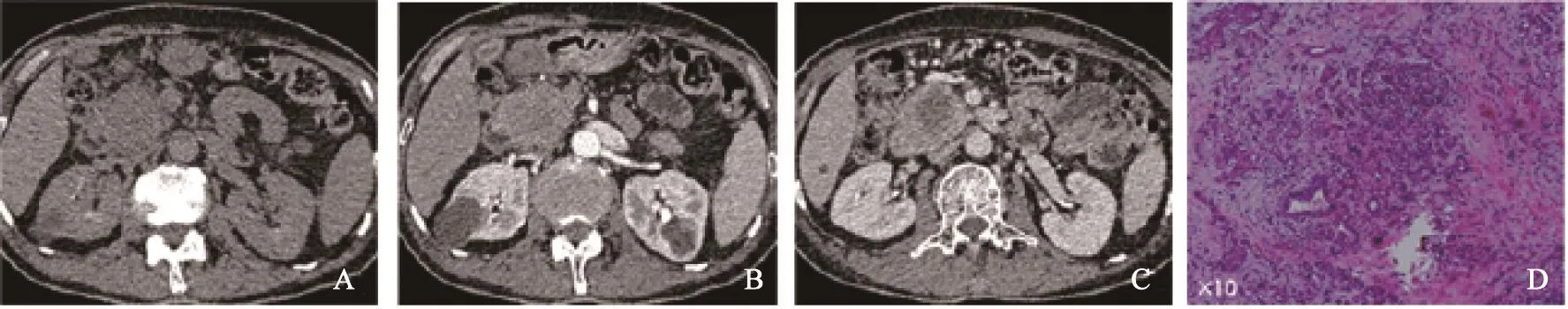
图1 胰头部胰腺腺鳞癌CT及病理表现

图2 胰体尾部胰腺腺鳞癌CT表现
3 讨 论
胰腺腺鳞癌是一类较为罕见的胰腺外分泌肿瘤,仅占胰腺恶性肿瘤的3%~4%。因肿瘤含有腺癌及鳞癌两种肿瘤细胞,被称为胰腺腺鳞癌,又名胰腺黏液表皮样癌或棘皮样癌[3]。对于胰腺腺鳞癌的病理学诊断,目前尚未有明确的定义。部分文献将肿瘤内鳞癌细胞含量超过30%作为诊断依据,而另有部分文献将找到鳞癌细胞即诊断为胰腺腺鳞癌[1,4]。胰腺腺鳞癌好发于60岁以上男性,平均年龄为66岁[4]。其临床症状与胰腺导管腺癌相似,如上腹痛、体重减低、黄疸等。
腺鳞癌常见于腺癌好发部位,如肺、食管、涎腺等[4]。其恶性程度高,进展快。相较于导管腺癌,腺鳞癌预后更差[4],分化程度更低,淋巴结转移阳性率更高[5-7]。相关研究表明,胰腺腺鳞癌发生于胰体尾部较胰头部多见。相较于导管腺癌,其病灶更大[5-8]。本组病灶大小平均为3.7 cm× 4.8 cm,最大者长径可达10.0 cm,与文献报道一致。研究表明,手术切除是胰腺腺鳞癌的最佳治疗手段[8],进行手术切除的胰腺腺鳞癌患者中位生存期为12个月,而无法手术的患者中位生存期仅为5个月[5]。多数病灶出现周围脏器侵犯及肝转移,
肿瘤标记CA19-9与CEA常作为胰腺癌及消化道肿瘤的辅助诊断指标,但目前尚未有一项肿瘤标记能对肿瘤的腺癌及鳞癌成分进行共同标示[9-11]。部分研究报道胰腺腺鳞癌患者中CA19-9与CEA浓度有不同程度升高,但对肿瘤组织学分型并无特异性[12]。本研究中4例患者CA19-9明显升高,3例轻度升高,仅1例患者CEA升高,与文献报道一致。本研究及其他文献报道中AFP等其他肿瘤标记均未见异常改变。Inoue等报道该肿瘤可分泌类甲状旁腺激素相关蛋白(parathyroid hormone-related protein,PTH-rP),出现血钙升高[13]。
胰腺腺鳞癌较为特征的影像学表现为:胰体尾部的较大肿块,多呈浸润性生长;与导管腺癌相比,胰腺腺鳞癌病灶较小时即可出现明显的囊变坏死,从而在动态增强中表现为不均匀环形强化,强化方式为渐进性轻度强化[14-18]。其CT渐进性强化的病理学基础为:肿瘤内鳞癌细胞主要分布于囊壁上皮及肿瘤中心部分,呈巢状紧密排列,中央乏血供,其倍增时间短,生长速度快,常因供血不足而出现坏死囊变;而实性成分多由腺癌细胞组成,该细胞呈管状、筛状排列,间质纤维组织增生,血管生成较少,混杂有鳞癌细胞,故在增强CT中实性成分呈渐进性不均匀强化[18]。本组8例病灶均出现中心坏死囊变,囊变区域与实性成分分界不清,实性成分呈轻度强化。仅1例患者呈实性均匀渐进性强化,考虑为鳞癌细胞含量较少而导致其影像学表现不同。而腺鳞癌转移灶内绝大多数为腺癌细胞,很少发现鳞癌成分[18]。导管腺癌的病灶均由腺癌细胞组成,发生坏死囊变的概率较低。胰腺腺鳞癌继发的影像学表现包括位于胰头部的病灶侵犯,压迫胆、胰管,表现为双管征及梗阻性黄疸,但梗阻程度及症状较导管腺癌要轻。远端胰腺的萎缩、出血、钙化等表现较为罕见。
胰腺腺鳞癌需与以下胰腺疾病相鉴别:①胰腺导管腺癌,典型的胰腺癌发生坏死囊变的概率较低。位于胰头部的肿瘤更易出现双管征,扩张更明显。病灶远端的胰腺常发生萎缩,远端胰管发生扩张。而肿块边界模糊,侵犯胰周组织及胰周淋巴结转移与胰腺腺鳞癌的影像学表现相似。若胰腺腺鳞癌未发生中心坏死囊变,两者较难鉴别。② 实性假乳头状瘤,常发生于年轻女性,肿块多呈膨胀性生长,边界清晰,可发生囊变坏死及钙化。通常因肿块较大,压迫胆、胰管发生梗阻,较少侵犯胆、胰管。而胰腺腺鳞癌呈恶性浸润性生长,边界模糊,肿块多累及胆、胰管发生扩张,较少出现钙化。胰腺腺鳞癌CA19-9升高也有助于两者的鉴别诊断。③ 肿块性慢性胰腺炎:肿块性慢性胰腺炎的病灶边界较光整,内部多见钙化,增强后早期强化不明显,门静脉期逐渐轻度均匀强化。常伴有主胰管串珠样的扩张及沿胰管内分布的钙化灶。
综上所述,胰腺腺鳞癌作为一种罕见的胰腺肿瘤,与胰腺导管腺癌具有共同的临床症状及实验室检查表现,且两者治疗方案相似。CT检查对胰腺腺鳞癌的诊断具有提示作用:胰腺腺鳞癌肿块体积较大,常发生中心坏死囊变,呈环形渐进性轻度强化,且多见淋巴结转移及肝转移。
[1] MADURA J A, JARMAN B T, DOHERTY M G, et al. Adenosquamous carcinoma of the pancreas [J]. Arch Surg, 1999, 134(6): 599-603.
[2] HSU J T, YEH C N, CHEN Y R, et al. Adenosquamous carcinoma of the pancreas [J]. Digestion, 2005, 72(2-3): 104-108.
[3] CIHAK R W, KAWASHIMA T, STEER A, et al. Adenoacanthoma (adenosquamous carcinoma) of the pancreas [J]. Cancer, 1972, 29(5): 1133-1140.
[4] KARDON D E, THOMPSON L D, PRZYGODZKI R M, et al. Adenosquamous carcinoma of the pancreas: a clinicopathologic series of 25 cases [J]. Mod Patho, 2001, 14(5): 443-451.
[5] OKABAYASHI T, HANAZAKI K. Surgical outcome of adenosquamous carcinoma of the pancreas [J]. World J Gastroenterol, 2005, 14(44): 6765-6770.
[6] SMOOT R L, ZHANG L, Sebo T J, et al. Adenosquamous carcinoma of the pancreas: a singleinstitution experience comparing resection and palliative care [J]. J Am Coll Surg, 2008, 207(3): 368-370.
[7] KATZ M H, TAYLOR T H, AL-REFAIE W B, et al. Adenosquamous versus adenocarcinoma of the pancreas: a population-based outcomes analysis [J]. J Gastrointest Surg, 2011, 15(1): 165-174.
[8] BOYD C A, BENARROCH-GAMPEL J, Sheffield K M, et al. 415 patients with adenosquamous carcinoma of the pancreas: a population-based analysis of prognosis and survival [J]. J Surg Res, 2005, 174(1): 12-19.
[9] TRIKUDANATHAN G, DASANU C A. Adenosquamous carcinoma of the pancreas: a distinct clinicopathologic entity [J]. South Med J, 2010, 103(9): 903-910.
[10] VOONG K R, DAVISON J, PAWLIK T M, et al. Resected pancreatic adenosquamous carcinoma: clinicopathologic review and evaluation of adjuvantchemotherapy and radiation in 38 patients [J]. Hum Pathol, 2010, 41(1): 113-122.
[11] MURAKAMI Y, YOKOYAMA T, YOKOYAMA Y, et al. Adenosquamous carcinoma of the pancreas: preoperative diagnosis and molecular alterations [J]. J Gastroenterol, 2003, 38(12): 1171-1175.
[12] YIN Q, WANG C, WU Z, et al. Adenosquamous carcinoma of the pancreas: multidetector-row computed tomographic manifestations and tumor characteristics [J]. J Comput Assist Tomog, 2013, r37(2): 125-133.
[13] INOUE T, NAGAO S, TAJIMA H, et al. Adenosquamous pancreatic cancer producing parathyroid hormone-related protein [J]. J Gastroenterol, 2004, 39(2): 176-180.
[14] KOBAYASHI N, HIGURASHI T, IIDA H, et al. Adenosquamous carcinoma of the pancreas associated with humoral hypercalcemia of malignancy (HHM) [J]. J Hepatobiliary Pancreat Surg, 2005, 15(5): 531-535.
[15] NA Y J, SHIM K N, CHO M S, et al. Primary adenosquamous cell carcinoma of the pancreas: a case report with a review of the Korean literature [J]. Korean J Intern Med, 2011, 26(3): 348-351.
[16] DING Y, ZHOU J, SUN H, et al. Contrast-enhanced multiphasic CT and MRI findings of adenosquamous carcinoma of the pancreas [J]. Clin Imaging, 2013, 37(6): 1054-1060.
[17] YIN Q, WANG C, WU Z, et al. Adenosquamous carcinoma of the pancreas: multidetector-row computed tomographic manifestations and tumor characteristics [J]. J Comput Assist Tomogr, 2013, 37(2): 125-133.
[18] KOSMAHL M, PAUSER U, PETERS K, et al. Cystic neoplasms of the pancreas and tumor-like lesions with cystic features: a review of 418 cases and a classification proposal [J]. Virchows Arch, 2004, 445(2): 168-178.
Manifestations of pancreatic adenosquamous carcinoma on dynamic contrast-enhanced CT
FU Yi1, XIAO Yaoxing2, ZHANG Xi1
(1. Department of Diagnostic Radiology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2. Department of Pathology,Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University,Shanghai 200032, China)
ZHANG Xi E-mail: zhangxi0009@163.com
Objective:To analyze the manifestations of pancreatic adenosquamous carcinoma on dynamic contrast-enhanced CT.Methods:Nine patients (6 men and 3 women; mean age, 58.7 years; range, 44-73 years) with pancreatic adenosquamous carcinoma confirmed by pathological examination underwent CT examination. The location, size, margin, contrast enhancement were evaluated.Results:The masses were localized in the pancreas (head in 3 cases, body and tail in 6 cases). The tumor size ranged from 2.0 cm×2.0 cm to 10.0 cm×6.6 cm, with an average size of 3.7 cm×4.8 cm. All masses were ill-de fined. Five masses invaded the peripancreatic tissues. The solid components’ CT values were (30.7±4.7) Hu, (60.2±14.5) Hu and (71.2±21.4) Hu on plan scan,arterial phase and portal vein phase. Eight masses with the presence of central necrosis showed heterogeneous and poorly enhanced areas. Only one tumor was moderately enhanced. Two patients with lesions in the head of pancreas had liver and lung metastases.Conclusion:CT imaging can provide useful information in the diagnosis of pancreatic adenosquamous carcinoma.
Pancreatic neoplasm; Computed tomography; Pancreatic carcinoma
R445.3
A
1008-617X(2017)04-0301-05
2016-12-25
2017-02-03)
国家自然科学基金项目(No:81271574);上海市自然科学基金项目(No:11ZR1407800)
张汐 E-mail:zhangxi0009@163.com

