微生物木聚糖酶的研究进展及其在食品领域的应用
温博婷,孙丽超,王凤忠,辛凤姣
中国农业科学院农产品加工研究所,北京 100193
微生物木聚糖酶的研究进展及其在食品领域的应用
温博婷,孙丽超,王凤忠,辛凤姣
中国农业科学院农产品加工研究所,北京 100193
木聚糖是半纤维素的主要组成成分,也是自然界第二丰富的可再生资源。木聚糖的结构稳定、组成复杂,很难在自然条件下自我降解,只有通过多种酶组成的木聚糖酶系的协同作用才可以更好地水解木聚糖或含有木聚糖的底物。木聚糖酶系主要由微生物产生,不同来源的木聚糖酶的性质存在较大差异。介绍了木聚糖水解酶系的组成和作用机理,木聚糖酶的分类和酶学性质,并对木聚糖酶在食品领域的应用进行了综述。
木聚糖;木聚糖酶;菌种;食品;应用
木聚糖是植物细胞壁的主要成分,但由于细胞壁的结构复杂使得木聚糖的工业化利用成为难题。微生物产生的木聚糖酶是木聚糖酶的主要来源,可将木聚糖降解为寡聚木糖、木糖和单糖。目前针对木聚糖酶的研究主要集中于木聚糖酶的菌种筛选和基因克隆表达。
1 木聚糖的结构组成
生物质资源是地球上最丰富的可再生资源,全球每年产生约2000亿吨的光合产物,其中木质纤维素成分占60%以上[1]。木质纤维素类资源在我国非常丰富,主要来源于林业、农业生产,造纸工业,木材工业以及许多的农用工业。木质纤维素由纤维素、半纤维素和木质素组成,其中半纤维素是自然界中仅次于纤维素的第二丰富的多糖。半纤维素包括木聚糖、木葡聚糖(D-木糖和D-葡萄糖的异质聚合物)、葡甘露聚糖(D-甘露糖和D-葡萄糖的异质聚合物)、半乳葡甘露聚糖(D-半乳糖、D-甘露糖和D-葡萄糖的聚合物)、阿拉伯半乳聚糖(D-半乳糖和阿拉伯糖的聚合物)。半纤维素、纤维素(β-1,4-葡聚糖)和木质素(复杂的多酚化合物)三者紧密缠绕,构成了植物细胞壁的主要成分。木聚糖是半纤维素的主要成分,是植物细胞的主要多糖结构,占所有可再生有机碳的1/3[2]。木聚糖通常存在于植物次生壁[3],大量存在于被子植物中的硬木(15%~30%的细胞壁成分)、裸子植物中的软木(7%~10%的细胞壁成分)以及一年生植物(<30%的细胞壁成分)[4]。在细胞壁中,木聚糖存在于纤维素和木质素的交界处,这对于植物细胞壁的纤维聚合力及完整性十分重要[5]。
2 木聚糖酶的组成及作用机理
木聚糖酶是一类可以将木聚糖降解成低聚木糖或木糖的复合酶系,主要包括内切β-l,4-D-木聚糖酶、β-D-木糖苷酶、α-L-呋喃阿拉伯糖苷酶、α-D-葡糖苷酸酶、α-D-葡萄糖醛酸苷酶、乙酰木聚糖酯酶和酚酸酯酶[6]。不同来源的木聚糖酶在主链的聚合度,支链的数量、种类、长度及其结合位点都有所不同。图1展示了木聚糖酶系的组成及其作用位点。降解木聚糖的过程中,外切酶与内切酶相互促进,加速了木聚糖的降解过程。①内切β-1,4-D-木聚糖酶(endo-β-1,4-D-xylanase,EC3.2.1.8),简称木聚糖酶,通常所说的木聚糖酶即指此酶,是木聚糖降解酶中最主要的酶,也是当前研究的热点。主要水解木聚糖主链的β-1,4-糖苷键,生成寡聚糖。②β-D-木糖苷酶(β-D-xylosidase,EC3.2.1.37),作用于寡聚木糖的还原端生成木糖。③α-L-呋喃阿拉伯糖苷酶(α-L-arabinofuranosidase)分为两种,一种是外切型酶(EC3.2.1.55),作用于α-硝基酚-呋喃型阿拉伯糖苷或者分支阿拉伯聚糖;另一种是内切1,5-α-L-阿拉伯聚糖酶(EC3.2.1.99),只对阿拉伯聚糖侧链有活性。④α-D-葡萄糖醛酸苷酶(α-D-glucuronidases,EC3.2.1.139),主要水解4-O-甲基葡萄糖醛酸与木糖之间的α-1,2-糖苷键,与木聚糖酶相互促进而加快木糖的产生。⑤乙酰木聚糖酯 酶(acetylxylan esterases,EC3.1.1.72), 作用 于木糖残基的C-2和C-3位上的乙酰基。⑥酚酸酯酶(phenol aid esterases)主要包括阿魏酸酯酶(feruloyl esterases,EC3.1.1.73)和香豆酸酯酶(p-coumaric acid esterases,EC3.2),前者可切除阿魏酸与阿拉伯糖残基之间的酯键,后者作用于香豆酸和阿拉伯糖残基之间的酯键。
有研究表明,有些木聚糖酶不能降解侧链被取代的木糖单元之间的糖苷键[8],而有些酶只能水解木寡糖上的侧链取代基[9]。Talaromyces thermophilus产生的α-L-呋喃阿拉伯糖苷酶可以促进固定化的木聚糖酶对小麦阿拉伯木聚糖的降解,同时产物木二糖和木糖的产量增加[10-11],由此得出了3种木聚糖降解酶的最优作用顺序:α-L-呋喃阿拉伯糖苷酶、木聚糖酶、β-D-木糖苷酶,在木聚糖酶中加入α-L-呋喃阿拉伯糖苷酶可以将水解率提高2倍[12]。这说明需要多种酶的协同作用才可以更好地水解木聚糖或含有木聚糖的底物。
3 木聚糖酶的分类及发酵研究
3.1 木聚糖酶的分类及酶学特性
第一次关于木聚糖酶的报道是在1955年,当时木聚糖酶被命名为聚戊糖酶(pentosanase)。在1961年经International Union of Biochemistry and Molecular Biology(IUBMB)认证,给予了分类编号EC3.2.1.8。木聚糖酶属于O-糖苷水解酶家族GH10和GH11,在GH5、GH7、GH8、GH16、GH26、GH43、GH52、GH62也有部分木聚糖酶,其中研究最多的是GH10和GH11家族。GH10家族的木聚糖酶分子量高,等电点低,有4~5个底物结合位点,是由8个α螺旋和8个β折叠构成的桶状结构,该家族的大部分木聚糖酶是从非还原端水解木糖之间的糖苷键的。目前获得的GH10家族的木聚糖酶基因序列已达上千条,生物多样性丰富,且大约60%来源于细菌。GH11家族的木聚糖酶分子量低,等电点高,双交换的催化机制,是由2个谷氨酸作为催化残基和2个或3个β折叠片组成的三级结构,唯一的一个α螺旋在第二个β折叠的疏水端。GH11家族的基因序列只有400多条,生物多样性较低,细菌来源的序列数量和真核生物来源的差不多。相比GH10家族,GH11家族的木聚糖酶的专一性更高,对长链的木聚糖底物的水解活性远高于GH10家族,因此,GH11家族木聚糖酶在工业生产中应用更为广泛。木聚糖酶通常为单体蛋白,分子量为8~145kDa,不同来源的木聚糖酶分子量差异较大。等电点为3~10的多数的木聚糖酶的最适反应pH值为4.0~7.0,最适反应温度为40~75℃。
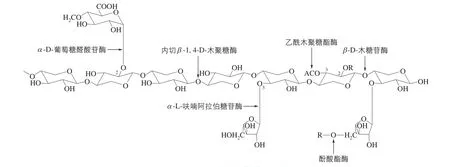
图1 木聚糖酶的作用位点
3.2 木聚糖酶的发酵生产
木聚糖酶主要由微生物分泌,已报道的能产生木聚糖酶的微生物有丝状真菌、细菌和链霉菌,同时藻类、原生动物、腹足类动物及节肢动物也可以产生木聚糖酶[13]。目前针对木聚糖酶的研究比较深入,菌种筛选、基因工程酶的构建表达及分离纯化、酶学性质的研究都有大量的报道[14-15]。
3.2.1 筛选天然菌株生产木聚糖酶
可应用于生产的可以分泌木聚糖酶的微生物主要是真菌和细菌,其中真菌主要包括曲霉、青霉等,细菌主要包括链霉菌和芽孢杆菌等。如表1,青霉Pol6的特色之处在于所分泌的胞外木聚糖酶的最适反应条件为酸性,可以应用较极端环境,如饲料和食品领域。米曲霉HML366所产生的木聚糖酶具有较好的热稳定性和pH耐受性,可以应用于造纸和生物能源领域。链霉菌CS624和短小芽孢杆菌SS1所分泌的木聚糖酶都可以高效酶解麦麸生成低聚木糖。异硫链霉菌LMZM以玉米芯为底物进行液体发酵,所产生的木聚糖酶用于纸浆漂白时可以提高纸张的亮度。纤维化纤维细菌CKMX1产生的木聚糖酶在pH5.0~9.0、温度50~60℃内活性稳定,可以在制浆造纸领域有广泛应用。由此可以看出,目前分泌木聚糖酶的微生物所利用的底物大多是廉价的木质纤维素类原料,利用农业废弃物秸秆等作为碳源和诱导物高效生产木聚糖酶,不但解决了资源浪费和环境污染问题,还可以使酶的生产成本降低,对木聚糖的工业化生产和应用具有深远意义。
木聚糖或含木聚糖的木质纤维素原料可以作为微生物生长的碳源,也可以成为木聚糖酶的诱导剂。通过筛选菌种获得木聚糖酶通常是诱导型的,也有极少数的木聚糖酶是组成型的。底物浓度过高或产物积累可能导致代谢阻遏或产物/底物抑制作用,同时由于木聚糖主链的聚合度不同,支链上残基在主链上的结合位点也不同,化学性质比较复杂,所以木聚糖的降解需要多种酶的协同作用才能实现。利用自然界中微生物之间的协同关系构建的复合菌系所产生的复合酶系就可以减少或消除这些抑制作用。
3.2.2 构建基因工程菌生产木聚糖酶
随着基因工程技术的不断发展,木聚糖酶基因可以在大肠杆菌、芽孢杆菌、酵母、丝状真菌表达系统中表达。表2列举了几种木聚糖酶的表达菌株及其酶学性质。如从嗜热裂孢菌克隆了XynA基因并在毕赤酵母X-33中表达,重组酶蛋白在pH6.0~9.0和60~80℃的环境中能维持60%的酶活性,由于其对pH和温度有较高的耐受性,使该酶具有较大的应用潜力。从芽孢杆菌中克隆到的木聚糖酶基因Xyn11A,该基因编码366个氨基酸,重组蛋白酶的最适反应温度为55℃。将黑曲霉IA-001的XynB基因进行优化,并克隆到毕赤酵母GS115中,优化后的重组蛋白比野生型酶活性提高了2.8倍,重组后的蛋白可以表达更高的木聚糖酶活。
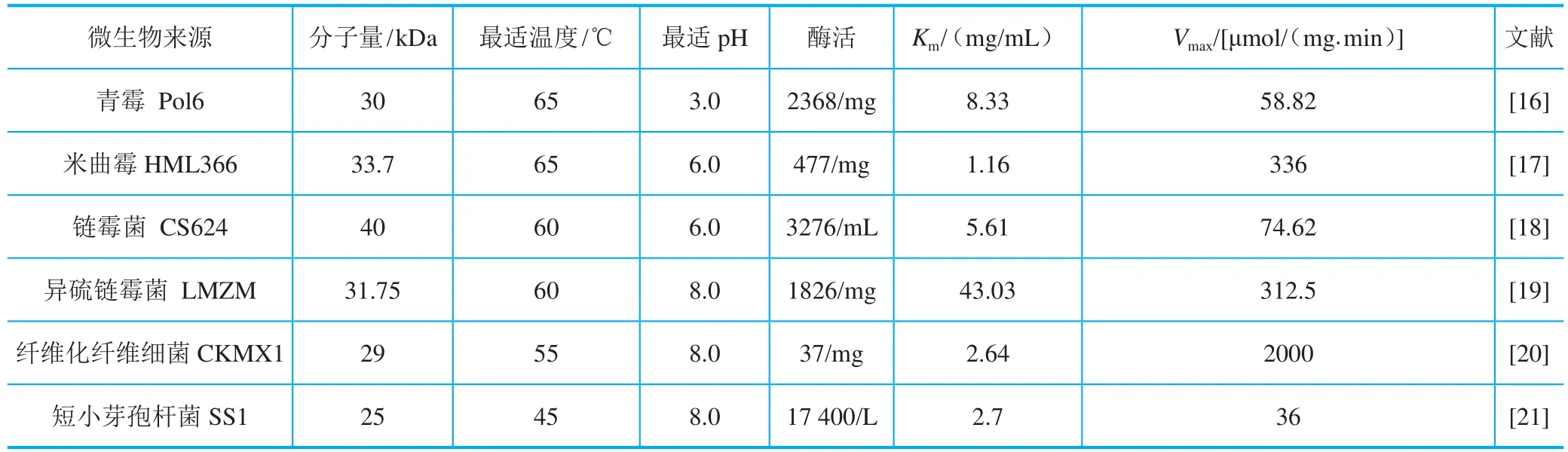
表1 筛选菌种分泌木聚糖酶及其酶学性质
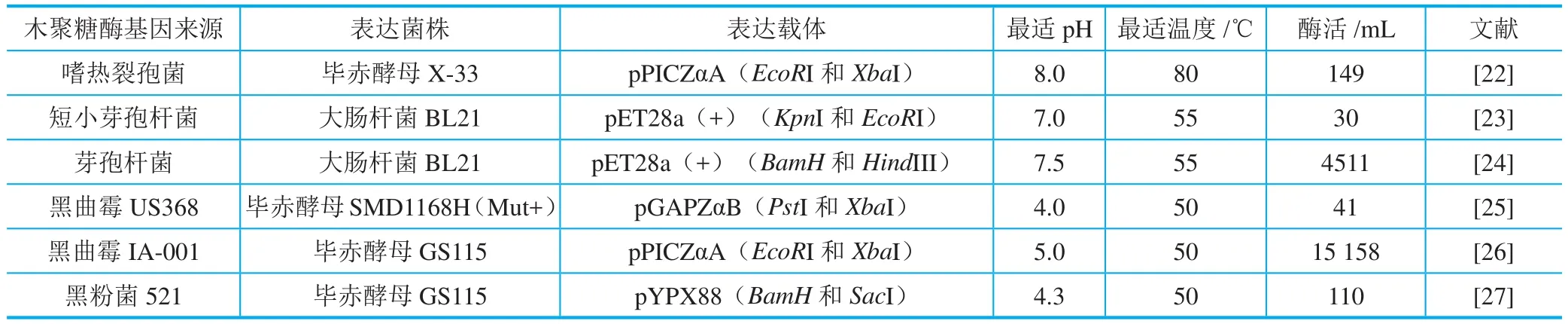
表2 木聚糖酶基因工程表达菌株和载体
目前木聚糖酶的生产主要有3个途径。①筛选可以分泌新型水解酶的微生物;②通过酶工程手段改造当前的工业菌株;③在生产过程中优化一些影响因子,如底物类型、培养条件、酶制剂的循环利用及生产流程的重新设计[28]。酶制剂生产成本是主要瓶颈问题。当前用于生产的木聚糖酶多来源于菌株发酵,虽然复合菌系分泌的复合木聚糖酶可以更好地减少底物抑制,但酶活较低;基因工程得到的单一重组蛋白虽具有更好的酶活性,但很难利用天然的木质纤维素,使成本增加。因此应针对不同应用领域及目的选择不同的技术手段。
4 木聚糖酶在食品领域的应用
木聚糖酶对人体健康有很多好处,如消化多纤维食物以获得更多的营养成分或减轻消化不良,可以增加肠道内利用木聚糖的益生菌等。木聚糖酶可广泛应用于造纸、食品、饲料及生物转化等行业。在食品领域,木聚糖酶目前主要应用于以下几个方面。
4.1 烘焙
在食品 烘焙方面,木聚糖酶在其中的作用主要是面粉改良剂,可以使面团具有更好的延展性以及较强的持气和产气能力。面粉改良剂包括化学改良剂和酶制剂改良剂,相比化学改良剂,酶制剂改良剂具有天然绿色、对人体无毒无害的优点。因此,绿色天然的酶制剂作为面粉改良剂具有很好的前景。小麦面粉中含有约2%的木聚糖成分,包括水溶性木聚糖和水不溶性木聚糖,其中水不溶性木聚糖占木聚糖总量的75%[29]。面粉中的水不溶性木聚糖会使面团体积减小,面团瓤的质构变差。利用木聚糖酶水解木聚糖生成的可溶性糖,可以增强面团的持气能力,使面包或馒头体积增大,同时还增加了面制品的糖度、膜强度及弹性。Doring等[30]将木聚糖酶加入到黑麦面粉中,面团的体积相比未添加酶的面团增加了10%。用于面粉改良的木聚糖酶中还含有较低活性的β-木糖苷酶等外切酶、较高活性的阿魏酸酯酶,可以使面粉中的水溶性木聚糖含量增加并且增强水溶性木聚糖的氧化凝胶作用[31]。
4.2 果蔬加工
在农产品提取方面,如果蔬、咖啡、植物油和淀粉的提取,需要先破碎细胞壁,而成熟的细胞壁主要由纤维素、半纤维素和果胶等物质组成。以新鲜的蔬菜和水果的加工提取为例,常见的方法,如榨汁、浸泡取汁不能充分提取到被纤维素、半纤维素和果胶所包裹的淀粉和维生素等成分,若采取酸碱、蒸煮的方法则会破坏果蔬本身的色香味。利用纤维素酶、木聚糖酶和果胶酶,可以在较温和的条件下软化组织、破碎细胞壁,充分提取具备原有风味的提取物[32]。
4.3 功能性低聚木糖制备
低聚木糖是目前市场上前景较好的功能性食品添加剂,黏度很低,比其他功能低聚糖更耐酸耐碱。低聚木糖可以显著增殖双歧杆菌;不会导致龋齿;促进人体对钙的吸收;具有甜味,但热量低且很难被人体消化,可供糖尿病等特殊人群食用[33]。内切型木聚糖酶酶解木聚糖后,经分离提纯即得到低聚木糖。由于利用的是内切型木聚糖酶,因此反应副产物较少,目前工业上都采用酶水解法制备低聚木糖[34]。
4.4 啤酒酿造
在麦类啤酒酿造方面,由于小麦啤酒中含有大量的戊聚糖及阿拉伯木聚糖,使得麦汁过滤成为难题。有研究表明,添加0.045%木聚糖酶可以使麦汁过滤速度加快1倍以上[35]。啤酒中含有电解质、维生素、多糖类、多肽类以及多种有机酸、酚、酮类物质,这些成分可以促进人体的消化吸收,增强血液循环。因此啤酒可以作为功能性食品的基质,适合开发富含低聚木糖的功能性啤酒[36-37]。
5 展 望
木聚糖酶广泛分布在微生物中,由于可以降解木聚糖成分,而成为自然界碳循环中一种很重要的酶。木聚糖酶在饲料、食品、造纸和生物能源等多个领域中有重要的应用,具有较高的商业价值和市场潜力。目前关于木聚糖酶的研究主要集中于高产木聚糖酶菌株的选育、复合菌系及复合酶系的构建、基因工程菌的构建、培养条件的优化、酶学性质及酶的纯化研究,以及耐高温、耐酸碱、无纤维素酶污染的木聚糖酶的筛选等。但如何获得低成本、高催化效率的木聚糖酶是当前木聚糖酶工业化生产应用的主要瓶颈问题。可以考虑利用富含木质纤维素成分的农业废弃物作为底物,为工业化生产木聚糖酶提供了更为广泛且廉价的原料,并针对不同应用领域及目的而选择不同的技术手段筛选木聚糖酶。
[1] SIMON J,MÜLLER H P,KOCH R,et al. Thermoplastic and biodegradable polymers of cellulose[J]. Polymer Degradation and Stability,1998,59(1):107-115.
[2] WHISTLER R L,MASEK E. Enzymatic hydrolysis of xylan[J].Journal of American Chemical Society,1955,77(5):1241-1243.
[3] WONG K K Y,TAN L U L,SADDLER J N. Multiplicity of beta-1,4-xylanases in microorganisms:functions and applications[J].Microbiology Review,1988,52(3):305-317.
[4] SINGH S,MADLALA A M,PRIOR B A. Thermomyces lanuginosus:properties of strains and their hemicellulases[J]. FEMS Microbiology Review,2003,27(1):3-16.
[5] BEG Q K,KAPOOR M,MAHAJAN L,et al. Microbial xylanases and their industrial applications:a review[J]. Applied Microbiology and Biotechnology,2001,56(3):326-338.
[6] SUNNA A,ANTRANIKIAN G.Xylanolytic enzymes from fungi and bacteria[J]. Critical Reviews in Biotechnology,1997,17(1):39-67.
[7] 孙振涛,赵祥颖,刘建军,等. 微生物木聚糖酶及其应用[J].生物技术,2007,17(2):93-97.
[8] LEE S F,FORSBERG C W. Purification and characterization of an alpha-L-arabinofuranosidase fromClostridium acetobutylicumATCC824 [J]. Canada Journal of Microbiology,1987,33:1011-1016.
[9] POUTANEN K,TENKANEN M,KORTE H,et al. Accessory enzymes involved in the hydrolysis of xylans[M]//LEATHAM G F,HIMMEL M E. Enzymes in Biomass Conversion. Washington,DC:American Chemical Society,1991:426-436.
[10] GUERFALI M,GARGOURI A,BELGHITH H. Catalytic properties ofTalaromyces thermophilus,α-L-arabinofuranosidase and its synergistic action with immobilizedendo-β-1,4-xylanase[J]. Journal of Molecular Catalysis B Enzymatic,2011,68(2):192-199.
[11] RAHMAN A K,SUGITANI N,HATSU M,et al. A role of xylanase,alpha-L-arabinofuranosidase,and xylosidase in xylan degradation[J]. Canadian Journal of Microbiology,2003,49(1):58-64.
[12] KAMBOUROVA M,MANDEVA R,FIUME I,et al. Hydrolysis of xylan at high temperature by co-action of the xylanase fromAnoxybacillus flavithermusBC and the beta-xylosidase/alphaarabinosidase fromSulfolobus solfataricusOalpha[J]. Journal of Applied Microbiology,2007,102(6):1586-1593.
[13] PRADE R A. Xylanases:from biology to biotechnology[J].Biotechnology and Genetic Engineering Reviews,1996,13(1):101-131.
[14] 王丹丹,周晨妍,付冠华. 木聚糖酶基因克隆和表达的研究进展[J].中国生物制品学杂志,2013,26(8):1193-l196.
[15] DOMINGUEZ N,MANUEL E,LAURA I,et al. Prebiotic effect of xylooligosaccharides produced from birchwood xylan by a novel fungal GH11 xylanase[J]. Food Chemistry,2017,232:105-113.
[16] DRISS D,BHIRI F,SIELA M,et al. Puri fi cation and properties of a thermostable xylanase GH 11 fromPenicillium occitanisPol6 [J].Applied Biochemistry and Biotechnology,2012,168 (4):851-863.
[17] HE H,QR N Y,LI N,et a1. Purification and characterization of a thermostable hypothetical xylanase fromAspergillus oryzaeHML366[J]. Applied Biochemistry and Biotechnology,2015,175(6):3148-3161.
[18] MANDER P,YUN H C,PRADEEP G C,et a1. Biochemicalcharacterization of xylanase produced fromStreptomyeessp.CS624 using an agro residue substrate[J]. Process Biochemistry,2014,49(3):45l-456.
[19] LUO L,CAI J,WANG C,et a1. Puri fi cation and characterization of an alkaliphilicendo-xylanase fromStreptomyces althioticusLMZM and utilization in pulp industry[J]. Journal of Chemical Technology Biotechnology,2015,91(4):165-171.
[20] WALIA A,MEHTA P,CHAUHAN A,et a1. Purification and characterization of cellulase-free low molecular weightendoD-1,4 xylanase from an alkalophilicCellulosimicrobium cellulansCKMXI isolated from mushroom compost[J]. World Journal of Microbiology and Biotechnology,2014,30(10):2597-2608.
[21] BAJAJ B K,KHAJURIA Y P,SINGH V P. Agricultural residues as potential substrates for production of xylanase from alkalithermotolerant bacterial isolate[J]. Biocatalysis and Agricultural Biotechnology,2012,1(4):314-320.
[22] ZHAO L,GENG J,GUO Y,et al. Expression of theThermobifida fuscaxylanase Xyn11A inPichia pastorisand its characterization[J].Bmc Biotechnology,2015,15(1):18-29.
[23] GOSWAMI G K,KRISHNAMOHAN M,NAIN V,et al. Cloning and heterologous expression of cellulose free thermostable xylanase fromBacillus brevis[J]. Springer Plus,2014,3(1):1-6.
[24] BAI W,XUE Y,ZHOU C,et al. Cloning,expression,and characterization of a novel alkali-tolerant xylanase from alkaliphilicBacillussp. SN5[J]. Biotechnology and Applied Biochemistry,2015,62(2):208-217.
[25] ELGHARBI F,HMIDA-SAYARI A,ZAAFOURI Y,et al.Expression of anAspergillus nigerxylanase in yeast:application in breadmaking andin vitrodigestion[J]. International Journal of Biological Macromolecules,2015,79:103-109.
[26] GAO H,YAN P,ZHANG B,et al. Expression ofAspergillus nigerIA-001endo-β-1,4-xylanase inPichia pastorisand analysis of the enzymic characterization[J]. Applied Biochemistry and Biotechnology,2014,173(8):2028-2041.
[27] HAN H,YOU S,ZHU B,et al. Characterization and high expression of recombinantUstilago maydis,xylanase inPichia pastoris[J].Biotechnology Letters,2015,37(3):697-703.
[28] HOWARD R L,ABOTSI E,VAN RENSBURG E J,et al. Lignocellulose biotechnology:issues of bioconversion and enzyme production[J]. African Journal of Biotechnology,2004,2(12):602-619.
[29] 周素梅,向波,王璋,等.小麦面粉中阿拉伯木聚糖研究进展[J].粮油食品科技,2001,9(2):20-30.
[30] DÖRING C,HUSSEIN M A,JEKLE M,et al. On the assessments of arabinoxylan localization and enzymatic modi fi cations for enhanced protein networking and its structural impact on rye dough and bread[J]. Food Chemistry,2017,229:178-187.
[31] 沃尔夫冈·埃拉. 工业酶:制备与应用[M]. 北京:化学工业出版社,2006.
[32] 徐君飞,张居作. 木聚糖酶的应用研究进展[J]. 农产品加工,2007,8:58-59.
[33] 许正宏,熊筱晶,陶文沂. 低聚木糖的生产及应用研究进展[J]. 食品与发酵工业,2001,28(1):33-56.
[34] 吕银德,赵俊芳. 功能性低聚木糖的研究进展[J]. 农产品加工·学刊,2011,6:96-98.
[35] 杨观中. 真菌木聚糖酶在小麦啤酒酿造中的应用[J]. 酿酒,2007,34(1):51-53.
[36] 周涛. 利用低聚糖浆研制低发酵度功能性啤酒[J]. 啤酒科技,2004,10:30-31.
[37] 刘国锋,王颖,郭学武,等. 木聚糖酶在功能性啤酒中的应用[J]. 酿酒科技,2013,2:65-67.
Advances in microbial xylanase and its application in food industry
WEN Boting,SUN Lichao,WANG Fengzhong,XIN Fengjiao
Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China
Xylan is the main component of hemicellulose and also the second most abundant renewable resource in nature.Due to the stable and complex structure of xylan, it is dif ficult to degrade itself under natural condition. So a variety of enzymes are needed to better hydrolysis xylan or substrate which contained xylan. Xylanase system is mainly produced with microorganisms, and characteristics are different between different sources of xylanase. This paper described the composition and hydrolysis mechanism, the classi fication and enzyme characteristic, and the application of xylanase in food field.
xylan; xylanase; strain; food; application
10.3969/j.issn.1674-0319.2017.05.014
温博婷,助理研究员。研究方向:生物酶研究与应用。E-mail:botingw@126.com
王凤忠,研究员。研究方向:功能食品与生物活性物质。E-mail:wangfengzhong@sina.com辛凤姣,研究员。研究方向:生物酶研究与应用。E-mail:xinfengjiao@caas.cn
国家重点研发计划重点专项(2017YFD0400200),国家自然科学基金面上项目(31571963)

