小剂量MA与CAG方案诱导治疗老年急性髓系白血病的效果比较
张春静 姜中兴 田文亮 郭荣 李英梅 李丽
(郑州大学第一附属医院 血液科 河南 郑州 450052)
小剂量MA与CAG方案诱导治疗老年急性髓系白血病的效果比较
张春静 姜中兴 田文亮 郭荣 李英梅 李丽
(郑州大学第一附属医院 血液科 河南 郑州 450052)
目的对比分析采用小剂量米托蒽醌、阿糖胞苷(MA)与阿克拉霉素、阿糖胞苷、G-CSF(CAG)方案诱导治疗老年急性髓系白血病(AML)患者的效果。方法回顾性分析2012年5月1日至2016年5月1日郑州大学第一附属医院连续收治的100例年龄≥60岁确诊AML患者的临床资料。其中,NPM1+FLT3-ITD-者占10%(10/100),46例采用小剂量MA方案诱导化疗,54例采用CAG方案诱导化疗,诱导化疗后评价效果。与CAG组相比,小剂量MA化疗组患者发病时WBC显著升高(P=0.005),FLT3-ITD+患者比例显著升高(P=0.006)。结果5例(5%)早期死亡,70例(70.0%)患者在接受第1个诱导化疗后获得缓解,54例(54.0%)获得完全缓解(CR),16例(16.0%)获得部分缓解(PR),其中46例应用小剂量MA方案化疗的患者中,24(52.2%)例达到CR,6例(6.0%)达到PR,总有效率为65.2%。54例老年AML应用CAG方案诱导化疗,30例(55.6%)例达到CR,10例(18.2%)达到PR,总有效率为71.4%,两组方案的CR、总CR差异无统计学意义(P=0.735,0.335)。两组化疗不良反应差异无统计学意义(P均>0.05)。结论老年AML患者应用小剂量MA与CAG诱导化疗治疗效果相似,且未增加患者的不良反应,为白细胞增高患者的另一选择。
老年;急性髓系白血病;诱导化疗方案
随着我国进入老龄化社会,加之环境因素影响,每10万人中约有4人发生急性白血病[1]。急性髓系白血病(acute myeloid leukemia,AML)约占急性白血病总发病人数的70%[1]。美国癌症组织[2]估计美国2013年约有14 590例新发的AML患者(中位年龄为65岁),10 370例死于AML。所以AML是老年人中较为高发的肿瘤之一,老年AML患者年龄为65~70岁,其基础病、合并症多,化疗耐受性差等因素使治疗相关死亡率高达25%,完全缓解(complete remission,CR)率仅为33%~45%,无病生存(disease-free survival,DFS)率仅为20%,生存期(overall survival,OS)率低于10%[3]。按照中国AML治疗指南,年龄≥60岁的AML患者诱导方案仍推荐缓解率较低的标准剂量的“7+3”方案,同时推荐了CAG[阿克拉霉素(Acla)、阿糖胞苷(Ara-C)、G-CSF]方案为主的预激方案,一些回顾性研究显示了CAG方案的优势。但国外的研究力求提高标准方案中蒽环类药物的剂量,高剂量的蒽环类药物确实提高了老年急性髓系白血病患者的CR率[4],但是由于老年患者的基础病存在,在一定程度上也增加了患者早期死亡风险,对长期生存无改善。本研究回顾性分析老年AML应用小剂量的MA和CAG方案诱导化疗的效果及预后因素。
1 资料与方法
1.1一般资料选取2012年5月至2016年5月郑州大学第一附属医院连续收治的100例老年AML患者,经MICM分型确诊的年龄>60岁的AML。诊断标准均参照张之南主编的《血液病诊断与疗效标准》[5]。
1.2治疗方法
1.2.1诱导化疗 46例采用MA方案:MIT(山东罗欣股份有限公司产品),1.4 mg/(m2·d)静脉滴注,d1~9;Ara-C,70 mg/(m2·d),d1~7。54例患者采用CAG:Acla,20 mg/d静脉滴注,d1~4;Ara-C,10 mg/m2静脉滴注,1次/12 h,d1~14;G-CSF,200 μg/(m2·d)皮下注射,d1~14,至外周血白细胞>20×109/L停药。
1.2.2支持治疗 HGB<70 g/L或出现明显贫血症状时给予输注悬浮红细胞。PLT<20×109/L输注机采血小板。中性粒细胞绝对计数(ANC)<0.5×109/L给予G-CSF,200 μg/(m2·d),皮下注射。
1.3疗效评估CR:骨髓中无AML细胞(原始细胞<0.05),无髓外白血病症状,ANC>1×109/L,HGB>100 g/L,PLT>100×109/L,达到以上标准并维持4周以上。总CR率:随访期达到CR患者比例。早期死亡:在治疗效果可以评估前死亡。复发:获得CR患者骨髓原始细胞再次>0.05或出现髓外浸润。DFS时间:获得CR患者,从CR之日至复发或者CR状态下死亡的时间。OS时间:所有患者从诊断之日至死亡或末次随访的时间。
1.4随访通过电话或查阅门诊、住院AML患者病例资料的方式进行随访,随访时间截止至2016年5月1日。
1.5统计学处理使用SPSS 17.0统计学软件进行数据分析,疗效参数采用χ2检验,分子生物学资料的组间比较应用非参数检验中两独立样本Mann-WhitneyU秩和检验法,以P<0.05为差异有统计学意义。
2 结果
2.1诊断时患者特征100例患者中,男性56例(56%),中位年龄65(60~75)岁。发病时中位血细胞数:WBC,9.34(0.3~293.7)×109/L,HGB,81(44~148)g/L,PLT,37.5(1~229)×109/L,骨髓原始细胞为0.483(0.175~0.944)。FAB分型:M0 6例(6.0%)、M1 2例(2.0%)、M2 54例(54.0%),M4 6例(6.0%),M5 30例(30.0%),M6 2例(2.0%)。染色体预后良好、中等、不良分别占4.0%、84.0%、12.0%。NPM1+FLT3-ITD-患者占10.0%(10/100),FLT3-ITD+患者占12%(12/100),AML-ETO+c-Kit+患者占2.0%(2/100),AML-ETO+c-Kit-患者占2.0%(2/100),c-Kit+患者占2.0%(2/100)。与CAG方案化疗组比较,小剂量MA化疗方案患者发病初诊时WBC显著升高(P=0.005),FLT3-ITD+患者比例显著升高(P=0.006),其余临床特征差异无统计学意义(P均>0.05)。见表1。
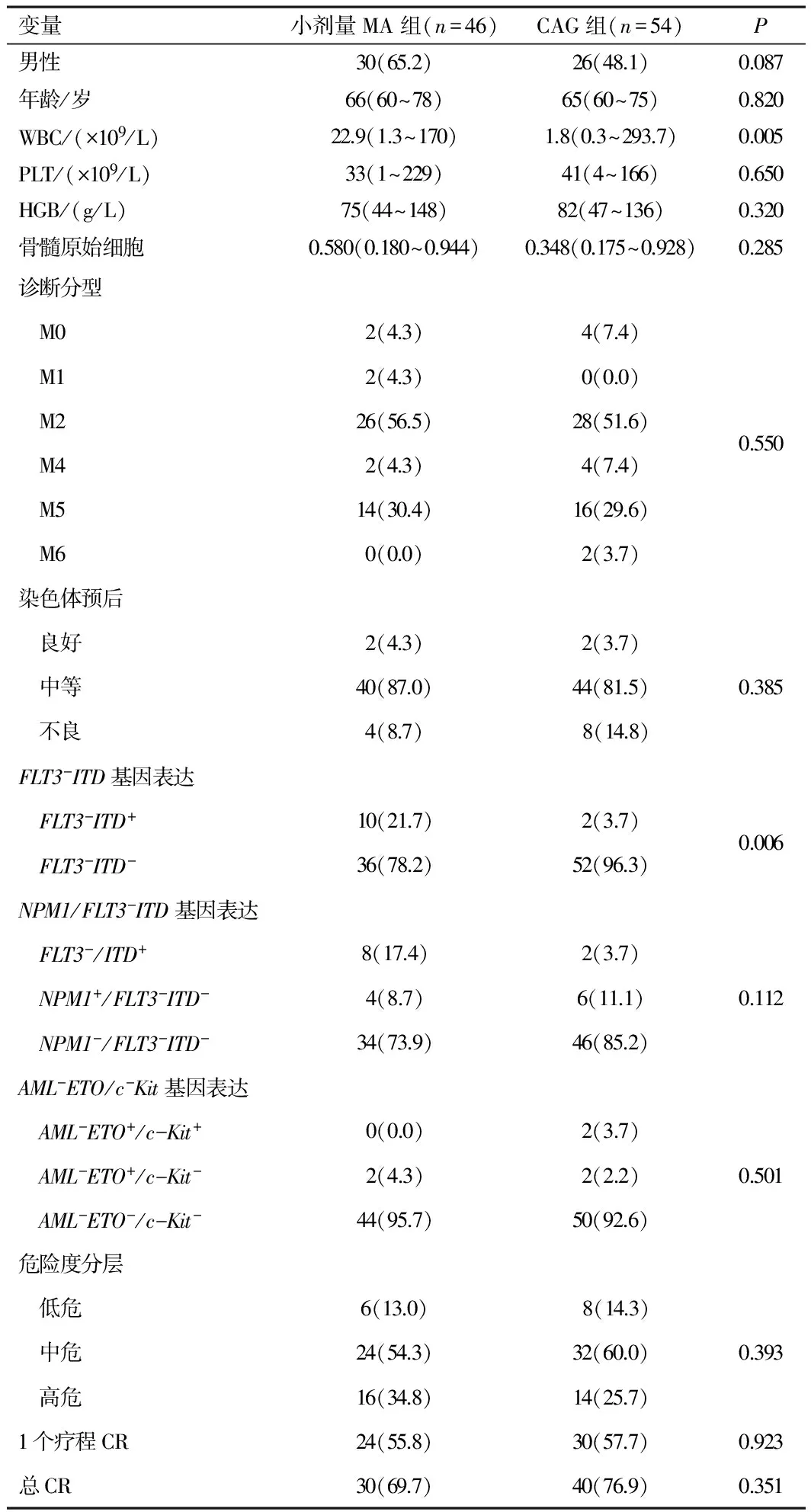
表1 两组临床、分子生物学特征及治疗效果比较[n(%)]
注:按年龄<70岁、CR及伴NPM1+FLT3-ITD-表达3个独立预后因素进行危险度分层,无不良预后因素为低危,具备1个不良预后因素为中危,具备2个及以上不良预后因素为高危。
2.2诱导化疗100例患者中,5例(5%)早期死亡,70例(70.0%)患者在接受第1个诱导化疗后获得缓解,54(54.0%)例获得CR,16例(16.0%)获得部分缓解(partial remission,PR),其中46例应用小剂量MA方案化疗的患者中,24(52.2%)例达到CR,6例(13.0%)达到PR,总有效率为65.2%,54例老年AML应用CAG方案诱导化疗,30例(55.6%)达到CR,10例(18.5%)达到PR,总有效率为74.1%。两组方案的CR、总CR差异无统计学意义(P=0.735,0.335)。本研究中年龄>70岁患者中,应用小剂量MA方案组与CAG方案化疗组CR率分别为18.2%和26.3%(P=1.000),早期死亡率分别为27.2%和10.7%(P=0.327)。年龄≤70岁的患者,应用小剂量MA方案组与CAG方案化疗组总CR率分别为62.9%和71.4%(P=0.445),早期死亡率分别为0%和0%。两组患者发生早期死亡主要原因为肺部感染、呼吸衰竭及脑出血等。
2.3化疗不良反应两组化疗方案不良反应主要包括骨髓移植、肺部感染、出血、胃肠道反应及肝功能损害,大部分患者经输成分血、G-CSF及抗感染等对症支持治疗可耐受。有4例直接死于并发症,其中1例死于脑出血,3例死于肺部感染(表2)。本研究显示两组诱导化疗方案骨髓抑制、出血及胃肠道反应等不良反应差异无统计学意义(P>0.05)。其中骨髓抑制期,全部患者中性粒细胞恢复至>0.5×109/L的中位时间为16(12~52)d,PLT恢复至>20×109/L的中位时间为17.5(12~28)d,血小板中位输注量为3(0~11)个治疗量,输悬浮红细胞6(0~18)U。小剂量MA与CAG组中性粒细胞恢复时间、血小板恢复时间及血小板输注量(4个治疗量比2.5个治疗量)、输注悬浮红细胞(6 U比4 U)差异无统计学意义(P>0.05)。

表2 小剂量MA与CAG诱导化疗不良反应比较(n)
2.4生存期随访至2016年5月1日,全部患者中位生存时间6.0(0.5~36.0)个月,随访发现,应用小剂量MA与CAG方案的患者3个月的生存率分别为69.6%和72.2%,6个月生存率分别为50.0%和50.0%,1年生存率分别为19.6%和23.9%,2年生存率分别为15.2%和14.8%,两组生存率差异无统计学意义(χ2=0.024,P=1.00)。
3 讨论
年龄>60岁的人群中,AML发病率达14/10万,美国癌症组织研究显示[2],美国2013年约有14 590例新发的老年AML患者(中位年龄为65岁),死亡率高达71.1%。随着社会老龄化,AML治疗日益受到人们关注。目前老年AML的治疗方法尚未统一,根据中国急性髓系白血病指南可选择支持治疗、低剂量化疗、标准剂量化疗、强烈化疗、临床试验性治疗和造血干细胞移植等治疗方法[6]。
Thomas等[4]报道了应用MA(米托蒽醌45 mg/m2,d1~3;阿糖胞苷500 mg/m2,d1~7)与应用标准剂量方案治疗难治和复发AML,其CR率分别为63%(39/62)和58%(60/103),总有效率分别为94%和83%,差异无统计学意义(P>0.05)。但大剂量的米托蒽醌组血液毒性高,血象中白细胞>1.0×109/L和粒细胞>0.5×109/L所需时间分别为33(23~61)d和34(22~47)d,且53%的AML患者有严重的感染,早期死亡率为6.5%,中位生存期为8.1个月。也有相关研究应用低剂量MA联合小剂量美法兰治疗9例老年AML或高危MDS患者,其CR为33%,中位OS为326 d,早期死亡率为11%[7]。总体上,相关文献报道老年AML患者接受诱导缓解化疗CR率为42%~60%,中位生存时间为5~10个月,大剂量的化疗药物可以提高老年AML的CR率,但导致老年AML患者的骨髓抑制Ⅲ~Ⅳ级发生率增加,强烈化疗并不优于减低剂量化疗方案。加大化疗药物的剂量,虽然缓解率提高,但化疗药物的不良反应增加,增加了治疗相关病死率。对于不能耐受标准剂量化疗的老年AML,低剂量的化疗不仅降低了早期死亡率,长期生存时间也无差异。同样本研究采用小剂量MA与CAG方案诱导化疗老年AML,总CR率分别为65.2%和74.1%,早期死亡率为5.0%,2年生存率分别为15.2%和14.8%,与国内外相关文献相比本组患者总体CR率较高,考虑与患者ECOG评分均在2分以下,均进行了小剂量MA或CAG方案诱导及相应的诱导后治疗有关。Li等[8]采用多中心实验,登记了112例老年AML(包括初诊、复发、难治的患者)和骨髓增生异常综合征(MDS)患者应用CAG方案化疗,CR率为30.8%(8/26),PR率为42.3%(11/26),总有效率达73.1%。62例难治性老年AML患者中,30例(48.4%)得到完全缓解,18(29%)得到部分缓解,总有效率为48例(77.4%),也证实了老年患者获益于CAG诱导化疗方案。小剂量MA诱导化疗老年AML与CAG方案相比疗效相同,生存时间、骨髓抑制等不良反应差异均无统计学意义(P>0.05)。对于初诊白细胞增高老年AML患者,小剂量MA方案是一种可行的治疗方案。
结合我国老年人基础病多,一般状态差,心脏疾病、肾脏疾病等老年多发疾病都会影响化疗药物在体内代谢,导致老年AML对化疗药物不耐受。本研究中应用减低剂量MA方案诱导化疗老年AML治疗效果与CAG方案差异无统计学意义(P>0.05),在患者不宜接受强化疗时,应用CAG方案与小剂量MA方案不失为一个可行的选择,可延长老年AML的OS。在我国,CAG方案已广泛应用于AML和MDS。但对于不良核型的或高危老年AML患者,传统的诱导化疗缓解率低。目前为提高CR和OS,国内外研究者不断探讨新的方案以期提高患者的长期生存时间同时降低治疗相关死亡率,新药如克拉曲滨、DNA去甲基药物单用或联合其他药物。也有相关研究证实应用地西他滨联合CAG方案的多项临床试验结果均肯定了去甲基化药物单用或联合其他药物治疗预后差的老年初诊AML能够延长OS期,提高缓解率,其安全性及可耐受性亦得到肯定。Park等[9]单用去甲基药物地西他滨治疗中位年龄为72岁的中、高危老年AML(58例)CR率为42.9%,OS和PFS分别为302 d和284 d。这些新药的研究为老年AML患者带来了新的希望。
多项研究显示,老年患者的预后较年轻患者差,其主要原因为老年患者基础疾病多、脏器功能差、对药物不良反应耐受性差,治疗AML药物相关不良反应大,常伴有预后不良的染色体核型存在及耐药基因的过度表达,因此,如何提高老年AML的疗效,延长生存期及改善生存质量成为目前亟待解决的问题。Tasaki等[10]的研究显示,65~74岁、75~79岁、80~84岁的3组患者CR率分别为50%、53.8%、42.9%;年龄<75岁、≥75岁中位生存时间分别为14个月和7个月,2年存活率分别为13%和5%。本研究年龄>70岁患者中,应用小剂量MA方案组与CAG方案化疗组CR率分别为18.2%和26.3%,早期死亡率分别为27.2%和10.7%,其CR率较低,可能与本研究中年龄>70岁的老年AML的脏器功能差、对化疗耐受性差、染色体复杂核型多见有关。相关研究证实年龄是老年白血病预后不良因素,但绝非独立因素,染色体核型是目前认为最重要的老年AML预后因素,刘辉等[11]回顾性分析了123例老年AML染色体核型分布特征,117例老年AML染色体检测成功,其中良好预后核型16例(13.7%),中等预后核型54例(46.1%),不良预后核型47例(40.2%),其他出现的不良预后核型包括5q-、7q-、t(9;21)的11q23的异常及t(9;22)。大量研究显示具有良好及中等细胞遗传学且患者一般情况良好的情况下,可以给予联合诱导化疗,而含有预后不好的细胞遗传学患者,可以应用新药或进入临床试验研究。本组研究中,患者中位年龄为65(60~75)岁,预后良好染色体占4.0%(4/100),伴有-5、-7或复杂核型等预后不良染色体占12%(12/100)。随着AML分子研究机制越来越清晰,其治疗手段越来越靶向化、规范化,相信疗效一定可以提高,FLT3阳性被广泛认为是AML患者预后不良的因素,目前针对该基因新的靶向治疗药物索拉菲尼的问世,为AML的治疗带来希望。刘莎等[12]研究了应用索拉菲尼治疗FLT3阳性的AML患者,其CR率为77.8%,提高了患者的CR。
本研究应用CAG与小剂量MA方案治疗老年AML,两组诱导化疗方案不良反应主要包括骨髓移植、肺部感染、出血、胃肠道反应及肝功能损害,大部分患者经输成分血、G-CSF及抗感染等对症支持治疗可耐受。本研究显示两组诱导化疗方案的不良反应差异无统计学意义(P>0.05)。
总之,老年患者基础病多、对药物的代谢慢,对于老年AML的治疗要根据白细胞计数、染色体核型等综合评价,可以选择低毒性、高效、耐受性好的个体化方案及新药治疗来提高CR,延长生存时间。通过相关文献分析,CAG方案对于初诊时WBC不高的老年AML是一个可行性治疗方案。故本研究对比了CAG与小剂量MA方案效果,两种方案在治疗效果上相似,并且小剂量的MA为初诊时白细胞增高时的老年AML的一种可行性选择。
[1] Brunning R D. Classification of acute leukemias[J]. Semin Diagn Pathol,2003,20(3):142-153.
[2] Brandwein J M, Geddes M, Kassis J, et al. Treatment of older patients with acute myeloid leukemia (AML): a Canadian consensus[J]. Am J Blood Res,2013,3(2):141-164.
[3] Sudo K, Ema H, Morita Y, et al. Age-associated characteristics of murine hematopoietic stem cell[J]. J EXP Med,2000,192(9):1273-1280.
[4] Thomas X, Elhamri M, Chelghoum Y, et al. Intensive chemotherapy with mitoxantrone administered as a single injection in patients with high-risk acute myeloid leukemia :results of the MEA 2000 trial[J].Ann Hematol,2005,84(6):376-382.
[5] 张之南.血液病诊断与疗效标准[M].第3版.北京:科学出版社,2007:131-134.
[6] 中华医学会血液学分会.成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2011年版)[J].中华血液学杂,2011,32(11):804-807.
[7] Yamauchi T, Negogo E, Aral H, et al. Combined lowdose cytarabine, melphalan and mitoxantonefor older patients with acute myeloid leukemia or high-risk myelodysplastic syndrome[J]. Anticancer Research,2007,27(4C):2635-2639.
[8] Li J M, Shen Y, Wu D P, et al. Aclarubicin and low-dose cytosine arabinoside in combination with granulocyte colony-stimulating factor in treating acute myeloid leukemia patients with relapsed or refractory disease and myelodysplastic syndrome: a multicenter study of 112 Chinese patients[J]. Int J Hematol,2005,82(1):48-54.
[9] Park H, Cho H, Lee J, et al. Treatment choice of decitabine versus conventional chemotherapy for the treatment of elderly patients with newly diagnosed acute myeloid leukemia[J]. Blood,2015,126(23):4922-4971.
[10] Tasaki T, Yamauchi T. The response to induction therapy is crucial for the treatment outcomes of elderly patients with acute myeloid leukemia: single-institution experience[J]. Anticancer Research,2014,34(10):5631-5636.
[11] 刘辉,裴蕾,宁尚勇,等.123例老年急性髓系白血病患者单体核型分布特征[J].中华老年医学杂志,2015,10(34):1091-1093.
[12] 刘莎,魏旭东,尹青松,等.索拉菲尼联合化疗治疗FLT3突变阳性急性髓系白血病九例报告并文献分析[J].中华血液学杂志,2015,3(36):241-243.
ComparisonoftherapueticefficaciesofMAandCAGinductionchemotherapyregimeninelderlyacutemyelogenousleukemiapatients
Zhang Chunjing, Jiang Zhongxing, Tian Wenliang, Guo Rong, Li Yingmei, Li Li
(DepartmentofHematology,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052 ,China)
ObjectiveTo analyze the difference of therapuetic efficacies of MA and CAG induction chemotherapy regimen in elderly acute myelogenous leukemia (AML) patients.MethodsFrom May of 2012 to May of 2016, the clinical data of 100 consecutive hospitalized 60-plus-year-old AML patients were retrospectively analyzed.NPM1+FLT3-ITD-accounted for 10 cases (10%), 46 patients
MA regimen and 54 patients received CAG regimen, MA group had higher WBC andFLT3-ITD+positive mutations at diagnosis compared with CAG group (P=0.005,P=0.006).ResultsFive patients (5%) died in early phase. Complete remission (CR) rate after the first cycle of induction chemotherapy was 54.0% (54/100), overall CR rate was 70.0%(70/100), CR rate after the first cycle of induction chemotherapy and overall CR rate were indiscriminate between MA and CAG regimen. Two groups of adverse reaction of chemotherapy were indiscriminate (P>0.05).ConclusionThere is indiscrimination of efficacy among MA and CAG induction chemotherapy in old AML patients.
elder;acute myeloid leukemia ;induction chemotherapy
R 733.71doi: 10.3969/j.issn.1004-437X.2017.17.005
2016-12-06)
姜中兴,E-mail: jiangzx313@126.com。

