浅谈如何在元素复习中运用坐标图进行复习《从自然界获取铁和铜》单元复习有感
朱蓉玲
【分类号】G633.8
一、教材分析
本节课选自苏教版化学必修1专题3第二单元第一课时,教材主要介绍了铁、铜在自然界的主要存在形式,以及高炉炼铁的原理、设备、原料、反应过程与产物,最后简单介绍了几种工业炼铜的方法。
本节课编排在铝的学习之后,是对金属元素学习的延伸,并且继铝土矿中铝的提取之后,從铁、铜的存在和提取着手,介绍了它们的冶炼方法,能加深学习者对本专题的“从矿物到基础材料”的理解,通过对这些元素的制备、性质等的探究,学生能进一步体验化学研究方法和途径,同时也在巩固铁、铜相关的性质和化学反应的基础上获得新的知识建构。其中铜的冶炼方法中初步涉及铜的冶炼方法,这为必修2中粗铜精炼的学习打下基础
针对教材安排本节复习课的设计打破了以往元素化合物复习过程中“结构—性质—制备—用途”的传统模式,而是从大家熟悉的有关铁和铜的相关物质入手,找出里面的价态关系,从化合价的变化角度牵引出各类不同化合价物质之间的转化关系,从而将铁、铜的性质复习好,让学生的思路更清晰,无论是对前面钠、镁、铝还是后面的硫的学习都起到一个示范作用,利用这样的方式复习元素,学生会更清楚也能更好地掌握元素的性质。
二、学情分析
学习者在前面通过钠、镁、铝的学习已经掌握了一定的元素学习的方法和经验。但是学习者是高一新生,对知识的迁移、运用能力相对较弱,将已有知识框架与新知识结合起来的能力还不足,面对元素多种化合物之间的相互转化,学生往往感到力不从心,很乱很早,所以提供一种新的元素复习模式至关重要。
三、教学重点:亚铁离子和铁离子之间的相互转化
教学难点:亚铁离子和铁离子之间的相互转化
四、教学目标
1、知识与技能:
(1) 掌握亚铁离子与铁离子之间的相互转化及其应用。
(2)知道自然界铁、铜的存在形式及常见的冶炼方法。
(3)掌握高炉炼铁的原理,知道其工艺流程和原料、设备、与产物。
(4)初步知道工业炼铜的方法,复习古代湿法炼铜的方法,知道生物炼铜的方法。
2、过程与方法:
(1)在对工业炼铁的原料、原理、设备、工艺流程与产物的探讨中提高用所学化学知识解决实际问题的能力。
3、情感态度与价值观:
(1)体会铁、铜的冶炼对人类文明的影响。
(2)通过高铝炼铁、生物炼铜的学习,建立环保节能意识。
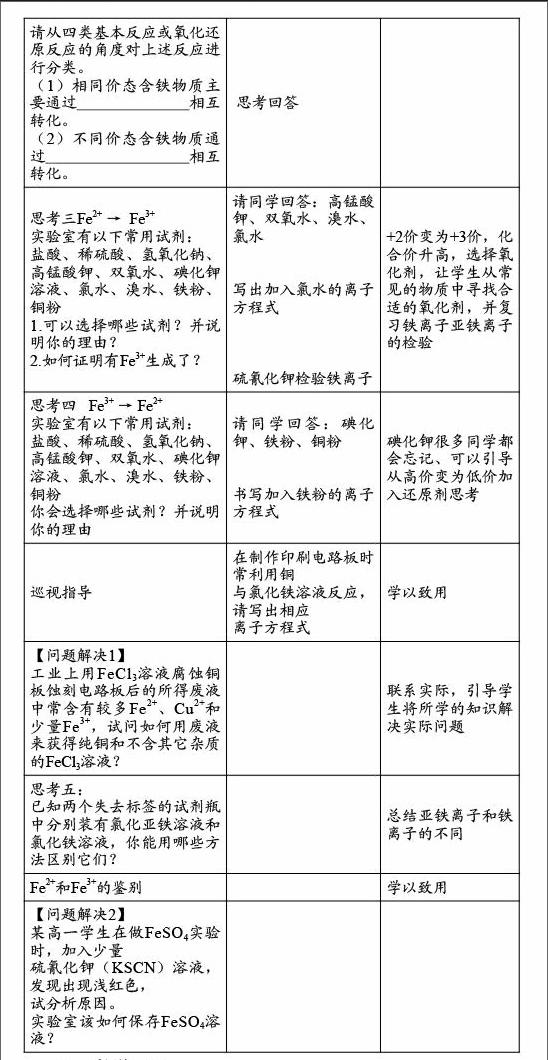
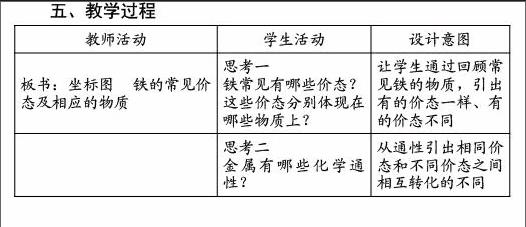
五、教学过程
教师活动 学生活动 设计意图
板书:坐标图 铁的常见价态及相应的物质 思考一
铁常见有哪些价态?
这些价态分别体现在哪些物质上?
让学生通过回顾常见铁的物质,引出有的价态一样、有的价态不同
思考二
金属有哪些化学通性? 从通性引出相同价态和不同价态之间相互转化的不同
请从四类基本反应或氧化还原反应的角度对上述反应进行分类。
(1)相同价态含铁物质主要通过 相互转化。
(2)不同价态含铁物质通过 相互转化。 思考回答
思考三Fe2+ → Fe3+
实验室有以下常用试剂:
盐酸、稀硫酸、氢氧化钠、高锰酸钾、双氧水、碘化钾溶液、氯水、溴水、铁粉、铜粉
1.可以选择哪些试剂?并说明你的理由?
2.如何证明有Fe3+生成了? 请同学回答:高锰酸钾、双氧水、溴水、氯水
写出加入氯水的离子方程式
硫氰化钾检验铁离子 +2价变为+3价,化合价升高,选择氧化剂,让学生从常见的物质中寻找合适的氧化剂,并复习铁离子亚铁离子的检验
思考四 Fe3+ → Fe2+
实验室有以下常用试剂:
盐酸、稀硫酸、氢氧化钠、高锰酸钾、双氧水、碘化钾溶液、氯水、溴水、铁粉、铜粉
你会选择哪些试剂?并说明你的理由 请同学回答:碘化钾、铁粉、铜粉
书写加入铁粉的离子方程式 碘化钾很多同学都会忘记、可以引导从高价变为低价加入还原剂思考
巡视指导 在制作印刷电路板时常利用铜
与氯化铁溶液反应,请写出相应
离子方程式
学以致用
【问题解决1】
工业上用FeCl3溶液腐蚀铜板蚀刻电路板后的所得废液中常含有较多Fe2+、Cu2+和少量Fe3+,试问如何用废液来获得纯铜和不含其它杂质的FeCl3溶液?
联系实际,引导学生将所学的知识解决实际问题
思考五:
已知两个失去标签的试剂瓶中分别装有氯化亚铁溶液和氯化铁溶液,你能用哪些方法区别它们?
总结亚铁离子和铁离子的不同
Fe2+和Fe3+的鉴别
学以致用
【问题解决2】
某高一学生在做FeSO4实验时,加入少量
硫氰化钾(KSCN)溶液,发现出现浅红色,
试分析原因。
实验室该如何保存FeSO4溶液?
六、教学反思
上完学生反映很清晰,尤其是亚铁离子和铁离子这个重点,很清晰之间的相互转化。对前面元素复习还是后面元素的学习都是一个例子。其中对铜的部分提的不多,怎么很好地过渡还要多加思考。endprint

