粗毛纤孔菌三萜初级纯化及体外降血脂研究
杜令娟,康宁,李德海,周聪,顾嘉琳,王占斌
(东北林业大学 林学院,哈尔滨 150040)
粗毛纤孔菌三萜初级纯化及体外降血脂研究
杜令娟,康宁,李德海*,周聪,顾嘉琳,王占斌
(东北林业大学 林学院,哈尔滨 150040)
为研究粗毛纤孔菌三萜类化合物的初级纯化工艺及其对体外降血脂功能影响,试验选用粗毛纤孔菌三萜粗提物为原料,采用大孔树脂法静-动态筛选最佳纯化条件,并考察纯化后三萜对体外结合胆酸盐降血脂能力的影响。结果表明,D-101树脂纯化效果最好,其动态纯化条件为:上柱流速0.25 mL/min,上样质量浓度2.0 mg/mL,pH值为6;洗脱流速1 mL/min,乙醇体积分数80%,洗脱体积4BV。在此条件下三萜纯化物纯度为35.4%,比粗提物提高5.36倍。体外胆酸盐结合实验说明,纯化前的结合量1.31±0.09 μmol/100mg,纯化后的结合量为1.58±0.06 μmol/100mg,分别是辛伐他汀的46.33%和58.4%。初步得出结论:粗毛纤孔菌三萜类化合物降血脂活性与其纯度呈正相关,纯化工艺能够提高粗毛纤孔菌三萜类化合物降血脂功能,本研究结果为开发新型高纯度降血脂药物提供科学依据。
粗毛纤孔菌;三萜类化合物;纯化;大孔树脂;降血脂
0 引言
粗毛纤孔菌(Inonotushispidus)为锈革孔菌科,纤孔菌属真菌,主要分布于东北三省等北温带地区[1],具有促消化、降血压、降血脂、降血糖等多种功能,常用来治疗胃病、痛风以及关节炎等疾病[2]。研究表明三萜类化合物为粗毛纤孔菌中主要活性物质,其具有抗肿瘤、抗炎、降血糖及降血脂等多种生理功能[3],在医药领域、保健品行业都有着巨大的应用价值和开发潜能。因此,关于粗毛纤孔菌三萜类化合物的研究越来越受人们的关注。
目前,国内外对于天然活性物质中三萜类化合物的提取分离纯化及功能性研究较多,比如李娇妹[4]对杏鲍菇三萜纯化物抗肿瘤作用的研究;Rui M.[5]等对灵芝子实体中三萜分离纯化工艺的研究;张月红[6]对青钱柳叶中三萜的提取分离纯化及其抑菌活性的研究;Hao R[7]等采用超临界萃取法对蓝桉树中三萜提取工艺的研究。而关于粗毛纤孔菌三萜类化合物的分离纯化以及其体外降血脂功能研究却少有报道,因此限制了三萜类化合物的开发利用和实现工业化生产的可能性。大孔树脂法因具有操作简便、吸附量大、选择性好等优点,是分离纯化三萜类化合物较广泛的一种方法。本实验研究了粗毛纤孔菌三萜类化合物的初级纯化工艺,并对纯化后三萜类化合物进行了体外降血脂作用的分析研究,以期为粗毛纤孔菌的资源利用及开发新型天然降血脂药物的研究提供理论基础和实验依据。
1 材料与方法
1.1 材料与试剂
粗毛纤孔菌:采自东北林业大学林场,42℃恒温干燥24 h,粉碎至粉末,过筛(40目),得粗毛纤孔菌干粉,低温保藏备用。
AB-8、D-101、NKA-9、X-5大孔树脂 南开大学化工厂;胰蛋白酶、胃蛋白酶 Biotopped公司;其它试剂均为国产分析纯。
1.2 仪器与设备
722s紫外分光光度计,上海第三分析仪器厂;JA2003分析天平,上海良平仪器仪表有限公司;8601精密pH计,上海康代仪器有限公司;IS-RSDS台式恒温振荡器,上海捷呈实验仪器有限公司;DK-8D电热恒温水槽,上海森信实验仪器有限公司;FLUKO高剪切乳化机,上海弗鲁克流体机械制造有限公司;6700 FT-IR傅里叶变换红外光谱仪,美国。
1.3 试验方法
1.3.1 粗毛纤孔菌三萜类化合物的制备
取一定量粗毛纤孔菌干粉,以料液比(1∶53)加入75%乙醇溶液,在25℃、10 000 r/min条件下,剪切提取3 min,重复3次,在67℃水浴锅中浸提5.25 h,取出冷却,在4 000 r/min条件下离心10 min,上清液抽滤、减压浓缩,42℃烘干,得粗毛纤孔菌三萜粗提取物,低温冷藏备用[8]。
1.3.2 三萜类化合物含量的测定
采用香草醛-冰乙酸法[9]。准确称取白桦脂醇标品,用95%乙醇溶解,定容于5 mL容量瓶中,得标准溶液(100 ug/mL),分别取0.10、0.20、0.40、0.60、0.80、1.00 mL,沸水浴蒸干乙醇后加入0.20 mL 5%香草醛-冰乙酸溶液和0.80 mL高氯酸并摇匀,再以70℃水浴15 min,常温放置3 min后以乙酸乙酯定容,于551 nm处进行比色测定,绘制三萜标准曲线,得回归方程为Y=0.012 58X+0.0103 6(R2=0.999 2),将样品吸光度带入标准曲线计算出样品中三萜含量。
1.3.3 粗毛纤孔菌三萜类化合物的初级纯化工艺
(1)大孔树脂的静态筛选
分别准确称取经预处理后的4种型号树脂AB-8、D-101、NKA-9、X-5各8 g于锥形瓶中,加入50 mL粗毛纤孔菌三萜粗提液,恒温振荡12 h(120 r/min)后过滤,后用50 mL体积分数为80%乙醇洗脱树脂,测定滤液及洗脱液中三萜的含量,计算树脂的吸附率和解吸率,以回收率为评价指标筛选出纯化效果最佳的大孔吸附树脂。

(1)

(2)
回收率(%)=吸附率×解析率×100。
(3)
(2)大孔树脂动态纯化三萜类化合物
取预处理后的D-101型树脂适量,湿法装柱,柱高20 cm。每次取30 mL质量浓度(0.05、0.10、0.15、0.20、0.25、0.30 mg/mL)和pH值(4、5、6、7、8)的样品溶液以流速(0.25、0.5、1、1.5、2 mL/min)上柱,吸附完成后,以4BV蒸馏水洗脱至无色,再用体积分数(50%、60%、70%、80%、90%、100%)的乙醇溶液以洗脱流速(0.25、0.5、1、2、4 mL/min)进行洗脱,每0.5BV体积收集一管,共收集8管,用分部收集器收集流出液。通过测定三萜类化合物的质量浓度,以三萜类化合物回收率为考察指标,筛选最佳上样流速、上样液质量浓度、上样液pH值、洗脱流速、乙醇体积分数、洗脱体积。
1.3.4 三萜类化合物体外降血脂作用的测定
(1)胆酸盐标准曲线的绘制
根据刘荣[10]等的方法稍作修改。取具塞试管,依次加入2.5 mL样液和7.5 mL60%硫酸溶液,以70℃水浴20 min后再冰浴5 min,于387 nm波长处测定其吸光度值,绘制标准曲线。
(2)胆酸盐结合能力的测定
参照文献[11],略作修改。取具塞三角瓶,分别加入1 mL三萜纯化液和粗提液,然后再依次加入3 mL 胃蛋白酶(10 mg/mL)和1 mL 的HCl溶液(0.01 mol/L),在37℃恒温振荡消化1 h,以氢氧化钠溶液(0.1 mol/L)调pH至6.3后加入4 mL 胰蛋白酶(10 mg/mL),振荡消化1 h后再分别加入4 mL胆酸盐(1 mmoL/L),恒温振荡1 h,离心20 min(4 000 r/min),分析上清液中的胆酸盐。
1.3.5 数据分析
实验中的数据均以(平均值±标准差)表示,每个实验均平行测定3次,所有数据均用SPSS17.0和Origin 8.6等软件处理完成。
2 结果与分析
2.1 粗毛纤孔菌三萜类化合物初级纯化工艺的研究
2.1.1 大孔吸附树脂的静态筛选分析
大孔吸附树脂纯化效果与树脂的种类及自身的性质有关,因此试验选取不同类型和极性的树脂进行吸附和解析试验,结果见表1。

表1 大孔树脂静态吸附及解吸效果
注:不同小写字母表示组间有显著性差异(P<0.05)。
由表1可知,三萜类化合物的吸附强弱及解析的难易程度存在显著性差异(P<0.05)。其中非极性树脂(D-101)对三萜类化合物的纯化效果明显高于其它三种大孔树脂,吸附率为44.23±0.43%、解析率为89.17±0.61%,总回收率可达39.44±0.76%,这是由于非极性树脂能够有效地从极性溶剂中吸附非极性物质,而粗毛纤孔菌三萜类化合物一般为非极性物质或弱极性物质,故选择D-101为纯化效果最佳的大孔树脂。
2.1.2 上样液pH对树脂吸附性能影响
调节上样液pH值分别为4.0、5.0、6.0、7.0、8.0,比较各pH值条件下三萜类化合物回收率的差异,研究pH值条件对D-101吸附粗毛纤孔菌三萜类化合物效果的影响,结果如图1所示。
由图1可知,D101型大孔树脂对粗毛纤孔菌三萜类化合物的吸附效果随上样液pH值的变化而发生显著性的变化。其吸附效果先随上样液pH值的增大而增强,再随pH值的增大而减弱,于弱酸性(pH=6)时达到最佳,此时三萜类化合物回收率最高,值为70.24±0.38%。三萜皂苷因其分子中的羧酸基而呈酸性,属酸性皂苷,容易在酸性溶液中被吸附[12],溶液随pH的升高而逐渐澄清,同时三萜类化合物在大孔树脂中扩散速度加快,因此确定最佳上样液pH为6。

图1 样品液pH值对树脂吸附的影响Fig.1 Effect of pH on polyphenols adsorption by macroporous resin
2.1.3 上样液浓度对树脂吸附性能影响
比较不同上样液浓度条件下三萜类化合物回收率的差异,研究不同上样浓度对D-101吸附粗毛纤孔菌三萜类化合物效果的影响,结果如图2所示。

图2 上样浓度对回收率的影响Fig.2 Effect of sample solubility on the recovery rate
由图2可知,三萜类化合物回收率与上样液呈浓度依赖性关系,在0.5~2.0 mg/mL时随上样液浓度的增大而上升,在2.0~3.0 mg/mL时随上样液浓度的增大而下降,于2.0 mg/mL上样液浓度时达到最高,值为66.18±0.27 %。随着三萜类化合物浓度的逐渐增大,三萜分子与树脂间接触面积增大,扩散速度加快,但当三萜类化合物浓度增加到一定程度时,树脂表面反而会由于接触三萜分子过多而阻碍其它三萜分子扩散,进而导致树脂回收率下降[13],因此选择2.0 mg/mL为最佳的上样浓度。
2.1.4 上样液流速对树脂解析性能影响
不同的上样液流速直接影响了树脂对样品的吸附效果,因此,本实验研究三萜提取液的流速对吸附效果的影响,结果如图3所示。

图3 上样液流速对树脂吸附的影响Fig.3 Effect of flow rate on adsorption efficiency by macroporous resin
由图3可知,三萜类化合物回收率与上样液流速呈负相关,其在0.25~2.0 mL/min范围内随上样液流速的增大而降低,于0.25 mL/min上样流速时达到最高,为66.59±0.13%。低流速可以促进树脂对三萜类化合物的吸附,但流速过低不仅会延长操作时间,同时也会增大洗脱液的用量进而造成资源的浪费,因此在评价树脂的吸附效果时不仅要考虑能最大限度地回收样品,同时也要缩短工作周期及减少成本[14],经综合考虑后选择0.25 mL/min作为最佳的上样速度。
2.1.5 乙醇体积分数对树脂洗脱效果的影响
在对树脂中被吸附物质进行解析时,洗脱液浓度的大小会对被吸附物质的溶解度产生直接影响,进而会影响样品的回收率。因此,本实验研究乙醇体积分数对D-101树脂中三萜类化合物解析效果的影响,结果如图4所示。
由图4可知,三萜类化合物的解析效果与乙醇浓度存在一定的量效关系,其解析效果先随乙醇浓度的升高而增强,于80%乙醇浓度时达到最强,此时回收率为67.56±0.82%,后随乙醇浓度的继续升高,其解析效果反而有所下降,这可能是由于过高的样液浓度导致三萜类化合物的溶解性降低,洗脱效果不好,造成资源浪费。这与李从镇[15]在大孔树脂分离纯化虫草素时结果一致,考虑实际效果以及综合成本等因素,所以选择最佳的乙醇洗脱液浓度为80%。

图4 不同分数乙醇对树脂洗脱效果的影响Fig.4 Effects of different fractions of ethanol on the elution of resin
2.1.6 洗脱流速对树脂洗脱效果的影响
在对饱和吸附的树脂进行解析时,洗脱液流速极大地影响了被吸附物质的溶解度与解离程度。因此,本实验研究洗脱流速对洗脱效果的影响,结果如图5所示。

图5 洗脱流速对树脂吸附的影响Fig.5 Effect of elution rate on desorption efficiency of macroporous resin
由图5可知,三萜类物质的解析效果与洗脱流速呈一定的量效关系。三萜类物质的回收率先随洗脱流速的增大而上升,于1 mL/min时达到最高,值为69.53±0.08%,后随洗脱流速的增大而降低,这可能是由于洗脱流速过快导致洗脱剂未能充分地与三萜相作用,进而无法将其从树脂中解析出来,造成三萜回收率下降,同时过快的洗脱流速易造成纯化周期延长,纯化成本增加[16]。因此选择1 mL/min作为洗脱液流速为最佳条件。
2.1.7 洗脱体积对树脂洗脱效果的影响
合适的洗脱体积不仅能提高样品的回收率,同时也能节约原料,降低成本。因此,本实验研究洗脱体积对树脂洗脱效果的影响,如图6所示。
从图6可以看出,饱和的D-101型大孔吸附树脂,先用一定量蒸馏水洗去吸附的可溶性糖类等水溶性杂质,再以80%乙醇进行洗脱。三萜类物质在0.5~2BV范围内洗脱效果明显,当洗脱体积高于2BV时,洗脱剂对三萜类化合物基本无解析效果,为节约成本,选择2BV作为三萜物质的最佳洗脱体积,这与孙静[17]在大孔树脂提纯黄花油点草总黄酮工艺的研究结果一致。

图6 洗脱体积对回收率的影响Fig.6 Effect of elution volume on the recovery rate
2.2 样品纯度分析
粗毛纤孔菌三萜类化合物经D-101型大孔树脂的最佳工艺条件纯化后,三萜类化合物的纯度、质量、含量与纯化前进行比较分析,结果见表2。
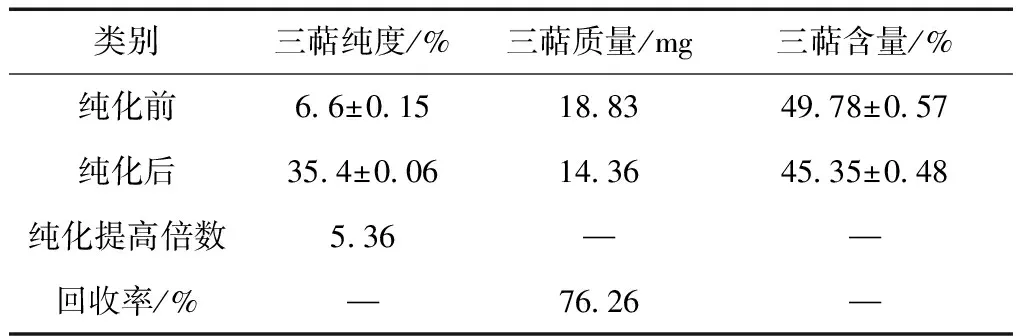
表2 三萜类化合物纯化前与纯化后比较
粗毛纤孔菌三萜类化合物纯化后,纯度提高了5.36倍,回收率高达76.26%,三萜含量高达45.35±0.48%,说明定量分析时样品中含有三萜,为后续实验提供基础。试验结果表明:用D-101型大孔树脂纯化三萜类化合物是可行的,最佳纯化工艺流程:以浓度2.0 mg/mL,pH6的三萜溶液上柱,流速为0.25 mL/min,依次用4BV蒸馏水、2BV80%乙醇溶液进行洗脱,洗脱流速控制为1 mL/min。经D-101型树脂分离纯化工艺操作简单分离效果较好,对实际生产具有一定的指导意义。
2.3 三萜类化合物对体外降血脂作用的影响
以辛伐他汀片为阳性对照,三萜类化合物浓度为40 mg/mL时,对纯化前后三萜类化合物的降血脂活性进行评价,结果见表3。

表3 纯化前后三萜类化合物的体外降血脂作用
注:表3中不同大写字母表示同一列比较具有显著性差异(P<0.05)。
从表3可以看出,辛伐他汀作为一种降血脂药物的主要成分,结合胆酸盐的能力显著高于纯化前后三萜类化合物(P<0.05)。纯化后三萜对胆酸盐结合能力高于三萜粗提物,但差异性不显著(P>0.05)。说明纯化前后三萜类化合物都对胆酸盐有结合能力,结合量越高,说明其降胆固醇效果越好,降血脂活性越强,因为结合胆酸盐能力越强,胆固醇在肝脏中转化胆汁酸越快,从而达到降脂的目的[18]。纯化后三萜类化合物结合牛磺胆酸钠能力最强,结合量最大1.58±0.06 μmol/100mg,相对辛伐他汀的吸附率最高,值为55.83±0.56 %;Kim等[19]认为这是由于在羟基含量相同时,牛磺胆酸钠疏水性强,能更好的通过疏水作用力吸附于其他羟基中,导致纯化后三萜类化合物降血脂作用明显。
3 结论
本文研究结果表明,对粗毛纤孔菌三萜类化合物纯化效果较好的大孔树脂为D101型,其吸附率为44.23±0.43%,解吸率为89.17±0.61%,动态纯化工艺参数为:上柱流速0.25 mL/min,上样质量浓度2.0 mg/mL,pH值为6,洗脱流速1 mL/min,乙醇体积分数80%,洗脱体积4BV,在此条件下三萜类化合物纯度为35.4%,比粗提物提高5.36倍。分离纯化后三萜类化合物对三种胆酸盐结合能力均有提高,且对牛磺胆酸钠的结合能力最强,纯化后的结合量为1.58±0.06 μmol/100 mg,达到了辛伐他汀的58.4%,具有较好的降血脂功效。因此,对粗毛纤孔菌三萜类化合物的纯化还有待进一步研究,提高其纯度和降血脂作用。
[1] Cui B K,Dai Y C,Yang H.Notes on the medicinal fungus of inonotus hispidus[J].Edible Fungi of China,2009,28(4):6-7.
[2] Zan L F,Qin J C,Zhang Y M,et al.ChemInform abstract:antioxidant hispidin derivatives from medicinal mushroom inonotus hispidus[J].Cheminform,2011,42(48):770-772.
[3] Bednarczykcwynar B,Zaprutko L.Recent advances in synthesis and biological activity of triterpenic acylated oximes[J].Phytochemistry Reviews,2015,14(2):203-231.
[4] 李娇妹.杏鲍菇三萜类化合物提取纯化工艺及抑制肿瘤活性研究[D].天津:天津大学,2015.
[5] Domingues R M A,Oliveira E L G,Freire C S R,et al.Supercritical fluid extraction of eucalyptus globulus bark - a promising approach for triterpenoid production[J].International Journal of Molecular Sciences,2012,13(6):7648-7662.
[6] 张月红.青钱柳叶三萜类化合物提取纯化、分离鉴定及其抑菌活性研究[D].南昌:江西农业大学,2012.
[7] Hao R X,Zhang J S,Tang Q J,et al.Isolation,purification and identification of two new triterpenoid constituents from the fruiting bodies of Ganoderma lucidum[J].Mycosystema,2006,25(4):599-602.
[8] 付元真,王新新,王晓,等.高速剪切提取金银花11种活性成分及其抗氧化活性[J].食品与发酵工业,2016,42(5):239-245.
[9] Li Z,Yang Y,Huang X,et al.Lotus leaf total triterpenoid extraction eechnology research and content determination[J].Guangdong Chemical Industry,2016,43(9):110-111.
[10] 刘荣,王蕾,栾淑莹,等.水溶性黑木耳多糖体外结合胆酸盐能力的分析[J].食品工业科技,2015,36(17):358-361.
[11] Kahlon T S,Smith G E.In vitro binding of bile acids by blueberries,plums,prunes,strawberries and apples [J].Food Chemistry,2007,100(3):1182-1187.
[12] 崔炳群.应用大孔吸附树脂纯化荷叶生物碱的研究[J].现代食品科技,2013,29(7):1664-1669.
[13] Zhang M,Yang H,Zhang H,et al.Development of a process for separation of mogroside V from Siraitia grosvenorii by macroporous resins[J].Molecules,2011,16(9):7288-7301.
[14] 李勇超,杨靖,职明星,等.D101大孔树脂提纯发酵液中紫杉醇的研究[J].食品与生物技术学报,2010,29(5):711-714.
[15] 李从镇.大孔吸附树脂分离纯化虫草素的研究[D].福州:福建师范大学,2014.
[16] Aiken G R,Thurman E M,Malcolm R L,et al.Comparison of XAD macroporous resins for the concentration of fulvic acid from aqueous solution[J].Analytical Chemistry,1979,51(11):1799-1803.
[17] 孙静,刘洁琼,黎伟华,等.陕产黄花油点草总黄酮部位纯化工艺研究[J].中草药,2013,44(10):1275-1279.
[18] Jiao R,Zhang Z,Yu H,et al.Hypo-cholesterolemic activity of grape seed proanthocyanidin is mediated by enhancement of bile acid excretion and up-regulation of CYP7A1[J].Journal of Nutritional Biochemistry,2010,21(11):1134-1139.
[19] Kim C H,Heung J C.A synthesis of O-diethylaminoethyl chitosan and its binding ability of cholate and deoxycholate anion in vitro[J].Polymer Bulletin,1999,42(1):25-32.
PrimaryPurificationandinvitroHypolipidemicActivityofTriterpenoidfromInonotushispidus
Du Lingjuan,Kang Ning,Li Dehai*,Zhou Cong,Gu Jialin
(College of Forestry,Northeast Forestry University,Harbin 150040)
In order to study the primary purification process of triterpenoid fromInonotushispidusand their effects invitrohypolipidemic activity,triterpenoid fromInonotushispiduswas selected as raw material and macroporous resin was used to screen the best purification conditions.Then,the effect of purified triterpeniod combined with bile salt invitrohypolipidemic activity was studied.The results showed that D-101 resin was the best,and its dynamic purification conditions were as follows:the column flow rate was 0.25 mL/min,loading mass concentration was 2.0 mg/mL,pH was 6;elution flow rate was 1 mL/min,ethanol volume fraction was 80%,elution volume was 4BV.Under these conditions,the purity of triterpenoids was 35.4%,which was 5.36 times higher than that of the crude extract.The experiment result of bile salts-combined in vitro indicated that,the binding amount before purification was 1.31±0.09μmol/100 mg,the after purification was 1.58±0.06μmol/100 mg,which was 46.33% and 58.4% of simvastatin respectively.The preliminary conclusion was that the hypolipidemic activities of terpenoid fromInonotushispiduswas positively related to their purity,and the purification process can improve the hypolipidemic activities.The results would provide a scientific basis for the development of new highly purified hypolipidemic drugs.
Inonotushispidus;triterpeniod;purification;macroporous resin;hypolipidemic activity
S 131
:A
:1001-005X(2017)05-0029-06
2017-05-16
中央高校基本科研业务费专项资金资助(2572014CA19);黑龙江省自然科学基金面上项目(C2015062)
杜令娟,硕士研究生。研究方向:食品化学及林下资源植物有效成分研究。E-mail:562918463@qq.com
李德海,博士,副教授。研究方向:食品化学及林下资源植物有效成分研究。E-mail:lidehaineau@163.com
杜令娟,康宁,李德海,等.粗毛纤孔菌三萜初级纯化及体外降血脂研究[J].森林工程,2017,33(5):29-34.

