X线辐射后A549细胞上清外泌体GPC1表达与细胞周期的关系
王立威 佟志敏 李 宁 李诗扬 崔营营 陈玉丙
(长春市人民医院,吉林 长春 130051)
X线辐射后A549细胞上清外泌体GPC1表达与细胞周期的关系
王立威 佟志敏1李 宁2李诗扬2崔营营2陈玉丙2
(长春市人民医院,吉林 长春 130051)
目的观察X线辐射对A549肺腺癌细胞周期及对细胞上清外泌体磷脂酰肌醇蛋白聚糖(GPC)1表达的影响。方法培养肺腺癌细胞A549并分别给予0、0.5、1、1.5、2 Gy剂量照射,照射后继续培养6、12 h收集细胞,用PI法检测细胞周期;收集细胞上清液,超速离心法提取外泌体,Western印迹检测外泌体GPC1表达。结果G2期细胞的比例随着剂量的增加而增加,差异有统计学意义(P<0.001),其他各剂量组与2 Gy组比较差异有统计学意义(P<0.05);各剂量组S期细胞比例均高于0 Gy组(P<0.05);Western印迹结果显示,随辐射剂量增大,GPC1表达量逐渐降低。结论辐射能够诱导A549细胞G2期、S期阻滞,同时细胞上清外泌体GPC1蛋白表达减少,二者具有相关性。
外泌体;肺癌;磷脂酰肌醇蛋白聚糖
目前肺癌主要以化疗、放疗、靶向治疗等综合治疗为主,其中放射治疗是治疗局部晚期肺癌的有效方法,普遍应用于临床〔1〕。近年来研究发现,不少蛋白在放射治疗中起着增敏、指示预后等重要作用〔2〕。磷脂酰肌醇蛋白聚糖(GPC)1在胰腺癌、乳腺癌、人神经胶质瘤细胞中高表达,而在正常组织中低表达,起着肿瘤生物标志物的作用〔3〕。外泌体是在多泡体内形成的小囊泡,通过胞吐释放,在血液、尿液等多种体液中均能被检测到,外泌体膜表面分布着多种蛋白,能够揭示其来源细胞的细胞状态〔4,5〕。研究发现GPC1 可以准确鉴别出健康人、良性胰腺疾病与早期胰腺癌、晚期胰腺癌〔6,7〕。目前A549细胞外泌体GPC1与放疗的相关研究还未见报道,本文利用不同剂量的X线照射肺腺癌A549细胞,观察辐射对A549细胞周期及对A549细胞上清液中外泌体GPC1表达的影响。
1 材料与方法
1.1材料 肺腺癌A549细胞株(购自中国科学院上海细胞库);胎牛血清(Biologicallndustries,以色列);细胞增殖与毒性检测试剂盒、免疫印迹化学发光试剂(上海七海复泰生物科技有限公司);蛋白电泳试剂(生工生物工程(上海)股份有限公司);蛋白预染mark、SDS-PAGE上样缓冲液(Thermo,美国);Anti-GPC1抗体(Abcam,美国);二喹啉甲酸(BCA)蛋白定量试剂盒(北京博迈德科技发展有限公司);瓦里安直线加速器23(EXVarianMedicalSystems,Inc.);蛋白电泳仪(北京六一仪器厂);超速离心机(贝克曼,美国);酶标仪、增强化学发光法(ECL)化学发光仪(Gene,美国)
1.2肺腺癌细胞A549的培养 在无菌工作台内准备9 ml无血清培养基置于离心管内,将细胞从液氮内取出置于37℃水浴中使其快速融化,吸入先准备好的培养液中1 200 r/min离心3 min,弃上清加入6 ml含10%血清的培养液培养过夜,换新鲜培养液,2 d传代一次。
1.3A549细胞照射及细胞周期检测 取对数生长期的A549细胞,用0.25%胰酶消化并计数,按每孔2×105/ml细胞数接种于6孔培养板中,于37℃ CO2培养箱中培养过夜。分别给予0、0.5、1、1.5、2 Gy剂量照射细胞,照射后在37℃ CO2培养箱中培养6、12 h后收集细胞,每管加1 ml 75%酒精固定过夜;按下列比例配制细胞周期缓冲液:1 ml缓冲液、碘化丙啶PI 25 μl,RNase A 20 μl。每管分别加入500 μl上述缓冲液。于37℃CO2培养箱中孵育30 min,流式细胞仪检测细胞周期。
1.4超离法提取细胞上清外泌体、Western印迹法检测外泌体GPC1表达 将A549细胞消化并计数,以2×107/ml细胞数接种于T75培养瓶中,于37℃CO2培养箱中培养过夜;按0、0.5、1、1.5、2 Gy剂量分别照射细胞,于37℃ CO2培养箱中继续培养6、12 h后收集细胞上清;利用超速离心法提取上清液中的外泌体:(1)将细胞上清液收集到50 ml离心管内4℃、2 000 r/min离心30 min;(2)将上清转移到干净的超速离心管,4℃、12 000 r/min离心45 min;(3)将上清转移到干净的超速离心管,4℃、110 000 r/min离心2 h,倒掉上清;(4)用9 ml磷酸盐缓冲液(PBS)重悬沉淀,用0.22 μm 滤器过滤到另一个干净的超速离心管中;(5)4℃、110 000 r/min离心70 min,倒掉上清;(6)用500 μl磷酸盐缓冲液(PBS)重悬沉淀转移到1.5 ml EP 管中;加300 μl蛋白裂解液,置于-70℃和37℃环境中各1 h反复冻融。应用BCA蛋白定量试剂盒对样品蛋白进行定量测定;配制15%的分离胶:准备10 μg蛋白,沸水煮10 min,12 000 r/min离心10 min,调节电压为80 V,进行电泳。待样品跑到分离胶处调节电压为120 V;观察溴酚蓝迁移至玻璃板下沿时关闭电源结束电泳并准备转膜;300 mA转膜90 min;按1∶1 000比例加入一抗(注意不要有气泡),于4℃封闭过夜;按1∶1 000比例加入二抗,放于37℃水平摇床孵育1 h;取ECL显色液各1 ml混匀后加到膜上,确保膜的每个位置均接触ECL,再于ECL化学发光仪内显色。
1.5统计学分析 应用SPSS21.0软件进行单因素方差分析、LSD法及非参数检验法。
2 结 果
2.1不同剂量X线辐射A549细胞并继续培养6、12 h后细胞周期的变化 与0 Gy组相比,各剂量组细胞G2期的比例随着辐射剂量的增加而增加(P<0.001)。各剂量组S期细胞比例均高于0 Gy组(P<0.05)。
2.2不同剂量放疗后继续培养6、12 h后A549细胞上清液外泌体GPC1蛋白表达情况 培养6、12 h后,与0 Gy组相比各剂量组GPC1蛋白表达均减少(P<0.001),以2 Gy组减少最为明显(P<0.001)。见图1。
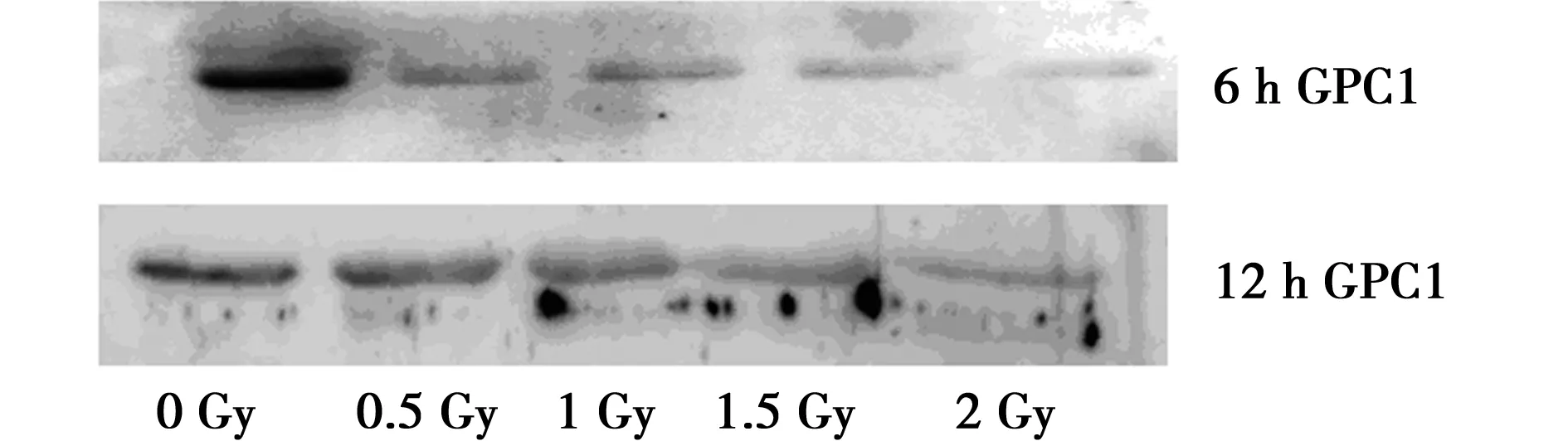
图1 A549细胞上清液外泌体GPC1蛋白检测电泳图
3 讨 论
非小细胞肺癌是最常见的恶性肿瘤之一,具有发病率和死亡率高等特点,局部晚期非小细胞肺癌的治疗主要是以放射治疗为主的综合治疗〔8〕。通过辐射作用,肿瘤细胞周期、增殖均可受到抑制,从而阻止肿瘤细胞的恶性增长。本研究结果表明放疗可以引起肺腺癌A549细胞G2期、S期阻滞,且G2期随辐射剂量的增加阻滞作用越明显。放疗可以抑制A549细胞上清外泌体GPC1蛋白的表达且呈剂量依赖性。与以往研究结果一致〔8~10〕。外泌体是在细胞内形成的小囊泡,通过胞吐作用释放到细胞外,其内容物包括蛋白、核酸、脂质等多种物质,起着信息传递、调控等作用〔11〕。研究发现,辐射可以通过影响外泌体中内容物的表达,从而发挥特异的生物功能〔12〕。肿瘤细胞来源的外泌体富含GPC1,Melo等〔7〕在胰腺癌血浆外泌体中检测到GPC1高表达,可准确将健康人与胰腺癌、良性胰腺疾病与早晚期胰腺癌加以鉴别,作为胰腺癌的生物标志物。本研究提示其在非小细胞肺癌中具有诊断价值。本研究成功地在A549细胞上清中检测到外泌体GPC1的表达,同时发现随着辐射剂量增加,外泌体GPC1表达逐渐减少,这与辐射的周期抑制作用相一致。提示GPC1很可能起到一种放疗疗效的指示作用,但具体机制还需进一步研究。
1She J,Yang P,Hong Q,etal.Lung cancer in China:challenges and interventions〔J〕.Chest,2013;143(4):1117-26.
2周发为,杨年红,游文忠.CD24蛋白表达在术后放疗宫颈癌患者预后中的意义 〔J〕.中国现代医学杂志,2016;26(4):39-44.
3Su G,Meyer K,Nandini CD,etal.Glypican-1 is frequently overexpressed in human gliomas and enhances FGF-2 signaling in glioma cells 〔J〕.Am J Pathol,2006;168(6):2014-26.
4Guo L,Guo N.Exosomes:potent regulators of tumor malignancy and potential bio-tools in clinical application 〔J〕.Crit Rev Oncol Hematol,2015;95(3):346-58.
5Yu S,Cao H,Shen B,etal.Tumor-derived exosomes in cancer progression and treatment failure 〔J〕.Oncotarget,2015;6(35):37151-68.
6Herreros-Villanueva M,Bujanda L.Glypican-1 in exosomes as biomarker for early detection of pancreatic cancer 〔J〕.Ann Transl Med,2016;4(4):64.
7Melo SA,Luecke LB,Kahlert C,etal.Glypican-1 identifies cancer exosomes and detects early pancreatic cancer 〔J〕.Nature,2015;523(7559):177-82.
8宋淑军,左晓勇,徐冰心,等.X线照射剂量率对A549肺癌细胞周期的影响 〔J〕.癌症进展,2016;14(10):970-6.
9罗利民.电离辐射对肺癌A549细胞凋亡及细胞周期的影响〔J〕.2009;15(5):410-1.
10杨艳明,王志成,王铁君,等.乏氧 /辐射双敏感启动子介导分泌型人 TRAIL基因对肺腺癌 A549细胞周期及增殖的影响〔J〕.中国老年学杂志,2009;29(6):1376-8.
11Fujita Y,Kosaka N,Araya J,etal.Extracellular vesicles in lung microenvironment and pathogenesis〔J〕.Trends Mol Med,2015;21(9):533-42.
12王晨袁,邵春林.电离辐射诱导的外泌体的生物学效应〔J〕.国际放射医学核医学杂志,2017;41(2):121-4.
〔2017-07-13修回〕
(编辑 郭 菁)
R73
A
1005-9202(2017)18-4480-03;doi:10.3969/j.issn.1005-9202.2017.18.021
吉林省科技发展计划项目(20160101104JC)
1 吉林省申邦细胞工程研究所 2 吉林大学第二医院
陈玉丙(1967-),男,副主任医师,博士,硕士生导师,主要从事肿瘤放射治疗及基础研究。
王立威(1964-),男,副主任医师,主要从事神经外科疾病、立体定向放射治疗研究。

