甲状腺乳头状癌合并侵袭性纤维瘤病1例报道
洪 洋,于天宇,孙 辉,付言涛
(吉林大学中日联谊医院甲状腺外科,吉林省外科转化医学重点实验室,吉林 长春130033)
甲状腺乳头状癌合并侵袭性纤维瘤病1例报道
洪 洋,于天宇,孙 辉,付言涛*
(吉林大学中日联谊医院甲状腺外科,吉林省外科转化医学重点实验室,吉林 长春130033)
甲状腺乳头状癌为甲状腺癌最常见病理类型。侵袭性纤维瘤病(AF)又称纤维瘤病,也有称硬纤维瘤、肌肉腱膜纤维瘤或韧带样型纤维瘤,是一种起源于肌肉、深筋膜和腱膜等处的富含胶原纤维成分的纤维组织肿瘤,虽为良性病变,但无包膜,常有类似恶性肿瘤的局部浸润性生长的生物学行为。其仅占所有肿瘤的0.03%,占软组织肿瘤的3%。美国AF年发病率为(2-4)/100 000[1]。其可发生于全身各处,局部复发率高,但无远处转移。本文报道1例甲状腺癌合并甲状腺侵袭性纤维瘤病病例并复习相关文献,对其特征、诊疗方式及预后进行探讨。
1 病例资料
患者,女,34岁,3年前体检发现甲状腺双叶肿物,2年前于笔者所在医院门诊行局麻下细针穿刺细胞学检查,结果示:(甲状腺左叶)见异型细胞,倾向乳头状癌。遂收入院拟行手术治疗。甲状腺双叶未触及明显肿物,双侧颈部及锁骨上区未触及明显肿大淋巴结。入院行甲状腺及颈部淋巴结彩色多普勒超声检查:右叶下极腺体层内可见1个等回声结节,大小0.8 cm×0.5 cm,边界清,可见血流信号。左叶下极腺体浅层被膜下可见范围2.0 cm×0.5 cm回声减低区。中部腺体内可见1个低回声结节,大小0.5 cm×0.5 cm,边界不清,无血流(如图1)。双侧颈部扁平淋巴结,皮髓质结构清晰。
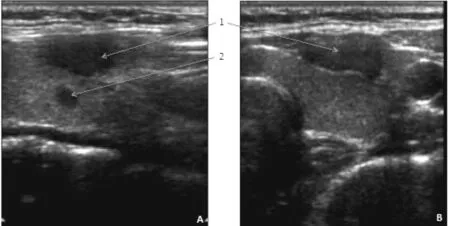
图1 甲状腺结节及AF超声图像
完善术前检查后于入院第4天行手术治疗。手术前行淋巴结穿刺细胞学及洗脱液检查以评估左侧颈部IV区淋巴结,未见癌细胞,洗脱液Tg值为0.04 ng/ml。取颈部低领弧形切口,探查见甲状腺左叶下极术前超声定位腺体表面低回声区可见类似肉芽肿性炎症改变,表面与甲状舌骨肌稍黏连,考虑穿刺出血形成炎性肉芽肿的可能,术中神经监测技术(IONM)定位、解离喉返神经并采用精细化被膜外操作技术保护甲状旁腺,将甲状腺左叶腺体组织连同黏连的甲状舌骨肌一并切除。切除组织送冰冻病理检查,结果示:甲状腺左叶乳头状癌(直径0.5cm),另见梭形细胞增生结节(大小1.3×0.6×0.5 cm)。向家属交代病情,行甲状腺全切除术及中央组淋巴结清扫术。
术后石蜡病理检查示:甲状腺左叶乳头状癌(直径0.3 cm,非外科缘),另见梭形细胞增生结节(大小1.3 cm×0.6 cm×0.5 cm),形态学及免疫标记结果符合AF,局部累及横纹肌,外科缘阴性。免疫组化:Vimentin(+)、β-catenin(+)及SMA(+),CD34(血管+),Ki67(5%+),cytokeratins(-)、S-100(-)及Bcl-2(-),中央组淋巴结未见转移。甲状腺右叶结节性甲状腺肿伴甲状腺腺瘤,散在灶状淋巴细胞。术后患者恢复良好,无声音嘶哑及低血钙症状,术后第4天出院。密切进行随访2年,至今AF及甲状腺癌均未复发。
2 讨论
患者术前甲状腺细针穿刺抽吸(FNA)检查,甲状腺左叶结节考虑为甲状腺乳头状癌。根据2012年甲状腺结节与分化型甲状腺癌的诊治指南,甲状腺癌伴对侧叶甲状腺结节,选择甲状腺全切加中央组淋巴结清扫术。术前彩超检查发现甲状腺左叶下极表面可见一低回声区,术中探查考虑FNA穿刺出血造成肉芽肿性炎症可能,术中快速病理提示梭形细胞,考虑未提示恶性病变,未给予足够重视。术后病理回报术前彩超发现低回声区为纤维瘤病。术中误诊的原因,主要是对此病缺乏足够的认识,警惕性不足。
AF最早由Muller报道并命名。黄飞龙等[2]对中国近20年报道的969例AF的统计显示,男女比例为1∶1.71,高发于10-40岁,平均年龄29岁,复发率为24.54%。按发病部位分为: 腹部外型AF(50%-60%)、 腹壁型AF(约25%)及腹内型AF(约15%)[3]。国外有报道认为还有多发性 AF及Gardner综合征相关性 AF两种较少见类型[4]。Kruse 等[5]对1968-2008年有明确报道的179例患者的研究显示,腹部外型病例中仅12%位于头颈部,其中下颚骨、颈部及上颌骨所占比例分别为32%、27%及10%。
AF病因不明,可能与创伤、手术、内分泌、结缔组织生长调节异常及遗传缺陷有关。研究表明其发病机制可能与编码β-catenin 的 CTNNB1 基因及腺瘤性结肠息肉病(APC)等基因突变有关[3,6]。
临床多表现为发病部位无痛性、不易推动的质硬肿物及周围神经、血管等组织器官受压、受侵导致的相应症状。本例患者为甲状腺癌手术中误切发现,并无相应的临床症状。
影像学诊断首选MRI,多表现为肌肉组织占位性病变。可见肿瘤无包膜、边缘不光整,爪样浸润,且无坏死、钙化、瘤周水肿、骨质破坏等改变。大多数学者认为其呈T1W1低信号,T2W1高信号。增强后明显强化伴有T1W1及T2W1呈双低信号的无强化区域,这一特点具有较强特异性,与仅呈T2W1高信号的绝大多数恶性肿瘤相鉴别[3,6-8]。超声及CT具有其特征但难以准确鉴别,可作为辅助诊断措施。
以往确诊依靠术后病理结果,镜下可见梭形纤维母细胞、肌纤维母细胞及其间较多的胶原纤维;细胞核点彩状染色,有少量核仁,几乎无核分裂像和恶性细胞学特征。免疫组化:β-catenin 弥漫(+)为其特征性标志,vimentin(+),SMA(+),雄激素受体(+)、cathepsin D(+),生长抑素(+),Ki-67 (+),80%的AF中雌激素受体β(+);S-100(-)、CD34(-)、ERα(-)、孕酮受体(-)、Her2(-)、desmin(-)、cytokeratins(-)、c-kit(-)[3,9]。本例患者Vimentin(+)、β-catenin(+)及SMA(+),Ki67(5%+),cytokeratins(-)、S-100(-)及Bcl-2(-),仅有CD34不符,符合AF免疫组化特征。近年超声或CT引导下细针穿刺细胞学检查联合免疫组化染色技术的发展可帮助实现术前早期诊断[10]。
颈部有多个重要神经、血管走形,因此颈部AF若不及时治疗可对患者造成致命性伤害。首选治疗方法是手术治疗。李晓军[11]等对127例AF患者进行了回顾性分析,结果显示其复发率高达38.74%。Huang P W等[12]对46例AF患者的研究结果显示,外科缘阳性为AF复发危险因素。因此外科手术切除范围对于AF患者至关重要。大多数学者认为应行扩大切除,切缘应距肿瘤边缘2-3 cm,并将受累组织一并切除。术中应行切缘快速冰冻病理检查以确保切缘阴性[13]。但因颈部解剖复杂,且AF具有浸润性生长特性,切除范围未必可以实现,此时可将病变累及肌肉组织整体切除而无需强调肿瘤扩大切除范围[14],避免破坏头颈部重要结构和功能,术后再辅以放射治疗。该患手术中被误认为瘢痕性肉芽肿,将甲状腺连同累及甲状舌骨肌一并切除,符合了颈部AF的切除原则。
对于外科缘阳性、术后肿瘤肉眼残留、手术近切缘、局部复发等患者可采用放射治疗。Micke O等[15]对13个临床中心698例患者进行的meta分析显示,切缘阳性及阴性的患者术后放疗均可显著提高局部控制率。但放疗会产生疼痛、皮肤溃疡、肢体纤维化、水肿及肌挛缩等并发症,放疗范围及剂量使用尤为重要。患者为头颈部AF,无意中发现,切缘阴性,且合并甲状腺癌,考虑放疗副作用较大,给予定期复查。Ballo 等[16]推荐于病灶周围5-8cm进行放疗,剂量每次2Gy,共56Gy。除此之外,还可采用化疗、他莫昔芬、 伊马替尼、 非甾体类抗炎药等姑息治疗方式[17]以稳定病情,实现长期带瘤生存。对于某些不可切除及切除后会产生严重功能障碍的肿瘤,也有学者主张观察等待治疗。但颈部分布有气管、神经、血管等重要结构,一旦受到肿瘤侵袭将产生严重后果,观察与等待是否适用有待进一步探讨[4]。
由于AF具有复发率高的特点,术后需定期复查MRI、B超及CT,复发患者应及时行手术及其他治疗,力求达到外科缘阴性标准。大部分头颈部AF复发发生于术后2年内,但持续时间在数月-10年以上不等。这提示随访时间应至少为2年,尽可能更长[4]。
[1]Escobar C,Munker R,Thomas J O,et al.Update on desmoid tumors[J].Annals of Oncology Official Journal of the European Society for Medical Oncology,2012,23(3):562.
[2]黄飞龙,邱法波,张晓锋,等.中国近20年侵袭性纤维瘤的流行病学特征及诊疗分析[J].山东医药,2013,53(24):61.
[3]马冬捷,张志庸,李单青.侵袭性纤维瘤病的诊治进展[J].北京医学,2015(03):272.
[4]Eelco de Bree MD PhD,Odysseas Zoras MD PhD,Hunt J L,et al.Desmoid tumors of the head and neck:A therapeutic challenge[J].Head & Neck,2014,36(10):1517.
[5]Kruse A L,Luebbers H T,Grätz K W,et al.Aggressive fibromatosis of the head and neck:a new classification based on a literature review over 40 years (1968-2008)[J].Oral & Maxillofacial Surgery,2010,14(4):227.
[6]袁志平,宋永文,李晔雄.侵袭性纤维瘤病诊治进展[J].肿瘤学杂志,2008,14(03):236.
[7]庄晓曌,陈应明,余深平,等.侵袭性纤维瘤病的MRI表现及其临床病理[J].中华普通外科学文献(电子版),2012,06(02):27.
[8]高远翔,张黎芳.侵袭性纤维瘤病的CT和MR特点[J].中国医学影像学杂志,2012(11):828.
[9]古庆家,何 刚,樊建刚,等.头颈部侵袭性纤维瘤病临床分析[J].临床耳鼻咽喉头颈外科杂志,2014(18):1370.
[10]Owens CL,Sharma R,Ali SZ.Deep fibromatosis (desmoid tumor):cytopathologic characteristics,clinicoradiologic features,and immunohistochemical findings on fine-needle aspiration[J].Cancer,2007,111:166.
[11]李晓军,范志刚,权少敏,等.韧带样型纤维瘤127例临床分析[J].中华临床医师杂志:电子版,2015(9):215.
[12]Huang P W,Tzen C Y.Prognostic factors in desmoid-type fibromatosis:a clinicopathological and immunohistochemical analysis of 46 cases[J].Pathology-Journal of the RCPA,2010,42(2):147.
[13]Bertani E,Testori A,Chiappa A,et al.Recurrence and prognostic factors in patients with aggressive fibromatosis.The role of radical surgery and its limitations[J].World Journal of Surgical Oncology,2012,10(3):1.
[14]Plukker JT,Van Oort I,Vermey A,et al.Aggressive fibromatosis (non-familial desmoid tumour):therapeutic problems and the role of adjuvant radiotherapy[J].British Journal of Surgery,1995,82(4):510.
[15]Micke O,Seegenschmiedt M H.Radiation therapy for aggressive fibromatosis (desmoid tumors):Results of a national Patterns of Care Study[J].Int J Radiat Oncol Biol Phys,2005,61(3):882.
[16]Ballo M T,Zagars G K,Pollack A,et al.Desmoid tumor:prognostic factors and outcome after surgery,radiation therapy,or combined surgery and radiation therapy[J].Journal of Clinical Oncology,1999,17(17):158.
[17]刘志萍,罗京伟,徐国镇.头颈部侵袭性纤维瘤病放射治疗研究进展[J].癌症进展,2016,14(4):304.
*通讯作者
1007-4287(2017)09-1452-03
2016-09-21)

