CARD9在感染性疾病中的研究进展
曹 静 张福仁
CARD9在感染性疾病中的研究进展
曹 静1,2张福仁1,2
胱天蛋白酶募集域蛋白9(CARD9)是CARD蛋白家族中的一员,是重要的衔接蛋白,通过蛋白-蛋白相互作用调节细胞内信号传递。CARD9能高效整合多种固有免疫受体的识别信号,在机体对真菌、细菌、病毒等的识别和抵抗方面起重要作用。近年来有多例因CARD9缺陷导致的深部真菌病和泛发性复发性皮肤黏膜真菌感染的病例报道,使得CARD9在感染性疾病中的研究日益受到关注。本文就CARD9在感染性疾病中的分子调控机制进行了综述。
胱天蛋白酶募集域蛋白; 感染性疾病; 固有免疫; 信号通路
胱天蛋白酶募集域蛋白9(caspase recruitment domain protein 9,CARD9)是包含CARD蛋白(CARD containing proteins)家族中的一员,通过蛋白-蛋白相互作用调节细胞内信号传导,是细胞内信号传导重要的衔接蛋白。CARD9位于染色体9q34.3,cDNA全长2108 bp,编码536个氨基酸残基,产生分子大小为62.3kD的蛋白质。CARD9在结构上包含着2个功能区,一个是位于氨基末端的胱天蛋白酶募集域(CARD);另一个位于羧基末端的7肽重复特征的卷曲螺旋域,行使蛋白质寡聚化功能;与大鼠cDNA比对发现,大鼠CARD9的cDNA也编码536个氨基酸,与人类相似度高达88%[1]。CARD9位于细胞内,存在于多种组织中,如脾、胸腺、肺、骨髓等,尤其是在骨髓源巨噬细胞和骨髓源树突状细胞中有大量表达,而T细胞、B细胞和NK细胞中表达并不多,这提示CARD9可能主要参与机体的固有免疫反应[2]。固有免疫系统中能够识别病原体相关分子模式(pathogen associated molecularpatterns,PAMP)的受体称为模式识别受体(PRR)[3],巨噬细胞和树突状细胞都是先天免疫细胞,表达着多种模式识别受体,PRR在细胞内、外和细胞膜上均有分布,包括Toll样受体(TLRs)、核苷酸寡聚化区样受体(NLRs)、RIG-I样受体(RLRs)以及树突状细胞相关的C型凝集素受体(CLRs)等[4-6]。受体偶联之后,PRRs就会启动细胞内信号的传导,CARD9能够高效整合多种固有免疫受体的识别信号,激活NF-KB、MAPK等通路,在机体的固有免疫中发挥重要作用。现对CARD9在不同感染性疾病中的分子调控机制进行阐述。
1 细菌感染
免疫受体酪氨酸激活基序(immunoreceptor tyrosine-based activation motif,ITAM)是受体相关分子胞内段上的特定结构,在固有免疫和适应性免疫中都起到重要作用。Hara等[7]发现CARD9可能是ITAM下游分子,参与多种信号通路的激活,用ITAM关联受体激动剂刺激CARD9基因敲除小鼠(CARD9-/-)和野生型小鼠的树突状细胞,发现CARD9-/-细胞NF-κB入核与DNA结合作用显著低于野生型细胞,MAPK通路的激活不受影响;用Toll样受体激动剂刺激,结果CARD9-/-细胞IκBa的降解和NF-κB与DNA结合情况并没有受到损害,而MAPK通路中Jnk和P38的磷酸化却受到抑制。这表明ITAM偶联受体介导骨髓来源细胞NF-κB的激活必须有CARD9的参与,而Toll样受体介导的MAPK通路激活也需要CARD9的存在。Hsu等[2]研究发现CARD9参与胞内菌感染时机体固有免疫的调节,并且对Nod2介导的P38和Jnk这两个MAPK通路的激活有至关重要的作用。他们用多种细菌胞壁成分刺激野生型小鼠和CARD9-/-小鼠巨噬细胞,发现用Poly(I:C)和MDP刺激的CARD9-/-小鼠巨噬细胞P38通路不能激活,IL-6和TNF产生缺失,而LPS刺激却无异常,并且NF-κB通路的激活在两种细胞中也无差异;构建CARD9和Nod2表达载体转染293T细胞进一步研究得出CARD9为Nod2的下游信号组件,能激活MAPK通路,而对Nod2诱导的NF-κB通路没有影响,可见CARD9在Nod2介导的通路中有选择的激活P38通路而不是NF-κB通路。另外,TLR-5受体识别细菌鞭毛蛋白并引发细胞免疫的过程是在CARD9参与下完成的[8]。2010年Dorhoi等[9]发现CARD9在机体控制结核分枝杆菌感染中也必不可少。结核分枝杆菌感染的CARD9-/-小鼠比野生型小鼠更早出现感染症状,结核杆菌负荷也更高,化脓性肉芽肿出现更快,粒细胞聚集更迅速,血清和肺中的促炎性细胞因子和粒细胞集落刺激因子水平也更高;但是CARD9-/-小鼠的T细胞反应正常;CARD9-/-小鼠感染之后细菌增殖不受控制,出现了致死的系统性炎症反应。除此之外,索状因子(TDM)是吞噬细胞识别分枝杆菌的重要成分,Miyake等[10]发现不仅Mincle可以识别索状因子,Dectin-3也在分枝杆菌的识别中发挥作用,Zhao等[11]又探索发现Mincle与Dectin-3之间密切相关:首先由Dectin-3识别TDM并通过Card9-Bcl10-Malt1复合物激活转录因子NF-κB,使得Mincle的表达量上调,Mincle又能识别更多的TDM再次激活NF-κB信号,激活机体免疫反应。CARD9不仅在识别分枝杆菌的多条通路中起调节作用,还可辅助视黄酸诱导蛋白-1(RIG-I)间接识别细菌入侵。RIG-I是RIG-I样受体家族(RLRs)中的一员,是机体识别和抵抗RNA病毒感染的重要受体[12],然而Abdullah等[13]发现RIG-1不仅可以识别RNA病毒,还可在CARD9的参与下识别入侵细胞的李斯特菌所分泌的核酸,产生IL-1β,介导免疫反应的发生。CARD9蛋白是胞内重要的衔接蛋白,能传递由TLRs、NLRs和RLRs等介导的信号,激活NF-κB和MAPK通路,调节细菌侵时机体的免疫反应和炎症反应。
2 真菌感染
Dectin-l和Dectin-2是两种主要在巨噬细胞和树突状细胞表面表达的C型凝集素样模式识别受体,它们分别通过p-葡聚糖和a-甘露聚糖对真菌进行识别,通过CBM复合体(Card9-Bcl10-Malt1)激活NF-KB信号通路,产生多种细胞因子,参与机体抗真菌的固有免疫[14]。Saijo等[15]发现IL-17A在宿主抗真菌的适应性免疫也发挥重要保护作用,而这两条信号通路能诱导Th1和Th17细胞的分化,促进IL-17A的分泌[16]。Leibund等[17]发现,当CARD9缺失时,白念珠菌感染的小鼠Th17细胞及IL-17的产生缺失,无法启动抗真菌的适应性免疫应答。与此同时,临床上的几例由于CARD9突变导致的患者对真菌易感的情况,为之前的研究提供了临床依据。2009年Glocker[18]报道了一个易患慢性皮肤黏膜真菌感染的大家族,并对其中的36例进行了基因学分析,发现4例患者均携带CARD9基因上的一个纯合突变Q295X,导致CARD9蛋白的编码提前终止,野生型CARD9蛋白缺失,同时携带此突变的患者Th17细胞数量明显较正常人低。2013年Drewniak[19]报道一位念珠菌性脑膜炎患者CARD9蛋白缺失,中性粒细胞失去对念珠菌杀伤作用,基因学研究发现该患者携带两个杂合突变位点c.214G.A和c.1118G.C使得蛋白质发生G72S和R373P改变,导致蛋白缺失。同年Lanternier等[20]对17例深部真菌病患者基因进行测序,也发现了CARD9基因上的两个罕见纯合突变位点:Q289X和R101C,它们分别导致野生型CARD9蛋白的完全缺失和表达下降,IL-6和IL-17A水平也显著降低,这提示CARD9常染色体隐性遗传缺陷可能是深部真菌病的发病原因。近年来,随着对CARD9在真菌易感性方面研究的深入,研究人员在遇到难治性复发性真菌病时,开始有意识地从遗传学角度寻找病因。从2009年至今,共有11篇[18-28]关于CARD9基因缺陷导致真菌感染发生的病例报道(表1),包括8种不同的致病真菌和14种不同的突变位点(图1),其中有5例是我国患者,致病真菌分别是疣状瓶霉[21]和多主棒孢霉菌[27]。
不论是细菌还是真菌感染,一旦病原微生物进入吞噬细胞内,就会有吞噬溶酶体形成,成熟的吞噬溶酶体会释放大量活性氧(ROS),抑制病原微生物的增殖、扩散[29]。Wu等[30]研究发现CARD9也参与调节巨噬细胞释放ROS杀灭入侵病原微生物,它能抑制LyGDI(GDP解离抑制剂)对GTP酶Rac1的抑制作用,激活Rac1,产生ROS抑制和杀灭病原微生物。
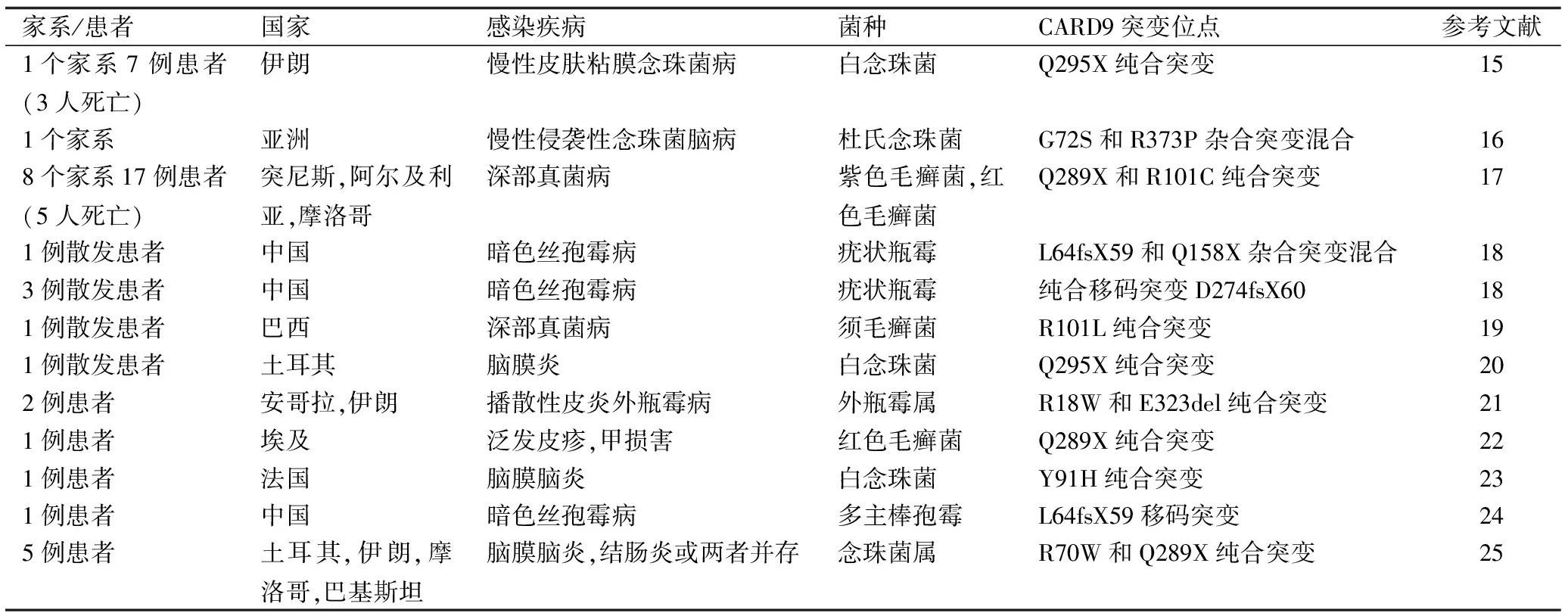
表1 CARD9突变病例摘要

图1 CARD9突变位点示意图
3 病毒感染
Hsu等[2]2007年研究发现胞内微生物感染需要CARD9作为招募蛋白,这里的胞内微生物不仅指胞内菌,也包括病毒。他们用水疱性口炎病毒(VSV)感染野生型和CARD9-/-小鼠巨噬细胞,检测MAPK和NF-κB的激活情况,结果NF-κB通路未受影响,而P38和Jnk的磷酸化受到抑制。提示在机体抵御病毒感染时P38和Jnk通路的激活及相关细胞因子的产生可能需要CARD9参与。维A酸诱导基因I样受体家族(RLRs),包括RIG-I(retinoic acid-inducible gene I)、黑素瘤分化相关基因5(melanoma differentiation-associated gene 5, MDA5)和遗传学和生理学实验室蛋白2(laboratory of genetics and physiology 2, LGP2),是一类识别细胞内RNA病毒的受体[12]。RLR识别RNA病毒后将信号传递给干扰素(IFN)调节因子和NF-κB信号通路,产生IFN、IL-6和IL-1β前体等调节免疫反应, Poeck等[31]用水疱性口炎病毒或脑心肌炎病毒刺激CARD9-/-小鼠树突状细胞,发现NF-κB亚单位p65入核水平和IL-6、IL-1β产生水平远远低于野生型细胞,但是干扰素的产生却没有受到影响,这提示RLR识别RNA病毒后NF-κB信号通路的激活是依赖CARD9的,而干扰素的合成与CARD9不相关,可见CARD9是有选择性地调节RLR介导的炎症反应。Gianni等[32]研究发现,CARD9也参与了机体对抗单纯疱疹病毒的防御机制。RAD50是来自核内的DNA传感器蛋白,能识别受损的双链DNA并启动修复信号[33],2014年Roth等[34]研究发现RAD50不仅能在细胞核内识别和修复DNA损伤,还能在细胞质中与CARD9形成复合体识别病毒DNA,募集BCL10蛋白与CARD9一起激活NF-κB通路,产生IL-1β的前体,为后续IL-1β的产生及抗病毒的适应性免疫应答反应提供信号。流感病毒是一种常见的能引起病毒性肺炎并可以诱发急性呼吸窘迫综合征的病原体,其肺部严重的病理改变可能是由于流感病毒刺激引起强烈的固有免疫反应所致。 Uematsu等[35]用流感病毒感染野生型和CARD9-/-小鼠,观察他们的生存率和肺部的病理改变,结果CARD9-/-小鼠的生存率明显高于野生型小鼠,缺陷小鼠肺部的炎症性细胞因子和趋化因子也显著低于野生型小鼠,但是病毒的清除,I型干扰素的产生,抗病毒的T细胞和B细胞免疫反应却没有受到影响。可见CARD9在病毒性肺炎的发生过程中主要介导炎症反应和早期固有免疫的发生,对适应性免疫反应并没有很大影响。这为治疗严重的病毒性肺炎提供了新思路。
4 结语
CARD9是胞内信号传导的重要衔接蛋白,在多种系统疾病中广泛表达,并能调控NF-κB、MAPK等信号通路,尤其在机体对病原微生物防御反应和固有免疫中起重要调节作用。CARD9缺失导致患者对真菌易感,已经成为公认的常染色体隐性遗传疾病,虽然现在临床上因CARD9突变发生的只有真菌感染性疾病,但是经过大量实验室研究发现,CARD9突变对其他病原微生物的感染也有重要影响。CARD9已是感染性疾病发生发展机制中的重要一员,在此仅将近年来与CARD9相关的感染性疾病的研究进行归纳整理,随着对其作用机制在感染性疾病中的深入研究,有可能为感染性疾病发生发展机制及临床治疗提供新思路。
[1] Bertin J, Guo Y, Wang L, et al. CARD9 is a novel caspase recruitment domain-containing protein that interacts with BCL10/CLAP and activates NF-kappa B[J]. J Biol Chem,2000,275(52):41082-41086.
[2] Hsu YM, Zhang Y, You Y, et al. The adaptor protein CARD9 is required for innate immune responses to intracellular pathogens[J]. Nat Immun,2007,8(2):198-205.
[3] Medzhitov R. Approaching the asymptote: 20 years later[J]. Immunity,2009,30(6):766-775.
[4] Sancho D, Reis e Sousa C. Signaling by myeloid C-type lectin receptors in immunity and homeostasis[J]. Annu Rev Immunol,2012,30:491-529.
[5] Kerrigan AM, Brown GD. Syk-coupled C-type lectins in immunity[J]. Trends Immunol,2011,32(4):151-156.
[6] Osorio F, Reise Sousa C. Myeloid C-type lectin receptors in pathogen recognition and host defense[J]. Immunity,2011,34(5):651-664.
[7] Hara H, Ishihara C, Takeuchi A, et al. The adaptor protein CARD9 is essential for the activation of myeloid cells through ITAM-associated and Toll-like receptors[J]. Nat Immun,2007,8(6):619-629.
[8] Atif SM, Lee SJ, Li LX, et al. Rapid CD4+ T-cell responses to bacterial flagellin require dendritic cell expression of Syk and CARD9[J]. Eur J Immunol,2015,45(2):513-524.
[9] Dorhoi A, Desel C, Yeremeev V, et al. The adaptor molecule CARD9 is essential for tuberculosis control[J]. J Exp Med,2010,207(4):777-792.
[10] Miyake Y, Toyonaga K, Mori D, et al. C-type lectin MCL is an fcRγ-coupled receptor that mediates the adjuvanticity of mycobacterial cord factor[J]. Immunity,2013,38(5):1050-1062.
[11] Zhao XQ, Zhu LL, Chang Q, et al. C-type lectin receptor dectin-3 mediates trehalose 6,6'-dimycolate (TDM)-induced mincle expression through CARD9/Bcl10/MALT1-dependent nuclear factor (NF)-kappaB activation[J]. J Biol Chem,2014,289(43):30052-30062.
[12] Loo YM, Gale M Jr. Immune signaling by RIG-I-like receptors[J]. Immunity,2011,34(5):680-692.
[13] Abdullah Z, Schlee M, Roth S, et al. RIG-I detects infection with live Listeria by sensing secreted bacterial nucleic acids[J]. EMBO J,2012,31(21):4153-4164.
[14] Gross O, Gewies A, Finger K, et al. Card 9 controls a non-TLR signalling pathway for innate anti-fungal immunity[J]. Nature,2006,442(7103):651-656.
[15] Saijo S, Ikeda S, Yamabe K, et al. Dectin-2 recognition of alpha-mannans and induction of Th17 cell differentiation is essential for host defense against Candida albicans[J]. Immunity,2010,32(5):681-691.
[16] Robinson MJ, Osorio F, Rosas M, et al. Dectin-2 is a Syk-coupled pattern recognition receptor crucial for Th17 responses to fungal infection[J]. J Exp Med,2009,206(9):2037-2051.
[17] Leibund Gut-Landmann S, Gross O, Robinson MJ, et al. Syk- and CARD9-dependent coupling of innate immunity to the induction of T helper cells that produce interleukin 17[J]. Nat Immun,2007,8(6):630-638.
[18] Glocker EO, Hennigs A, Nabavi M, et al. A homozygous CARD9 mutation in a family with susceptibility to fungal infections[J]. N Engl J Med,2009,361(18):1727-1735.
[19] Drewniak A, Gazendam RP, Tool AT, et al. Invasive fungal infection and impaired neutrophil killing in human CARD9 deficiency[J]. Blood,2013,121(13):2385-2392.
[20] Lanternier F, Pathan S, Vincent QB, et al. Deep dermatophytosis and inherited CARD9 deficiency[J]. N Engl J Med,2013,369(18):1704-1714.
[21] Wang X, Wang W, Lin Z, et al. CARD9 mutations linked to subcutaneous phaeohyphomycosis and TH17 cell deficiencies[J]. J Allergy Clin Immunol,2014,133(3):905-908 e3.
[22] Grumach AS, de Queiroz-Telles F, Migaud M, et al. A homozygous CARD9 mutation in a Brazilian patient with deep dermatophytosis[J]. J Clin Immunol,2015,35(5):486-490.
[23] Herbst M, Gazendam R, Reimnitz D, et al. Chronic candida albicans meningitis in a 4-year-old girl with a homozygous mutation in the CARD9 gene (Q295X)[J]. Pediatr Infect Dis J,2015,34(9):999-1002.
[24] Lanternier F, Barbati E, Meinzer U, et al. Inherited CARD9 deficiency in 2 unrelated patients with invasive Exophiala infection[J]. J Infect Dis,2015,211(8):1241-1250.
[25] Jachiet M, Lanternier F, Rybojad M, et al. Posaconazole treatment of extensive skin and nail dermatophytosis due to Autosomal recessive deficiency of CARD9[J]. JAMA Dermatol,2015,151(2):192.
[26] Gavino C, Cotter A, Lichtenstein D, et al. CARD9 deficiency and spontaneous central nervous system candidiasis: complete clinical remission with GM-CSF therapy[J]. Clin Infect Dis,2014,59(1):81-84.
[27] Yan XX, Yu CP, Fu XA, et al. CARD9 mutation linked to Corynespora cassiicola infection in a Chinese patient[J]. Br J Dermatol,2016,174(1):176-179.
[28] Lanternier F, Mahdaviani SA, Barbati E, et al. Inherited CARD9 deficiency in otherwise healthy children and adults with Candida species-induced meningoencephalitis, colitis, or both[J]. J Allergy Clin Immunol,2015,135(6):1558-1568.
[29] Lambeth JD. NOX enzymes and the biology of reactive oxygen[J]. Nat Rev Immunol,2004,4(3):181-189.
[30] Wu W, Hsu YM, Bi L, et al. CARD9 facilitates microbe-elicited production of reactive oxygen species by regulating the LyGDI-Rac1 complex[J]. Nat Immun,2009,10(11):1208-1214.
[31] Poeck H, Bscheider M, Gross O, et al. Recognition of RNA virus by RIG-I results in activation of CARD9 and inflammasome signaling for interleukin 1 beta production[J]. Nat Immun,2010,11(1):63-69.
[32] Gianni T, Leoni V, Chesnokova LS, et al. αvβ3-integrin is a major sensor and activator of innate immunity to herpes simplex virus-1[J]. Proc Natl Acad Sci USA,2012,109(48):19792-19797.
[33] Maser RS, Monsen KJ, Nelms BE, et al. hMre11 and hRad50 nuclear foci are induced during the normal cellular response to DNA double-strand breaks[J]. Mol Cell Biol,1997,17(10):6086-6096.
[34] Roth S, Rottach A, Lotz-Havla AS, et al. Rad50-CARD9 interactions link cytosolic DNA sensing to IL-1β production[J]. Nat Immun,2014,15(6):538-545.
[35] Uematsu T, Iizasa E, Kobayashi N, et al. Loss of CARD9-mediated innate activation attenuates severe influenza pneumonia without compromising host viral immunity[J]. Sci Rep,2015,5:17577.
(收稿:2016-08-23 修回:2016-09-04)
Updateofcaspaserecruitmentdomaincontainingprotein9ininfectiousdiseases
CAOJing1,2,ZHANGFuren1,2.
1.ShandongProvincialHospitalforSkinDiseases,ShandongUniversity,Jinan250022,China; 2.ShandongProvincialInstituteofDermatologyandVenereology,ShandongAcademyofMedicalSciences,Jinan250022,China
ZHANGFuren,E-mail:zhangfuren@hotmail.com
Caspase recruitment domain-containing protein 9 (CARD9) is a member of the CARD protein family, which is a nonredundant adapter protein regulating intra-cellular signal transduction pathway through CARD-CARD interaction. CARD9 is a key signaling molecule for innate immune responses, which plays an important role in recognizing and resisting the fungi and bacteria infection. CARD9 deficiency has been reported to be associated with severe fungal diseases and chronic mucocutaneous candidiasis. The potential molecular mechanism of CARD9 in infectious diseases is reviewed in this article.
way caspase recruitment domain-containing protein; infectious diseases; innate immune; signal path
1山东大学附属省皮肤病医院,山东大学,济南,250022 2山东省皮肤病性病防治研究所,山东省医学科学院,济南,250022
张福仁,E-mail: zhangfuren@hotmail.com

