基于多学科协作的胰腺肿块影像诊断思路
陆建平, 边云
·影像诊断思路·
基于多学科协作的胰腺肿块影像诊断思路
陆建平, 边云
胰腺疾病; 胰腺肿瘤; 体层摄影术,X线计算机; 磁共振成像; 多学科协作
近年来,随着影像技术的快速发展和应用的普及,在胰腺疾病诊断水平明显提高的同时,也使胰腺占位性病变的检出率显著提高。多学科的交叉融合使我们对胰腺疾病的认识不断地丰富和深入,逐步由“Surgery First”向多学科综合诊治团队(multi-disciplinary team,MDT)模式转变。从疾病的诊断、术前评估至疗效评价等,无创影像几乎涉及MDT模式下的每一个环节。传统与现代碰撞中,国内外涌现出诸多的胰腺疾病诊断共识和指南,这就要求各科相关医师必须以共识和指南为准则,遵循规范。目前,以CT和MRI为代表的高端影像设备在国内已普及,但规范化应用于诊断亟待加强。鉴于此,有必要形成MDT模式下的影像诊断思路和报告规范,以体现认知进展及学科进步,也利于学术交流和国际接轨。本文就胰腺占位性病变探讨胰腺规范化扫描技术、临床常规诊断思路和诊断报告的书写规范。
胰腺肿块诊断的影像学方法选择
目前有多种影像学检查应用于胰腺肿块的诊断,它们有各自的优势和不足,可以相互补充、相互印证,恰当地选择影像学方法不仅可以提高诊断效率和水平,而且可以节约经费。多层CT具有扫描速度快、容积数据采集、图像空间分辨率高等优点,后期可通过原始横轴面薄层图像进行多种三维后处理,能准确显示肿块与周围脏器的空间关系,特别是与周围重要血管之间的关系,能对肿块进行分期和切除性评价,成为胰腺肿块的首选影像方法。依据最新2015年美国国立综合癌症网络胰腺癌临床实践(NCCN)指南,当怀疑胰腺占位时优选胰腺高分辨率MSCT增强扫描[1]。胰腺增强一般采用三期扫描:动脉期、胰腺实质期和门脉期。动脉期胰腺实质强化不明显,主要评估肿块周围的重要动脉;胰腺实质期可以获得正常胰腺组织与肿块间的最佳对比度;最后是门脉期,此期正常胰腺实质内对比剂基本消退,如果此期仍可见局灶性强化多数提示为纤维组织的延迟强化,此期也适用于评估肝脏转移。表1为我院640层MSCT扫描参数设置,尤其强调薄层(1mm)和碘对比剂注射流率和总量对胰腺病变的细节显示至关重要。当遇有碘过敏患者怀疑胰腺占位或不能排除肝脏转移,可选择MRI检查。

表1 640层CT胰腺扫描参数
MRI对胰腺肿块的独特优势是软组织对比优于CT。在显示囊液性成分、胰胆管和病灶内出血等方面优于CT。脂肪抑制技术减少了相位伪影,增加了胰腺信号强度。三维动态增强扫描类似于多期增强CT,能清晰显示病灶的血供特点以及与周围结构的关系。磁共振胰胆管成像(magnetic resonance cholangiopancreatography,MRCP)显示较小的囊性病变及病变与胰管间的关系方面优于MSCT,它的效能等同于逆行性胰胆管造影(endoscopic retrograde cholangiopancreatography,ERCP)[2]。近年来发展的多种扩散加权成像技术(DWI、IVIM、DKI等)在显示病灶的异质性方面具有较大潜能。然而,MR检查亦有其不足之处,包括有较多禁忌证(心脏起搏器、幽闭恐惧症)、扫描时间长、图像会受到呼吸、胃肠道蠕动和心血管搏动等运动的影响、偏远地区技术应用受限等。表2为我院3.0T MR胰腺扫描参数设置。
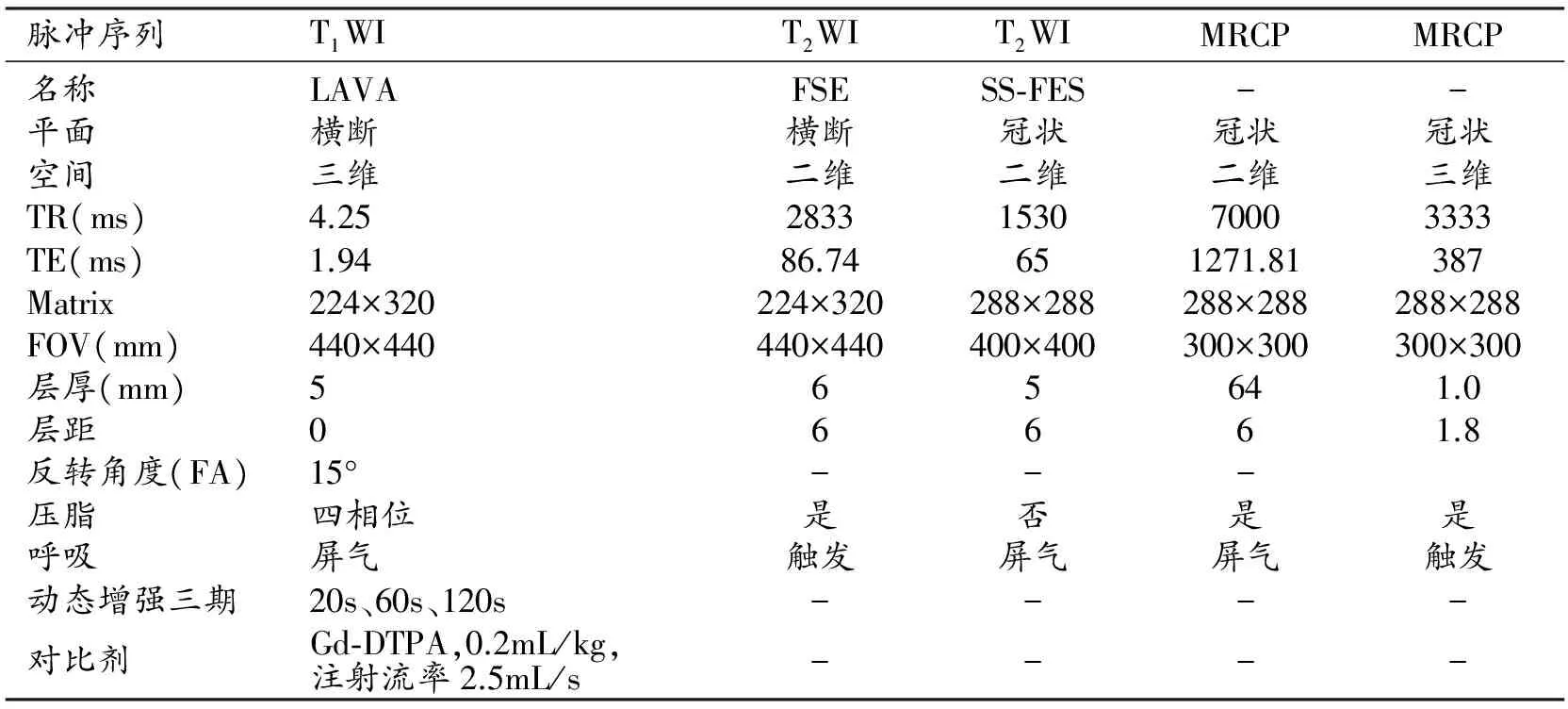
表2 3.0 T MR扫描主要参数设定
注:T1WI:T1加权成像;T2WI:T2加权成像;MRCP:磁共振胰胆管造影;LAVA:基于肝脏容积加速采集序列;FSE:快速自选回波序列;SS-FSE:单次激发快速自选回波序列;四相位:水相、脂相、水脂结合相、水脂分离相;-:无值
超声以其经济、简便、无创等优点成为最常用的胰腺疾病的筛查方法,但有15%~25%患者的超声图像受到气体和胰腺位置的干扰而无法诊断[3],超声对胰腺肿块的检出率在50%~70%[4]。EUS是胰腺肿块诊断的重要工具,其诊断其敏感度为76.7%,特异度为91.7%[5]。EUS下细针穿刺(fine-needle aspiration,FNA)获取胰腺组织将其诊断敏感性、特异性分别提高到91.0%和94.0%[6],并且有利于后续的免疫组化及基因研究与诊断,不足之处主要为因穿刺点选择受限致细胞学检查不准确,有一定比例的假阴性,而且需要有操作经验的资深医生实施。ERCP能显示胰腺导管的解剖精确、可靠,并且可以同时获取病理组织和开展介入手术;其不足之处为有创、昂贵、操作者依赖性以及不能显示胰管腔外结构等。新指南中认为EUS、PET-CT的价值是可作为MSCT的补充,EUS-FNA优于ERCP下的病理检查,最常见的并发症为出血和急性胰腺炎,但发生率低[2]。
全面了解患者临床资料
全面了解临床资料是提高胰腺病变影像诊断准确性的前提。
1.年龄和性别
年龄和性别是重要的诊断线索。85%的胰腺实性-假乳头状瘤(solid-pseudopapillary neoplasm,SPN)发生于年轻女性;黏液性囊腺瘤(mucinous cystic neoplasm,MCN)和浆液性囊腺瘤(serous cystadenoma,SCN)以50~60岁女性高发,分别占99.8%和80.0%[7];胰母细胞瘤主要发生在10岁以下男童;肿块型胰腺炎(mass-forming pancreatitis,MFP)以中青年男性居多;胰腺导管上皮癌(pancreatic ductal adenocarcinoma,PDAC)、自身免疫性胰腺炎(autoimmune pancreatitis,AIP)、导管内乳头状黏液性肿瘤(intraductal papillary mucinous neoplasm,IPMN)和胰腺转移瘤则以中老年男性居多;胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasm,PNEN)多发生于60岁左右,如果为功能性肿瘤,则会更年轻,男女比例约1∶1。
2.病史
慢性胰腺炎(chronic pancreatitis,CP)患者通常有大量吸烟和/或饮酒史。当患者出现多种肿瘤或与多发神经内分泌肿瘤I型(multiple endocrine neoplasia,MEN)相关性较高的单一肿瘤或表现时,如垂体泌乳素瘤、甲状旁腺功能亢进,需要怀疑MEN Ⅰ型的可能。当患者胰腺肿瘤同时伴发马凡综合征或甲状腺髓样癌时,要考虑MEN Ⅱ型可能。当患者伴有颅内血管母细胞瘤和视网膜、肾脏、肾上腺、附睾等多脏器病变时,要考虑von Hippel-Lindau(VHL)综合征的可能。
3.临床症状
无症状或症状不典型的患者就诊:这类患者通常于体检时无意发现,或仅伴有轻微的腹痛、腹部包块,而其它临床和化验血指标均正常,以SPTP、MCN、SCN、IPMN和无功能的PENP为主。
有典型临床症状和化验指标的患者就诊:胰腺癌(pancreatic cancer,PC)、MFP、AIP或胰腺其它占位压迫胰胆管的患者常以梗阻性黄疸就诊。血清IgG4或其它少见免疫学指标增高提示AIP。PDAC或其它胰腺恶性肿瘤患者通常CA19-9、CA242、CA50、CEA等癌性指标增高。CA19-9正常、AFP升高提示胰腺腺泡细胞癌(acinar cell carcinoma of the pancreas,ACCP)。Wipple三联征患者、空腹血浆胃泌素、胰高血糖素、生长抑素升高提示胰腺神经内分泌肿瘤。
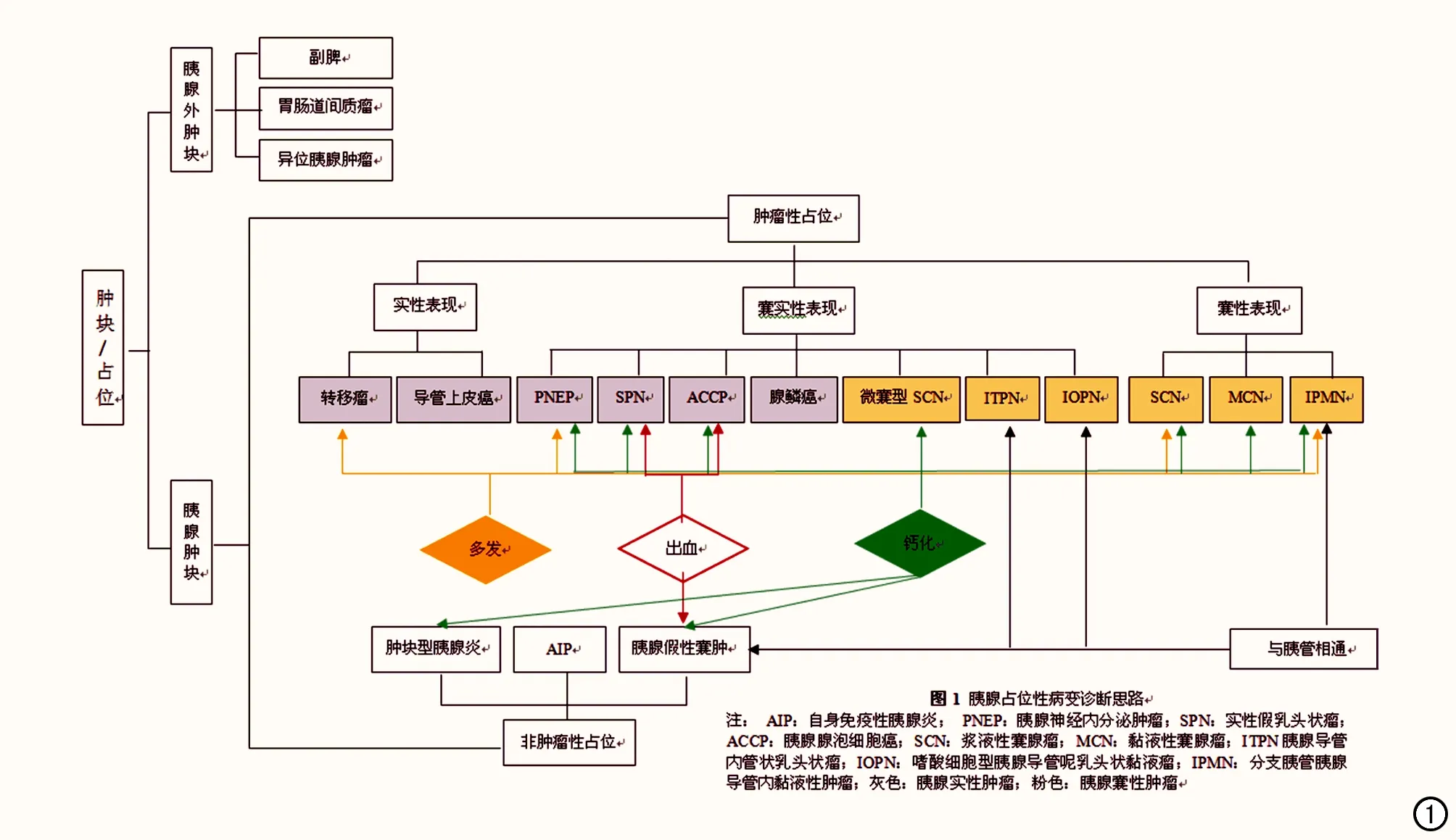
图1 胰腺占位性病变诊断思路。注: AIP:自身免疫性胰腺炎; PNEP:胰腺神经内分泌肿瘤;SPN:实性假乳头状瘤;ACCP:胰腺腺泡细胞癌;SCN:浆液性囊腺瘤;MCN:黏液性囊腺瘤;ITPN胰腺导管内管状乳头状瘤;IOPN:嗜酸细胞型胰腺导管呢乳头状黏液瘤;IPMN:分支胰管胰腺导管内黏液性肿瘤;灰色:胰腺实性肿瘤;粉色:胰腺囊性肿瘤。
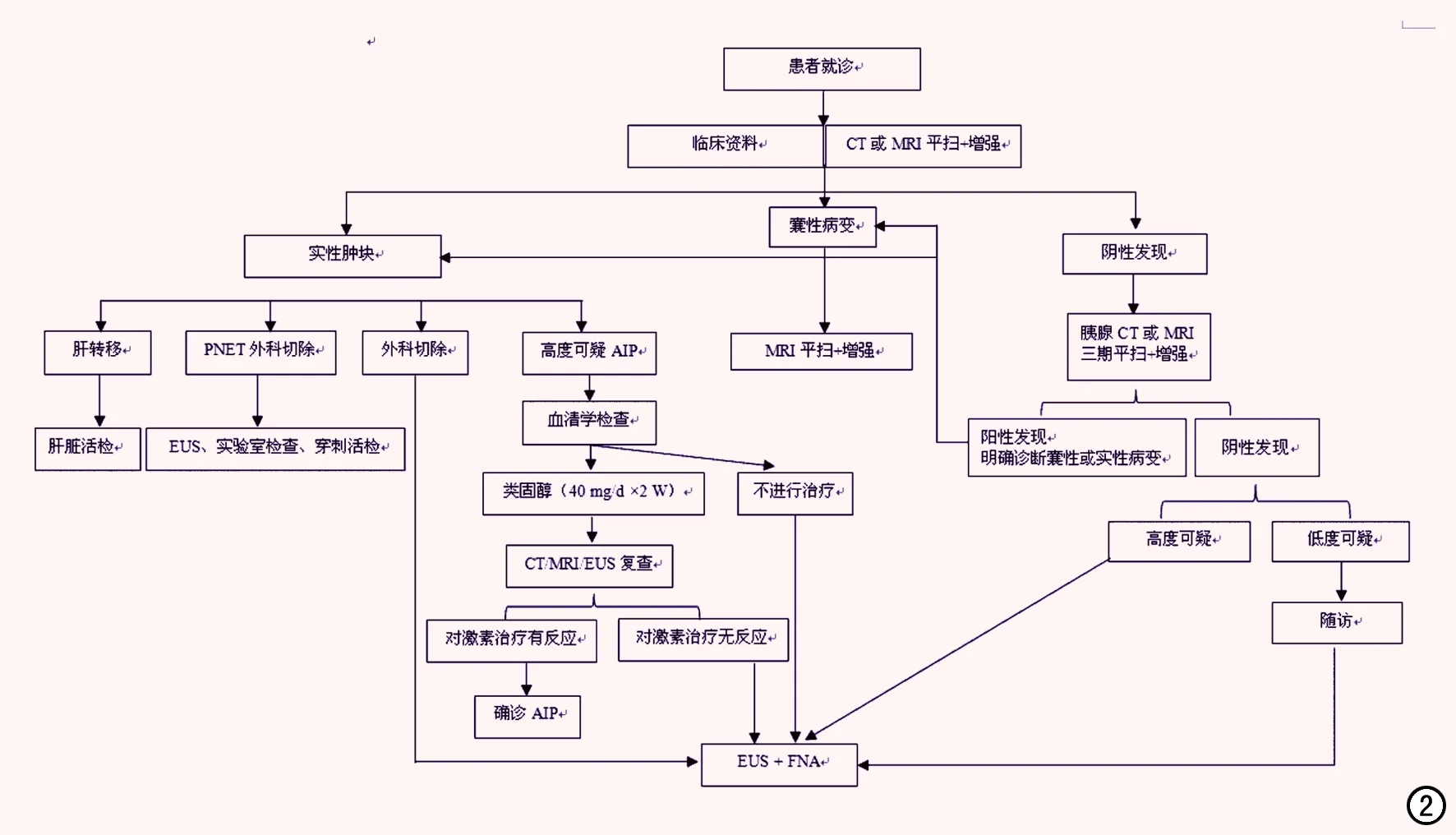
图2 胰腺肿块或占位病变的诊断流程。
胰腺占位的影像诊断思路
胰腺占位性病变在影像学中既有共性,也有个性。诊断时可依照以下顺序:首先确定有无胰腺占位,其次确定肿瘤性占位还是非肿瘤性占位,再次确定是胰腺实性、囊实性或囊性占位。本文重点介绍我院MDT工作中常见的胰腺占位的影像学诊断思路和检查流程,见图1、2和表3。
1.明确有无胰腺占位
影像诊断中定位非常重要,首先我们要确定肿块是来自于胰腺还是胰腺外其它脏器占位。当肿块太大或与某脏器关系密切,定位诊断仍有一定困难。
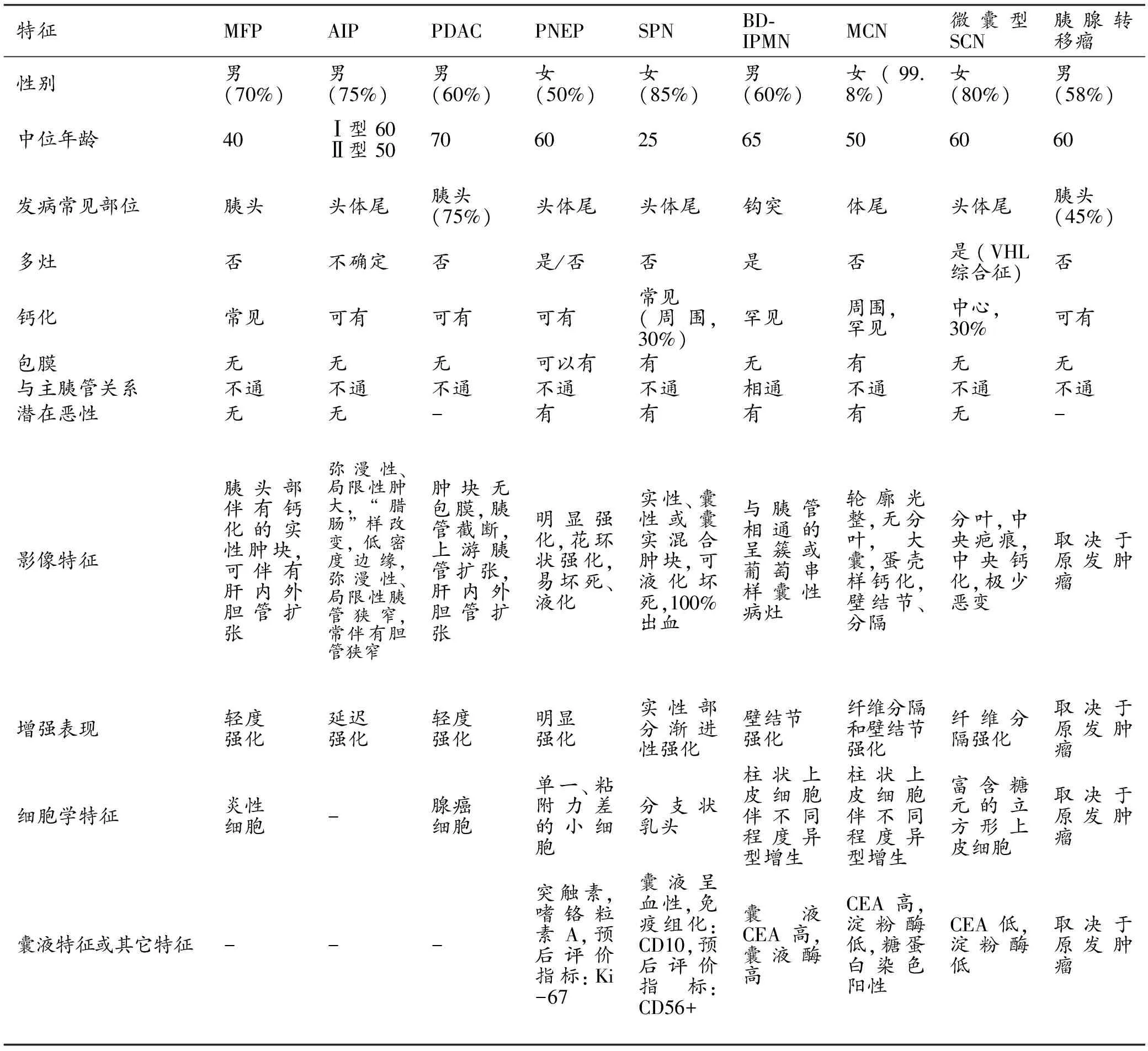
表3 胰腺肿瘤和肿瘤样病变鉴别[32]
注:MFP:肿块型胰腺炎;AIP:自身免疫性胰腺炎;PDAC:导管上皮癌;PNEP:胰腺神经内分泌肿瘤;SPN:实性假乳头状瘤;BD-IPMN:分支胰管胰腺导管内黏液性肿瘤;MCN:黏液性囊腺瘤;SCN:浆液性囊腺瘤; VHL综合征:希-淋病;-:无值。
副脾:是一种脾脏先天变异,发生率10%~30%[8],胰尾是副脾第二大好发部位,又称“胰内副脾”,通常小于3 cm,位于胰腺背侧。缺乏经验的临床医师常将副脾误诊为PNEP。副脾的CT和MRI表现与脾脏类似,动脉期增强出现不均匀花斑样强化,超顺磁氧化铁增强T2WI上信号下降有助于明确诊断[9]。
胃肠道间质瘤:胃肠道间质瘤通常外生性生长,肿瘤呈类圆形,中央可发生坏死,增强后不均匀强化,肿块与邻近脏器粘连,与胰体尾部体积较大的肿瘤如SPN、无功能PNEP容易混浠。鉴别时需通过多平面重组,仔细分析肿块与胃肠道间关系,当胃肠道间质瘤中央坏死与肠腔或胃腔相通时,钡餐造影可以显示窦道,并且肿块可随体位的变化而变化[10]。异位胰腺肿瘤:胰岛细胞瘤可异位于十二指肠、肝十二指肠韧带、肝脏、胰周脂肪组织、脾门、结肠系膜、胸腹腔,患者常出现Wipple三联征等典型临床症状可有助于诊断。SPN向胰外生长,并从系膜处获得营养,与系膜粘连,则会随着系膜而发生移动,可以使得两次检查时间相近的肿块不在同一部位,此类肿瘤较易误诊为系膜或小肠肿瘤。SPN也可发生异位,占所有胰腺外分泌肿瘤的0.1%~3.0%,发生在前肠和近段中肠的任意部位。除了部位不在胰腺,其余表现均和胰腺内SPN表现一致。异位的胰腺组织也可发生肿瘤,如ACCP,目前报道不足7例。
2.明确肿瘤性占位还是非肿瘤性占位
胰腺肿瘤性占位与非肿瘤性占位因临床处理原则不同,故正确诊断至关重要。胰腺肿瘤性占位与非肿瘤性占位较难鉴别的有以下几种病变。
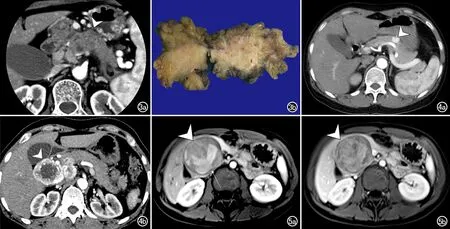
图3 胰腺导管上皮癌(PDAC)。a) 胰腺实质期CT增强图像,可见胰体部肿块增强后呈无包膜的低密度肿块(箭头); b) 大体病理标本图,显示肿瘤位于胰腺体部。 图4 胰腺神经内分泌肿瘤(PNEP)。a) 胰腺实质期CT增强图像,显示肿块明显强化(箭头); b) 另一层面示病灶可见典型的花环状强化(箭头)。 图5 胰腺实性假乳头状瘤(SPN)。a) MR T1WI增强动脉期,示胰头部肿块内可见出血(箭头)和实性成分(箭),实性成分呈轻度强化; b) 延迟期示肿瘤实性成分明显强化(箭头)。
肿块型胰腺炎(mass-forming pancreatitis,MFP):MFP与PDAC有较多临床和影像表现的共同点,导致鉴别困难。MFP是CP的一种特殊类型,胰头肿块常见,其内可见钙化,胆总管逐渐变窄,胰管狭窄无PC明显,无明显截断征,可出现胰管穿通征、肾前筋膜增厚。当肿块逐渐增大,钙化移位、出现淋巴结转移和肝脏转移提示为恶变病变。我们需要结合化验指标,病史长短、黄疸轻重、腹痛与黄疸出现先后来综合诊断。
自身免疫性胰腺炎(autoimmune pancreatitis,AIP):常见于中老年男性,多以梗阻性黄疸为首发症状,腹痛常不明显,类固醇激素有效[11]。由于AIP常被误诊为PC导致不必要的手术,近年来已引起重视。2008年日韩两国专家取得共识,推出亚洲AIP诊断标准[12]:①典型影像学表现为胰体弥漫性或局限性肿大;有时伴有包括和(或)低密度边缘;弥漫性、局限性、局灶性胰管狭窄;通常伴有胆管狭窄。②血清IgG4水平增高或其他自身抗体阳性;③组织学提示淋巴浆细胞浸润伴纤维化;①+②和(或)③即可诊断AIP。
胰腺假性囊肿(pancreatic pseudocyst,PPC):既可以与胰管相通,也可与胰管不相通,与胰腺囊性肿瘤较易混淆。PPC分为三种类型[13],Ⅰ型:急性胰腺炎所致的坏死性PPC,伴有正常胰管解剖,罕与囊肿交通;Ⅱ型:CP急性发作导致的坏死性PPC,伴有正常胰管,但与囊肿交通;Ⅲ型:CP所致的潴留性PPC,伴有胰管狭窄,并和囊肿交通。Ⅱ型和Ⅲ型PPC与分支胰管型IPMN较易混淆,PPC患者常伴有急性胰腺炎表现或具有CP基础。
3.肿瘤性占位的性质
胰腺肿块可分为实性和囊性肿块。但是,部分实性肿块易于囊变和部分囊性肿块因实性成分的增多而外观表现为囊实混合型肿块,这些都会增加胰腺肿块的诊断难度。此时我们要结合其病理学基础来深刻了解胰腺肿块内各种成分所对应的影像学表现。
实性表现为主的胰腺肿瘤:PDAC的两种主要成份是肿瘤细胞和纤维组织,均为实性,且乏血供,决定了PDAC呈低密度或者T1WI低信号,T2WI稍高信号,肿块呈实性,极少囊变,增强后一般只有轻度强化(图3)。
囊实混合表现的胰腺肿瘤:易囊变的胰腺实性肿瘤有PNEP、SPN,其次还见于ACCP和胰腺腺鳞癌(pancreatic adenosquamous carcinoma,PASC),它们囊变的病理基础各不相同。
随着对PNEN认识的深入,发现囊变的不少,以胃泌素瘤和无功能肿瘤多见,胰岛素瘤相对少见[7]。胰岛素瘤通常体积较小,动脉期强化显著,而非功性PNEN的强化方式与细胞增殖指数Ki-67阳性指数及肿瘤是否侵犯血管有关,G1期肿瘤较G2、G3期肿瘤在动脉期强化更显著[14];体积较大的肿瘤可因中央区域坏死、囊变或退变、玻璃样变性而呈现周边“花环样”显著强化、中央无强化的表现,这是与其它囊实性肿块的重要鉴别点(图4)。
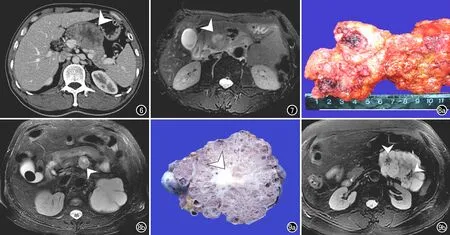
图6 囊实混合型胰腺腺泡细胞癌(ACCP),胰腺实质期CT增强扫描示胰体部肿块呈分叶状(箭头),强化不均匀,大小约5.0 cm×4.8 cm。 图7 胰腺腺鳞癌(PASC),横轴面T2WI示胰头部肿块,肿块外周实性成分呈稍高信号,中心坏死区呈高信号(箭头)。图8 嗜酸性胰腺导管内乳头状黏液瘤(IOPN)。a) 大体病理标本,显示分支胰管内实性肿块; b) 横轴面T2WI示胰体部圆形肿块呈稍高信号(箭头)中心可见点状高信号。 图9 微囊型浆液性囊腺瘤(SCN)。a) 大体病理标本,显示胰尾部肿块,中央可见白色纤维组织(箭头); b) 胰腺横轴面T2WI,显示胰尾部肿块呈分叶状,其内有多个微囊呈高信号,中心可见低信号的星芒状中央纤维(箭头)。
SPN本身为实性,但由于内部肿瘤的蜕变而形成大片囊性结构,而使肿块表现为实性、囊性或囊实混合外观,SPN被认为最易囊变的胰腺实性肿瘤[7]。SPN的实性区由大小均匀一致的小圆形细胞组成,T1WI上呈等低或低信号,T2WI上呈等高或高信号;实性成分向囊性成分过度区域则由大量假性乳头状结构交织排列而成的血窦构成,平扫T1WI等或等高信号,T2WI等或等低信号,增强后呈渐进性强化;囊性区域液化坏死组织在T1WI上呈低信号、T2WI上呈高信号,出血的表现则正好相反,是其特征性表现,发生率高[15](图5)。SPN囊实成分的分布也各不相同,可以表现为相间存在,也可以表现为实性成分位于周边,或者大小不等的多个囊腔位于肿块的边缘。
ACCP从肿瘤分化水平高至低,肿块可表现为等、等低或等密度影,坏死是其特征表现,表现为裂隙状、漩涡状,即使肿块很小也会出现坏死[16],由于ACCP间质内血窦丰富,也易发生出血(图6)。PASC含有>30%鳞状上皮成分,该成分易于囊变坏死,影像上表现为囊实混合肿块(图7)。
囊性肿块因实性成分的增多而表现为囊实混合型肿块:这类肿块包括微囊型SCN、嗜酸细胞型IPMN(intraductal oncocytic papillary neoplasm,IOPN)、胰腺导管内管状乳头状肿瘤(intraductal tubulopapillary neoplasm,ITPN)。微囊型SCN因囊内分隔较多,增强后分隔轻度强化,而使整个肿块呈囊实外观。IOPN和ITPN均为实性成分多,黏液分泌少的肿瘤,表现为位于胰管内偏实性肿块(图8)。
囊性表现为主的胰腺肿瘤:主要有SCN、MCN和IPMN。SCN常见类型为多囊型、蜂窝型、寡囊型。SCN典型影像表现为微囊,蜂窝状,囊壁薄,病灶中心可见星芒状疤痕可伴有钙化(图9)。MCN单发,囊壁厚,蛋壳样钙化及分隔,壁结节(图10)。MCN的恶变率大约为17.5%,若能在“原位癌”时诊断,患者可完全治愈[17]。影像上出现下列征象提示恶变:①囊内实性成分增多;②有明显强化的壁结节;③囊壁不规则增厚以及大囊附近出现多个子囊;④囊内实性成分较多、肝内转移及相邻血管受侵;⑤肿瘤直径>8cm[18,19]。SCN和MCN均与胰管不相通,IPMN与胰管相通。IPMN按其形态可分为分支胰管型、主胰管型和混合型,以前两者多见[20]。分支胰管型IPMN呈与胰管相通的“葡萄串状”的囊性病灶,常常伴有上游胰管的扩张;主胰管型IPMN表现为主胰管弥漫性或局段性扩张,胰管内可见细小壁结节;混合型IPMN同时兼有二者表现[2]。在上述三型中主胰管型和混合型IPMN恶变率最高,下列征象提示有恶变:发生胰腺炎、主胰管直径>15mm、有壁结节和钙化提示主胰管型IPMN恶变侵向,囊腔>3cm、囊壁增厚、有壁结节和胰管扩张10mm提示分支胰管型IPMN恶变侵向[21-23](图11)。值得注意的是IPMN易并发黏液阻塞性胰腺炎,有时甚至以炎性肿块表现,误诊为其他性质的病例不在少数。
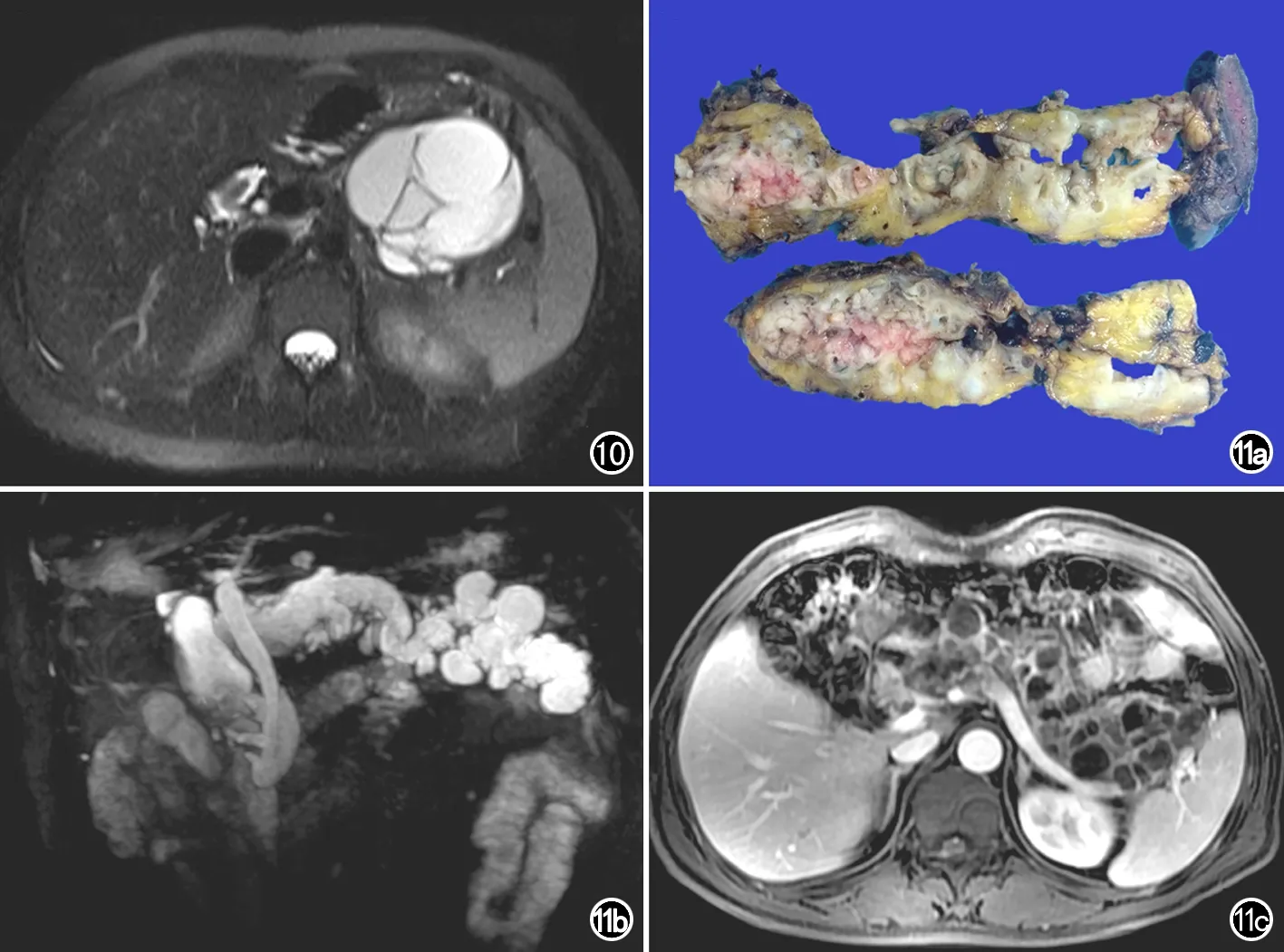
图10 多囊型黏液性囊腺瘤(MCN),胰腺横轴面T2WI示肿瘤呈多囊状,囊与囊之间可见多条低信号分隔,未见明确的壁结节。 图11 混合型胰腺导管内乳头状黏液瘤(IPMN)。a) 大体病理标本示主胰管全程扩张,胰腺内多发囊实性病变; b) MRCP示胰管全程扩张,伴有多发分支胰管囊状扩张; c) 胰腺T1WI实质期增强图像,显示主胰管全程扩张伴有多发分支胰管囊状扩张,其内可见强化的壁结节和分隔。
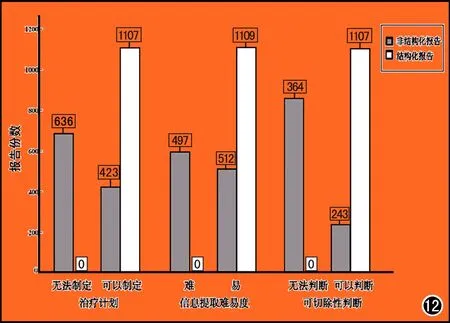
图12 非结构化报告和结构化报告间比较。
4.有助于胰腺肿块诊断的其它影像学特征
病灶位置、大小、数量和胰腺轮廓:PDAC、MFP和SCN均以胰头部多见,分支型IPMN以钩突多见,MCN多发生于胰体尾部。胰腺肿块基本以单发为主,多灶性肿块并不多见,主要发生在MEN Ⅰ型和Ⅱ型、分支胰管型IPMN、VHL和胰腺转移瘤。胰腺肿块的良恶性与病灶发现时的大小有较大的相关性,直径≤2 cm的肿瘤局限于胰腺轮廓内,直径>2 cm的肿瘤常常突出于胰腺,使其轮廓变形,胰腺各部分比例失调,肿块上游胰腺常常萎缩。位于胰头部肿块,由于其生长空间狭小,较易引起胰胆管梗阻,所以发现时肿块体积一般较小;对于恶性度较高或有功能的胰腺肿瘤(如PC、功能性PNEN)往往发现时体积较其它胰腺占位直径小。无功能PNEN、SPN、ACCP体积变化较大,直径可以从数毫米至十几厘米不等,与偶然的影像体检相关,也可能与肿瘤乏嗜神经现象有关[24]。
包膜和边界:肿块侵袭性越强则与周围分界越不清楚。而肿块的包膜也是与周围组织分界是否清楚的主要原因之一,包膜的存在与否、完整与否均提示着肿瘤的恶性程度[25]。通常恶性度高的肿瘤因其浸润性生长而无包膜(如PDCA);当包膜不完整或者原本完整的包膜出现不完整,说明肿瘤突破包膜呈浸润性生长,提示肿瘤发生恶变。
钙化:肿块出现钙化以MFP和PPC最多见。ACCP大约有30%左右的钙化,这是与PDAC的重要鉴别点[26,27]。SCN的钙化多发生在肿块中心的星芒状疤痕上(10%)。MCN则以囊壁钙化更常见(25%),Sahani等[28]认为MCN出现囊内间隔的不规则增厚和钙化提示肿瘤恶变。
肿块与胰管的关系:可分为与胰管相通和不相通。在MRCP或沿着主胰管方向进行曲面重组(curve planar reformation,CPR),大部分胰腺肿块可以明确与胰管之间的关系。当肿块与胰管不相通时,常对胰管产生浸润性和(或)外压性影响。PDAC对胰管浸润常表现为肿块处突然截断,并继发上游胰管扩张,扩张的上游胰管多呈平滑连续性,胰头癌常同时合并软藤状扩张的胆总管,出现典型的“双管征”。其余胰腺肿块对胰管产生的影响以外压性改变为主。与胰管相通的病变主要有IPMN、ITPN和PPC。

图13 上海长海医院胰腺癌影像学结构化报告模板(a~c)。
胰腺肿块的影像诊断报告
影像学报告是影像科医生与多学科交流最重要的手段。一份完整、全面的胰腺影像学报告需要包括以下三大方面:①胰腺实质的描述,包括肿块位置、大小、密度(尤其是胰腺实质期)、胰胆管改变;②胰腺周围重要血管的描述,尤其是肿块与邻近重要血管间的接触关系和有无血管变异;③其它方面描述,包括肝脏、肾脏、胃肠、腹膜、网膜、淋巴结等由于我国各地医疗水平的差异,影像学报告自由度高,术语使用不规范,评价内容不全面,导致影像学报告价值有限。因此,标准规范的结构化影像学报告显得尤为重要,尤其需要共识或指南性的文献来指导,从而提高胰腺影像学评价的质量。研究表明一份完整、全面、精确的结构化报告可以更加迅速、有效地加强学科间交流,优化治疗方案、减少转诊时间、减低医疗费用[29-32]。根据我院一项研究表明结构化报告在治疗计划的制定,信息提取、可切除性判断上均较非结构化报告有明显提高(图12、13)。
胰腺肿块的诊治是临床重要课题,临床的终极目标是胰腺肿块的治疗和治愈,实现这个目标需要多学科通力合作,合作的平台是规范和共识,形成规范和共识的基础之基础是影像诊断和评估,结合最新的国内和国际指南,用清晰的影像诊断思路,形成结构科学的影像学报告,影像医学必将在MDT模式下发挥其最大价值。
[1] 李晓青,钱家鸣. 《2015年美国国立综合癌症网络胰腺癌临床实践指南(V2版)》更新要点及临床路径[J].临床肝胆病杂志,2015,31(5):649-653.
[2] 周振宇,王捷.2015年NCCN胰腺癌指南诊疗更新解读[J].岭南现代临床外科,2015,15(4):377-381.
[3] 谢德荣,马林,林显敢.胰腺癌临床实践-争论与共识[M].广州:广东科技出版社,2009:371-373.
[4] Rickes S,Unkrodt K,Neye H,et al.Differentiation of pancreatic tumours by conventional ultrasound, unenhanced and echo-enhanced power Doppler sonography[J].Scand J Gastroenterol,2002,37(11):1313-1320.
[5] Li H,Hu Z,Chen J,et al.Comparison of ERCP,EUS,and ERCP combined with EUS in diagnosing pancreatic neoplasms:a systematic review and meta-analysis[J].Tumour Biol,2014,35(9):8867-8874.
[6] Hewitt MJ,McPhail MJ,Possamai L,et al.EUS-guided FNA for diagnosis of solid pancreatic neoplasms:a meta-analysis[J].Gastrointest Endosc,2012,75(2):319-331.
[7] 繆飞.胰腺影像学[M].北京:人民卫生出版社,2015:275,282,307.
[8] 向波,张翔,杨全,等.CT量化分析在诊断副脾中的应用[J].放射学实践,2007,29(6):680-684.
[9] 赵旭,周志强.胰腺异位副脾的CT、MRI诊断进展[J].医学综述,2014,20(9):1650-1652.
[10] 班永光,栾钦花,李吉昌,等.多种影像学检查方法对腔外型胃肠道间质瘤的诊断价值探讨[J].医学影像学杂志,2013,23(5):734-737.
[11] 李兆申,廖专.慢性胰腺炎基础与临床[M].上海:上海科学技术出版社,2013:1-20.
[12] Otsuki M,Chung JB,Okazaki K,et al.Asian diagnostic criteria for autoimmune pancreatitis: consensus of the Japan-Korea Symposium on Autoimmune Pancreatitis[J].J Gastroenterol,2008,43(6):403-408.
[13] D′Egidio A,Schein M.Pancreatic pseudocysts:a proposed classification and its management implications[J].Brit J Surg,1991,78(8):981-984.
[14] Tatsumoto S,Kodama Y,Sakurai Y,et al.Pancreatic neuroendocrine neoplasm:correlation between computed tomography enhancement patterns and prognostic factors of surgical and endoscopic ultrasound-guided fine-needle aspiration biopsy specimens[J].Abdom Imaging,2013,38(2):358-366.
[15] 马小龙,汪建华,蒋慧,等.胰腺实性-假乳头状瘤的不同类型影像学表现与病理对照分析[J].中华医学杂志,2012,92(3):170-174.
[16] 许舒航.胰腺腺泡细胞癌的CT、MRI表现特征[J].中华放射学杂志,2015,(11):848-852.
[17] Pederzoli P,Bassi C.Uncommon Pancreatic Neoplasms[M].Italy:Springer,2013:15.
[18] Tanaka M,Fernandez-del Castillo C,Adsay V,et al.International consensus guidelines 2012 for the management of IPMN and MCN of the pancreas[J].Pancreatology,2012,12(3):183-197.
[19] 康文全,付剑云,郭梅梅.胰腺囊性病变的研究进展[J].医学综述,2013,19(15):2757-2760.
[20] Tanaka M,Chari S,Adsay V,et al.International consensus guidelines for management of intraductal papillary mucinous neoplasms and mucinous cystic neoplasms of the pancreas[J].Pancreatology,2006,6(1-2):17-32.
[21] Ogawa H,Itoh S,Ikeda M,et al.Intraductal papillary mucinous neoplasm of the pancreas:assessment of the likelihood of invasiveness with multisection CT[J].Radiology,2008,248(3):876-886.
[22] 张倩倩,黄勇,申洪明.胰腺导管内乳头状黏液性肿瘤的影像学进展[J].实用放射学杂志,2013,29(9):1523-1526.
[23] 《中华胰腺病杂志》编辑委员会.我国胰腺囊性肿瘤共识意见(草案 2013,上海)[J].中华胰腺病杂志,2013,13(2):79-90.
[24] 马小龙,蒋慧,汪建华,等.胰腺腺泡细胞癌的CT特征分析[J].中华放射学杂志,2012,46(8):693-696.
[25] Frazier AA.Radiologic-pathologic features to discern nonepithelial versus epithelial pancreatic tumors[J].Radiographics,2016,36(1):122.
[26] Chiou YY,Chiang JH,Hwang JI,et al.Acinar cell carcinoma of the pancreas:clinical and computed tomography manifestations[J].J Comput Assist Tomogr,2004,28(2):180-186.
[27] Khalili M,Wax BN,Reed WP,et al.Radiology-pathology conference.Acinar cell carcinoma of the pancreas[J].Clin Imaging,2006,30(5):343-346.
[28] Sahani DV,Kadavigere R,Saokar A,et al.Cystic pancreatic lesions:a simple imaging-based classification system for guiding management[J].Radiographics,2005,25(6):1471-1484.
[29] Brook OR,Brook A,Vollmer CM,et al.Structured reporting of multiphasic CT for pancreatic cancer:potential effect on staging and surgical planning[J].Radiology,2015,274(2):464-472.
[30] Langlotz CP.Structured radiology reporting:are we there yet?[J].Radiology,2009,253(1):23-25.
[31] Larson DB,Towbin AJ,Pryor RM,et al.Improving consistency in radiology reporting through the use of department-wide standardized structured reporting[J].Radiology,2013,267(1):240-250.
[32] Wagh MS,Draganov PV.Pancreatic masses:advances in diagnosis and therapy[M].Switzerland:Springer,2016:204-205.
R576; R814.42; R445.2
A
1000-0313(2017)09-0909-09
2016-09-04)
200433 上海,中国人民解放军海军军医大学第一附属医院(上海长海医院)影像医学科
陆建平(1959-),男,江苏太仓人,博士,主任医师,教授,博士生导师,主要从事胰腺疾病影像诊断与病理相关性研究工作。
10.13609/j.cnki.1000-0313.2017.09.004

