DH-PSF三维动态多粒子追踪在活细胞成像的应用
李 恒,陈丹妮,于郭宝平
1)深圳大学光电工程学院,光电子器件与系统教育部/广东省重点实验室,广东深圳 518060;2)深圳大学信息工程学院,广东深圳 518060

【光电工程/OptoelectronicEngineering】
DH-PSF三维动态多粒子追踪在活细胞成像的应用

1)深圳大学光电工程学院,光电子器件与系统教育部/广东省重点实验室,广东深圳 518060;2)深圳大学信息工程学院,广东深圳 518060
利用双螺旋点扩散函数三维定位的能力建立了三维多粒子追踪成像系统,成像深度可达到4 μm,定位精度达到20 nm,并在该系统上实现了对巨噬细胞内多个荧光微球的动态追踪.结果显示,细胞内荧光探针的运动范围达到7 μm,可实时获取荧光微球在细胞内的运动速率,研究表明该系统是生物学家研究细胞内分子转运和相互关系非常有用的工具.
光学工程;三维成像;多粒子;点扩展函数;纳米定位;活细胞;动态追踪
细胞是生命体最基本的单元,其功能与细胞器的结构变化以及细胞内生物分子的动态变化密切相关,只有理解细胞在生命过程中分子机制的交互作用,才能深入了解生命活动的本质[1].显微镜的诞生使得科学家对于细胞微观信息的获取成为可能,从发现和认识细胞,到阐明细胞的周期循环和凋亡规律等方面,显微镜都具有重大的推动作用.然而,传统显微镜已经无法满足人类对了解细胞内蛋白质等生物大分子功能的需求,生物分子在细胞内的运转,以及细胞内结构的相互作用关系等一系列在体活动,目前也无法通过生物物理实验方法来实现,致使活细胞的研究陷入瓶颈[2].
近年来,随着激光技术、荧光材料制备、荧光标记和图像处理等技术的快速发展[3],以及高性能探测器件的不断涌现,光学显微技术进入崭新的发展阶段[4-6].新一代的光学显微镜以其所具有的高时空分辨率、无损伤以及对活细胞单分子探测的可行性等优点,成为生物学家的研究热点[7-9].随着超分辨显微成像技术的快速发展,实现纳米级定位精度的成像方法层出不穷,这些方法多是基于二维定位或者成像深度较低,活细胞成像多采用扫描方式实现[10-17],会限制活细胞的成像应用.
巨噬细胞是免疫细胞的一种,具有调节免疫效应的作用,通过吞噬凋亡细胞、杀灭微生物、抗原呈递和分泌细胞因子等对机体炎症和免疫应答进行的调控.大量的研究主要集中在巨噬细胞的识别与吞噬上, 但对巨噬细胞吞噬的动态过程及吞噬后在胞内运动轨迹的研究还比较少[18].本研究通过特殊设计的三维超分辨成像方法,得到4μm厚度的超分辨动态成像,实现了巨噬细胞内吞的实时记录,为生物学研究提供非常有用的工具.
1 成像原理
采用双螺旋点扩展函数方法实现三维超分辨成像,双螺旋点扩展函数就是利用拉盖尔-高斯模式(Laguerre-Gauss,LG)组合叠加形成,具有自成像的现象,其函数横截面为双螺旋形,随系统轴向位置发生旋转而不散焦,通过所形成双螺旋点的旋转角度就可以精确记录三维位置[19-20].
原始的双螺旋点扩展函数是由LG模式的复振幅叠加形成,由此所产生的双螺旋形式也是复振幅形式,因此会造成大量的光能吸收使光能利用率非常低,以及产生双螺旋点的杂散光影响较大等问题,使之无法用于活细胞的三维成像当中.在前期工作中利用优化迭代算法对双螺旋点扩展函数进行改造,以此获得具有高效的双螺旋点扩展函数模型(double helix point spread function,DH-PSF)[21].
基于前期相位片的制备,利用DH-PSF搭建了具有三维超分辨能力的成像系统,如图1(a).相位片设计参数基于100倍物镜而定,物镜的数值孔径(numerical aperture,NA)为1.4.选择产生荧光中心波长λ=550nm,孔径通光直径D=5mm,像素化后像素数336×336,像素大小为16μm,DH-PSF螺旋点旋转180°后对应的轴向距离范围为4μm.由此实现成像系统的搭建,利用Olympus81倒置荧光显微镜为基础,选择浸油物镜(NA=1.4,100×),激发光波长为488nm,激光光束经过扩束准直光路后由物镜激发样品产生荧光,由物镜收集后经过管镜(fTL2=180mm),通过一组4F系统(透镜1和透镜2),相位片放于傅里叶面位置,最终信号经过4F系统成像到探测器上.

图1 基于DH-PSF三维成像原理Fig.1 Principle of three-dimensional imaging based on DH-PSF
为更好利用双螺旋点扩展函数实现三维定位,需要对该方式进行标定,以确定系统所能达到的成像深度以及所在位置的定位精度信息.标定选择100nm荧光微球(Thermo-Fisher公司,型号T8864,其激发波长与发射波长为EX/EM=488nm/560nm)作为显微成像目标,激光出射功率约10mW;电子倍增式电荷耦合装置(electron multiplying charge coupled device, EMCCD)探测器像元大小为8μm×8μm,制冷温度为-70℃,单幅曝光时间为30ms,所获得图像总光子数约为5000,结合纳米位移台样品步进,每一个步进位置采集100幅数,步进量设定为100nm,得到在不同z向位置处的双螺旋点图像,如图1(b)所示,所形成的光斑近似为双高斯形态对称分布,由此利用双高斯函数进行拟合,
其中,A1和A2为两个旁瓣的幅值; (μx1,μy1)和(μx2,μy2)分别为两个旁瓣的横向位置信息;σ1和σ2为2个旁瓣的标准差.通过数据拟合得到在各z轴位置处所对应的横向位置信息,并由此可以获得相应的旋转角度,其中,2个旁瓣所对应位置的连线中心定义为实际横向位置,而旁瓣连线与水平方向的夹角则与z轴步进一一对应,因此利用上述系统可以得到在整个轴向位置所对应的角度信息,如图2(a)所示.而每一个轴向位置处所对应的(x,y,z)方向的定位精度是通过重复采集该位置处的位置信息统计所得,其结果如图2(b)所示.

图2 DH-PSF系统标定结果Fig.2 Calibration results of DH-PSF system
2 基于DH-PSF的动态追踪成像
巨噬细胞作为免疫细胞具有对多种刺激快速反应的能力,利用该反应可以快速获取巨噬细胞的胞内反应过程,巨噬细胞的内吞表现为:按照吞噬物进入溶酶体的途径,由巨噬细胞识别异物后,伸出伪足包裹,细胞表面膜产生内陷,摄入到细胞内形成吞噬体,吞噬体由微管向细胞核转移中与溶酶体融合形成吞噬溶酶体,而异物在吞噬溶酶体中会通过氧依赖机制或者氧非依赖机制被消化或者杀灭,最终不能消化的病原或异物则会被排出胞外[18].实验以巨噬细胞(型号为Raw)为对象,同时采用40nm荧光微球(ThermoFisher公司,型号为T8864,EX/EM=488nm/560nm)作为标记物.巨噬细胞对于外来的异物选择相对盲目,因此当异物到达细胞附近,巨噬细胞就会形成内吞现象.
具体处理过程如下:
1)细胞培养:巨噬细胞种于培养皿上,注入含有体积分数为10%的胎牛血清(fetal calf serum, FBS)酚红(dulbecco’s modified eagle medium, DMEM)培养液使其生长,在37℃培养箱中培养24~48h,CO2体积分数5%,细胞状态以细胞密度及细胞贴壁状态为准.
2)标记物制备:荧光微球用质量分数为1%的磷酸缓冲盐溶液(phosphate buffer saline, PBS)稀释100倍,超声震荡避免荧光珠团聚.
3) 细胞清洗及处理:37℃ PBS清洗2遍后加入2mL的37℃活细胞成像缓冲液.
4)细胞成像:显微镜样品台加装恒温系统,培养皿加入稀释标记物液后立即观察成像.
按照上述步骤对细胞处理并进行活细胞实验,观察结果显示巨噬细胞具有不同的动态情况.图3(a)为白光照明下的细胞形态,图3(b)为暗场情况下荧光图像序列,黄色线条是为了识别细胞轮廓勾勒出的,视场显示两个细胞A和B,荧光微球在培养液中做布朗运动,当吸附到细胞膜上之后会产生相应的吞噬反应,由荧光图像可以观察到荧光微球在细胞膜以及细胞内部的不同运动形式,图像中细胞A和B分别可见荧光微球量较少.分别捕捉到荧光微球在细胞的变化,其中,荧光微球1(A(1))和3(B(3))分别沿膜表面产生疑似跨膜运动,成像记录到在膜位置处的微动;荧光微球2(A(2))和4(B(4))则在细胞内部有大范围移动,其他的微球则在细胞内多呈微动状态,图像记录到微球在细胞内运动的全部过程.
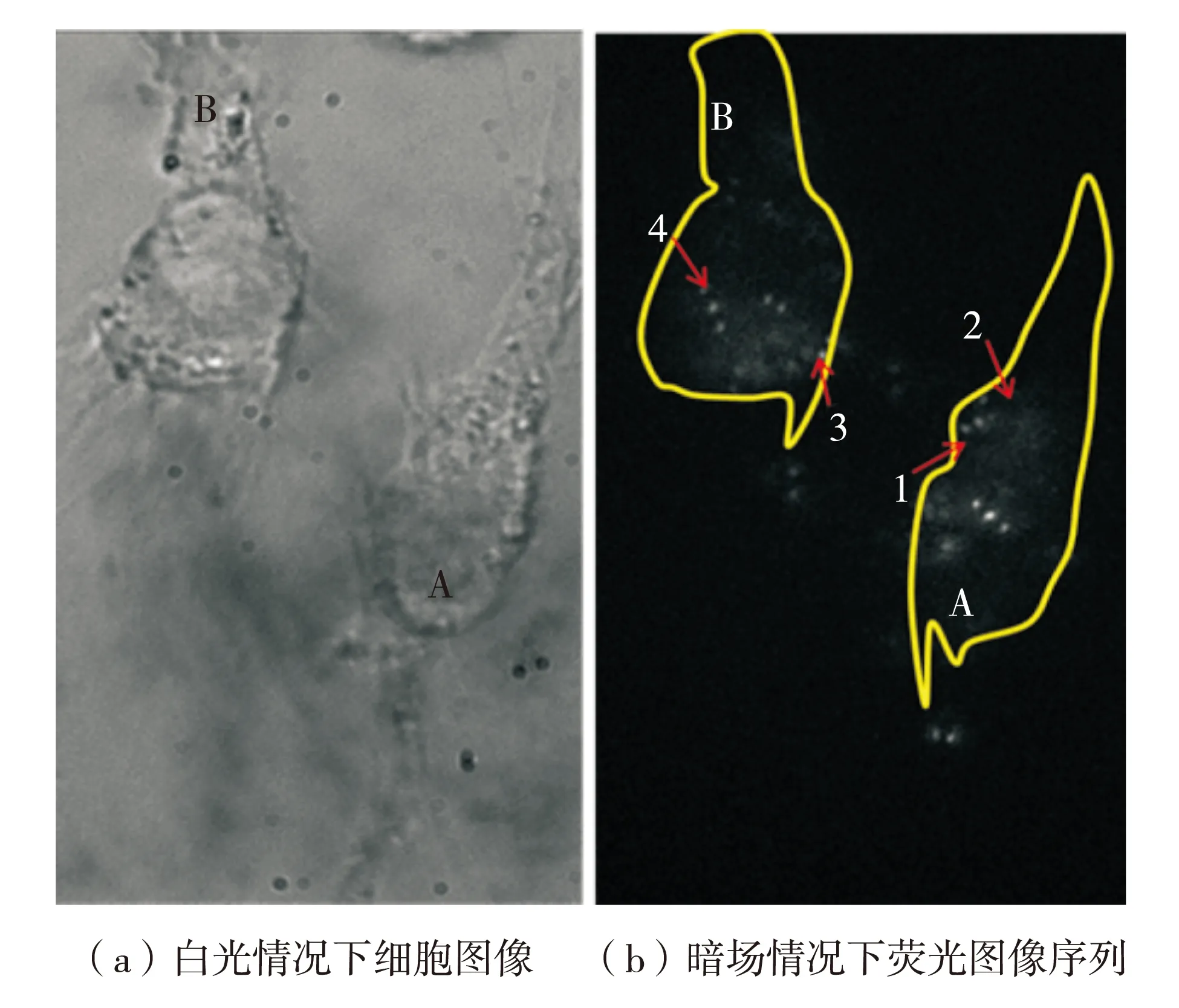
图3 Raw细胞图像Fig.3 Raw cell image
分析图像序列,将所得到的双螺旋点进行拟合定位,利用模式匹配的方法实现图像重构,以此获取荧光微球在三维位置的精确定位,如图4,色条表示按照时间序列荧光微球的运动轨迹.

图4 三维重构图像结果Fig.4 3D image reconstruction results
荧光微球在整个三维空间的定位信息被获取,因此,所在位置处的移动量以及相应时刻的移动速率亦可计算获得,如图5.相应的表示细胞A和B上分别标记的4个荧光微球在对应时刻的移动量(I)和运动速率(II).计算分析结果,荧光微球在细胞内能达到7μm移动量,在细胞内的运动速率最大为3μm/s,同时在细胞内的动态时间维持在30~60s.

图5 荧光微球移动量(I)和运动速率(II)统计Fig.5 Statistics of the motion (I) and rate (II) of fluorescent microspheres
(续图5)

图5 荧光微球移动量(I)和运动速率(II)统计Fig.5 Statistics of the motion (I) and rate (II) of fluorescent microspheres
结 语
完整活细胞实现多粒子定位追踪对于超分辨成像在活体细胞的应用是非常大的挑战,通过DH-PSF方法将点扩展函数改造成双螺旋的形式,在4μm轴向范围内产生连续旋转,且不会散焦的光斑,利用双高斯拟合方法实现所形成光斑的三维信息位置获取,通过计算分析能够得到约20nm左右的定位精度,且可用于三维方向的多粒子追踪,为细胞内大分子运动规律的研究提供有利工具.本研究通过上述方法对巨噬细胞进行成像,通过该系统成功得到在活细胞状态下,同时记录多个荧光微球在巨噬细胞内的各种不同运动轨迹和实时数据结果,下一步工作中还将结合单分子定位方法同时获得细胞的骨架结构,以此将实现细胞的全功能信息提取.
致谢:衷心感谢屈军乐教授的悉心指导!
/
:
[1] Xie X S, Yu J, Yang W Y. Living cells as test tubes[J]. Science,2006,312(5771):228-230.
[2] 牛憨笨,陈丹妮,尹 君.细胞内分子检测及成像技术研究[J].深圳大学学报理工版,2011,28(1):1-16. Niu Hanben,Chen Danni, Yin Jun.Advances in approaches of molecules detecting and imaging in cells[J].Journal of Shenzhen University Science and Engineering,2011,28(1):1-16.(in Chinese)
[3] 许改霞,杨坚泰,Roy Indrajit,等.纳米颗粒在穿透血脑屏障研究中的应用[J].深圳大学学报理工版,2009,26(1):1-8. Xu Gaixia,Yang Kentye,Roy Indrajit,et al.The application of nanoparticle in BBB transmigration[J].Journal of Shenzhen University Science and Engineering,2009,26(1):1-8.(in Chinese)
[4] Ober R J, Ram S, Ward E S. Localization accuracy in single-molecule microscopy[J]. Biophysical Journal,2004,86(2):1185-1200.
[5] Hess S T, Girirajan T P K, Mason M D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy[J]. Biophysical Journal,2006,91(11):4258-4272.
[6] Rust M J, Bates M, Zhuang X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM)[J]. Nature Methods,2006,3(10):793-796.
[7] 邵永红,李 恒,王 岩,等.基于同步扫描相机的荧光寿命测量系统研究[J].深圳大学学报理工版,2009,26(4):331-336. Shao Yonghong, Li Heng,Wang Yan,et al.A fluorescence lifetime spectrometer based on a synchroscan streak camera[J].Journal of Shenzhen University Science and Engineering,2009,26(4):331-336.(in Chinese)
[8] Vo-Dinh T, Masters B R. Biomedical photonics handbook[J]. Journal of Biomedical Optics,2004,9(5):1110-1111.
[9] Mizushima N, Levine B. Autophagy in mammalian development and differentiation[J]. Nature Cell Biology,2010,12(9):823-830.
[10] 陈丹妮,于 斌,刘 夏,等.基于数字微镜装置的结构光照明层析成像[J].深圳大学学报理工版,2008,25(4):376-380. Chen Danni,Yu Bin,Liu Xia,et al.Sectioned imaging of DMD-based structured illumination fluorescence microscopy[J].Journal of Shenzhen University Science and Engineering,2008,25(4):376-380.(in Chinese)
[11] Huang B, Wang W, Bates M, et al. Three-dimensional super-resolution imaging by stochastic optical reconstruction microscopy[J]. Science,2008,319(5864):810-813.
[12] Juette M F, Gould T J, Lessard M D, et al. Three-dimensional sub-100nm resolution fluorescence microscopy of thick samples[J]. Nature Methods,2008,5(6):527-529.
[13] Pavani S R P, Piestun R, Thompson M A, et al. Three-dimensional super-resolution imaging with a double-helix microscope[C]// Proceedings Advances in Imaging. Vancouver,Canada: OSA Publishing,2009.
[14] Herbert S, Soares H, Zimmer C, et al. Single-molecule localization super-Resolution microscopy: deeper and faster[J]. Microscopy and Microanalysis,2012,18(6):1419-1429.
[15] Ram S, Kim D, Ober R J, et al.3D single molecule tracking with multifocal plane microscopy reveals rapid intercellular transferrin transport at epithelial cell barriers[J]. Biophysical Journal,2012,103(7):1594-1603.
[16] Abrahamsson S, Chen J, Hajj B, et al. Fast multicolor3D imaging using aberration-corrected multifocus microscopy[J]. Nature Methods,2013,10(1):60-63.
[17] Chen Danni, Yu Bin, Li Heng, et al. Approach to multiparticle parallel tracking in thick samples with three-dimensional nanoresolution[J]. Optics Letters,2013,38(19):3712-3715.
[18] 王 炯, 黄维琳, 汪 诚, 等. 巨噬细胞吞噬凋亡中性粒细胞及吞噬诱导巨噬细胞死亡的实时动态观察[J]. 中国科学: 生命科学,2014,44(6):571-577. Wang Jiong, Huang Weilin, Wang Cheng, et al. Dynamic process of phagocytosis and fates of macrophages after their ingestion of apoptotic neutrophils[J]. Scientia Sinica Vitae,2014,44(6):571-577.(in Chinese)
[19] Schechner Y Y, Piestun R, Shamir J. Wave propagation with rotating intensity distributions[J]. Physical Review E,1996,54(1):50-53.
[20] Piestun R, Schechner Y Y, Shamir J. Propagation-invariant wave fields with finite energy[J]. JOSA A,2000,17(2):294-303.
[21] 李 恒, 于 斌, 陈丹妮, 等. 高效双螺旋点扩展函数相位片的设计与实验研究[J]. 物理学报,2013,62(12):124201. Li Heng, Yu Bin, Chen Danni,et al. Design and experimental demonstration of high-efficiency double-helix point spread function phase plate[J].Acta Physica Sinica,2013,62(12):124201.(in Chinese)
【中文责编:方圆;英文责编:木南】
ApplicationofDH-PSFthree-dimensionaldynamicmulti-particletrackingmethodinlivingcellimaging

1)CollegeofOptoelectronicEngineering,KeyLaboratoryofOptoelectronicDevicesandSystemsofMinistryofEducationandGuangdongProvince,ShenzhenUniversity,Shenzhen518060,GuangdongProvince,P.R.China2)CollegeofInformationEngineering,ShenzhenUniversity,Shenzhen518060,GuangdongProvince,P.R.China
Multi-particle tracking is one of the most challenging aspects of living cell imaging. We establish a three-dimensional multi-particle tracking imaging system based on three-dimensional positioning of double helix point spread function.The imaging depth and localization precision can achieve4μm and20nm, respectively. The result of dynamic tracking of fluorescence microspheres in Raw cells shows that the detectable trajectory range of intracellular moleculesis could be up to7μm and the velocity of probes could be obtained in real time. Therefore, this system is a very useful tool for studying the intermolecular interaction in living cell.
optical engineering; three-dimensional imaging; multi-particle; point spread function; nano-posi-tioning; living cell; dynamic tracking
2017-04-07;Accepted:2017-05-27
Associate professor Chen Danni.E-mail: dannyc007@163.com
Q 63;O 437
:Adoi:10.3724/SP.J.1249.2017.05526
Foundation:National Natural Science Foundation of China ( 61605127); Natural Science Foundation of Guangdong Province (2014A030312008); Shenzhen Science and Technology Research Foundation (JCYJ20150324141711698, JCYJ20160308104404452)
:Li Heng, Chen Danni, Yu Bin, et al.Application of DH-PSF three-dimensional dynamic multi-particles tracking method in living cell imaging[J]. Journal of Shenzhen University Science and Engineering, 2017, 34(5): 526-531.(in Chinese)
国家自然科学基金资助项目(61605127);广东省自然科学基金资助项目(2014A030312008);深圳市科技计划资助项目(JCYJ20150324141711698, JCYJ20160308104404452)
李 恒(1985—),男,深圳大学博士后研究人员.研究方向:超分辨成像.E-mail:liheng@email.szu.edu.cn
引文:李 恒,陈丹妮,于 斌,等.DH-PSF三维动态多分子追踪在活细胞成像的应用[J]. 深圳大学学报理工版,2017,34(5):526-531.

