硫酸软骨素脱蛋白工艺优化
许素文
谭 岸2
金晨钟1,3
胡一鸿1,3
(1. 湖南人文科技学院农药无害化应用重点实验室,湖南 娄底 417000;2. 湖南伍星生物科技有限公司,湖南 双峰 417700;3. 湖南省农田杂草防控技术与应用协同创新中心,湖南 娄底 417000)
硫酸软骨素脱蛋白工艺优化
许素文1
谭 岸2
金晨钟1,3
胡一鸿1,3
(1. 湖南人文科技学院农药无害化应用重点实验室,湖南 娄底 417000;2. 湖南伍星生物科技有限公司,湖南 双峰 417700;3. 湖南省农田杂草防控技术与应用协同创新中心,湖南 娄底 417000)
为了提高硫酸软骨素的品质,采用Sevag试剂对硫酸软骨素提取液进行脱蛋白处理,通过单因素试验和正交试验对脱蛋白工艺进行优化,得到最佳条件为:氯仿与异戊醇体积比2∶1,Sevag试剂用量为硫酸软骨素提取液体积的1/2,处理时间25 min,处理次数3。各因素对脱蛋白效果影响大小依次为氯仿异戊醇比例>处理时间>处理次数> Sevag试剂用量。在该最佳条件下,硫酸软骨素保留率为87.98%,脱蛋白率52.15%。经190~350 nm紫外扫描,未见280 nm处蛋白质特征吸收峰;经红外光谱分析,硫酸软骨的构型未发生变化,说明该方法稳定可靠,适合于工业化硫酸软骨素的脱蛋白。
Sevag试剂;硫酸软骨素;脱蛋白;红外光谱
硫酸软骨素广泛存在于动物组织中,是组成软骨、肌腱、血管壁等器官所必需的黏性蛋白多糖[1]。硫酸软骨素由重复单位的葡萄糖醛酸和乙酰半乳糖胺二聚体与蛋白质核心相连形成糖蛋白[2],具有增加骨密度[3]、促进神经细胞分裂与发育[4]、消炎[5]与免疫[6]等功能,已广泛应用于医药和保健食品等领域。硫酸软骨素可作为食品添加剂成分,也可在临床上应用于关节炎的治疗[7-8]。
硫酸软骨素按葡萄糖醛酸和乙酰半乳糖胺的羟基硫酸化程度分为A、C、D、E等不同构型。其中,A型与C型硫酸软骨素由于硫酸化程度低、活性高而受到广泛欢迎。硫酸软骨素的多聚糖与蛋白质共价连接,工业上制备高纯度硫酸软骨素的关键技术是在保持其天然构型的基础上尽量去除蛋白质。多糖类物质中蛋白质去除常采用Sevag法和三氯乙酸(trichloroacetic acid,TCA)法等[9-10]。其中,TCA法沉淀蛋白质效果好,但该试剂会造成多糖降解且溶于水,在最终产品中的残留难以去除[11];常规的Sevag法去除效率较低[12-13],但其去除效率仍可达85%[14],且该方法条件温和,是脱蛋白的经典方法[15]。目前,在生产上大都采用稀碱、蛋白酶、等电点沉淀等方法对原料进行处理,去除蛋白效果不佳,最终产品的纯度通常在93%以下。中国是硫酸软骨的生产和出口大国,占全球产量的80%[5],但国内纯化工艺水平较低,目前也未见Sevag法去除硫酸软骨素中蛋白质的相关报道。因此,本试验拟以硫酸软骨素提取液为原料,采用在常温下水溶性低的Sevag试剂(氯仿和异戊醇)进行脱蛋白处理,考察硫酸软骨素保留率与脱蛋白率,以期为硫酸软骨素的生产工艺改进提供依据。
1 材料与方法
1.1 主要材料
1.1.1 试验原料
硫酸软骨素提取液:硫酸软骨素含量为0.068 mg/mL,湖南伍星生物科技有限公司。
1.1.2 试剂与仪器
硫酸软骨素A标准品:生物试剂(BR级),美国Sigma公司;
间苯三酚:分析纯,美国Sigma公司;
KBr:光谱纯,天津金贝尔科技有限公司;
其他试剂均为国产分析纯;
紫外扫描分光光度计:UVmini-1240型,日本岛津公司;
FT-IR光谱仪:Nicolet iS50型,美国热电公司;
冷冻离心机:L530型,湖南湘仪实验仪器有限公司;
电子分析天平:AUY120型,日本岛津公司;
空气恒温振荡器:HZQ-C型,北京东联仪器公司。
1.2 试验方法
1.2.1 硫酸软骨素制备流程
牛软骨→弱碱煮沸→冷却→粗过滤→蛋白酶水解→离心→超滤→等电点沉淀→双氧水氧化→阴离子交换树脂纯化→硫酸软骨素提取液
1.2.2 蛋白质含量与硫酸软骨素含量测定
(1) 蛋白质含量测定:采用微量考马斯亮蓝法[16]。取1.6 mL待测样品溶液,加入0.4 mL考马斯亮兰G250溶液,摇匀后静置2 min,测定A595。以20~100 μg的牛血清蛋白为样品采用相同方法绘制标准曲线。
(2) 硫酸软骨素含量测定:参照高华等[17]的方法,在具塞试管中加入0.4 mL待测样品溶液,加入3 mL间苯三酚溶液,沸水浴30 min,测定A558。间苯三酚溶液配方:取30 mL冰醋酸、40 mL盐酸与10 mL 50 mg/mL的间苯三酚乙醇溶液混合。以0~16 μg硫酸软骨素标准品为样品采用相同方法绘制标准曲线。
1.2.3 硫酸软骨素脱蛋白 参照张雅利等[12]的方法,采用一定比例的氯仿异戊醇混合溶液作为Sevag脱蛋白试剂。
脱蛋白率与硫酸软骨素保留率按式(1)和(2)计算:
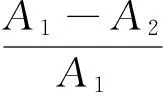
(1)

(2)
式中:
d——脱蛋白率,%;
A1——脱蛋白前溶液中蛋白质含量,μg/mL;
A2——脱蛋白后溶液中蛋白质含量,μg/mL;
r——硫酸软骨素保留率,%;
B1——脱蛋白前溶液中硫酸软骨素含量,μg/mL;
B2——脱蛋白后溶液中硫酸软骨素含量,μg/mL。
1.2.4 紫外扫描检测硫酸软骨素 参照Chen等[18]的方法,取硫酸软骨素溶液1 mL,加入蒸馏水2 mL,混匀后于波长190~350 nm范围扫描,检测280 nm处是否有蛋白质吸收峰。
1.2.5 红外光谱(FTIR)检测硫酸软骨素 醇沉硫酸软骨素提取液,制备无水硫酸软骨素成品[19-20]:取200 mL硫酸软骨素提取液,加入无水酒精使酒精体积分数达到75%,搅拌2 min,静置15 min后,再搅拌2 min,然后静置2 h,去掉酒精,保留含絮状沉淀的溶液。往沉淀中加入无水酒精,使酒精体积分数达到90%,搅拌2 min,静置15 min后,搅拌2 min,静置2 h。静置期间每隔0.5 h测定酒精体积分数,当其值低于90%时,加入无水酒精至酒精体积分数达到90%。然后5 000 r/min离心10 min,沉淀物于88 ℃干燥3.5 h,密封包装备用。
硫酸软骨素的红外光谱检测:参照Wang等[21]的方法,将无水硫酸软骨素与KBr按质量比1∶100均匀混合,研磨成粉末,粉末置于20 MPa压力压片,透射法检测,发射波长400~4 000 cm-1,分辨率4 cm-1,扫描数32。
1.2.6 单因素试验
(1) 氯仿与异戊醇体积比:在5个锥形瓶中各加入15 mL的硫酸软骨素提取液,固定Sevag试剂用量1/3倍硫酸软骨素提取液体积、处理时间20 min、处理次数1,分别在氯仿与异戊醇体积比为2∶1,3∶1,4∶1,5∶1,6∶1的条件下,测定上相溶液的蛋白质和硫酸软骨素含量,计算脱蛋白率和硫酸软骨素保留率。
(2) Sevag试剂用量:在5个锥形瓶中各加入15 mL硫酸软骨素提取液,固定氯仿与异戊醇体积比3∶1、处理时间20 min、处理次数1,分别在Sevag试剂用量1,1/3,1/4,1/5,1/6倍硫酸软骨素提取液体积条件下,测定上相溶液的蛋白质和硫酸软骨素含量,计算脱蛋白率和硫酸软骨素保留率。
(3) 处理时间:在5个锥形瓶中各加入15 mL硫酸软骨素提取液,固定氯仿与异戊醇体积比3∶1、Sevag试剂用量1/3倍硫酸软骨素提取液体积、处理次数1,分别在处理时间15,20,25,30,35 min条件下,测定上相溶液的蛋白质和硫酸软骨素含量,计算脱蛋白率和硫酸软骨素保留率。
(4) 处理次数:在锥形瓶中加入15 mL硫酸软骨素提取液,固定氯仿与异戊醇体积比3∶1、Sevag试剂用量1/3倍硫酸软骨素提取液体积、处理时间20 min,以上试验分别做1,2,3,4,5次,测定上相溶液的蛋白质和硫酸软骨素含量,计算脱蛋白率和硫酸软骨素保留率。
1.2.7 正交试验 通过单因素试验,选取Sevag试剂中氯仿与异戊醇体积比、Sevag试剂用量、处理时间、处理次数为考察因素,以硫酸软骨素脱蛋白率和硫酸软骨素损失率为考察指标,设计4因素3水平正交试验,采用综合加权法评分优选工艺条件,设脱蛋白率和硫酸软骨素保留率2项指标各占0.5权重,然后以最佳条件进行验证。
1.3 数据处理
数据采用mean ± SD (n=3)表示,采用SPSS 19.0的单向方差分析进行差异比较(P<0.05)(LSD法),以小写字母标注显著性差异。
2 结果与分析
2.1 蛋白质及硫酸软骨素含量标准曲线方程
2.1.1 蛋白质标准曲线 以牛血清蛋白浓度x(μg/mL)为横坐标,吸光度为纵坐标,绘制蛋白质标准曲线见图1,得到蛋白质含量测定的回归方程为:y=0.004 2x-0.001 3,相关系数R2=0.996 2。
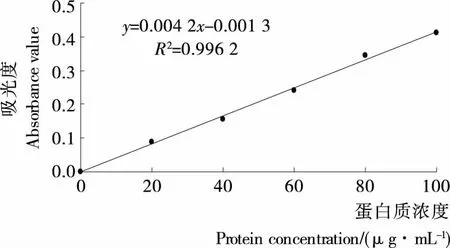
图1 蛋白质标准曲线
2.1.2 硫酸软骨素标准曲线 以硫酸软骨素浓度x(μg/mL)为横坐标,吸光度为纵坐标,绘制硫酸软骨素标准曲线见图2,得到硫酸软骨素含量测定的回归方程为:y=0.036 7x+0.006 3,相关系数R2=0.996 9。

图2 硫酸软骨素标准曲线
2.2 单因素试验结果分析
2.2.1 氯仿与异戊醇体积比对硫酸软骨素脱蛋白的影响
由图3可知,氯仿与异戊醇体积比为3∶1时,硫酸软骨素保留率最高,为80.65%,而此时脱蛋白率仍达到40.46%,但随着氯仿比例的上升,脱蛋白的效果急剧变差,氯仿与异戊醇体积比为4∶1时,脱蛋白率仅为24.44%。可能是分离时振荡频率较高,异戊醇用量少会产生泡沫影响了蛋白质变性效果。氯仿与异戊醇体积比为5∶1和6∶1时,脱蛋白率却略有上升,但与4∶1时相比均无显著差异。因此采用氯仿与异戊醇体积比为3∶1。
2.2.2 Sevag试剂用量对硫酸软骨素脱蛋白的影响 由图4可知,Sevag试剂用量逐渐减少,硫酸软骨素保留率逐渐上升,但脱蛋白的效果变差。Sevag试剂用量较大时,脱蛋白效果较好,但可能会使共价连接的蛋白质变性,造成硫酸软骨素保留率下降。因此采用的Sevag试剂用量为硫酸软骨素提取液体积的1/3。
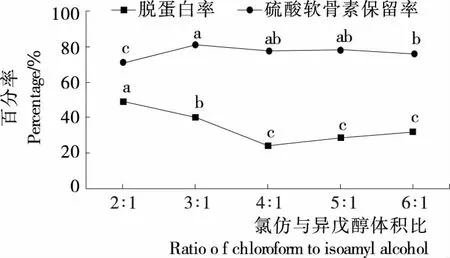
不同字母表示差异显著(P<0.05)
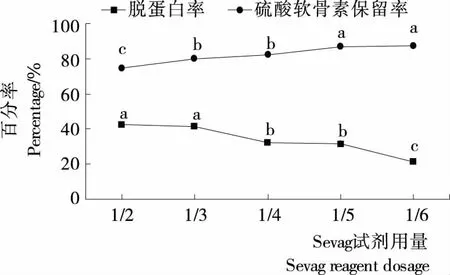
不同字母表示差异显著(P<0.05)
2.2.3 处理时间对硫酸软骨素脱蛋白的影响 由图5可知,处理时间越长,脱蛋白越彻底,但硫酸软骨素的保留率越低,可能是处理时间延长时蛋白质变性形成的胶絮状物与蛋白多聚糖共沉淀,硫酸软骨素保留率下降[12]。当处理时间大于25 min时,随着处理时间的延长,硫酸软骨素保留率显著下降,而其脱蛋白率差异不显著。因此处理时间采用25 min。
2.2.4 处理次数对硫酸软骨素脱蛋白的影响 由图6可知,随脱蛋白次数的增加,硫酸软骨素保留率呈下降趋势,脱蛋白率呈上升趋势。脱蛋白次数超过3次时,硫酸软骨素保留率开始急剧下降。脱蛋白次数达到5次时,脱蛋白率达到63.26%,但硫酸软骨素保留率仅为24.86%。每次去除蛋白时,不可避免地造成了糖蛋白的损失;硫酸软骨素保留率急剧下降的原因可能是经过多次脱除蛋白的操作,游离蛋白质沉淀后,多聚糖蛋白与氯仿的分子接触机率增大蛋白变性加剧[22]。因此处理次数采用2次。

不同字母表示差异显著(P<0.05)
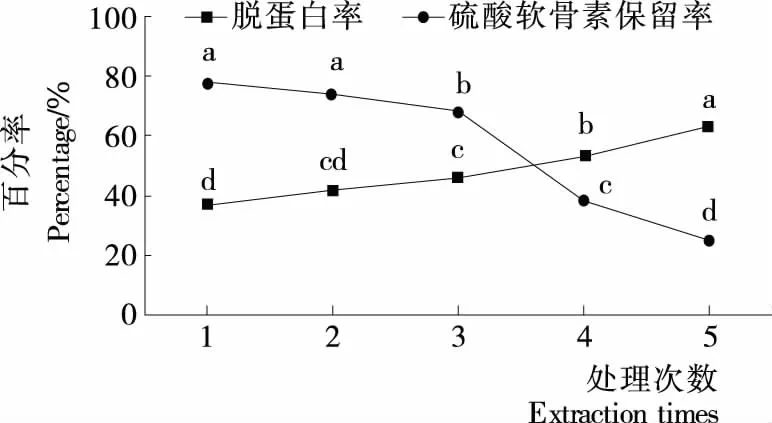
不同字母表示差异显著(P<0.05)
2.3 正交试验结果
根据单因素的试验结果设计的正交试验因素水平见表1,正交试验结果见表2。
通过表2直观分析显示,Sevag法脱蛋白的最佳条件为A1B1C2D3,影响脱蛋白效果的因素大小为氯仿与异戊醇体积比>处理时间>处理次数>Sevag试剂用量。
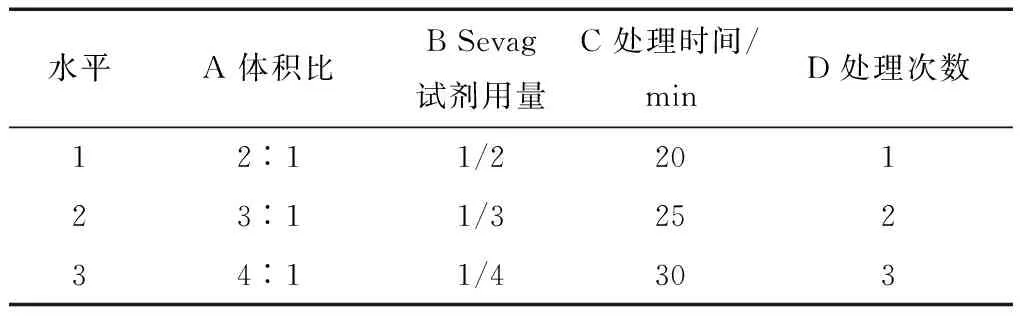
表1 正交试验因素水平设计
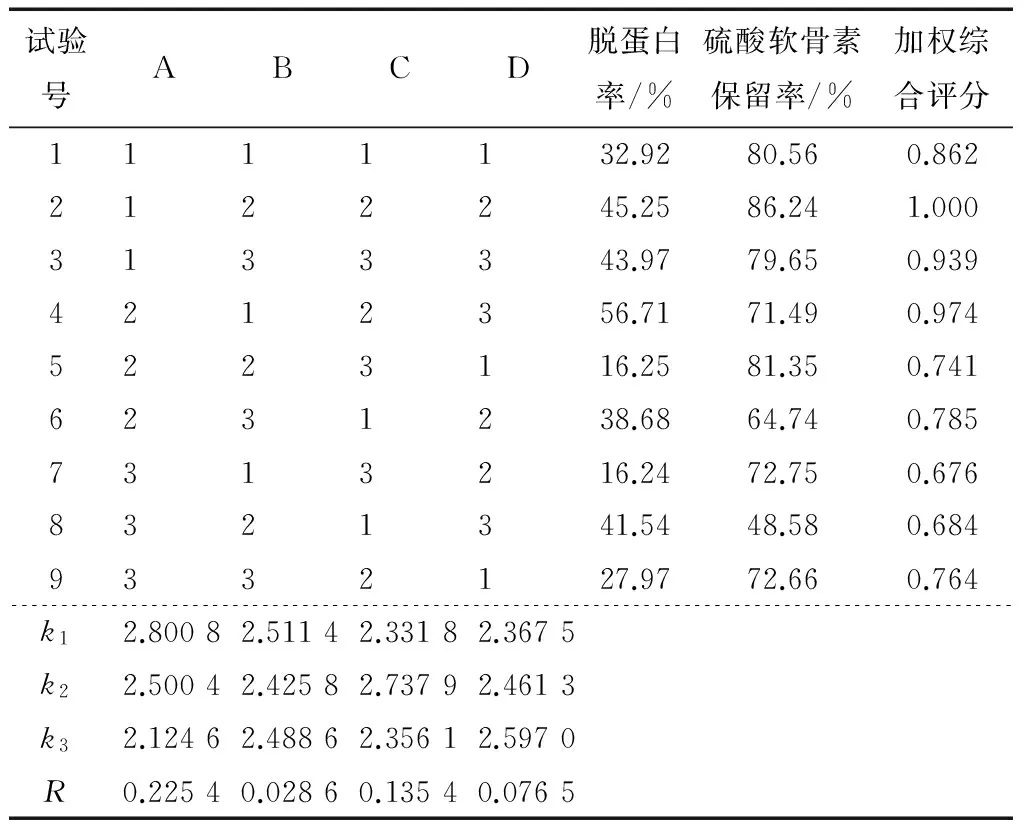
表2 正交试验结果†
† 加权综合评分以脱蛋白率与硫酸软骨素保留率之和最大值的试验行作为参照计算。
以极差值最小的B因素为误差项[23],对表2结果进行方差分析和F检验,发现氯仿与异戊醇体积比、处理时间各水平存在显著性差异,Sevag试剂用量、处理次数的影响不显著(见表3)。
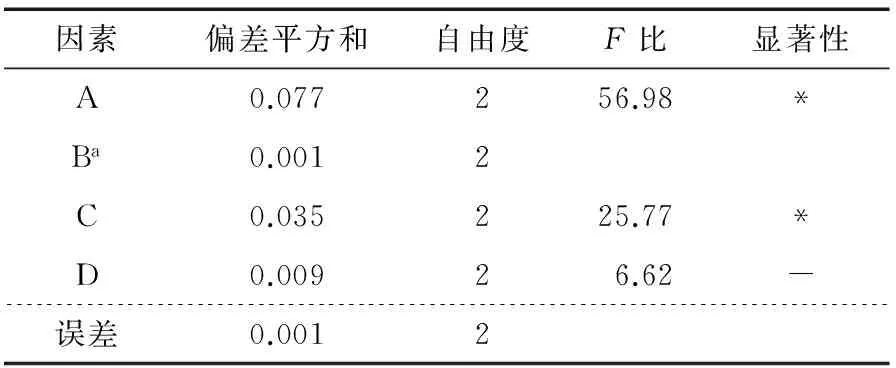
表3 正交试验方差分析†
† a表示误差列;*表示差异显著;-表示差异不显著(a=0.05)。
在优化的工艺条件下,进行3次验证实验,脱蛋白率为(52.15±1.18)%,硫酸软骨素保留率为(87.98±1.36)%,加权综合评分达1.066。
2.4 紫外扫描与FTIR检测验证
将脱蛋白后的硫酸软骨素用蒸馏水稀释2倍,在波长190~350 nm扫描,发现280 nm处无蛋白特征吸收峰(图7),说明该条件下脱蛋白效果良好。
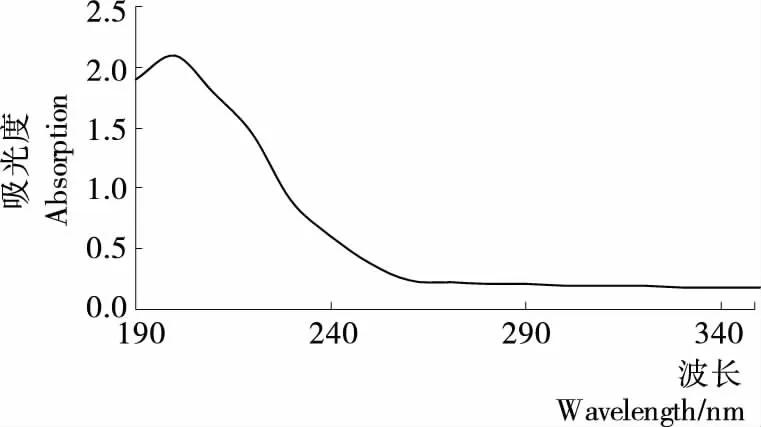
图7 脱蛋白后硫酸软骨素溶液紫外光谱
将无水硫酸软骨素成品进行KBr压片,FTIR透射法检测吸收光谱。FTIR光谱检测显示,3 500~3 200 cm-1的宽峰为O—H伸缩振动,3 000~2 800 cm-1的峰为糖的C—H伸缩振动[24];1 300~900 cm-1的峰为SO3的特征光谱,其中,稍弱的峰为SO3的反相伸缩振动,稍强的峰为SO3的同相伸缩振动;930,851,724 cm-1为硫酸软骨素的特征峰[25-26],见图8。由图8可知,脱蛋白前与脱蛋白后的硫酸软骨素SO3的特征光谱图一致,而且硫酸软骨素的特征峰强度增大,说明经Sevag试剂脱蛋白后,硫酸软骨素的构型没有发生变化,硫酸软骨素纯度增大。
3 结论
本试验以单因素试验为基础,结合正交试验及方差分析,得到了Sevag试剂对硫酸软骨素提取液脱蛋白处理的最佳工艺条件。在该试验条件下,脱蛋白率达到52.15%,硫酸软骨素保留率达到87.98%,硫酸软骨素的构型没有变化,品质有所提高,说明Sevag法不仅适用于去除蛋白多糖中的杂蛋白[22],而且适用于去除糖胺聚糖硫酸软骨素中的杂蛋白。本试验得出的最佳工艺参数在高纯度硫酸软骨素的开发中具有重要的参考价值。
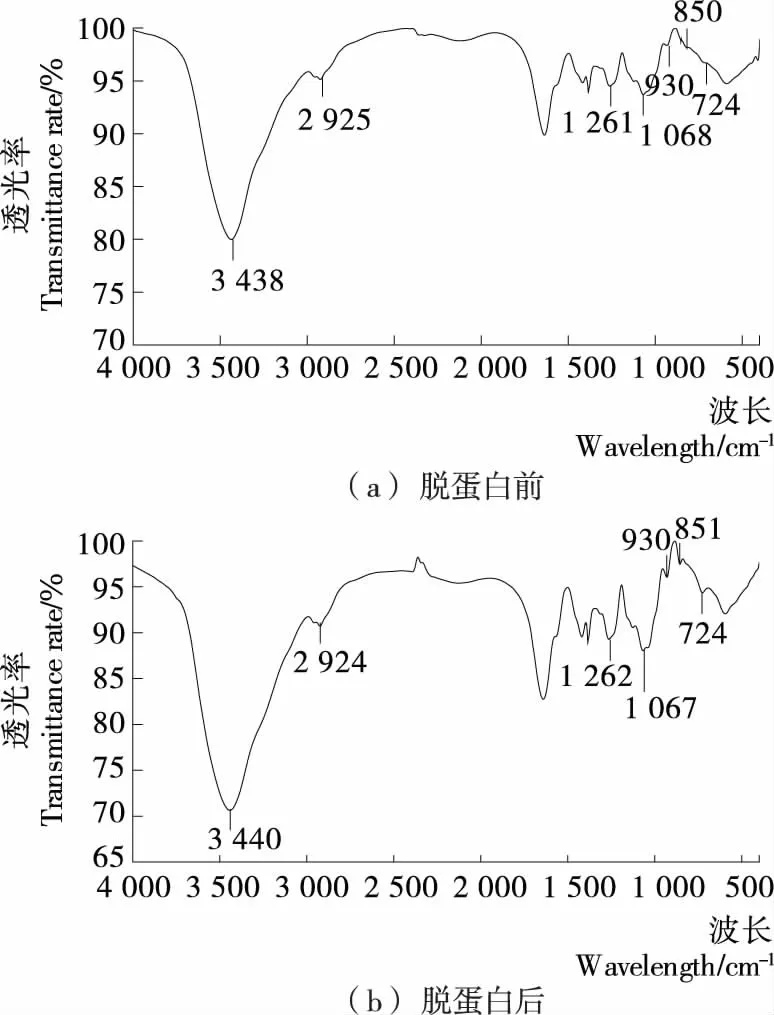
图8 硫酸软骨素的FTIR检测光谱
[1] HE Gui-dan, YIN Yong-guang, YAN Xia-xia, et al. Optimisation extraction of chondroitin sulfate from fish bone by high intensity pulsed electric fields[J]. Food Chemistry, 2014, 164(3): 205-210.
[2] NAKANO T, PIETRASIK Z, OZIMEK L, et al. Extraction, isolation and analysis of chondroitin sulfate from broiler chicken biomass[J]. Process Biochemistry, 2012, 47(12): 1 909-1 918.
[3] 张露勇, 刘婷, 刘师卜. 两种增加骨密度功能保健食品的功效研究[J]. 海军医学杂志, 2016, 37(6): 526-531.
[4] LAUDER R M. Chondroitin sulphate: A complex molecule with potential impacts on a wide range of biological systems [J]. Complementary Therapies in Medicine, 2009, 17(1): 56-62.
[5] 刘宁, 刘雅南, 刘涛, 等. 硫酸软骨素的制备研究及发展现状[J]. 食品工业科技, 2014, 35(3): 392-395.
[6] 李燕妮. 超滤法分离提取鸡胸软骨中硫酸软骨素和Ⅱ型胶原蛋白[J]. 化学与生物工程, 2011, 28(2): 49-51.
[7] MACCARI F, GALEOTTI F, VOLPI N. Isolation and structural characterization of chondroitin sulfate from bony fishes[J]. Carbohydrate Polymers, 2015, 129: 143-147.
[8] ZHANG Wu-xia, SUN Fei-fei, NIU Hong, et al. Mechanistic insights into cellular immunity of chondroitin sulfate A and its zwitterionic N-deacetylated derivatives[J]. Carbohydrate Polymers, 2015, 123: 331-338.
[9] 胡振清, 郑峰, 钟美瑶, 等. 硫酸软骨素的制备及纯化进展[J]. 化学工程与装备, 2016(1): 167-170.
[10] SHI Yu-gang, MENG Yue-cheng, LI Jian-rong, et al. Chondroitin sulfate: extraction, purification, microbial and chemical synthesis[J]. Journal of Chemical Technology and Biotechnology, 2014, 89(10): 1 445-1 465.
[11] 严婧, 夏伯侯, 章莹, 等. 响应面法优选铁皮石斛总多糖脱蛋白工艺[J]. 中国实验方剂学杂志, 2016, 22(17): 19-22.
[12] 张雅利, 张文娟, 何琼华. 胰蛋白酶-Sevag法联用脱柿多糖蛋白[J]. 食品工业科技, 2005(5): 107-108.
[13] 罗莹, 林勤保, 赵国燕. 大枣多糖脱蛋白方法的研究[J]. 食品工业科技, 2007(8): 126-128.
[14] 殷洪梅, 尚强, 萧伟. 金银花多糖脱蛋白方法的研究[J]. 中草药, 2010, 41(4): 584-586.
[15] 王珊, 黄胜阳. 植物多糖提取液脱蛋白方法的研究进展[J]. 食品科技, 2012, 37(9): 188-191.
[16] 张龙翔, 张庭芳, 李令媛, 等. 生化实验方法和技术[M]. 2版. 北京: 高等教育出版社, 1997: 138-140.
[17] 高华, 刘坤, 于兹东, 等. 间苯三酚分光光度法测定硫酸软骨素的研究[J]. 中国生化药物杂志, 2000, 21(5): 247-248.
[18] CHEN Yong, YIN Luo-yi, ZHANG Xue-jiao, et al. Optimization of alkaline extraction and bioactivities of polysaccharides from rhizome ofPolygonatumodoratum[J]. BioMed Research International, 2014, 2 014: 504 896.
[19] 梁宝东, 魏海香, 王田田, 等. 响应面法优化鱼骨中硫酸软骨素的醇沉工艺[J]. 中国酿造, 2014, 33(10): 104-108.
[20] 李利晓, 夏延斌. 正交实验法优化牛鼻软骨中硫酸软骨素的醇沉工艺[J]. 食品工业科技, 2012, 33(16): 261-264.
[21] WANG Yan, ZOU Ting-ting, XIANG Ming-hui, et al. Purification and characterization of a soluble glycoprotein from garlic (Alliumsativum) and itsinvitrobioactivity[J]. Preparative Biochemistry and Biotechnology, 2016, 46(7): 709-716.
[22] SU Yu-ting, XU Yong-jian. Study on the extraction and purification of glycoprotein from the yellow seahorse,HippocampuskudaBleeker[J]. Food Science & Nutrition, 2015, 3(4): 302-312.
[23] 张喜峰, 程广, 何倩, 等. 双水相萃取分离葡萄籽中原花青素[J]. 食品与机械, 2017, 3(33): 168-173.
[24] 詹玲, 潘思轶. 大豆糖蛋白的分离纯化及结构分析[J]. 食品科学, 2006, 27(12): 594-596.
[25] LARKIN P. Infrared and Raman spectroscopy: Principles and Spectral Interpretation[M]. Massachusetts: Elsevier Inc., 2011: 129-130.
[26] VIDAL B C, MELLO M L S. FT-IR microspectroscopy of rat ear cartilage[J]. PLoS One, 2016, 11(3): e0151989.
Optimization of deproteinization technology on chondroitin sulfate with Sevag method
XUSu-wen1
TANAn2
JINChen-zhong1,3
HUYi-hong1,3
(1.KeyLaboratoryofPesticideHarmlessApplication,HunanUniversityofHumanities,ScienceandTechnology,Loudi,Hunan417000,China; 2.HunanWuxingBiotechnologyCo.,Ltd,Shuangfeng,Hunan417700,China)3.HunanProvincialCollaborativeInnovationCenterforFieldWeedsControl,HunanUniversityofHumanities,ScienceandTechnology,Loudi,Hunan417000,China;
In order to promote the quality of chondroitin sulfate, Sevag reagent was used to deprotein the extraction of chondroitin sulfate through the single factor and the orthogonal tests to optimize the process of deproteinization. The optimal conditions were ratio of chloroform to isoamyl alcohol 2∶1 (V/V), Sevag reagent dosage 1/2 fold compared with the volume of chondroitin sulfate extraction, treated for 25 min and repeated treatment for 3 times. The factors influenced the extraction in the order of ratio of chloroform to isoamyl alchohol,treatment time , treatment times, and Sevag reagent dosage. Under the optimal conditions, the retention rate of chondroitin sulfate was 87.98%, and the deproteinization rate was 52.15%. No specific absorption of 280 nm was observed with ultraviolet (UV) scanning from 190 to 350 nm, and the configuration of chondroitin sulfate was confirmed untransformed with Fourier-transform infrared spectroscopy (FTIR) analysis. The results suggested that this deproteinization method was stable, reliable and suitable for deproteinization of chondroitin sulfate in industry.
Sevag reagent; orthogonal test; chondroitin sulfate; deproteinization; Fourier-transform infrared spectroscopy (FTIR)
湖南省科技计划重点研发与技术创新项目(编号:2016NK3093)
许素文,女,湖南人文科技学院在读硕士研究生。
胡一鸿(1965—),男,湖南人文科技学院教授,博士。 E-mail:huyhongwangyi@163.com
2017—03—03
10.13652/j.issn.1003-5788.2017.07.040

