基于全外显子组测序对病因不明致死性胎儿水肿遗传学病因的初步分析
殷 荣 杨 琳 胡黎园 周文浩
·论著·
基于全外显子组测序对病因不明致死性胎儿水肿遗传学病因的初步分析
殷 荣1)杨 琳2)胡黎园1)周文浩2)
目的 针对不明原因致死性胎儿水肿的患儿行全外显子组测序,分析与胎儿水肿表型相关的潜在候选基因。方法 收集2011年1月1日至2017年6月1日复旦大学附属儿科医院(我院)收治的不明原因致死性胎儿水肿并行全外显子组检测的病例,采集与致死性胎儿水肿有关的母亲、围生期和新生儿因素,按照我院转化医学中心建立的高通量测序数据分析流程,采用ExAC数据库、千人基因组数据库和我院分子诊断中心已经进行建立的13 810例全外显子组数据,行后续数据分析。结果 符合本文纳入标准的不明原因致死性胎儿水肿患儿18例进入本文分析,男、女各9例,胎龄(34±2)周,体重(2 935±911)g。2例患儿母亲有因胎儿水肿或胸腔积液引产的不良孕产史,3例患儿为试管婴儿。常见的临床表型除胎儿水肿和羊水过多外,还包括心功能不全、休克和肺发育不全等。7例患儿检测到符合罕见潜在致病标准的变异共9个。5例患儿检测到的杂合变异,2个为有害变异(无义变异位于FOXF1基因,移码变异位于RASA1基因),3个错义变异(位于FOXC2基因)。2例患儿检测到的杂合变异,4个变异位于PIEZO1基因2个均为有害变异,位于DSP基因的2个变异均为错义变异。上述基因进行通路富集分析发现,多集中在心血管、血管和血管内皮生长因子等通路上。结论 在病因不明的致死性胎儿水肿病例中检测到罕见潜在致病变异,结合既往报道文献,FLT4、SPTB、PIEZO1和FOXC2基因可考虑作为胎儿水肿候选基因;首次提出FOXF1、RASA1和DSP基因可能与胎儿水肿表型相关。
胎儿水肿; 致死性; 全外显子技术
胎儿水肿是一种罕见的严重先天性疾病,发病率1/1 700~1/3 000[1],治疗效果差,病死率高达50%[2]。其病因复杂,各个系统疾病终末期都可能出现胎儿水肿。近年来,随着染色体核型和单核苷酸多态性(SNP)等遗传检测方法在围生期的应用,临床对胎儿水肿的病因有了更深入的认识,但仍有15%~25%新生儿病因不明。病因不明是影响胎儿水肿预后的独立危险因素[3-5],诊断不明确导致临床治疗缺乏针对性,影响新生儿预后。本文针对病因不明致死性胎儿水肿患儿行全外显子组测序(WES),旨在发现可能的致病原因,建立初步候选致病基因与临床表型的关联性。
1 方法
1.1 胎儿水肿诊断标准 依据文献[1,6],胎儿超声发现胎儿存在≥2处不同部位体腔液体异常聚集,或者存在一处体腔液体聚集合并皮肤水肿(皮肤水肿≥5 mm)。其中体腔积液包括胸腔积液、腹腔积液和/或心包积液。
1.2 病例纳入标准 病因不明的非免疫性胎儿水肿死亡患儿,患儿死亡前在征得家长知情同意后进行了WES。需要说明的是,本文所指的病因不明的非免疫性胎儿水肿是指排除了:①已经明确病因的胎儿水肿死亡患儿,包括由自身免疫性溶血引起的免疫性水肿(Rh溶血和ABO溶血),②非免疫性胎儿水肿包括染色体异常(染色体核型分析或SNP分析),先天性心脏疾病(包括宫内原发的心律失常或复杂性先天性心脏病),先天性乳糜胸/腹(胸水或腹水检测乳糜阳性或单核细胞>0.80),宫内感染(病原学证实病毒感染),胎胎输血(胎儿B超诊断)。
1.3 临床资料采集 回溯病历,采集纳入病例的母亲、围生期和新生儿影响因素。①母亲因素:疾病诊断胎龄、宫内胸腔引流、妊娠高血压症、妊娠糖尿病、胎膜早破和羊水过多;②围生期因素:胎儿胎龄、体重、性别、生产方式和Apgar评分(1 和5 min);③新生儿因素:机械通气、血管活性药物、一氧化氮(NO)吸入和肺泡表面活性物质的应用。宫内胸腔引流定义:胎儿胸腔穿刺和/或胎儿胸腔羊膜腔分流;妊娠高血压症:孕母怀孕20周后出现高血压(收缩压>140 mmHg和/或舒张压>90 mmHg);妊娠糖尿病:符合中华医学会围产医学分会推荐的妊娠合并糖尿病临床诊断指南标准;胎膜早破:胎儿出生前胎膜破水时间>18 h;羊水过多为:胎儿超声单个羊膜腔≥8 cm或羊水指数≥24 cm;胎龄根据末次月经结合胎儿超声结果决定。
1.4 基因检测
1.4.1 DNA提取及全外显子组捕获 采用德国QIAGEN公司mini blood全血试剂盒提取基因组DNA,用美国ThermoFisher公司生产的NanoDrop紫外光分光度仪测定样本的浓度及定量。参照美国Agilent公司SureSelect Human All Exon试剂盒说明书,基因组DNA经过超声打断、末端修复、接头连接和杂交捕获。捕获文库采用美国Illumina公司HiSeq2000平台进行序列检测。
1.4.2 WES及数据筛选流程 原始图像文件经Illumina base calling Software 1.7进行图像识别(Base calling);Clean reads采用Burrows-Wheeler Aligner(BWA)软件v.0.5.9-r16,以人类基因组hg19(GRCh37)为参考序列进行比对;采用SAMtools软件v.0.1.16,对生成的BAM文件进行排序、合并、去除重复;采用SOAPsnp软件 v.1.05进行SNV分析;按照复旦大学附属儿科医院(我院)转化医学中心建立的高通量测序数据流程[7],外部数据库采用ExAC数据库(http://exac.broadinstitute.org/)及千人基因组数据库(http://phase3browser.1000genomes.org/),内部数据库采用我院分子诊断中心已经建立的13 810例全外显子组数据,进行后续数据分析。
1.4.3 罕见潜在致病变异的条件 ①该变异所在基因导致的疾病,与患儿表型相符合或部分相符合。②在显性遗传疾病的致病基因上检测到杂合变异,或在隐性遗传疾病的致病基因上检测到纯合或复合杂合变异,或在男性检测到X连锁隐性遗传疾病的致病基因的杂合变异。③已经报道的明确致病变异,或与已知致病变异位点相同但碱基及氨基酸改变不同,或在功能缺失为已知致病机制的基因上检测到有害变异(无义变异、移码变异、剪接位点+/-1或2、起始密码子变异、单个或多个外显子缺失),或在阴性家族史检测到新发变异,或在家系内患病成员携带相同变异。④对于显性致病基因,筛选变异频率在ExAC数据库及千人基因组数据库未见记录,内部数据库中<2(频率<0.01%);对于隐性致病基因,筛选变异频率在ExAC数据库及千人基因组数据库、内部数据库中均<0.1%。
2 结果
2.1 一般情况 2011年1月1日至2017年6月1日我院收治的胎儿水肿75例,符合本文病例纳入标准的不明原因的致死性胎儿水肿18例(24.3%)进入本文分析,病例排除流程见图1。表1总结和归纳了胎儿母亲、围生期和新生儿因素相关资料。18例中男女各9例,胎龄30~38(34±2)周,体重1 850~4 800(2 935±911)g。2例患儿母亲有因胎儿水肿或胸腔积液引产的不良孕产史,3例患儿为试管婴儿。均有羊水过多,9例行产前干预,除胎儿水肿外,常见的临床表型还包括心功能不全、休克和肺发育不全等(表1)。

图1 病例筛选流程图
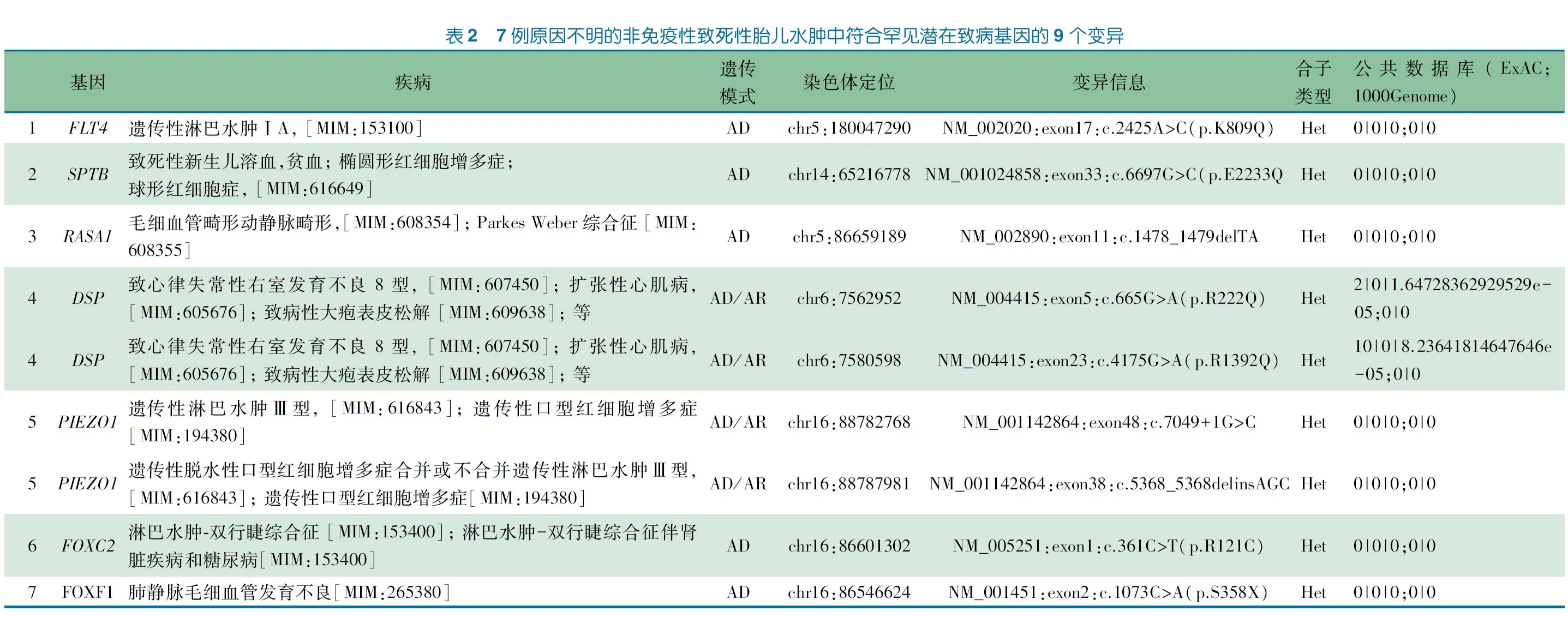
2.2 WES结果 在纳入的18例患儿中,7例检测到符合罕见潜在致病条件的变异共9个(表2)。
5例(例1、2、3、6、7)患儿检测到的杂合变异位于常染色体显性遗传致病基因,5个变异中,2个为有害变异(1个无义变异位于FOXF1基因 c.1073C>A(p.S358X),1个移码变异位于RASA1基因c.1478_1479delTA),3个错义变异(1个为HGMD:http://www.hgmd.cf.ac.uk收录的致病变异位于FOXC2 基因PMID 19760751)。
2例患儿(例4和5)检测到的杂合变异位于常染色体隐性遗传致病基因,4个变异中,位于PIEZO1基因2个均为有害变异(c.7049+1G>C; c.5368_5368delinsAGC);位于DSP基因的2个变异均为错义变异,其中c.4175G>A(p.R1392Q) 为HGMD收录的致病变异PMID 26406308,c.665G>A(p.R222Q) 为HGMD收录的致病相关变异。
2.3 检测罕见潜在变异基因的通路富集分析 图2显示,采用STRING(https://string-db.org/)在线分析软件进行基因通路富集分析发现,2.2中的基因多集中在心血管、血管和血管内皮生长因子等通路上。其中,FOXC2、FLT4和RASA1富集在血管内皮生长因子受体通路中;FOXC2、FOXF1、FLT4和RASA1富集在血管形态及血管发生通路中;FOXC2、FOXF1、FLT4和RASA1、DSP富集在心血管系统发育及循环系统发育通路中。
表1 致死性胎儿水肿患儿的临床表型

病例胎龄/周出生体重性别母亲孕产史临床表型1343065女无胎儿水肿,肺出血,房间隔缺损2363240男无羊水过多,胎儿水肿,新生儿惊厥,心功能不全3322370女第3胎1)胎儿水肿,气胸,肺动脉高压,弥散性血管内凝血,血小板减少4341950男第3胎2)胎儿水肿,休克,多器官功能衰竭,凝血障碍,弥散性血管内凝血,帽状腱膜下出血5332825女无胎儿水肿,先天性肺发育不全,肺动脉高压6322040女流产3)胎儿水肿,四肢肌张力低下,多器官功能衰竭7332560女无胎儿水肿,心包积液,低血糖,嗜酸细胞异常8354800男无胎儿水肿,多器官功能衰竭9352640男试管婴儿胎儿水肿,心功能不全,房扑10374730女无胎儿水肿,多器官功能衰竭11353150女无胎儿水肿,贫血,白细胞减少12353340男流产3)胎儿水肿,房间隔缺损13363045男无胎儿水肿,肺发育不全14332530女无胎儿水肿,面容异常(颈短,耳位低),肺动脉高压15301980男无胎儿水肿,房间隔缺损,肺动脉高压16384400男无胎儿水肿,多器官功能衰竭17331850男试管婴儿胎儿水肿,先天性肺发育不良18322330女试管婴儿胎儿水肿,凝血障碍,房间隔缺损
注 1)第1胎流产,第2胎21周因胸腔积液引产;2)第1胎36周胎儿水肿出生后死亡,第2胎女孩体健;3)不明原因流产
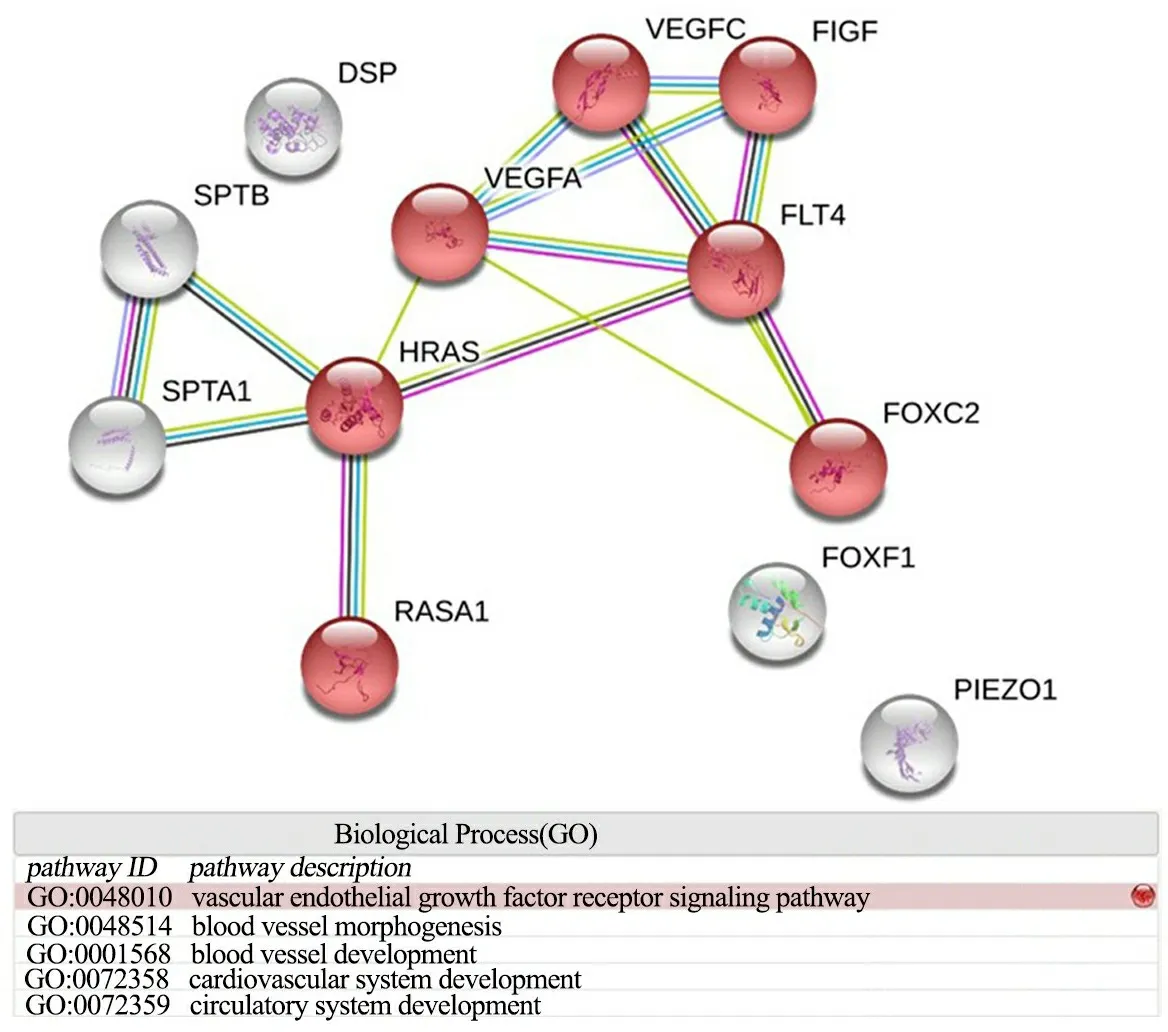
图2 罕见潜在变异基因的通路富集分析
2 讨论
胎儿水肿是围生期严重疾病,病因复杂,临床处理困难,是新生儿复苏和管理的难点。胎儿或新生儿任何一个系统的严重疾病都有可能影响到血管的毛细血管压和组织静水压,以及血浆和组织液体胶体渗透浓度的平衡,最终导致组织和体腔内液体集聚,形成胎儿水肿。
胎儿水肿的病因多样[8-10]。2015年美国非免疫胎儿水肿临床指南指出胎儿水肿的病因包括 :①心血管系统疾病,如先天性心脏病或心律失常,②染色体异常如21三体综合征等,③血液系统疾病,如地中海贫血等,④细菌或病毒感染,⑤胎胎输血综合征,⑥淋巴回流受阻如乳糜胸等,⑦不明病因。本研究排除因免疫性原因引起的胎儿水肿,排除已经明确病因的非免疫性免疫水肿包括染色体疾病,如21三体综合征,7号染色体异常,Turner综合征;先天性心血管畸形,如Ebstein畸形,左心室发育不良,心肌炎;心律失常,如阵发性室上速;先天性乳糜胸/腹;宫内感染,如CMV,HSV和微小病毒引发的胎儿水肿;胎粪性腹膜炎和胎胎输血。纳入本研究的病例为临床不能判定病因的病例,排除可能的环境因素对疾病的影响,考虑患儿的遗传背景可能是疾病的潜在病因。
近2年来WES技术应用于检测围生期不明原因死亡患儿,获得初步进展。研究报道,合并B超检查异常宫内死亡患儿,应用WES技术异常基因的检出率为10%~57%[11-13]。WES技术不仅将临床表型和已知的基因型相联系,还发现人类新的基因型。本研究纳入18例病因不明的非免疫性致死性胎儿水肿,行WES。针对检测到的罕见潜在致病变异进行分析,旨在为这类疾病探索可能的遗传学病因。其中7例患儿检测到了罕见潜在致病变异。通过通路富集分析,发现上述基因较集中地富集于血管内皮生长因子受体通路、血管形态及血管发生通路、心血管系统发育及循环系统发育通路中,故该类型通路上的基因发生突变可能造成患儿水肿表型。
在7例患儿中,5例无母亲胎儿水肿孕产史。其中,例1临床主要表型为孕30周B超发现胎儿水肿,检测到FLT4基因的错义变异c.2425A>C(p.K809Q)。FLT4基因是遗传性淋巴水肿(MIM:153100)的致病基因[14],表现为由于淋巴流动的改变导致四肢肿胀,并出现局部感染和身体损伤,OMIM数据库(https://www.ncbi.nlm.nih.gov/omim/?term=FLT4)检索到的2个研究均在胎儿水肿患儿检测到该基因的变异,且相同变异在家族内有高度异质性[15]。例2临床主要表型为胎儿水肿合并心功能不全,检测到SPTB基因错义变异c.6697G>C(p.E2233Q),该基因突变可导致红细胞形态异常和溶血。既往有2例胎儿严重水肿检测到该基因纯合变异[16-17]。例5临床表现为胎儿水肿,合并先天性肺发育不全,检测到PIEZO1基因2个变异c.7049+1G>C和c.5368_5368delinsAGC。PIEZO1基因可导致遗传性淋巴水肿(MIM:616843),可表现为广泛淋巴管发育不良,淋巴水肿,影响全身,包括肠和/或肺淋巴管扩张、胸腔积液、乳糜胸和/或心包积液[18]。2015年首次报道该基因可导致胎儿水肿[19]。例6主要表现为胎儿水肿,伴多器官功能衰竭,检测到FOXC2基因变异c.361C>T(p.R121C),该基因是淋巴水肿-双行睫综合征(MIM:153400)的致病基因[20]。主要表现为肢体淋巴性水肿、双行睫毛,还可以表现为角膜炎、角膜溃疡、畏光、上睑下垂、静脉曲张、唇裂和腭裂等。有研究报道在一个胎儿水肿家系中检测到FOXC2基因无义突变。例7主要表现为胎儿水肿及心包积液,检测到FOXF1基因无义变异c.1073C>A(p.S358X),该基因是肺静脉毛细血管发育不良(MIM:265380)的致病基因[21]。该疾病呈常染色体显性遗传,是新生儿持续性肺动脉高压的一种罕见原因,其特征是肺部毛细血管系统发育异常。可表现为呼吸困难、多种先天性异常,累及心血管、胃肠道、泌尿生殖系统和肌肉骨骼系统等。尚无明确胎儿水肿报道。
在7例患儿中,2例母亲有胎儿水肿孕史。其中,例4系G3P3,G1P136周胎儿水肿出生后死亡,G2P2女孩体健,例4主要表现为严重胎儿水肿、休克、多器官功能衰竭和凝血障碍,检测到DSP基因2个罕见变异c.665G>A(p.R222Q),c.4175G>A(p.R1392Q),DSP可导致常染色体隐性遗传的大疱表皮松解症致死性皮肤棘层松解型(MIM:609638)和常染色体显性遗传的致心律失常性右室发育不良(MIM:607450))等[22,23];例3系G3P1,G1P0为自然流产(原因不详),G2P0因孕21周发现胸腔积液引产,例3主要表现为严重胎儿水肿和凝血功能障碍。检测到RASA1基因移码变异c.1478_1479delTA,RASA1基因为导致毛细血管畸形(MIM:608354)的致病基因[24,25]。可表现为非典型性毛细管畸形,与动静脉畸形、动静脉瘘或韦伯综合征有关。DSP和RASA1尚无明确报道可导致胎儿水肿,基因的功能分析可能存在相关性,有待进一步研究。同时,对于原因不明的反复出现胎儿水肿的家系,如检测到显性致病基因,警惕先证者父母生殖细胞嵌合可能。
本研究,针对可能导致严重致死性胎儿水肿的遗传学病因进行初步探索,检测到罕见可能致病变异。上述变异所累及的基因中,通过通路富集分析发现,较集中地富集于血管内皮生长因子受体通路、血管形态及血管发生通路、心血管系统发育及循环系统发育通路中,故该类型通路上的基因发生突变,可能造成胎儿水肿表型。可作为候选基因。结合既往报道文献,FLT4、SPTB、PIEZO1和FOXC2基因仅在胎儿水肿患儿中有罕见报道,尚未建立明确的表型基因型关联性,且在家族内均有明显的异质性。
本文结果显示,上述4个基因可考虑作为胎儿水肿候选基因;并首次提出FOXF1、RASA1和DSP基因可能与胎儿水肿表型相关,有待进一步研究加以明确。对于临床相对较为常见的表型—胎儿水肿,尤其是严重致死性胎儿水肿,分子遗传学病因认识尚不充分,分析原因可能与以下因素有关:①既往研究多采用单基因一代测序,患儿尚无相应疾病特征性表型,所以未进行相应基因检测;②本研究纳入的患儿病情危重,疾病进展快,早期死亡,造成在此类疾病中,尚未进行相关分子遗传学检测。
本研究仅为针对严重致死性胎儿水肿病因学的初步探索,尚需进一步的家系内验证和扩大样本量进行验证,并进一步进行功能学研究,才能建立明确的致病基因关联性。
[1]Bellini C, Hennekam RC. Non-immune hydrops fetalis: a short review of etiology and pathophysiology. Am J Med Genet A,2012,158A(3):597-605 .
[2]Society for Maternal-Fetal Medicine (SMFM), Norton ME, Chauhan SP,et al. Society for maternal-fetal medicine (SMFM) clinical guideline #7: nonimmune hydrops fetalis. Am J Obstet Gynecol,2015,212(2):127-139 .
[3]Nassr AA, Ness A, Hosseinzadeh P, et al. Outcome and Treatment of Antenatally Diagnosed Nonimmune Hydrops Fetalis. Fetal Diagn Ther,2017,doi: 10.1159/000475990 .
[4]Nakayama A, Oshiro M, Yamada Y, et al. The prognostic factors of hydrops fetalis with pleural effusion. Pediatr Int,2017,doi: 10.1111/ped.13357 .
[5]Weber AM, Philipson EH. Fetal pleural effusion: a review and meta-analysis for prognostic indicators. Obstet Gynecol,1992,79(2):281-286 .
[6]Bellini C, Donarini G, Paladini D, et al. Etiology of non-immune hydrops fetalis: An update. Am J Med Genet A,2015,167A(5):1082-1088 .
[7]黎籽秀, 刘博, 徐凌丽, 等. 高通量测序数据分析和临床诊断流程的解读. 中国循证儿科杂志, 2015, 10 (1) :19-24 .
[8]Okeke TC, Egbugara MN, Ezenyeaku CC,et al. Non-immune hydrops fetalis. Niger J Med. 2013,22(4):266-273 .
[9]Moreno CA, Kanazawa T, Barini R, et al. Non-immune hydrops fetalis: A prospective study of 53 cases. Am J Med Genet A, 2013,161A(12):3078-3086 .
[10]Lockwood CJ, Nadel AS, King ME, et al. Case records of the Massachusetts General Hospital. Case 16-2009. A 32-year-old pregnant woman with an abnormal fetal ultrasound study. N Engl J Med, 2009,360(21):2225-2235 .
[11]Yates CL, Monaghan KG, Copenheaver D, et al. Whole-exome sequencing on deceased fetuses with ultrasound anomalies: expanding our knowledge of genetic disease during fetal development. Genet Med, 2017, doi: 10.1038/gim.2017.31 .
[12]Shamseldin HE, Kurdi W, Almusafri F, et al. Molecular autopsy in maternal-fetal medicine. Genet Med,2017,doi: 10.1038/gim.2017.111 .
[13]Oshima Y, Yamamoto T, Ishikawa T, et al. Postmortem genetic analysis of sudden unexpected death in infancy: neonatal genetic screening may enable the prevention of sudden infant death. J Hum Genet, 2017,doi: 10.1038/jhg.2017.79 .
[14]Ghalamkarpour A, Holnthoner W, Saharinen P, et al. Recessive primary congenital lymphoedema caused by a VEGFR3 mutation. J Med Genet,2009,46(6):399-404 .
[15]Spiegel R, Ghalamkarpour A, Daniel-Spiegel E, Vikkula M, Shalev SA. Wide clinical spectrum in a family with hereditary lymphedema type I due to a novel missense mutation in VEGFR3. J Hum Genet, 2006,51(10):846-850 .
[16]Gallagher PG, Petruzzi MJ, Weed SA, et al. Mutation of a highly conserved residue of betaI spectrin associated with fatal and near-fatal neonatal hemolytic anemia. J Clin Invest,1997,99(2):267-277 .
[17]Gallagher PG, Weed SA, Tse WT, et al. Recurrent fatal hydrops fetalis associated with a nucleotide substitution in the erythrocyte beta-spectrin gene. J Clin Invest,1995,95(3):1174-1182 .
[18]Andolfo I, Alper SL, De Franceschi L, et al. Multiple clinical forms of dehydrated hereditary stomatocytosis arise from mutations in PIEZO1. Blood, 2013,121(19):3925-3935, S1-12 .
[19]Fotiou E, Martin-Almedina S, Simpson MA, et al. Novel mutations in PIEZO1 cause an autosomal recessive generalized lymphatic dysplasia with non-immune hydrops fetalis. Nat Commun,2015,6:8085 .
[20]Finegold DN, Schacht V, Kimak MA, et al. HGF and MET mutations in primary and secondary lymphedema. Lymphat Res Biol,2008,6(2):65-68 .
[21]Sen P, Yang Y, Navarro C, et al. Novel FOXF1 mutations in sporadic and familial cases of alveolar capillary dysplasia with misaligned pulmonary veins imply a role for its DNA binding domain. Hum Mutat,2013,34(6):801-811 .
[22]Jonkman MF, Pasmooij AM, Pasmans SG, et al. Loss of desmoplakin tail causes lethal acantholytic epidermolysis bullosa. Am J Hum Genet,2005,77(4): 653-660 .
[23]Barahona-Dussault C, Benito B, Campuzano O, et al. Role of genetic testing in arrhythmogenic right ventricular cardiomyopathy/dysplasia. Clin Genet,2010,77(1):37-48 .
[24]Eerola I, Boon LM, Mulliken JB, et al. Capillary malformation-arteriovenous malformation, a new clinical and genetic disorder caused by RASA1 mutations. Am J Hum Genet,2003,73(6):1240-1249 .
[25]Revencu N, Boon LM, Mendola A, et al. RASA1 mutations and associated phenotypes in 68 families with capillary malformation-arteriovenous malformation. Hum Mutat,2013,34(12):1632-1641
Pilot study of genetic etiology in neonates with agnogenic lethal fetal hydrops using whole-exome sequencing
YINRong1),YANGLin2),HULi-yuan1),ZHOUWen-hao2)
(Children'sHospitalofFudanUniversity,Shanghai201102,China; 1)DepartmentofNeonatology, 2)MolecularDiagnosticCentre)
YANG Lin, E-mail: yanglin_fudan@163.com
ObjectiveTo investigate potential candidate genes related to phenotype of agnogenic lethal hydrops using whole-exome sequencing.MethodsData of neonates with agnogenic lethal hydrops were collected from Jan 1st 2011 to June 1st 2017 in Children's hospital of Fudan University (our hospital) and WES was employed to analyze their genotype. Maternal, perinatal and neonatal risk factors were also collected from each neonate. We used next-generation sequencing data analysis pipeline established by Translational Medical Center, Children's Hospital of Fudan University. Public databases were used including the exome aggregation consortium (ExAC), and the 1000 Genome Project, as well as in-house database including 13 810 WES data for variants annotation and filtering.ResultsEighteen neonates with agnogenic lethal hydrops were included in this study, and half of them were male. Their gestational ages were among 34±2 weeks and birth weight was around (2 935±911) g. There were 2 patients' mothers with history of induced abortion because of hydrops or thoracic effusion fetus and 3 patients were IVF (In-Vitro Fertilization) infants. Besides hydrops and polyhydramnios, the other common clinical phenotypes were cardiac dysfunction, shock and pulmonary dysplasia. Nine variants in 7 patients were identified fitting our criteria for rare and likely pathogenic, including 5 heterozygous variants in 5 genes and 4 compound heterozygous variants in 2 genes. Among the 5 heterozygous variants, 2 variants were deleterious (one nonsense inFOXF1 gene and one frameshift inRASA1 gene), 3 variants were missense inFOXC2,FLT4 andSPTBgene. Among the 4 compound heterozygous variants, both variants inPIEZO1 gene were deleterious (one splicing site and one frameshift), other two variants inDSPgene were missense. The pathway enrichment analysis showed that these genes identified in the 7 patients focused on blood vessel, cardiovascular system development and vascular endothelial growth factor receptor signaling pathway.ConclusionSeven rare potential pathogenic gene variants were detected in agnogenic lethal hydrops neonates. Combined with previous literature,FLT4,SPTB,PIEZO1 andFOXC2 might be considered as candidate genes of fetal hydrops. Our study was the first report that suggestedFOXF1,RASA1 andDSPgenes could be related to the phenotype of fetal hydrops.
Fetal hydrops; Lethal; Whole-exome sequencing
2017-07-12
2017-08-18)
(本文编辑:张崇凡,孙晋枫)
复旦大学附属儿科医院 上海,201102;1)新生科,2)分子诊断中心
杨琳,E-mail: yanglin_fudan@163.com
10.3969/j.issn.1673-5501.2017.04.008

