雷公藤多苷肝毒性血清药物化学的初步研究△
王晓东,叶桃,金城,肖小河,赵奎君,蒲仕彪,马致洁*
(1.首都医科大学 附属北京友谊医院,北京 100050;2.解放军302医院 中西医结合研究中心,北京 100039;3.云南中医学院 中药学院,云南 昆明 650200)
·中药基础·
雷公藤多苷肝毒性血清药物化学的初步研究△
王晓东1,叶桃2,金城2,肖小河2,赵奎君1,蒲仕彪3*,马致洁1*
(1.首都医科大学 附属北京友谊医院,北京 100050;2.解放军302医院 中西医结合研究中心,北京 100039;3.云南中医学院 中药学院,云南 昆明 650200)
目的:通过对雷公藤多苷引起肝毒性入血成分的分析研究,探讨雷公藤潜在的肝毒性物质基础。方法:观察雷公藤多苷临床20倍等效剂量给药大鼠的肝组织病理形态学、血清AST和ALT来评价雷公藤多苷造成肝损伤的客观真实性;采用血清药物化学研究方法,在MSE质谱正负模式下,建立雷公藤多苷UPLC-Q/TOF-MS指纹图谱和其大鼠血清指纹图谱,比较确定雷公藤多苷的入血原型成分。结果:正常组与给药组大鼠肝组织病理切片指标、血清AST和ALT差异有统计学意义,血清指纹图谱的研究共鉴定Othosphenic Acid、Triptotriterpenic Acid、Demethylregelin、Wilforlide、Cangoronine 5个原型成分。结论:初步确定了雷公藤多苷引起肝毒性的入血成分,为其肝毒性物质基础的阐明奠定了基础。
雷公藤多苷;肝毒性;血清药物化学;指纹图谱
雷公藤是我国一味传统中药,性温,味苦涩,具有祛风除湿、舒筋活络、消肿止痛、杀虫解毒等功效,在临床上治疗类风湿性关节炎、红斑狼疮、肾病综合征等自身免疫性疑难病证有良好的效果,然而其毒副作用也越来越受到人们关注,特别是肝毒性作用报道颇多[1-3]。雷公藤提取物雷公藤多苷广泛应用于现代中药制剂,在临床上治疗各类难治自身免疫性疾病,然而,其不良反应涉及包括肝脏在内的多种器官和系统损害,且毒性成分不清,严重影响了临床用药的安全性。
中药血清药物化学是以经典的药物化学研究手段和方法为基础,运用现代分离技术及多维联用技术,分析鉴定口服中药后人或动物血清中移行成分,确定中药药效物质基础并研究其体内过程的应用学科[4]。近年来,血清药物化学研究方法引起了众多研究者的重视,在中药药效物质基础研究方面也发挥了很大作用[5-9]。本文在表征雷公藤多苷产生肝毒性的客观真实性的基础上,采用色谱-质谱联用技术(LC-MS)技术,通过研究口服雷公藤多苷的大鼠血清中移行成分来探索分析雷公藤肝毒性的可能成分,为雷公藤肝损伤的合理用药提供参考。
1 材料
1.1 仪器
自动生化仪(mindray BS-300);冷冻离心机(Sigma,德国);超高效液相色谱-质谱串联四极杆-飞行时间质谱仪(UPLC-Q-TOF,Acquity-Q-TOF Premier,美国Waters 公司);微量分析天平(Mettler Toledo AL204 瑞士);涡旋混匀器(HYQ 2121A);Masslynx 4.1工作站Gradient A10 Mill-Q超纯水器(法国Millipore 公司);Ostra TM 96-well plate固相萃取柱(25 mg 1/pkg,Waters)。
1.2 试剂与药品
雷公藤多苷片(浙江得恩德制药有限公司,规格:10 mg/片,批号:0507101);丙氨酸氨基转移酶(ALT)测定试剂盒(批号:140111011)、天门冬氨酸氨基转移酶(AST)测定试剂盒(批号:140211019),购自深圳迈瑞生物医疗电子股份有限公司;甲醇(色谱级,德国Merck公司);乙腈(色谱级,德国Merck公司);甲酸(色谱级,德国Merck公司);去离子水经(18.2 MΩ)Millipore Milli-Q系统(Millipore Co.,美国)超纯水器净化;亮氨酸-脑啡肽(Leucine-enkephalin,LE)标准品(Sigma 公司,USA);其他试剂为市售分析纯。
1.3 动物
SD大鼠,28只,SPF级,雌雄各半,6~8周龄,体质量(150±20)g,由中国人民解放军军事医学科学院实验动物中心提供[SCXK-(军)2007-004],实验动物分笼饲养于解放军302医院实验动物中心[SYXK(军)2002-00500],自由进食及饮水。实验室温度(21±2)℃,湿度65%~85%,具有控温定时排气通风设备。人工光照约12 h∶12 h的明暗周期。
2 方法
2.1 大鼠给药方法
空白组12只,给药组16只。将雷公藤多苷片研磨成粉末加0.9%氯化钠溶液充分溶解,配制成质量浓度为15 mg·mL-1(在前期试验基础上筛选出该质量浓度为雷公藤多苷的致毒质量浓度,人临床20倍等效剂量)的混悬液。按1 mL·(100g)-1·d-1,每天上午9:00—10:00灌胃,空白组每天灌以等量0.9%氯化钠溶液,给药周期为4周。每周称重1次,按实际体质量调整剂量。
2.2 大鼠生活生长行为状况观察
观察记录大鼠采食量、喝水量、皮毛色泽、精神、死亡等情况。
2.3 血清肝酶实验方法
每周在灌胃30 min后静脉眼眶取血,静置一段时间后4 ℃冷冻离心分离血清,全自动生化仪检测天门冬氨酸氨基转氨酶(AST)和丙氨酸氨基转氨酶(ALT)。
2.4 肝组织HE染色病理组织形态学检查
大鼠最后一次取血后处死,立即取肝组织,0.9%氯化钠溶液清洗。取肝右叶外侧下部大约1.5 cm×1.5 cm的肝脏组织(厚度不超过0.5 cm),放入预先配好4%的中性甲醛溶液固定24 h,从肝脏边缘向内切7~12块薄片,10%的中性甲醛溶液继续固定72 h,使组织保持本来的形态结构。再经脱水透明、浸蜡包埋、切片与贴片、脱蜡HE染色、脱水透明和封固过程,Oymptls光学显微镜观察,拍照。
2.5 色谱条件
色谱柱:Waters UPLC HSS T3柱(100 mm×2.1 mm,1.7 μm);流动相:1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B);流动相梯度洗脱顺序:0~1 min,5%~20%B;1~2 min,20%~30%B;2~4 min,30%~35%B;4~5 min,35%~40%B;5~20 min,40%~100%B。流速:0.3 mL·min-1;进样量:5 μL;柱温:35 ℃;样品温度:4 ℃。
2.6 质谱条件
离子源:ESI±;离子源电压:Capillary 3.2 kV;Sampling Cone 50 V;Extraction Cone 3 V;离子源温度:Source 100 ℃,Desolvation 350 ℃;去溶剂气:Desolvation,700 L·h-1;扫描范围:m/z50~1000;亮氨酸-脑啡肽(200 μg·L-1Lock mass)在线校正。
2.7 雷公藤制剂供试品溶液的制备
取雷公藤多苷片10片,除去薄膜衣,精密称定,研细,取细粉约0.5 g,精密称定,置25 mL量瓶中,加无水乙醇约20 mL,密塞,超声处理(120 W,40 kHz)60 min,冷至室温,加无水乙醇至刻度,摇匀,滤过。
2.8 血清药物化学样品的处理
大鼠血清保存在-80 ℃冰箱中,取出复融后,取大鼠血清200 μL加入到OstraTM96-well plate固相萃取柱(25 mg 1/pkg,Waters)中,加入1.5 mL 5%甲醇淋洗后,加入600 μL 1%甲酸乙腈,混匀,静置,在负压的条件下,抽取液体,4 ℃冷冻离心(18 000 r·min-1,10 min),取上清液。
2.9 数据处理
3 结果
3.1 雷公藤的肝毒性
3.1.1 大鼠的生活生长行为 空白组大鼠采食量、喝水量正常,皮毛颜色和光泽正常,生活行为正常。给药3周后,给药组大鼠出现活动明显的减少,食量下降,雌性大鼠甚至不采食,精神不济、呆滞,皮毛杂乱没有光泽,并伴有呼吸不顺的现象,雌性鼠比雄性鼠情况严重。
3.1.2 大鼠体质量 从图1可知,雷公藤多苷灌胃3周后,与空白组的大鼠相比,给药组大鼠体质量增长出现抑制(P<0.05);灌胃4周后,与空白组的大鼠相比,给药组体质量明显下降(P<0.01)。提示雷公藤多苷灌胃后,给药3、4周后给药组大鼠体质量降低。
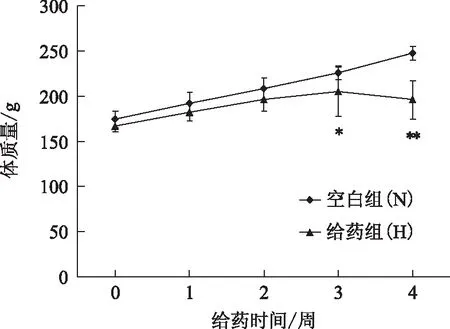
注:与空白组相比,*P<0.05,**P<0.01。图1 雷公藤多苷对大鼠体质量的影响
3.1.3 大鼠肝组织病理切片 从HE染色肝组织病理切片中可看出(见图2),空白组的大鼠肝组织切片结构正常,肝细胞大小一致,中央静脉周围的肝细胞索排布,无脂肪变性细胞,细胞质丰富,细胞核位于细胞中央;给药组的大鼠肝细胞大小不一,明显脂肪病变。
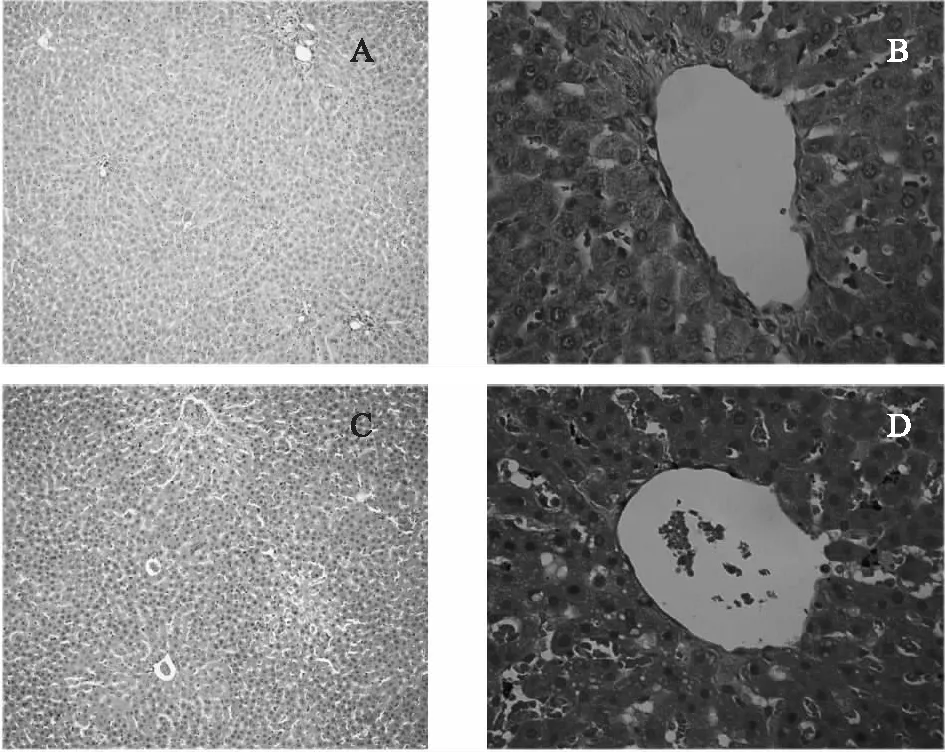
注:A.空白组(×100);B.空白组(×400);C.给药组(×100);D.给药组(×400)。图2 HE染色肝组织病理切片图
3.1.4 大鼠血清ALT、AST 从图3、图4可看出,与空白组的大鼠相比,给药3周后,给药组ALT显著升高(P<0.01),AST也明显升高(P<0.05)。给药4周后,给药组与空白组的大鼠相比,ALT和AST都非常显著升高(P<0.001)。提示,血清中肝酶活性增加,说明肝组织出现损伤而将ALT、AST释放入血。
3.2 雷公藤肝毒性入血原型成分分析
在MSE质谱正负模式下,以化合物的质谱特征为鉴定标准,以保留时间为对比序列,对含药血清和空白血清进行指纹图谱鉴定,两组血清再与雷公藤体外样品的色谱峰进行比对,各级色谱行为相同的色谱峰即为雷公藤血中移行原型成分(见图4和图5)。
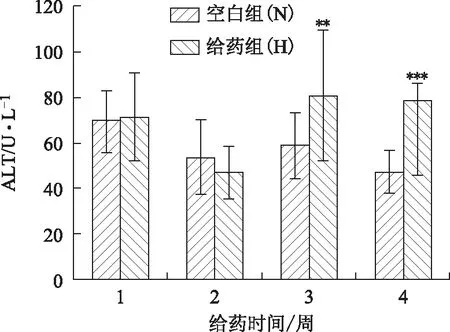
注:与空白组相比,**P<0.01,***P<0.001。图3 雷公藤多苷对大鼠血清ALT的影响
本实验在大鼠血清中总共指认了5个雷公藤大鼠血中移行原型成分S1、S2、S3、S4和S5。原型成分S1~S5与雷公藤体外样品的高低碰撞能下的色谱行为相同(见表1)。其中正离子模式下指认了S1、S2、S4、S5(见图5),负离子模式下指认了S1、S2、S3(见图6)。从表1所知,血中移行成分可能是雷公藤木栓烷型、齐墩果烷型和乌苏烷型三萜类化合物。提示雷公藤三萜类成分易被机体吸收,易被获取检测。
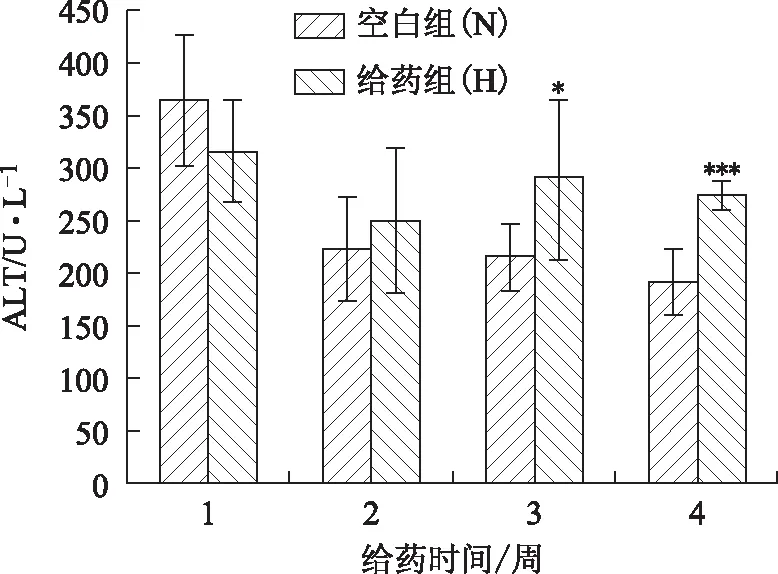
注:与空白组相比,*P<0.05,***P<0.001。图4 雷公藤多苷对大鼠血清AST的影响
对总离子流图中所获得的峰进行扫描,获得了S1、S2、S3、S4和S5指认化合物保留时间上的空白组血清、给药组含药血清和雷公藤多苷片的提取离子图的质谱图,见图7~14。
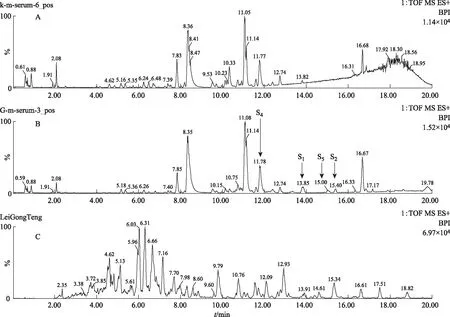
注:A.空白血清;B.给药组含药血清;C.雷公藤多苷片。图5 ESI+模式下各组血清总离子流图(BPI图)
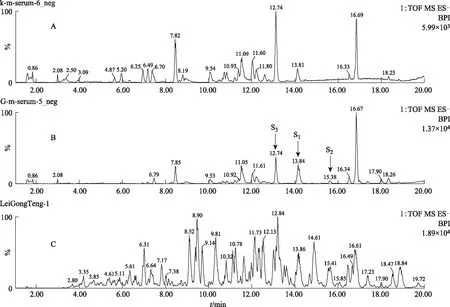
注:A.空白血清;B.给药组含药血清;C.雷公藤多苷片。图6 ESI-模式下各组血清总离子流图(BPI图)
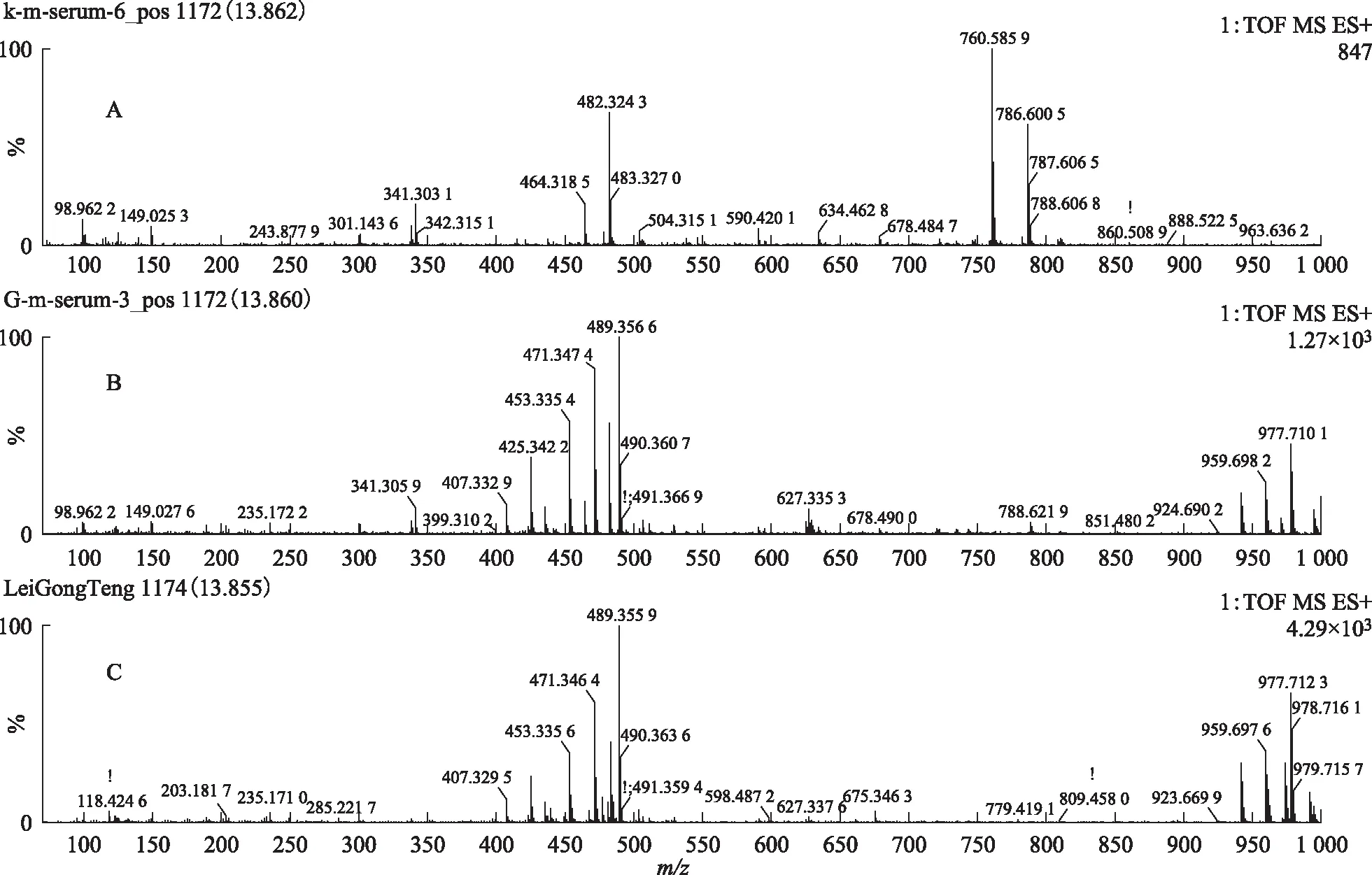
注:A.空白血清;B.给药组含药血清;C.雷公藤多苷片。图7 S1在ESI+模式下13.84 min的一级质谱图
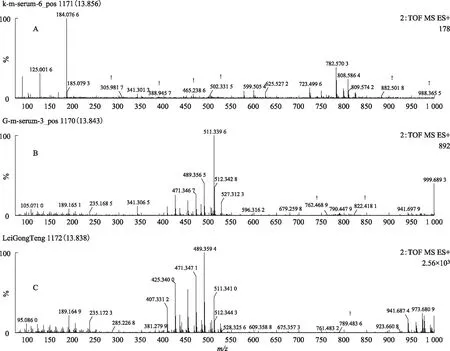
注:A.空白血清;B.给药组含药血清;C.雷公藤多苷片。图8 S1在ESI+模式下13.84 min的二级质谱图
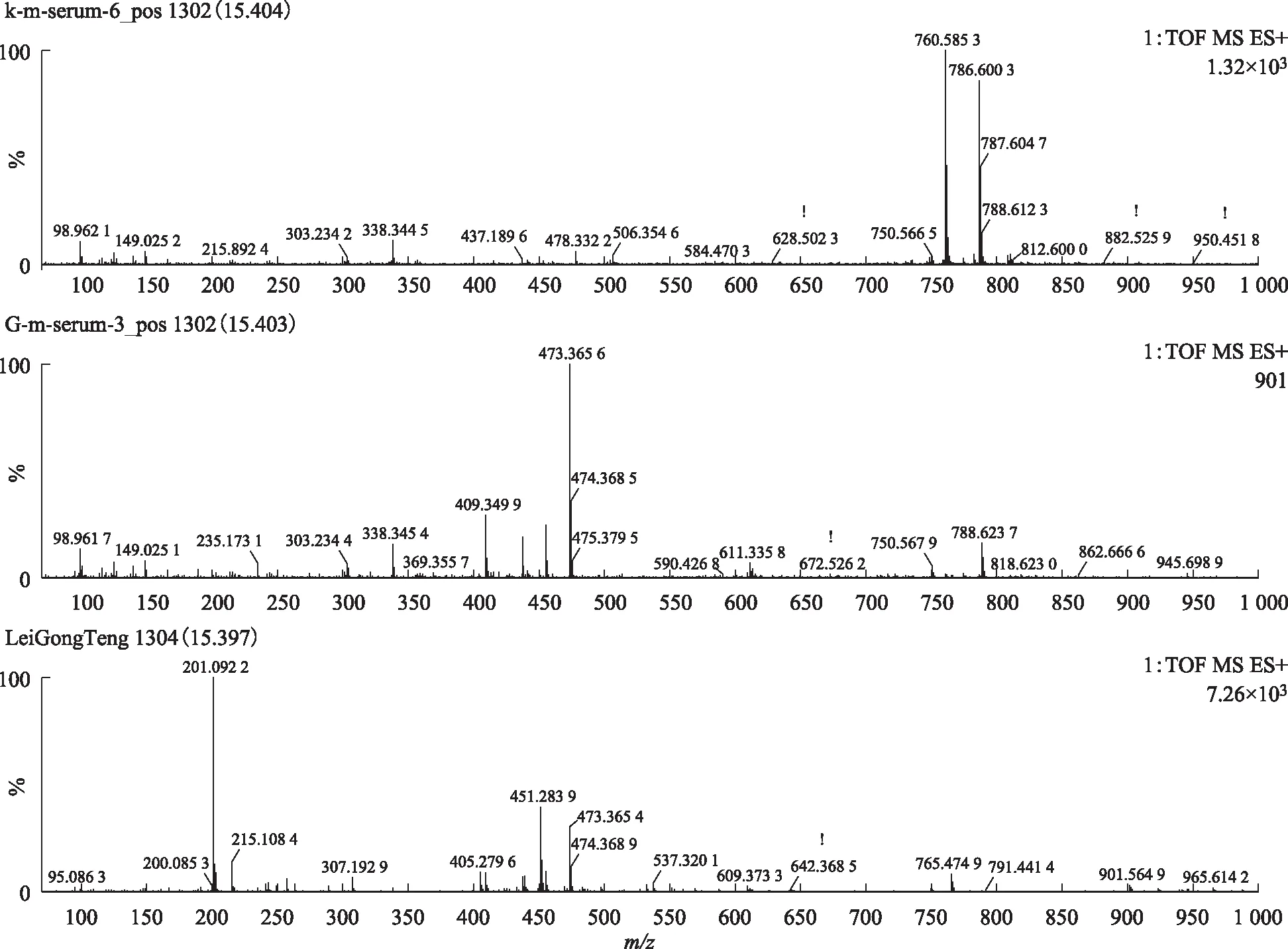
注:A.空白血清;B.给药组含药血清;C.雷公藤多苷片。图9 S2在ESI+模式下15.40 min的一级质谱图
注:A.空白血清;B.给药组含药血清;C.雷公藤多苷片。图10 S2在ESI+模式下15.40 min的二级质谱图
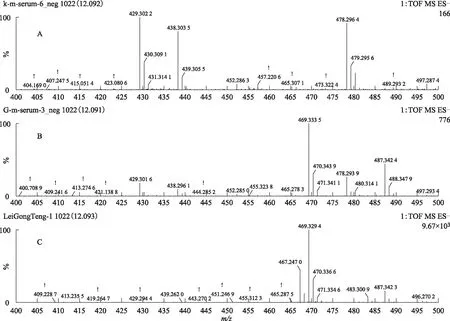
注:A.空白血清;B.给药组含药血清;C.雷公藤多苷片。图11 S3在ESI-模式下12.09 min的一级质谱图
注:A.空白血清;B.给药组含药血清;C.雷公藤多苷片。图12 S3在ESI-模式下12.09 min的二级质谱图
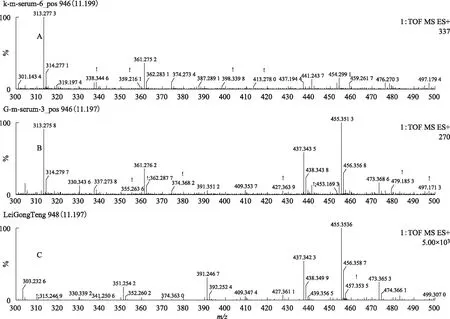
注:A.空白血清;B.给药组含药血清;C.雷公藤多苷片。图13 S4在ESI+模式下11.2 min的一级质谱图
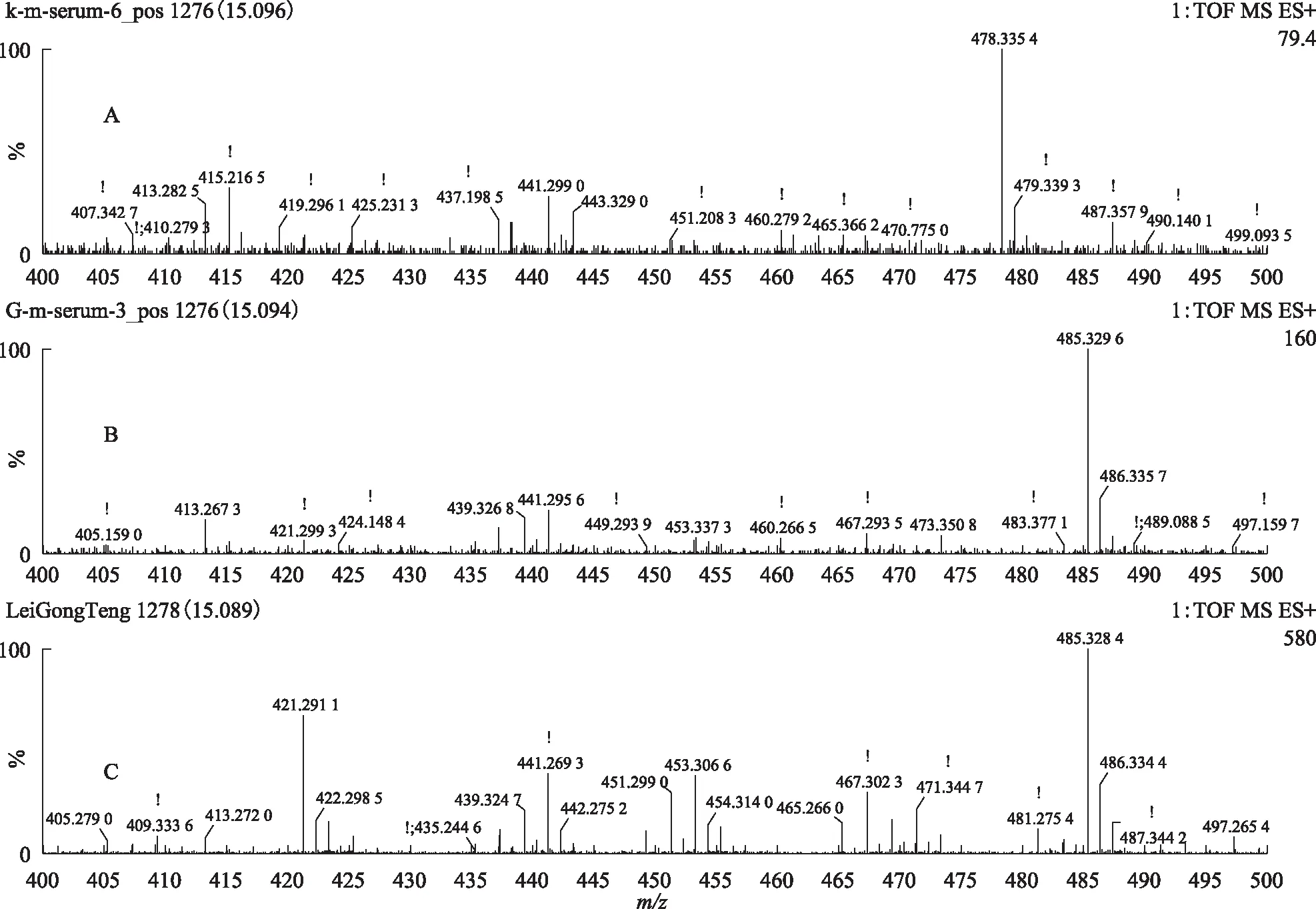
注:A.空白血清;B.给药组含药血清;C.雷公藤多苷片。图14 S5在ESI+模式下15.09 min的一级质谱图
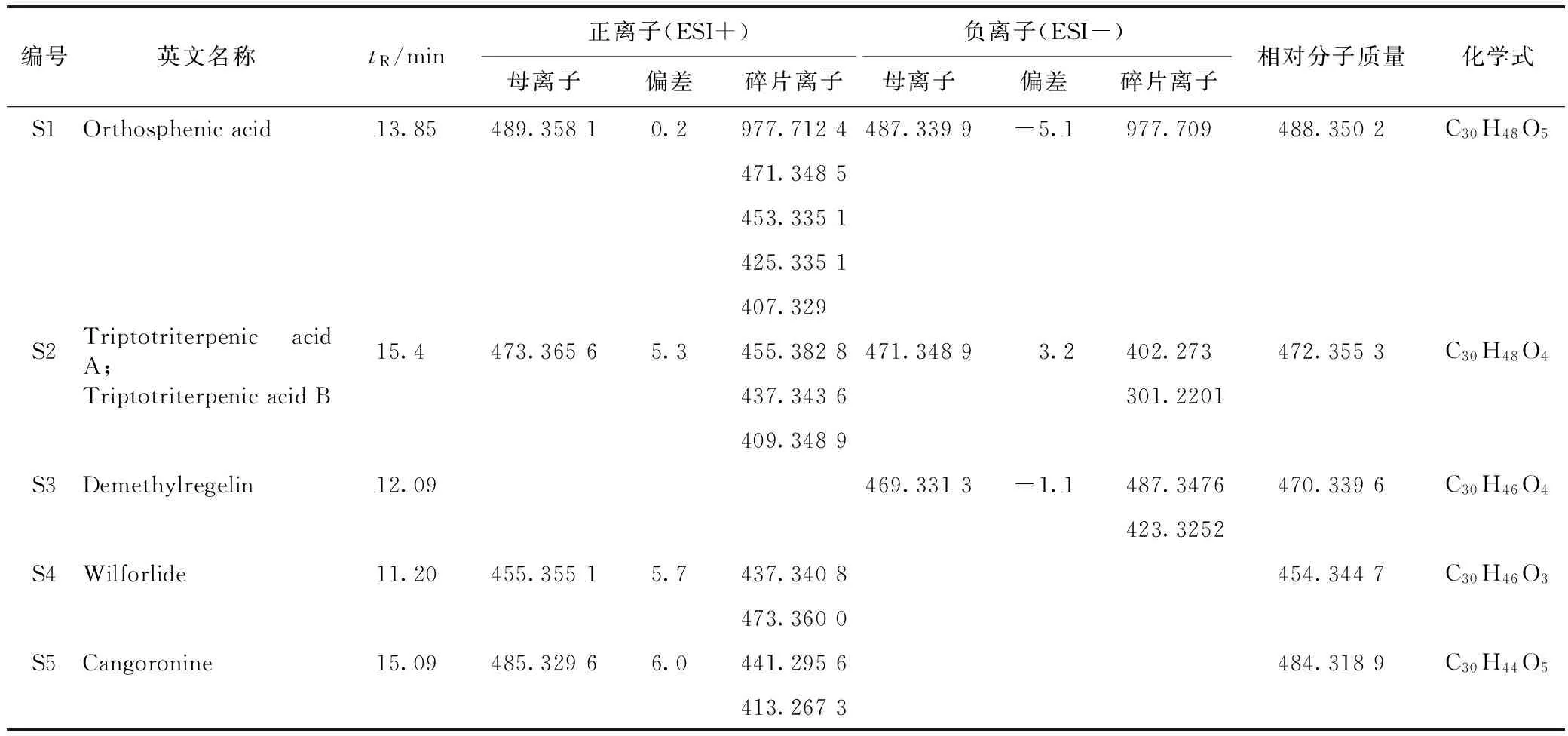
表1 雷公藤多苷血中移行成分—原型成分
4 讨论
雷公藤作为临床常用药,在治疗免疫疾病方面具有不可被替代的独特功效,然而雷公藤的主要活性成分也往往是其产生毒性的成分,雷公藤小鼠半数致死量均<2 mg·kg-1[10]。据临床观察[11],雷公藤及其制剂的毒副作用发生率为58.1%。其中有关雷公藤及其制剂(包括有雷公藤多苷片等)不良反应的报道大幅上升。雷公藤多苷是从雷公藤中提取的有效成分,其生理活性由二萜内酯、生物碱、三萜等成分协同产生。本实验在给予临床20倍等效剂量3周和4周后,大鼠出现明显体质量下降、血清AST和ALT异常升高的现象,表明雷公藤多苷可致肝损害。提示雷公藤制剂可致药源性肝损害,且与给药时间呈正相关。
目前,针对雷公藤药物单体成分的研究较多[12],但鲜见雷公藤其他成分或代谢成分的毒性报道。实验研究中,对于毒性成分的筛选大多数还停留在体外肝细胞、肝组织实验的基础上[13],且毒性检测结果无法完全反映药物在体内的行为,对雷公藤肝毒性的进一步研究缺乏指导意义。同时,关于雷公藤多苷的动物毒理实验的报道虽多,但是与临床结合不够紧密,不足以为临床提供有利参考[14-15]。
中药成分较为复杂,体外毒性成分不等于体内毒性成分,且很多体外毒性成分不能被机体吸收。药物无论经何种途径进入体内,其毒性成分必须以血液为媒介输送分布到作用部位或作用靶点,从而发挥产生作用。这些入血成分最真实地反应了中药化学成分在体内的变化,能充分体现其对机体产生的协调和拮抗作用,可代表中药作用的整体物质基础。因此,血液中的中药成分才可能是真正的体内直接作用物质[16]。
本实验完成了UPLC-Q-TOF/MS含雷公藤多苷大鼠血清指纹图谱的研究,共鉴定了血清中5个原型成分,即S1~S5,可能为雷公藤木栓烷型、齐墩果烷型和乌苏烷型三萜类化合物。且雷公藤三萜类成分易被机体吸收,易被获取检测。对雷公藤多苷进行血清药物化学研究,可初步确定血清中移行成分的来源,这些化合物可能包含雷公藤肝毒性物质,有助于进一步探讨研究确证雷公藤肝毒性成分。本实验借鉴中药血清药物化学方法分析血清中移行成分,初步阐述雷公藤肝毒性可能的外源性物质基础,为临床雷公藤安全用药提供参考;尝试建立中药毒性成分辨识模式,为类似毒性中药研究提供示例。
综上所述,雷公藤肝毒性是客观存在的,本文采用UPLC-Q-TOF/MS技术首次在大鼠体内血清中检测到上述雷公藤原型成分,血清中原型成分S1~S5可能包含雷公藤肝毒性成分,其是否为雷公藤肝毒性成分还有待进一步研究和验证。
[1] 王喜军.中药血清药物化学的研究动态及发展趋势[J].中国中药杂志,2006,31(10):789-791.
[2] 任献青,丁樱.雷公藤多苷肝损伤副作用的临床观察及对策[J].时珍国医国药,2008,18(5):23
[3] 万明,陈红燕.雷公藤中毒死亡83例死因分析[J].时珍国医国药,1999,9(2):128-129.
[4] 王喜军.中药血清药物化学的研究动态及发展趋势[J].中国中药杂志,2006,31(10):789-791.
[5] 吴芳芳,王喜军,韩莹,等.基于UPLC-HDMS技术的生脉散血清药物化学初步研究[J].世界科学技术—中药现代化,2010,12(4):657-665.
[6] 陶金华,狄留庆,濮雪莲,等.通塞脉微丸血清药物化学的初步研究(I)[J].中草药,2011,42(7):1267-1270.
[7] 李文兰,陈奇,白晶,等.基于HPLC-DAD-EMS/MS技术分析八珍汤在大鼠体内的代谢化学成分[J].中国药学杂志,2011,46(6):422-425.
[8] 孙琴,马丽,李兰,等.板蓝根中红细胞凝集效应组分的谱效关系研究[J].中草药,2012,43(1):125-131.
[9] 郭辉,刘晓,蔡皓,等.大黄附子汤血清药物化学初步研究[J].中草药,2013,44(5):528-531.
[10] 郑家润.雷公藤应用研究存在的问题[J].中国中西医结合杂志,2009,29(2):101.
[11] 张秋萍,宋洪涛.雷公藤制剂研究进展[J].中国药师,2009(7):881-883.
[12] 虞海燕,秦万章.雷公藤活性单体的筛选及毒性[J].浙江中医学院学报,2000,24(2):70.
[13] 刘史佳,刘子修,周玲,等.雷公藤活性成分对大鼠体内P450酶活性的影响[J].中药药理学通报,2011,27(2):276-280.
[14] 刘玉凤,邓惠英.雷公藤多甙致肝损伤的临床报道[J].中医药研究,1997,13(5):20.
[15] 李红刚,纪伟,苏建明,等.雷公藤多苷片的肝毒性及增效减毒的文献研究[J].中国中西医结合杂志,2012,32(3):415-418.
[16] 王喜军.中药血清药物化学[M].北京:北京科学出版社,2010.
PreliminaryStudyonSerumPharmacochemistryofTripterygiumGlycosidesHeptotoxicity
WANGXiaodong1,YETao2,JINCheng2,XIAOXiaohe2,ZHAOKuijun1,PUShibiao3*,MAZhijie1*
(1.BeijingFriendshipHospital,CapitalMedicalUniversity,Beijing100050,China;2.IntegrativeMedicalCenter, 302MilitaryHospital,Beijing100039,China;3.YunnanUniversityofTCM,Kunming650200,China)
Objective:To study the blood components in tripterygium glycosides on liver toxicity and further explore its material basis.Methods:The objective authenticity of liver damage caused by tripterygium glycosides were evaluated by observing the liver histopathology and serum levels of AST,ALT.The fingerprint of Tripterygium glycosides UPLC-Q-TOF/MS was established by serum pharmacochemistry and MSEmode in a mass spectrometer,and the serum ingredients were identified.Results:Compared with the blank group,the rats showed statistically significant differences in liver pathomorphology and serum AST and ALT after administratedTripterygiumextract four weeks.The serum fingerprint identified 5 components include othosphenic acid,triptotriterpenic acid,demethylregelin,wilforlide and cangoronine.Conclusion: The constituents of liver toxicity of tripterygium glycosides absorbed into blood are preliminarily identified,which could lay the foundation for clarification of its materials basis.
Tripterygium glycosides;liver toxicity;serum pharmacochemistry;fingerprint
2016-04-26)
北京市中医管理局项目(QN2014-18);首都中医药研究专项(14ZY12);北京友谊医院院启动项目(YYQDKT2014-20)
*
蒲仕彪,博士,讲师,研究方向:肝病的中医诊疗研究,E-mail:pushi511@126.com;马致洁,博士,主管中药师,研究方向:中药肝毒性及临床合理用药,Tel:(010)63138562,E-mail:13811647091@163.com
10.13313/j.issn.1673-4890.2017.3.012

