应用表型和基因型分析28℃鲜湿米粉中主要优势菌
,, ,,,,
(1.江西农业大学食品科学与工程学院,江西省天然产物与功能食品重点实验室,江西南昌 330045;2.南昌市食品药品检验所,江西南昌 330038;3.江西农业大学园林与艺术学院,江西南昌 330045)
应用表型和基因型分析28℃鲜湿米粉中主要优势菌
黄永平1,2,黄占旺1,*,万亮2,王素贞1,陈佳妮1,杨鼎超3,周明1
(1.江西农业大学食品科学与工程学院,江西省天然产物与功能食品重点实验室,江西南昌 330045;2.南昌市食品药品检验所,江西南昌 330038;3.江西农业大学园林与艺术学院,江西南昌 330045)
为研究鲜湿米粉中的优势菌,本文采用传统微生物培养方法和16S rDNA技术对28 ℃条件下鲜湿米粉的腐败菌进行分离鉴定,并了解鲜湿米粉贮藏期间的优势菌群与主要优势菌。结果表明,鲜湿米粉在28 ℃条件下,1 d后其菌落总数超过限量要求,2 d后感官出现明显腐败变质;经表型鉴定表明,其优势菌群包括肠杆菌科、乳酸菌、芽孢杆菌属,经基因型鉴定表明,肠杆菌属是导致鲜湿米粉腐败变质的主要优势菌。随着贮藏时间的延长,肠杆菌科占所有菌相的51.3%,是造成鲜湿米粉腐败变质的主要优势菌。
鲜湿米粉,优势菌,16S rDNA,肠杆菌属
随着我国人民生活水平的不断提高,消费者对食品质量安全问题越来越关注,也对于鲜湿米面制品的品质提出了更高要求。鲜湿米粉因其营养丰富、含水量高以及在生产加工、贮藏和流通环节极易受到微生物的污染而导致其品质败坏,导致其食用价值下降,货架期相应缩短[1-2]。因此,研究鲜湿米粉中的优势腐败菌并加以抑制,是当前鲜湿米粉保鲜和延长货架期的首要问题。
目前,研究食品工业中的优势菌主要采用传统微生物培养法和分子生物学法[3-5]。传统微生物培养法是通过传统方法进行微生物的分离纯化,再依据其菌落特征、菌体形态与生理生化等表型特征确定其微生物种类。然而,由于微生物种类繁多,菌落形态复杂多样,仅凭其表型特征来鉴定微生物的种属分类地位,不仅需要丰富经验,且工作耗时,尤其对那些生长条件特殊、形态相似的菌株,采用传统微生物培养法进行鉴定难度更大[6-7]。聚合酶链式反应(Polymerase Chain Reaction,PCR)为基础的16S rDNA法是近年来较为先进的分子生物学方法。该法简单快速,特异性强且重复性好,现已成为细菌与真菌鉴定的有效方法[8-11]。
现有研究[12-13]采用选择性培养基研究贮藏期内湿米粉中菌相的变化,虽取得一定效果,但仅局限于传统表型特征的鉴定。本文将传统微生物培养法与16S rDNA分子生物学鉴定相结合,对28 ℃条件下鲜湿米粉贮藏期间的主要优势菌进行分离鉴定,以为鲜湿米粉的保鲜技术研究,延长其货架期提供理论依据。

表1 湿米粉感官综合评价标准Table 1 Sensory and comprehensive evaluation standard of wet rice noodles
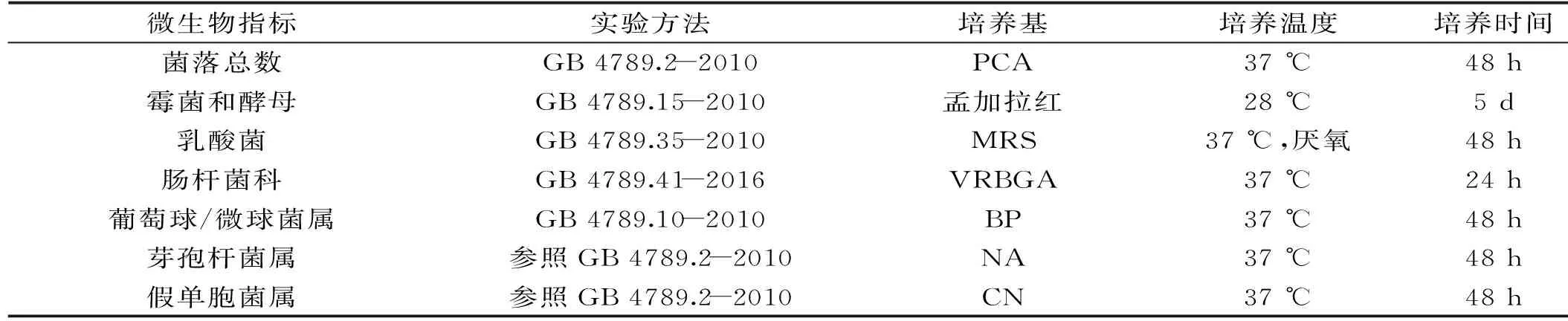
表2 湿米粉中微生物指标测定方法Table 2 Detecting methods of microorganism in wet rice noodles
1 材料与方法
1.1材料与仪器
按GB 4789.1-2010[14]的采样原则,本实验在南昌市青山湖区某一小作坊点购买当天现场制作生产的鲜湿米粉,取样后用无菌袋包装封口,放入冰盒内,迅速运回实验室,置于28±0.5 ℃生化培养箱中保温贮藏,定期(0、1、2、3、4 d)取样并进行各指标测定与分析;其中,从取样到实验展开不超过1 h。
平板计数琼脂(PCA)、孟家拉红、结晶紫中性红胆盐葡萄糖琼脂(VRBGA)、Baird-parker平板(BP)、MRS培养基、营养琼脂(NA)、CN琼脂、半固体琼脂、氧化酶试纸、过氧化氢(H2O2)试剂、革兰氏染色液、芽孢染色液 购自广东环凯微生物有限公司;Ezup柱式细菌基因组DNA抽提试剂盒、PCR扩增试剂盒(Taq)、溶菌酶、DNA Marker F、2xTaqMan Fast qPCR Master Mix 购自生工生物工程(上海)股份有限公司;通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)由生工生物工程(上海)股份有限公司合成;化学试剂均为分析纯。
LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;MDF-382E(N)医用低温冰箱 三洋电机国际贸易有限公司;MJ-180BF霉菌培养箱、SPX-150-Ⅱ生化培养箱 上海贺德实验设备有限公司;SW-CJ-2FD双人洁净工作台、BHC-1300ⅡB2生物安全柜 苏州安泰空气技术有限公司;TGL-16B高速台式离心机 上海安亭科学仪器厂;ZD8801台式回转摇床 金坛市盛蓝仪器制造有限公司;T-Gradient梯度PCR仪、Power Pack P25 T电泳仪 德国Biometra公司;Alliance 6.7凝胶成像分析系统凝胶成像系统 法国uvitec公司。
1.2实验方法
1.2.1 感官评定 参照LS/T 3202-1993[15],并结合湿米粉特性制定湿米粉感官综合评价标准,选取7位专业感官评定人员组成评定小组,分别采用目视法、鼻嗅法与口尝法,对湿米粉的色泽、气味、形态、口感进行综合评定,结果取其平均值,评价标准见表1。
1.2.2 优势菌的测定 无菌操作,采用选择性培养基通过稀释平板法进行优势菌的测定[16-17],具体各优势菌群的测定方法,见表2。培养后所得菌落计数结果以lg(CFU/g)表示。
1.2.3 优势菌的分离、纯化和保藏 依据Pulvirenti[18]报道,从不同选择性的最大稀释梯度平板上挑选典型菌落特征且占优势的菌落进行计数、编号,并反复进行平板划线分离,直到菌落特征和细胞染色形态一致,即为纯化菌株[19]。将已纯化后的菌株分别接种斜面及制成20%甘油菌悬液管,分别于4 ℃冰箱和-80 ℃医用低温冰箱保存备用[20]。
1.2.4 表型鉴定 挑取新鲜纯培养的单菌落进行染色镜检,包括革兰氏染色和芽孢染色,于显微镜油镜下观察并记录细胞的个体形态、染色情况[21]。同时,进行动力、氧化酶实验、过氧化氢(H2O2)酶实验、葡萄糖氧化发酵实验(O/F)和精氨酸双水解酶等生理生化分析。

表3 PCR反应体系和扩增条件Table 3 PCR reaction system and amplification conditions

表4 鲜湿米粉在28 ℃贮藏下其感官评定结果Table 4 Sensory evaluation of fresh wet rice noodles at 28 ℃
注:a~e不同贮藏时间下,同一实验指标的平均值±标准差之间的显著性(p<0.05),且不同字母间代表差异显著,相同字母间代表差异不显著,表5同。

表5 鲜湿米粉在28 ℃贮藏下其优势菌测定结果Table 5 Determination of dominant bacteria in fresh wet rice noodles at 28 ℃
注:-:由于湿米粉中假单胞菌属初始值<1 lg(CFU/g)(即未检出),因此后续未进行该指标的测定。
1.2.5 基因型鉴定 采用16S rDNA序列分析方法对优势分离菌进行基因型鉴定,具体参照Packeiser H等[22]的方法并稍有改动。
DNA提取:分离菌经纯培养后,使用Ezup柱式细菌基因组抽提试剂盒提取DNA。
引物设计:通用引物27F和1492R由上海生物工程有限公司设计和合成[23]。
PCR扩增:参考高磊等[24]的方法并略有改动,见表3。
产物检测:扩增产物用1%琼脂糖凝胶电泳进行检测,点样量为6 μL,经溴化乙锭染色后,凝胶成像。
序列分析:待PCR扩增产物达到纯化要求,将剩余产物送往上海生物工程有限公司测序。测序结果输入RDP网站的Classifier数据库中对比分析,确定分离菌的分类地位。
1.3数据处理
所有数据经SPSS 20.0处理,数据表示为平均值±标准差;对数据进行单因素方差分析,以p<0.05表示数据间差异显著;用Origin 8.5作图。
2 结果与分析
2.1鲜湿米粉在28 ℃贮藏下感官评定及优势菌的测定结果
由表4、表5可知,随着贮藏时间的延长,湿米粉的感官综合评分呈下降趋势,而菌落总数、肠杆菌科、葡萄球菌/微球菌属、芽孢杆菌属、霉菌和酵母的菌落数量总体均呈增长规律。贮藏第1 d后,菌落总数已超过106CFU/g,根据DB 45/319-2007[25]中微生物指标规定菌落总数不得超过8×104CFU/g的限量要求,其货架期不到1 d。相比鲜湿米粉的初始值,第1、2、3、4 d后的感官综合评分降低显著(p≤0.05),分别为52.3、21.1、4.7、0分;当鲜湿米粉在28 ℃条件下贮藏到第2 d,其感官综合评分降低到21.1分,湿米粉有强烈的酸味和臭味、表面有少许发黄、霉变、出现短条、静置有糊状渗滤液等明显腐败变质迹象,已达到感官的不可接受程度。通过比较各优势菌群数量可以发现,细菌是导致鲜湿米粉腐败变质的主要因素,这主要是由于湿米粉含水量较高,营养丰富,在适宜环境条件下,湿米粉中优势腐败菌群生长较快,最终导致样品的货架期较短。因此,通过感官综合评分和腐败菌的测定结果可知,选择湿米粉贮藏2 d后的菌落平板进行后续优势菌的分离鉴定研究。

表6 分离菌株的表型特征实验结果Table 6 Results of phenotypic characteristics of isolates
2.2优势菌表型鉴定结果
无菌操作,选取28 ℃条件下贮藏2 d后变质的湿米粉所测定的不同选择性平板上菌落,按照典型菌落特征和在数量上占优势的单菌落为原则,共挑选28株分离菌,分别进行表型特征鉴定。
根据《细菌伯杰氏鉴定手册》和M.H.Brown[26-27],由表6可知,分离菌经该形态学观察和常规生理生化等表型鉴定后,鲜湿米粉中的优势菌为乳酸菌、肠杆菌科、芽孢杆菌属、葡萄球菌属、不动杆菌属以及莫拉氏菌属,这与前人[12]指出的湿米粉中主要微生物为乳酸菌、肠杆菌科、葡萄球菌、酵母菌、霉菌的结论大体一致。结合表5发现,肠杆菌科在菌落总数的数量上最多,是导致鲜湿米粉腐败变质的主要优势菌,这与柳鑫等[12]研究表明乳酸菌是导致湿米粉腐败本质的主要优势腐败菌有所差异;与陈志瑜[13]的研究结果有芽孢杆菌属、葡萄球菌属、霉菌属为主要微生物也有所不同。分析原因可能:一是因地域、环境各异而选择的湿米粉试材,结果使得菌相种类分布有所不同,二是测定湿米粉中优势腐败菌所选择的培养基以及实验方法不同,结果导致优势腐败菌的种属也不一样;三是由于菌相之间存在拮抗作用或者代谢产物(如细菌素等抑菌性物质)对其他菌相产生了抑制作用,导致有的优势菌没有检测出来。
2.3优势菌基因型鉴定结果
将提取好的分离菌DNA经PCR扩增、1%琼脂糖凝胶电泳检测、EB染色、凝胶成像仪成像拍照后,结果如图1所示,可清晰看到条带且分子量大小约为1500 bp左右,无拖尾现象,满足测序要求,说明本实验的DNA提取质量和浓度以及PCR扩增条件是合适的。
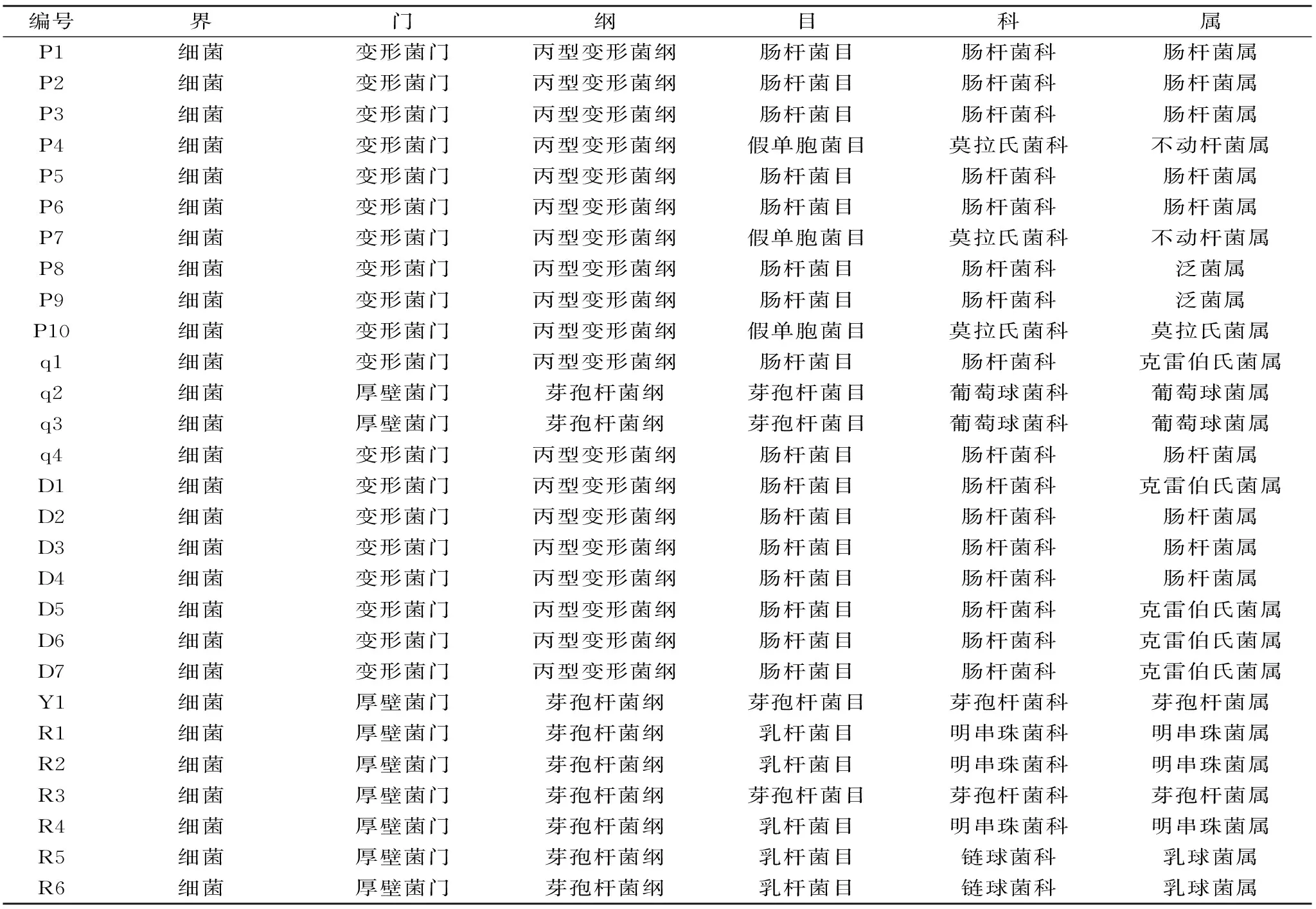
表7 分离菌株的分类地位Table 7 Taxonomic status of isolates

图1 部分PCR产物的琼脂糖凝胶电泳图谱Fig.1 Electrophoresis of PCR amplified products
将分离菌测序所得的16S rDNA 碱基序列输入RDP网站的Classifier数据库中对比分析,可知分离菌的界、门、纲、目、科、属分类地位。如表7所示,28 ℃条件贮藏2 d的鲜湿米粉中的28株分离菌,经16S rDNA基因型鉴定:P1、P2、P3、P5、P6、q4、D2、D3、D4为肠杆菌属,P4、P7为不动杆菌属,P8、P9为泛菌属,P10为莫拉氏菌属,q1、D1、D5、D6、D7为克雷伯氏菌属,Y1、R3为芽孢杆菌属,R1、R2、R4为明串珠菌属,R5、R6为乳球菌属,q2、q3为葡萄球菌属,这与传统表型特征鉴定结果大致相同,但有所差异;其中,利用16S rDNA序列分析技术对28株分离菌的鉴定结果不仅都达到了微生物属水平,而且可追溯和查询到每株菌的界、门、纲、目、科、属分类地位,而利用传统表型鉴定法只能初步鉴定到微生物的科属地位。另外,结合表5可以发现,肠杆菌属在菌落总数的数量上占优势,因此,肠杆菌属是造成鲜湿米粉腐败变质的主要优势菌。
2.4 28 ℃条件下鲜湿米粉贮藏期间优势菌变化情况
由图2中可以看出,28 ℃条件下的鲜湿米粉在贮藏期间受到不同腐败菌的影响,主要包括乳酸菌、肠杆菌科、芽孢杆菌属、葡萄球菌属以及少量的霉菌和酵母。随贮藏时间的延长,到达第4 d后,腐败菌菌相逐渐单一,葡萄球菌属、霉菌和酵母逐渐消失分别为0.2%、0,肠杆菌科、乳酸菌、芽孢杆菌属在菌相中占主导地位,分别为51.3%、24.3%、24.2%,成为优势菌,并且肠杆菌科占所有菌相的大部分,是造成鲜湿米粉腐败变质的主要优势菌。而柳鑫等[12]研究表明鲜湿米粉在30 ℃贮藏过程中乳酸菌是其腐败变质的优势腐败菌,这造成的差异可能是由于不同的生产加工条件,如生产加工的卫生环境、加工原料受到的污染程度等都有可能造成湿米粉中微生物的种类和数量产生差异。

图2 28 ℃条件下鲜湿米粉贮藏期间中优势菌变化Fig.2 Changes in fresh wet rice noodle of the dominant bacteria during 28 ℃ storage over time
3 讨论
本实验应用传统微生物培养法研究28 ℃条件下贮藏期间(0~4 d)鲜湿米粉中优势腐败菌,分别测定了菌落总数、肠杆菌科、乳酸菌、芽孢杆菌属、葡萄球菌属、霉菌和酵母和假单胞菌属,并观察了其感官品质的变化,结果发现,鲜湿米粉中菌落总数初始值未超过限量要求,贮藏1 d后其菌落总数超过限量要求,而感官贮藏2 d后才出现明显的腐败变质迹象,结果表明,鲜湿米粉28 ℃条件下贮藏的货架期不到1 d。同时,从微生物角度能更好地解析鲜湿米粉品质的好坏。因此,通过微生物角度可以提前揭示鲜湿米粉品质劣变情况,从而达到“先知先觉”并提前预防的效果。
为了解鲜湿米粉中的优势菌,本实验对28株分离菌进行传统表型特征发现,肠杆菌科、乳酸菌、芽孢杆菌属在整个贮藏期内占主导地位,成为优势菌,并且肠杆菌科占所有菌相的大部分,成为导致鲜湿米粉腐败变质的主要优势菌。经进一步16S rDNA基因型鉴定,不仅得到了28株分离菌的界、门、纲、目、科、属分类地位,而且发现肠杆菌属在菌落总数的数量上占优势,成为造成鲜湿米粉腐败变质的主要优势菌;结果表明,传统表型鉴定和16S rDNA基因型鉴定结果大体一致,两者相辅相成,相互印证,但16S rDNA序列分析技术更为简便、快速、准确地鉴定微生物属水平,而传统表型特征只能部分鉴定到属水平。
本实验的方法操作可行,但对实验过程的操作,应减少不必要的误差。主要包括:挑取优势菌落时,应挑取在数量上占优势的典型菌落用于后续实验研究;不同微生物指标的测定结果应对具有典型菌落特征的菌落进行计数;分离菌应反复分离纯化经镜检染色结果一致后,方可用于生理生化和分子生物学的实验研究;提取分离菌的DNA时,对于一些难消解的细胞,尤其是革兰氏阳性菌,其水浴过程中可能需要延长水浴时间或提高温度,才能获得一定浓度和质量要求的DNA;在PCR扩增过程中,应在洁净的冰浴条件下进行,严格控制好环境的温度和卫生,以免对实验结果造成影响。此外,由于一些难培养、对营养要求较高的优势菌,结果可能存在一定的局限性。
4 结论
鲜湿米粉在28 ℃条件下贮藏1 d后菌落总数超过限量要求,2 d后感官出现明显腐败变质;对2 d后鲜湿米粉中优势菌进行分离和鉴定,经表型特征鉴定表明,肠杆菌科、乳酸菌、芽孢杆菌属是导致鲜湿米粉腐败变质的优势菌群,经16S rDNA基因型鉴定表明,肠杆菌属是造成鲜湿米粉腐败变质的主要优势菌。此外,随着贮藏时间的延长,菌相逐渐单一,葡萄球菌属、霉菌和酵母逐渐消失,肠杆菌科、乳酸菌、芽孢杆菌属在菌相中占主导地位成为优势菌,并且肠杆菌科占所有菌相的51.3%,是造成鲜湿米粉腐败变质的主要优势菌。
[1]刘壮,凌彬,谢予江,等. 湿米粉在存放过程中的品质变化[J]. 粮食与饲料工业,2010(8):16-18.
[2]吴军辉,梁兰兰,幸芳,等. 湿米粉加工环节微生物污染情况调查[J]. 粮食与饲料工业,2012(6):28-30.
[3]Wan M,Rosenberg J N,Faruq J,et al. An improved colony PCR procedure for genetic screening of Chlorella,and related microalgae[J]. Biotechnology Letters,2011,33(8):1615-1619.
[4]Hofmann M A,Brian D A. Sequencing PCR DNA amplified directly from a bacterial colony.[J]. Methods in Molecular Biology,1993,15(1):205-210.
[5]Martinez-Ballesteros I,Paglietti B,Rementeria A,et al. Intra-and inter-laboratory evaluation of an improved multiplex-PCR method for detection and typing of Salmonella[J]. Journal of Infection in Developing Countries,2012,6(5):443.
[6]燕勇,李卫平,高雯洁,等. rDNA-ITS序列分析在真菌鉴定中的应用[J]. 中国卫生检验杂志,2008,18(10):1958-1961.
[7]Iwen P C,Hinrichs S H,Rupp M E. Utilization of the internal transcribed spacer regions as molecular targets to identify human fungal pathogens[J]. Medical mycology,2002,40(1):87.
[8]Bonnet C,Rigaud C,Chanteclaire E,et al. PCR on yeast colonies:an improved method for glyco-engineered Saccharomyces cerevisiae[J]. BMC Research Notes,2013,6(1):201.
[9]Zeijl C M J V,Kamp E H M V D,Punt P J,et al. An improved colony-PCR method for filamentous fungi for amplification of PCR-fragments of several kilobases[J]. Journal of biotechnology,1997,59(3):221-4.
[10]Müller H J,Prange D R. Colony PCR[M]. PCR-Polymerase-Kettenreaktion. 2016.
[11]Ward A C. Rapid analysis of yeast transformants using colony-PCR[J]. Biotechniques,1992,13(3):350.
[12]柳鑫,文丽,李莎,等. 湿米粉中菌相分析与微生物生长预测模型的建立[J]. 中国酿造,2013,32(1):65-70.
[13]陈志瑜. 鲜湿米粉保质保藏技术的研究[D]. 株洲:中南林业科技大学,2013.
[14]卫生部. GB 4789.1-2010 食品微生物学检验:总则[S]. 北京:中国标准出版社,2010.
[15]卫生部. LS/T 3202-1993 中华人民共和国行业标准:面条用小麦粉[S]. 北京:中国标准出版社,1993.
[16]李芸. 发酵米粉生产过程中的菌相变化及发酵对米粉品质的影响[D]. 北京:中国农业大学,2015.
[17]Harrigan W F. Laboratory methods in food microbiology[J]. Academic Pr,1998.
[18]Pulvirenti A,Solieri L,Gullo M,et al. Occurrence and dominance of yeast species in sourdough[J]. Letters in Applied Microbiology,2004,38(2):113-117.
[19]Shehata M G,Sohaimy S A E,El-Sahn M A,et al. Screening of isolated potential probiotic lactic acid bacteria for cholesterol lowering property and bile salt hydrolase activity[J]. Annals of Agricultural Sciences,2016,61(1):65-75.
[20]Barla F,Koyanagi T,Tokuda N,et al. Theγ-aminobutyric acid-producing ability under low pH conditions of lactic acid bacteria isolated from traditional fermented foods of Ishikawa Prefecture,Japan,with a strong ability to produce ACE-inhibitory peptides[J]. Biotechnology Reports,2016,10(C):105-110.
[21]周凤霞,白京生主编. 环境微生物.第二版[M]. 北京:化学工业出版社,2008.5.
[22]Packeiser H,Lim C,Balagurunathan B,et al. An extremely simple and effective colony PCR procedure for bacteria,yeasts,and microalgae[J]. Applied Biochemistry and Biotechnology,2013,169(2):695.
[23]潘晓倩,赵燕,张顺亮,等. 中温乳化香肠中一株优势腐败菌的分离鉴定与生物学特性[J]. 食品科学,2016,37(7):93-98.
[24]高磊,谢晶,叶藻,等. 冷鲜鸡腿肉中优势腐败菌的分离鉴定及腐败能力研究[J]. 食品与发酵工业,2015,41(8):48-53.
[25]卫生部. DB45/319-2007 鲜湿米粉质量安全要求[S]. 北京:中国标准出版社,2007.
[26]布坎南. 伯杰细菌鉴定手册[M]. 北京:科学出版社,1984.
[27]Brown M H. Meat microbiology[M]. applied science publishers,1982.
Dominantbacteriainfreshwetricenoodleduringstorageat28℃byphenotypeandgenotype
HUANGYong-ping1,2,HUANGZhan-wang1,*,WANLiang2,WANGSu-zhen1,CHENJia-ni1,YANGDing-chao3,ZHOUMing1
The dominant bacteria in fresh wet rice noodle during storage at 28 ℃ were isolated and identified by traditional microbial culture and 16S rDNA. The results showed that the total number of colonies exceeded the acceptance limits at day 1,indicating obvious spoilage of the wet rice noodle after 2 days. The dominant bacteria wereEnterobacteriaceae,Lactobacillus,andBacillussp. by phenotypic characterization,andEnterobactersp. were the main dominant spoilage bacteria by genotype identification. With the extension of storage time,Enterobacteriaceaeaccounted for 51.3% of all the bacteria,which was primarily responsible for the spoilage of fresh wet rice noodles.
fresh wet rice noodle;dominant bacteria;16S rDNA;Enterobactersp.
2017-02-15
黄永平(1988-),男,硕士研究生,研究方向:食品微生物,E-mail:349299456@qq.com。
*通讯作者:黄占旺(1964-),男,学士,教授,研究方向:食品微生物,E-mail:huangzw@163.com。
国家自然科学基金地区科学基金项目(31160337)。
(1.Jiangxi Key Laboratory of Natural Product and Functional Food,College of Food Science and Engineering,Jiangxi Agricultural University,Nanchang 330045,China;2.Nanchang Institute for Food and Drug Control;Nanchang 330038,China;3.College of Landscape and Art,Jiangxi Agricultural University,Nanchang 330045,China)
TS210.1
:A
:1002-0306(2017)17-0099-07
10.13386/j.issn1002-0306.2017.17.020

