植酸分子印迹聚合物的制备、表征及吸附性能
,,,,
(华中农业大学食品科技学院,湖北武汉 430000)
植酸分子印迹聚合物的制备、表征及吸附性能
张乃片,王承明*,奥文芳,李克超,白娟
(华中农业大学食品科技学院,湖北武汉 430000)
以植酸为模板分子,甲基丙烯酸(MAA)为功能单体,N,N′-乙烯基丙烯酰胺(EBA)为交联剂,过硫酸铵为引发剂,采用本体聚合法制备对植酸具有高特异选择性的植酸分子印迹聚合物(MIPs)。通过扫描电镜观察了分子印迹聚合物表面的结构,利用红外光谱进一步对其化学结构进行表征。通过动态吸附、静态吸附和选择性吸附考察了其吸附性能。研究表明植酸分子印迹聚合物对植酸的吸附高于对肌醇的吸附,植酸在印迹聚合物中的印迹因子为1.70,而与植酸结构相似物肌醇的印迹因子为1.46。解吸80 min,MIPs解吸达到稳定,解吸率达到89.59%。植酸分子印迹聚合物对植酸的吸附特异性强,对植酸的吸附量为21.38 μmol·g-1,解吸效果好,进行吸附-解吸附循环5次后,植酸印迹聚合物的性能稳定,对植酸吸附容量为65.62 μmol·g-1,是第一次吸附容量的90.00%,可重复使用。
植酸,分子印迹聚合物,表征,吸附性能,解吸
植酸又名肌醇六磷酸,一般以植酸盐形式存在于植物体内[1-2],其中以谷物,豆类及油科种子中含量较丰富[3]。虽然植酸及其盐由于其独特的生理、药理功能和化学特性,可作为添加剂[4-5]、抗氧化剂、螯合剂[6-7]等广泛使用,但在有关植物及其相关制品中,植酸不但会影响磷的消化吸收、矿物元素的利用,而且会影响蛋白质的吸收及消化酶的活性[8-11]。因此,对于植酸分离、纯化的研究也尤为重要。对于植酸的分离纯化,目前主要有金属离子沉淀法、溶剂抽提法、阴离子树脂交换法及电泳富集等[12]。我国国标法对植酸含量的测定,就是借助阴离子交换树脂法进行前处理分离的。但是由于利用离子交换来纯化植酸的方法易受共存阴离子影响,使得植酸的吸附量不高。所以有必要研制对植酸具有较高选择性固相萃取材料用于分离纯化植酸。
分子印迹聚合物稳定性好、选择性能力强,在高效分析与分离、手性拆分、环境监测与分析、传感器、人工酶与人工受体等领域应用广泛[13-17]。然而,将分子印迹制备萃取材料用于检测植酸的研究,国内外几乎未见报道。研制高选择性、稳定性好的吸附材料,对于植物及其相关制品中植酸的富集、分离纯化和分析尤为重要。
本研究通过分子印迹手段[18],以植酸为模板分子,甲基丙烯酸(MAA)为功能单体,N,N′-乙烯基丙烯酰胺(EBA)为交联剂,过硫酸铵为引发剂,采用聚合法制备对植酸具有高特异选择性的植酸分子印迹聚合物,研究了其对植酸的吸附和解吸能力,为植酸的富集、分离纯化和分析提供新思路。
1 材料与方法
1.1材料与仪器
植酸(纯度>90%) 麦克林公司;甲基丙烯酸(纯度>99%) Sigma公司;过硫酸铵(纯度>98%) Biosharp公司;N,N′-乙烯基丙烯酰胺(纯度>98%) 阿拉丁公司;乙醇,醋酸,丙酮 国药集团化学试剂有限公司。本实验所用试剂均为分析纯或色谱纯。
Waters 2998 高效液相色谱仪 株式会社日立制作所;Nicolet 470傅里叶变换红外光谱仪 美国热电尼高力公司;JSM-6390LV扫描电镜 日本电子公司;722N可见分光光度计 上海菁华科技仪器有限公司;SHZ-82A气浴恒温振荡器 常州澳华仪器有限公司;离心机 上海安亭科学仪器厂;冰箱 合肥美的荣事达电冰箱有限公司。
1.2实验方法
1.2.1 植酸分子印迹聚合物的制备 称取1.0 mmol标准植酸样品和16 mmol甲基丙烯酸于厚壁玻璃管中,加入5 mL(水∶乙醇=3∶1)混合溶液,25 ℃超声水浴1 h,加入12.5 mmol N,N′-乙烯基丙烯酰胺和0.100 g过硫酸铵,继续25 ℃下160 W超声水浴1 h,放置在低温环境4 ℃下静置24 h后,通入N230 min,脱氧密封。然后进行磁力搅拌,40 ℃下热聚合24 h,取出产物,抽滤,真空干燥24 h,用玛瑙钵体进行研磨,过200目筛。将样品溶解于丙酮中,去掉上清液,在60 ℃下真空干燥24 h,进行三次索式抽提:水∶乙酸=8∶2,200 mL,抽提48 h烘干;水,200 mL,抽提48 h烘干;乙醇,200 mL,抽提48 h烘干。得到植酸分子印迹聚合物。
空白聚合物(NIPs)制备除了不加入植酸,其他步骤与上述相同[19]。
1.2.2 植酸分子印迹聚合物的表征 采用溴化钾压片法[20],用美国的Nicolet傅里叶变换红外光谱仪对洗脱前MIPs、洗脱后MIPs和NIPs进行表征。将MIPs和NIPs表面喷金后,用扫描电子显微镜观察结构。
1.2.3 MIPs对植酸的吸附与解吸性能
1.2.3.1 动力学曲线测定 量取20 mL浓度为30 μmol·L-1的植酸溶液分别加入到10个锥形瓶中,加入50 mg的MIPs,在25 ℃恒温下分别振荡10、20、40、60、80、100、200、400、600 min,静置10 min后,移取上清液通过分光光度计测量溶液中的植酸浓度,计算平衡吸附量Qm,平行测定3次取平均值,并绘制吸附量时间关系曲线,考察印迹分子与植酸的结合效果,并确定达到平衡时的吸附时间。
Qm=(Co-Ct)×V/m
式(1)
式(1)中,Co为植酸初始浓度(μmol·L-1);Ct为t时间植酸的浓度(μmol·L-1);V为植酸溶液的体积(mL);m为吸附材料MIPs的质量(g)。
1.2.3.2 等温吸附性能的测定 量取浓度为5、10、15、20、25、30 mg/L的植酸溶液 20 mL,加入到6个锥形瓶中,分别加入50 mg的MIPs和NIPs,25 ℃恒温下振荡7 h,静置10 min后,移取上清液通过分光光度计测量溶液中植酸浓度,计算平衡吸附量Qe(μmol·g-1),平行测定3次取平均值,绘制吸附等温线。将获得的数据用langmuir和Fredunlich吸附等温线进一步评价MIPs和NIPs的结合特性。
Langmuir吸附等温方程:
Qe=KLQmCe/(1+KLCe)
式(2)
式(2)中,Qe是吸附容量(μmol·g-1);Ce是植酸的平衡浓度(μmol·L-1);KL是吸附分配系数(L·μmol-1);Qm是最大吸附容量(μmol·g-1)。
为方便研究,通常将它转化为线性方程:
Ce/Qe=Ce/Qm+1/KLQm
式(3)
式(3)中,KF是吸附系数(L/μmol-1);n是吸附常数(L/μmol-1)。
为方便研究,通常将它转化为线性方程:
logQe=logKF+1/n·logCe
式(4)
1.2.4 解吸性能的考察 选用甲醇∶乙酸∶水溶液(体积比7∶2∶1)作为解吸液,量取10 mL浓度为20 mg/L的植酸溶液置于5个20 mL不同的锥形瓶中,分别加入20 mg MIPs,振荡200 min,4000 r/min离心10 min,静置10 min后,移取上清液通过分光光度计测量溶液中的植酸的浓度,得到吸附量,弃上清液。加入10 mL洗脱液,测定不同时间段解吸液中植酸的浓度,得到洗脱量,计算解吸率。
式(5)
1.2.5 选择性吸附实验 为了表征MIPs的选择吸附性,选择与植酸结构相似的肌醇作为竞争底物进行实验[21]。分别称取50 mg MIPs,NIPs于25 mL容量瓶中,加入20 mL分别含12 μmol·L-1植酸,肌醇的混合溶液,并定容至25 mL。振荡200 min,静置10 min后,通过分光光度计测量溶液中的植酸浓度,计算平衡吸附量Qm(μmol·g-1)、印迹因子IF来评价MIPs和NIPs对植酸的选择特性。
1.2.6 重复使用性实验 称取0.5 g的MIPs于250 mL锥形瓶中,加入200 mL浓度为125 μmol·L-1的植酸溶液,25 ℃下振荡7 h,通过分光光度计测量溶液中的PA浓度,按照式(1)计算吸附容量。吸附达到平衡后,对印迹材料进行洗脱,然后真空干燥,记录质量,然后在同样的条件下重复5次,利用式(1)测定洗脱以后的MIPs对PA的吸附容量。
1.3数据统计分析
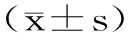
2 结果与讨论
2.1分子印迹材料的红外光谱
对MIPs和NIPs进行红外光谱分析,结果如图1所示,植酸标品在3400 cm-1附近为O-H的伸缩振动,1550 cm-1附近为C=C的骨架振动,在1000 cm-1附近为磷酸酯P=O和C-O的伸缩振动。NIPs、未洗脱的MIPs以及洗脱后的MIPs与植酸标品图谱对比,1000 cm-1附近波峰减弱,这与反应过程中磷酸酯P=O键的变化有关。在MIPs制备过程中,磷酸酯P=O键与功能单体甲基丙烯酸中羟基形成氢键,因而波峰减弱,说明植酸成功植入分子印迹体系。洗脱后的植酸分子印迹聚合物MIPs与MIPs以及空白对照NIPs对比,可以看出在3400 cm-1附近和1550 cm-1附近出现的吸收峰变尖锐,且在1200 cm-1附近出现O-H面内弯曲振动,这是因为在NIPs中,O-H基团主要和C=O之间形成氢键,在MIPs中O-H基团不仅与C=O之间形成氢键,还与P=O形成氢键[22]。MIPs洗脱之后这部分氢键从缔合态恢复游离态,使O-H吸收峰变得尖锐,表明植酸已经被很好的洗脱。
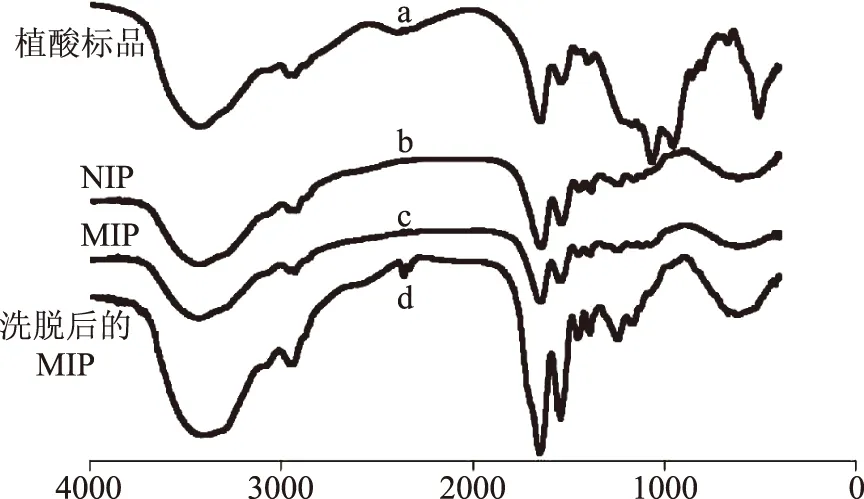
图1 红外光谱图Fig.1 FT-IR spectra注:a:植酸标品,b:洗脱后NIPs聚合物,c:洗脱前MIPs聚合物,d:洗脱后MIPs聚合物。
2.2扫描电镜分析
图2为植酸MIPs(a)和NIPs(b)的热场发射扫描电镜照片。由图2可见,NIPs表面较为光滑平整,颗粒间排列紧密,几乎无空穴产生。而MIPs的表面粗糙,颗粒间排列疏松且多孔,存在大量印迹空穴。与NIPs外貌的区别,证明了植酸分子印迹法的可能性,实验成功制备得到了以植酸为模板的分子印迹聚合物颗粒。

图2 植酸MIPs(a)和NIPs(b)的SEM图Fig.2 SEM photos of phytic acid MIPs(a)and NIPs(b)
2.3 MIPs对植酸的吸附性能
2.3.1 动力学曲线测定 图3为MIPs在不同吸附时间内对植酸的吸附动力学曲线。从图中可以看出,在200 min内,吸附速度较快,之后吸附容量增加缓慢,逐渐达到稳定。吸附容量在开始快速增加的原因是MIPs表面存在大量印迹空穴吸附位点,吸附交换的速度较快。随着时间的延长,MIPs表面印迹空穴吸附位点逐渐被植酸占用,使得吸附速率显著下降,并最终达到饱和[23]。

图3 MIPs对植酸吸附动力学曲线Fig.3 The phytic acid adsorption kinetics curve of MIPs
2.3.2 等温吸附曲线的测定 图4为MIPs和NIPs吸附植酸等温线,从图中可以看出,随着植酸浓度的增加,MIPs吸附量不断增加,在45 μmol·L-1时达到最大吸附量为59.58 μmol·g-1。经计算静态平衡吸附数据,使用 Langumir 与Freundlich 两种等温吸附方程进行分析,结果如图5、图6和表1所示。由表1中的等温模型回归参数可知,Langmuir线性回归系数(R2=0.990)高于Freundlich线性回归系数(R2=0.918),MIPs对植酸的最大吸附容量为59.58 μmol·g-1,更接近Langmuir模型拟合出的62.92 μmol·g-1,故植酸在MIPs上的吸附行为更好地符合Langmuir等温吸附方程,属于单分子层的吸附。
2.3.3 解吸性能的考察 如图7,在80 min之前,解吸速度较快;这是因为MIPs上有足够多的吸附结合位点。在80 min之后,随着MIPs上能够被植酸吸附的结合位点的减少,其解吸速度变缓,并逐渐达到平衡。杨挺等人制备出莱克多巴胺硅胶表面分子印迹材料,其解析率为92.3%[24];雷福厚等人成功合成脱氢枞胺分子印迹聚合物,在解吸时间12 h下,解吸率为95.9%[25]。本实验解吸200 min,其解吸率能达到92.3%,说明其解吸效果较好。

表1 25 ℃时植酸吸附的等温模型回归参数Table 1 The adsorption isotherm model regression parameters of phyticacid at 25 ℃

图4 25 ℃时MIPs和NIPs吸附植酸等温线Fig.4 The phyticacid adsorption isotherm of MIPs and NIPs at 25 ℃
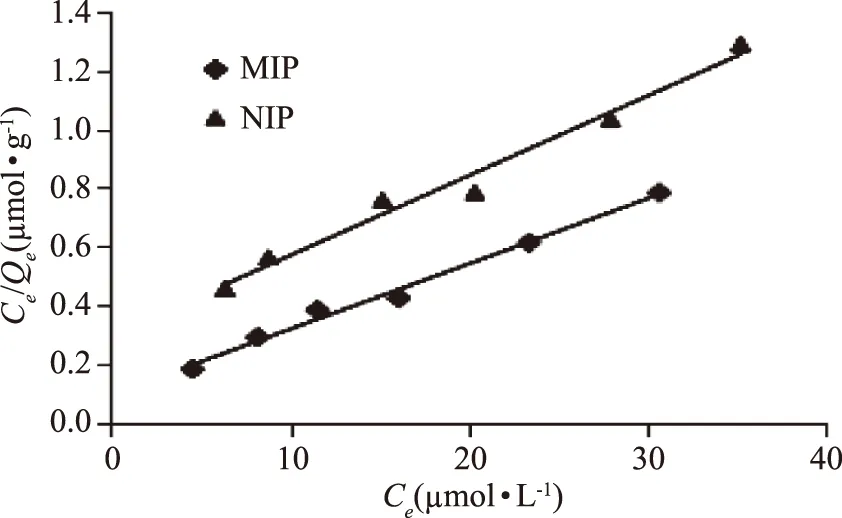
图5 25 ℃时MIPs和NIPs的Langmuir等温吸附回归线Fig.5 Langmuir sorption isotherm of MIPs and NIPs at 25 ℃
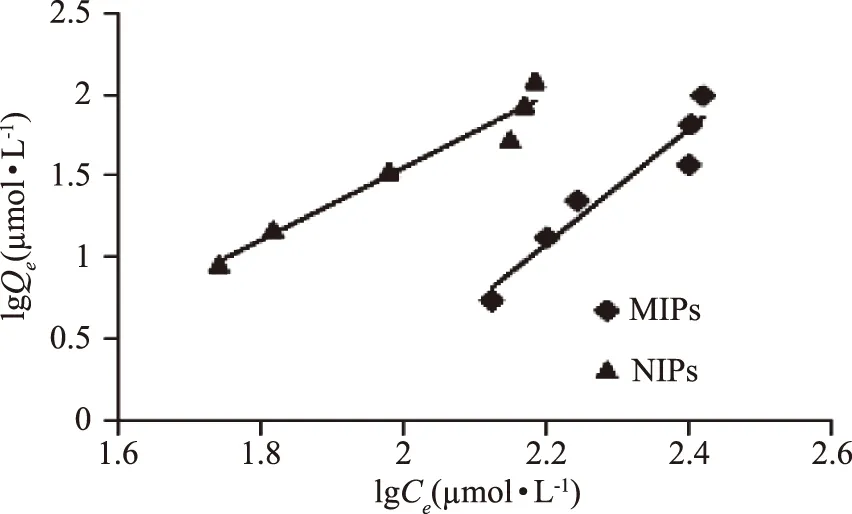
图6 25 ℃时MIPs和NIPs的Fredimlich等温吸附回归线Fig.6 Fredunlich sorption isotherm of MIPs and NIPs at 25 ℃

图7 植酸解吸曲线Fig.7 The desorption curve of phytic acid
2.3.4 选择性吸附 在竞争实验中,MIPs和NIPs对植酸和肌醇的平衡吸附量Qm、和印迹因子IF见表2。植酸在MIPs中的吸附量为21.38 μmol·g-1,高于其在NIPs中的吸附量12.58 μmol·g-1。印迹聚合物对植酸的印迹因子为1.70,而对肌醇的印迹因子为1.46。这是由于MIPs上有植酸洗脱而留下的印迹空穴,因而模板分子植酸能进入其中并很好的保留,但对于肌醇,则无类似高选择性空穴,因而吸附效果不佳。这说明印迹聚合物对模板分子植酸具有特异选择性和识别能力。

表2 植酸MIPs和NIPs对植酸和肌醇的吸附量和选择性选择特性Table 2 Adsorption capacity and selectivity of MIPs and NIPs for PA and MI
2.3.5 重复使用性 由SPSS19.0进行显著性分析,如图8所示,重复次数对吸附量的影响显著。MIPs初次对植酸的吸附量为72.91 μmol·g-1,5次洗脱后,对植酸吸附容量为65.62 μmol·g-1,是第一次吸附容量的90.00%,吸附量下降10.00%。而MIPs的初始质量为0.5 g,5次洗脱后,质量为最初投加量的88.19%,为0.4234 g,质量下降11.81%。这表明植酸分子印迹聚合物具有很好的实用稳定性和重复使用性,在短期内可以重复使用。
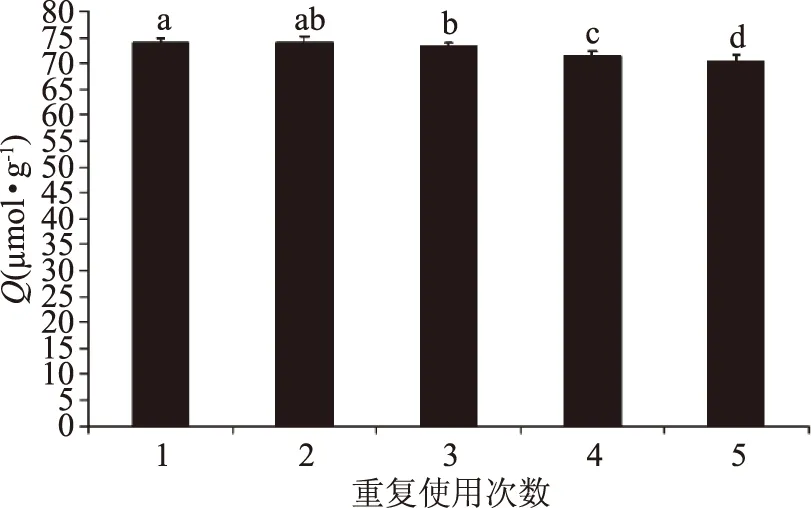
图8 循环使用测试结果 Fig.8 Recycling test results注:不同字母表示差异显著(p<0.05)。
3 结论
本实验采用本体聚合法成功制备出植酸分子印迹聚合物,通过扫描电镜确定了MIPs形貌。通过对其吸附性能的研究,证明分子印迹聚合物对植酸有良好的选择吸附性和解吸能力,短期内能重复利用,可以作为固相萃取材料,运用到植酸的富集、分离纯化以及检测的前处理过程。本体聚合法在制备MIPs过程中,会存在模板分子包埋过深或者无法洗脱的情况,为了更好的提高其吸附与解吸效率,今后的研究可以从制备方法着手,进一步改善实验效果,比如利用硅胶为基质的表面印迹技术,如今已广泛使用。
[1]元晓梅,蒋明蔚,胡正芝.粮谷食品中植酸检测方法的研究[J].食品与发酵工业,1997,23(1):25-31
[2]吴澎,田纪春,王凤成.谷物中植酸及其应用的研究进展[J].中国粮油学报,2009,24(3):137-143.
[3]Zhou JR,Erdman JW. Phytic acid in health and disease[J]. Critical Reviews in Food Science and Nutrition,1995,35(6):495-508.
[4]吴汉民.新保鲜剂植酸一低浓度限量应用的卫生安全性考证[J].食品与发酵工业,1991,6(4):26-32.
[5]Midorikawa K,Murata M,Oikawa S,et al. Protective effect of phytic acid on oxidative DNA damage with reference to cancer chemoprevention[J].Biochem Biophysical Research Communications,2001,288(3):552-557.
[6]王天丰,曹茜茜,撒悦,等. 植酸作为螯合剂去除根管玷污层的效力及其对牙本质化学组成的影响[J].口腔医学研究杂志,2016,32(4):374-378.
[7]Katherine L,EmPson TP,Labuza. Phytic Acid as a Food Antioxidant[J]. Journal of Food Science,1991,56(2):560-563.
[8]Raboy V.Seeds for a better future:Low phytate’grains help to overcome malnutrition and reduce pollution[J].Trends Plant Science,2001,6(10):458-462.
[9]Guttieri MJ,Peterson KM,Souza EJ. Agronomic performance of low phytic acid wheat[J].Crop Science,2006,46(6):487-493.
[10]Ravindran V. Phytate occurance,bio-availability and implications in poultry nutrition[J]. Poutry Avian Biology Reviewws,1995b,6(2):125-134.
[11]Viveros A,Centeno C,Brenes A,et al. Phytase and acid phosphatase activities in plant feedstuffs[J]. Journal of Agricultural & Food Chemistry,2000,48(9):4009-4013.
[12]张瑞.植酸的提取、分离与纯化工艺研究[D].安徽:合肥工业大学,2013.
[13]Vlatakis G,AnderssonL I,Muller R,et al. Drug assay using antibody mimics made by molecular imprinting[J].Nature,1993,361(3):645-647.
[14]李蓉,储大可,高永清,等. 复合分子印迹固相萃取-HPLC-MS/MS法测定植物源性食品中多种农药残留[J]. 分析实验室,2015(8):907-912.
[15]吴洪,赵艳艳,喻应霞,等. 分子印迹壳聚糖膜分离手性苯丙氨酸[J]. 功能高分子学报,2007,19(3):262-266.
[16]李国良,姚伟,韩建光,等. 农药丙溴磷分子印迹聚合物微球的制备与结合性能研究[J].分析测试学报,2009,28(2):207-211.
[17]姚婷,李腾飞,秦玉昌,等. 分子印迹表面等离子共振传感器在食品安全检测中的最新研究进展[J].分析测试学报,2015,34(2):37-244.
[18]唐志民,马新宾.林可霉素分子印迹材料的制备及吸附性能[J]. 中国粉体技术,2016(5):63-67.
[19]Giuseppe C,Manuela C,Ortensia IP. Gastro-intestinal sustained release of phytic acid by molecularly imprinted microparticles[J]. Pharmaceutical Development and Technology,2010,15(5):526-531.
[20]贺湘,高清涌,刘淑卿.红外微量溴化钾压片法及其应用[J]. 化学世界,1980(5):17-19.
[21]任鸿均.植酸、植酸钙和肌醇[J]. 化工科技市场,2003,26(4):25-30.
[22]Giuseppe C,Manuela C,Ortensia IP. Gastro-intestinal sustained release of phytic acid by molecularly imprinted microparticles[J]. Pharmaceutical Development and Technology,2010,15(5):526-531.
[23]赵娜,胡小玲,管萍,等. 乳液聚合法制备红霉素分子印迹聚合物微球及其吸附性能[J]. 物理化学学报,2014,30(1):121-128.
[24]杨挺,吴银良,李存,等. 莱克多巴胺表面分子印迹材料的制备、表征及吸附性能[J]. 中国农业科学,2013,46(6):1256-1262.
[25]雷福厚,赵慷,李小燕,等. 脱氢枞胺分子印迹聚合物的吸附性能研究[J]. 精细化工,2010,27(1):11-15.
Preparationandcharacterizationofphyticacidmolecularlyimprintedpolymeranditsadsorptionperformance
ZHANGNai-pian,WANGCheng-ming*,AOWen-fang,LIKe-chao,BAIJuan
(Huazhong agricultural University,Wuhan Institute of Food Science and Technology,Wuhan 430000,China)
The molecularly imprinted polymer(MIPs)were prepared by bulk polymerization using phytic acid(PA)as template molecule,MAA as functional monomer,N,N′-Ethylenebis(acrylamide)as crosslinker,Ammonium persulphate as initiator. Surface structure of molecularly imprinted polymers was observed by SEM,the chemical structure of MIPs was characterized by FT-IR. MIPs adsorption performance were investigated by dynamic adsorption,static adsorption and selective adsorption experiments. The experimental results showed that the PA MIPs exhibited good adsorption and recognition abilities,with imprinted factors of 1.70,while myo-inositol(MI)was 1.46. The adsorption reaction reached equilibrium after 80 min,and the desorption ratio of ractopamine reached 89.59%. The experimental results showed that MIPs not only have specific recognition selectivity,but also have good desorption property for PA,and the adsorption capacity of phytic acid was 21.38 μmol·g-1. After adsorption-desorption 5 times,MIPs were stable and reusable,the adsorption capacity of phytic acid was 65.62 μmol·g-1,which was 90.00% of the first adsorption capacity and could be cycle used.
phytic acid;molecularly imprinted polymer;characterization;adsorption performance;desorption
2017-03-22
张乃片(1992-),女,在读研究生,研究方向:食品工程,E-mail:zhangnaipian@100tal.com。
*通讯作者:王承明(1964-),博士,教授,研究方向:农产品加工储藏、食品安全、食品化学,E-mail:18971081261@126.com。
TS201.1
:A
:1002-0306(2017)17-0075-05
10.13386/j.issn1002-0306.2017.17.015

