茶叶水提物的抗氧化活性研究
罗思媛,郭红英,2,李清明,2,杨章清
(1.湖南农业大学食品科学与技术学院,湖南 长沙 410128;2.食品科学与生物技术湖南省重点实验室,湖南 长沙 410128)
茶叶水提物的抗氧化活性研究
罗思媛1,郭红英1,2,李清明1,2,杨章清1
(1.湖南农业大学食品科学与技术学院,湖南 长沙 410128;2.食品科学与生物技术湖南省重点实验室,湖南 长沙 410128)
以绿茶银毫、半发酵茶铁观音、全发酵茶普洱为研究对象,将其以1∶150的茶水比用沸水分别冲泡10、15、20、25和30 min,通过测定还原力、DPPH·和·OH的清除能力、螯合金属离子的能力测定,研究3种茶叶水提物(茶汤)进行抗氧化能力。结果表明:在冲泡时间为20 min时,茶汤的抗氧化性能较好。同等条件下,绿茶银毫的茶汤比其他两种的抗氧化能力强。4种化学模型所测得的数据表明,3种茶叶水提物的抗氧化效果为:不发酵茶(银毫)>半发酵茶(铁观音)>发酵茶(普洱)。
茶叶;水提物;抗氧化活性;发酵茶
茶是受人们喜爱的世界范围内的大众饮料,是世界三大饮料(茶、咖啡和可可)之首,也是我国最普及的一种天然饮料,我国用茶作饮料已有数千年的历史[1]。茶中含有许多益于人体健康的有机成分和无机矿质元素,在医疗与保健上有一定功效,大量医疗保健和养生作用在源远流长的传统医学宝库中有所体现,茶及茶叶提取物质对人体健康所产生的功效也已经被新科技从各方面证明[2]。联合国粮农组织(FAO)研究茶与人类健康关系时发现,茶中含有部分有效成分对多种人体常见病有广谱预防作用,包括茶叶中含有的氨基酸、维生素、矿物质、碳水化合物、蛋白质、脂肪、茶多酚等多种营养及活性成分[3]。茶叶中的抗氧化物质如茶多酚在延缓衰老、抑制肿瘤方面有一定作用,因其可有效清除脂类自由基和氧自由基,以预防脂质过氧化[4]。
茶叶为山茶科植物山茶的叶芽,其种类繁多,按制作工艺可分为不发酵的茶、轻度发酵的茶、半发酵的茶、全发酵的茶。一般绿茶属于不发酵的茶,像龙井茶、碧螺春、银毫等;白茶属于轻度发酵茶,像白毫银针、白牡丹等;青茶属于半发酵茶,像铁观音、乌龙茶等;红茶属于全发酵茶,像普洱红茶、小红茶等。试验选择全发酵茶普洱、半发酵茶铁观音、绿茶银毫作为材料,通过不同的冲泡时间,探讨其水提物的抗氧化活性,并对其饮用方式进行有意的探索。
1 材料与方法
1.1 试验材料
1.1.1 原 料全发酵茶普洱、半发酵茶铁观音、绿茶银毫均采购于大型超市。
1.1.2 主要试剂DPPH·(二苯基苦味酰基苯肼自由基,1,1-diphenyl-2-picrylhydrazyl,AR),美国Sigma公司;磷酸氢二钠、磷酸二氢钠、铁氰化钾、三氯乙酸、三氯化铁、七水硫酸亚铁、水杨酸、1,10-菲罗啉、EDTA、双氧水等均为国产分析纯,购于中国医药(集团)上海化学试剂公司。
1.1.3 主要仪器和设备HH-8型数显恒温水浴锅(上海浦东物理光学仪器厂);Cary 100 紫外可见光分光光度计(美国VARIAN公司);TD5A型台式多管架离心机(长沙英泰仪器有限公司);SPECTRA MAX 190酶标仪(Thermo electron corporation)。
1.2 试验方法
1.2.1 制备茶叶水提物用电子分析天平准确称取1 g普洱、铁观音、银毫,分别加入到150 mL沸水中泡茶10、15、20、25、30 min。然后取上清液,待其冷却后放于离心机中,以3 000 r/min转速离心分离10 min。用锥形瓶收集上层清液备用(当天试验须用当天泡的茶)。
1.2.2 茶叶水提物还原能力的测定还原能力是提供电子能力的一种重要的反应指标,而还原能力强的物质因其化学本质为还原剂,将会是良好的电子供体,中断自由基的连锁反应是通过给予氧化自由基、活性氧电子等形式,让自由基形态逐渐稳定,从而达到抗氧化的目的。研究发现还原力与物质的抗氧化活性呈正相关。一般情况下Fe3+被具有较强还原能力的物质还原成Fe2+,还原程度可依据显色反应判断,还原能力越强的物质其反应后的吸光度越大[5-6]。
具体操作:在洁净的试管中加入pH值为6.6、浓度为0.2 mol/L的磷酸钠缓冲液2.5 mL、测试样品2 mL及1%的铁氰化钾1 mL,将该混合液在50℃下水浴20 min后急速冷却,加入10%的三氯乙酸1 mL,以3 000 r/min转速离心10 min,取上层清液加0.1%三氯化铁溶液0.5 mL和蒸馏水2.5 mL,混合均匀,待10 min静置完毕,测定700 nm处其吸光值,全部测定值均取3次平均值。
1.2.3 茶叶水提物对二苯基苦味酰基苯肼自由基(DPPH·)清除能力的测定因为许多自由基化学性质极为活泼、寿命极短,故作为氧化反应的中间体时对操作有较为严格的要求。DPPH·体系是筛选抗氧化剂和自由基清除剂时使用最多的判定手段之一。DPPH·是一种较为稳定的人工合成的大分子自由基,分子结构中有未成对电子,在517 nm处有最大吸收值,其乙醇溶液呈蓝紫色。当其他自由基电子与未成对电子配对后会使DPPH·吸收值下降,且在一定范围内,其所接受的电子数与褪色程度呈定量关系。在与抗自由基活性物质的作用过程中,抗自由基活性物质的活性越强时其吸收值下降越多[7]。
具体操作:配置浓度为2×10-5mol/L的DPPH·乙醇溶液,并在4℃冰箱避光保存备用。临用时将DPPH·、50%乙醇溶液及样品液按照表1进行反应,静置30 min,以50%乙醇溶液为空白溶剂,于DPPH·溶液的最大吸收波长517 nm处测Ao、Ai、Aj所表示的样品的吸光度值。所有试样的测定值均取3次平行试验的平均值。

表1 DPPH·试验加样方案(mL)
样品对DPPH·自由基的清除能力按公式(1)计算:
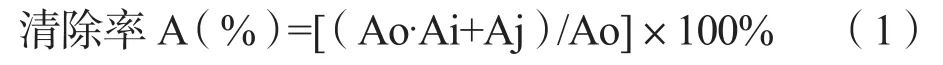
其中,Ao:溶剂与DPPH·混合液的吸光度;Ai:样品与DPPH·反应后的吸光度;Aj:溶剂与样品混合液的吸光度。
1.2.4 茶叶水提物对羟基自由基(·OH)清除率的测定·OH作为一种极强的氧化剂,是机体内活性最强、毒性最大、半衰期最短的氧自由基,凭借其超快的反应速度,生物体内所有的分子基本都能与其发生反应,如使酶和蛋白质变性等。研究样品对·OH的清除作用对研究样品抗氧化性有指导意义,因此创建了许多测定方式,如水杨酸比色法、DMSO荧光法、邻菲罗啉化学发光法、邻二氮菲Fe2+氧化分光光度法等[8]。当中以Fenton反应为借鉴建立出反应体系模型的水杨酸比色法,即Fe2+与H2O2反应生成·OH。·OH存活时间短、反应活性强,若想有效捕捉·OH可利用水杨酸,体系反应后会产生于510 nm处有强吸收的有色产物,如果将带有清除·OH功能的被测物添加进去,便会和水杨酸一同竞争·OH,以降低紫色产物的生成量。在510 nm处采用固定时间反应法以蒸馏水为空白测量吸光度。
具体操作:在试管中按表2依次加入6 mmoL FeSO4·7H2O2、6 mmoL水杨酸、样品,混合摇匀后加入3 mmoL H2O2,然后加入蒸馏水定容至8 mL,摇匀,室温下静置30 min。测Ao、Ai、Aj所表示的吸光度值。每个试样做3个平行试验,取其平均值。
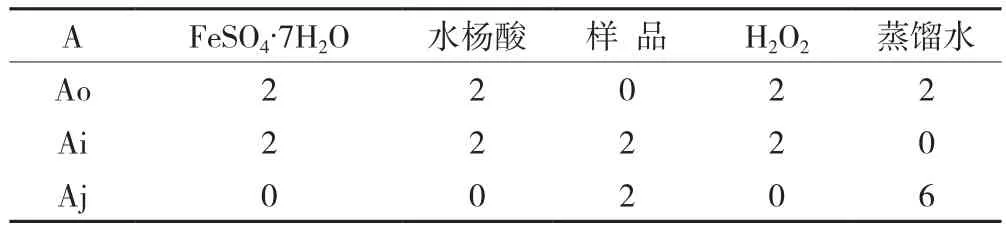
表2 ·OH试验加样方案(mL)
样品对羟基自由基(·OH)的清除能力按公式(2)计算:
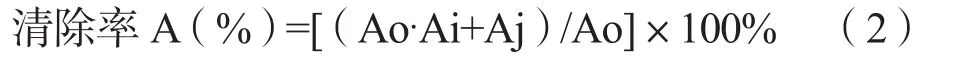
其中,Ao:溶剂与水杨酸混合液的吸光度;Ai:样品与水杨酸、溶剂反应后的吸光度;Aj:样品本身的吸光度。
1.2.5 测定茶叶水提物螯合金属离子能力过渡金属离子与活性氧自由基的产生以及毒性作用等紧密相连,是由于其参与了生物体内大量的氧化过程,以Fe2+在氧化应激过程中的主要表现为例:一是催化Haber Weiss反应促使危害性更大的·OH被O2-生成;二是催化RO·和ROO·由脂质过氧化物均裂产生,此二者均可通过诱发新的脂质过氧化的链式反应而产生毒性醛等;三是催化儿茶酚胺类化合物、巯基化合物的自氧化,促使H2O2和O2-·的生成等[9]。微量的金属离子可诱导油脂的氧化速率提高1036倍,此外,Cu2+可催化低密度脂蛋白LDL氧化。螯合金属离子的间接机制是抗氧化剂清除·OH的主要机理,即使能利用抽氢反应开展,但是·OH一旦在生物体系中产生就会迅速与周围的生物分子发生反应,因此研究抗氧化剂清除自由基的机制时应该着重考察其螯合金属离子的能力[10],此次采用Fe2+螯合试验。
具体操作:取1 mL茶汤,加入2 mL 0.284 8 mmol/L硫酸亚铁溶液,摇至均匀,6 min后加入2 mL 0.854 4 mmol/L邻菲罗啉溶液,振荡混匀,反应20 min后于510 nm处测定吸光度。不加硫酸亚铁茶汤为空白。另以0.05~0.3 mg/mL Na2EDTA标准溶液代替茶汤作标准曲线,得到回归方程y=0.675 9x+0.070 5,相关系数R2=0.999 8。样品的Fe2+螯合能力以mg/mL Na2EDTA计[11]。每份试样重复测定3次。
2 结果与分析
2.1 茶叶水提物的还原能力
绿茶银毫、半发酵茶铁观音、全发酵茶普洱3种茶叶水提物的还原力如图1所示,可见其均具有较强的还原能力。在10~15 min时,增势平缓,说明其中的抗氧化成分正缓慢从茶叶中溶出;在15~20 min,增幅变大,说明茶叶中的抗氧化物质溶出速度和溶出量大幅度增加;25 min后还原力有所下降,原因可能是随着时间的延长,一些抗氧化物质结构上发生了改变,导致活性下降。3种茶叶中绿茶银毫的水提物(同等固液比条件下做了两倍稀释)还原能力最强,铁观音次之,普洱最弱。茶的抗氧化功效主要归功于茶叶中的茶多酚,主要因为其结构中所具有的多个酚羟基,易提供氢离子而被氧化成醌类。茶多酚可以作用于与自由基产生有关的酶,直接清除螯合金属离子、自由基,抑制自由基的产生等。茶的加工工艺会影响其茶多酚含量,如在加工过程中,绿茶和半发酵茶需要经过高温杀青,该过程将使鲜叶中的多酚氧化酶钝化甚至失活,以阻止多酚类物质进一步氧化而使茶多酚得以保留,而发酵茶在漫长的温、湿环境下其多酚类物质经过酶促氧化和非酶促氧化,形成了更为复杂的化合物[12]。
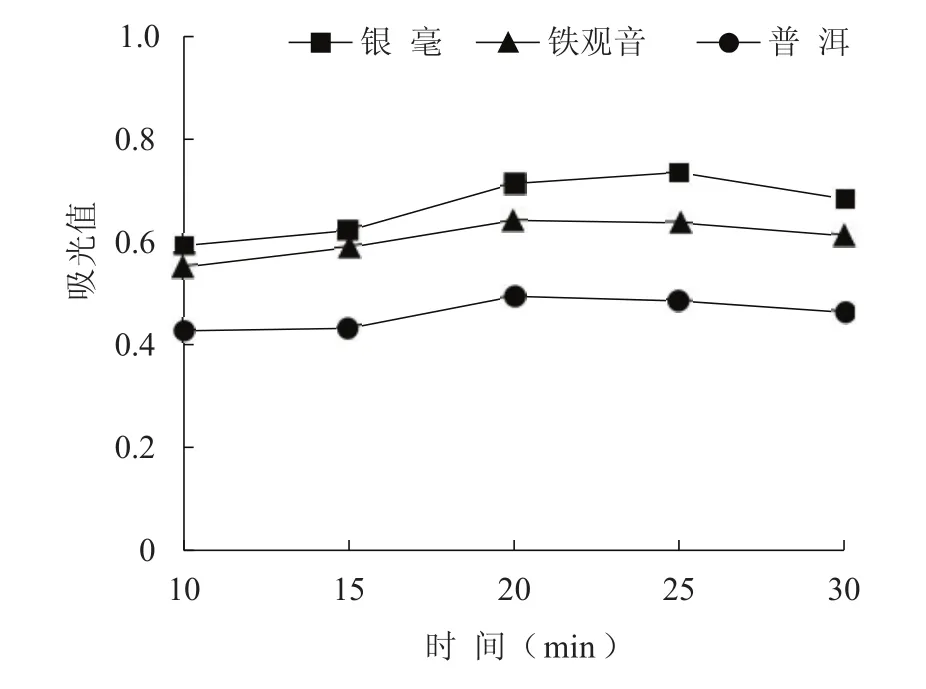
图1茶叶水提物的还原力
2.2 茶叶水提物对DPPH·清除能力
DPPH·清除能力的测定,属于评价自由基清除剂和抗氧化剂的功能活性时使用频率最高的评价方法之一。3种茶叶水提物对DPPH·的清除能力如图2所示,可见3种茶叶水提物中,泡茶时间为20 min时出现最高清除率,说明此时三者水提物中清除自由基活性物质含量最高,对DPPH·清除能力均为最强。其中银毫对DPPH·的清除率最高,最大清除率可达70%,比铁观音最大清除率高16%,比普洱的高一倍多。
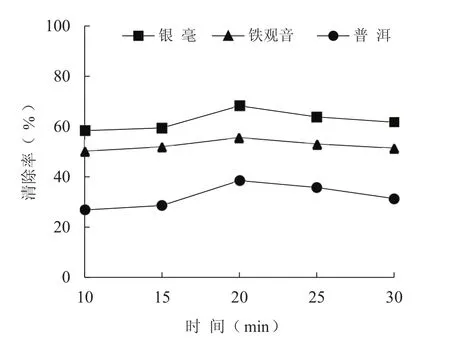
图2茶叶水提物对DPPH·自由基的清除率
2.3 茶叶水提物对·OH的清除能力
·OH是机体内半衰期最短、活性最强、破坏性最大的自由基,因此研究样品对·OH的清除能力对抗氧化性研究具有重要意义。3种茶叶水提物对·OH的清除效果如图3所示,可见3种茶叶水提物均对·OH均有不同程度的清除作用,且在0~20 min范围内,茶叶水提物对·OH的清除能力随着冲泡时间的增长而增强;20 min后,清除作用则有所减弱。3种茶叶中银毫的水提物对·OH的清除能力最大为58%,约比铁观音的高9%,比普洱高19%。
2.4 茶叶水提物螯合金属离子的能力
试验选用Fe2+体系,考察了3种茶叶水提物对金属离子的螯合能力(样品对Fe2+螯合能力以mg/mL Na2EDTA计),结果如图4所示,可见3种茶叶水提物对Fe2+的螯合能力强弱程度为:银毫>铁观音>普洱。3种茶叶水提物对Fe2+的螯合能力与泡茶的时间长短也有一定的关系,随着泡茶时间的增加,对Fe2+的螯合能力增强,在20 min时达到最大值,稍后变化趋于平缓。银毫茶叶水提物的最大螯合能力与0.302 mg/mL Na2EDTA相当,铁观音的与0.271 mg/mL Na2EDTA相当,普洱的相当于0.178 mg/mL Na2EDTA。
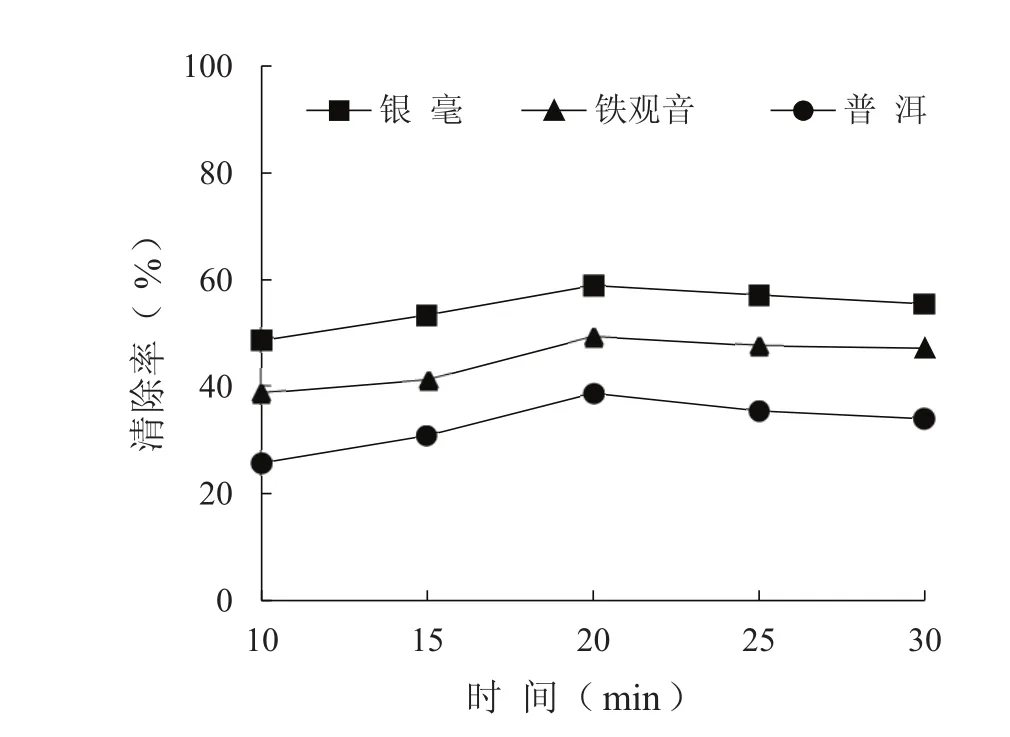
图3茶叶水提物对·OH的清除能力

图4茶叶水提物螯合金属离子的能力
3 结论与讨论
将银毫、铁观音和普洱三种茶叶以1∶150的茶水比进行泡茶,通过控制泡茶时间的长短来研究3种茶叶水提物的抗氧化活性,发现在10~20 min时,茶叶水提物的抗氧化活性都在增强,除了银毫与普洱在泡茶25 min时测得的还原能力值最大外,其他都在20 min时达到最大值,说明这时茶叶中的抗氧化活性成分基本被水所浸提,冲泡20 min后再饮用比较好。通过4种化学模型所测得的数据表明,3种茶提物的抗氧化效果为不发酵茶(银毫)>半发酵茶(铁观音)>发酵茶(普洱),这与茶叶的加工工艺有关:相对而言,作为全发酵茶的普洱,其茶多酚保留量最少;而作为半发酵茶的铁观音,在酶促氧化等反应的影响下,部分茶多酚遭受损失,最终保留量较少;作为不发酵茶的银毫保留的多酚类物质最多。
[1] 周金伟,陈 雪,易有金,等. 不同类型茶叶体外抗氧化能力的比较分析[J]. 中国食品学报,2014,14(8):262-269.
[2] 赵 航,盛婧雪,李全顺,等. 3种茶提取物对MCF-7细胞增殖、凋亡的影响及其与蛋白激酶B的相关性[J]. 中国生物制品学杂志,2011,24(1):30-33.
[3] 金 亮,李小白,华 侨,等. 不同种类茶叶抗氧化活性及茶汤颜色参数比较[J]. 中国食品学报,2016,16(2):242-250.
[4] 高玉萍,唐德松,龚淑英. 茶提取物抗氧化活性与茶多酚、儿茶素关系探究[J]. 中国食品学报,2013,13(6):40-47.
[5] Karolina A W,Anna O,Tomasz O,et al. The influence of common free radicals and antioxidants on development of Alzheimer’s Disease[J]. Biomedicine & Pharmacotherapy,2016,78(1):39-49.
[6] Chen Y,Wang M F,Rosen R T,et al. 2,2-Dipheny1-1-picrylh ydrazy lradical-scavengingative components from polygonum multiflorum Thunb[J]. Joumal of Agricultural Food Chemistry,1999,(47):226-228.
[7] 高 强,吴振莹,方 玲,等. 青檀内生真菌球毛壳的抗氧化活性[J].江苏农业科学,2013,41(5):293-296.
[8] Qixiao Z,Ruijie Y,Leilei Y et al. Screening of lactic acid bacteria with potential protective effects against cadmium toxicity[J]. Food Control,2015,(54):23-30.
[9] 田宝玉,林丽萍,黄 薇,等. 低值水产品蛋白资源酶解产物的抗氧化性分析和评价[J].中国农学通报,2012,28(26):110-114.
[10] Patrizia D,Aquila,Giuseppina Rose et al. SIRT3 gene expression: a link between inherited mitochondrial DNA variants and oxidative stress[J]. Gene,2012,497(2):323-329.
[11] 郭红英. 麦胚蛋白酶解物的制备及其抗氧化功能研究[D]. 镇江:江苏大学,2009.
[12] 东 方,揭国良,何普明. 不同发酵程度茶叶的体内与体外抗氧化功能比较[J]. 中国茶叶加工,2015,(4):40-45.
(责任编辑:夏亚男)
Antioxidant Activity of Aqueous Extract of Tea
LUO Si-yuan1,GUO Hong-ying1,2,LI Qing-ming1,2,YANG Zhang-qing1
(1. College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, PRC; 2. Hunan Provincial Key Laboratory of Food Science and Biotechnology, Changsha 410128, PRC)
Taking three kinds of tea, Yinhao, Tie Guanyin, Pu’er tea as the materials, added 150 times boiling water and soaked for 10 min, 15, 20, 2 and 30 min, through four chemical model (recucing power, scavenging activity against DPPH·and·OH and chelating activity) to investigate the antioxidant capacity of three kinds of tea aqueous extracts. The results showed that the antioxidant capacity of aqueous extract from not fermented tea Yinhao was the strongest and when the tea was soaked for 20 min, its aqueous extract had the best antioxidant capacity. According to the data obtained from four chemical models, the antioxidation effect of 3 kinds of tea water extract was: non-fermented tea (Yinhao) > half fermentation tea (Tie Guanyin) > fermentation tea (Pu’er).
tea; aqueous extract; antioxidant activity; fermented tea
TS272
:A
:1006-060X(2017)08-0081-04
10.16498/j.cnki.hnnykx.2017.008.022
2017-06-19
湖南农业大学科学基金项目(11YJ17)
罗思媛(1996-),女,湖南邵阳市人,本科,主要从事农副产品加工技术的研究。
郭红英

