脑梗死静脉溶栓后继发脑出血发生现状及高危因素分析
万 婷 许倩瑜 许遵宝
·护理论著·
脑梗死静脉溶栓后继发脑出血发生现状及高危因素分析
万 婷 许倩瑜 许遵宝
目的:探讨脑梗死静脉溶栓后继发脑出血发生现状及高危因素。方法:选取2015年2月~2017年2月本地区脑梗死静脉溶栓患者528例,了解纳入脑梗死静脉溶栓患者一般资料、临床表现、实验室指标、治疗方法、辅助检查。引入二分类Logistic回归模型分析脑梗死静脉溶栓后继发脑出血高危因素,研究其相关性。结果:脑梗死静脉溶栓后患者继发脑出血34例,转化率6.44%。糖尿病病史、发病至溶栓时间>3 h、溶栓前NIHSS评分≥15分、溶栓前血糖>7.8 mmol/L、溶栓后收缩压>140 mmHg和大面积脑梗死者继发脑出血转化率与同组比较,差异有统计学意义(P<0.05)。以患者静脉溶栓后继发脑出血作为因变量,糖尿病病史、发病至溶栓时间>3 h、溶栓前NIHSS评分≥15分、溶栓前血糖>7.8 mmol/L、溶栓后收缩压>140 mmHg和大面积脑梗死6项作为自变量,引入二分类Logistic回归模型中分析,结果显示上述指标均是脑梗死静脉溶栓后继发脑出血的独立风险因素。结论:脑梗死静脉溶栓后继发脑出血现状不容乐观,存在一定风险,而积极掌握和早期识别脑出血转化高危因素,有助于重点防控,从而降低脑梗死静脉溶栓后继发脑出血率、提高溶栓质量,促进患者早日康复。
脑梗死;静脉溶栓;脑出血;高危因素doi:10.3969/j.issn.1672-9676.2017.17.001
脑梗死作为脑血管意外之一,是一种突然发病、以局灶性神经功能丧失为主要临床特征的急性脑血管疾病,具有高发病率、高病死率和高致残率等特点,对患者生活质量及生命安全构成极大威胁[1]。据文献资料显示,目前我国脑梗死每年患病率150/10万,病死率高达120/10万,因此备受关注和研究[2]。自尿激酶、重组组织型纤溶酶原激活剂以及阿替普酶等溶栓药物问世以及临床应用以来,脑梗死病死率和致残率明显下降,但药物溶栓所致的出血问题也不断出现,极大影响了溶栓质量,甚至加重病情,不利于患者日后康复[3]。目前虽然对脑梗死静脉溶栓后继发脑出血研究报道甚多,但结果存在一定差异,使得脑梗死静脉溶栓后继发脑出血现状多种多样,且因研究方法、研究标准、人群不同而致高危因素不同,不利于本地区脑梗死静脉溶栓治疗工作的开展[4-5]。本研究通过加强地区性脑梗死静脉溶栓后继发脑出血现状的调查以及筛查其高危因素,旨在掌握本地区脑梗死静脉溶栓后继发脑出血相关信息,根据其高危因素,做好防控工作,从而提高溶栓效果,降低脑梗死出血转化率,促进患者早日康复。
1 资料与方法
1.1 一般资料 选取2015年2月~2017年2月本地区脑梗死静脉溶栓者528例,纳入标准:(1)符合《中国急性缺血性卒中诊治指南》[6]且经头颅CT或MRI明确诊断。(2)发病6 h以内。(3)肢体肌力≤3级。(4)神经功能缺损评分(NIHSS评分)≥4分。(5)病历资料完整。(6)签署研究知情同意书,自愿参加。排除标准:(1)精神疾病、语言不畅。(2)溶栓禁忌证。(3)既往存在颅内出血、脑动脉瘤以及伴有癫痫。(4)首次头颅CT或MRI检查即存在出血。(5)腔隙性脑梗死。(6)心肺肝肾功能严重异常以及脑部存在其他疾病。(7)中途因死亡、转院等原因退出本研究。其中男322例,女206例。年龄39~68岁。病程1~4 h。梗死部位:大脑半球387例,小脑96例,其他部位45例。NIHSS评分7~22分。其中大面积脑梗死179例。基础疾病:高血压266例,糖尿病51例,冠心病132例,高脂血症79例,吸烟史101例,饮酒史54例。脑梗死静脉溶栓后继发脑出血者34例,转化率6.44%。本研究符合医学伦理要求,经医学伦理委员会同意。
1.2 方法 528例脑梗死静脉溶栓治疗采用重组组织纤溶酶原激活剂(rt-PA),按照0.9 mg/kg剂量给药,最高不超过90 mg,总剂量的10%静脉推注、另外90%于60 min内静脉持续滴入,24 h后复查头颅CT未出现出血现象后,采用抗血小板聚集、抗凝干预且结合控制血压、调节血糖和血脂等对症处理及一般支持治疗。或采用尿激酶进行溶栓治疗,剂量100~150万U加入100 ml生理盐水,于30 min内静脉滴入。
1.3 观察指标 观察和记录528例脑梗死静脉溶栓患者一般资料,包括:(1)性别、年龄、病程、吸烟史、饮酒史、高血压病史、糖尿病史、冠心病史等。(2)临床表现。入院时血压、血糖、心率、意识、NIHSS评分等。(3)实验室指标。入院时红细胞计数、白细胞计数、血小板计数、血肌酐、血总胆固醇、甘油三酯、凝血酶原时间、国际标准化比值、纤维蛋白原定量、活化部分凝血活酶时间等。(3)治疗方法。溶栓治疗时间窗、溶栓药物及其剂量、抗凝治疗时间窗及药物剂量、抗血小板聚集治疗药物及其剂量。(4)辅助检查。头颅CT/MRI检查结果,例如梗死部位、面积大小、涉及范围、有无出血。
1.4 评价标准 参考《中国急性缺血性卒中诊治指南》[6]评价脑梗死患者静脉溶栓后出现继发脑出血情况,包括出血性脑梗死1型:梗死灶边缘小斑点状出血。出血性梗死2型:梗死区域内融合斑点状出血、无明显占位效应。脑实质内血肿1型:血肿体积≤30%梗死体积且伴轻微占位效应。脑实质血肿2型:血肿体积>30%梗死体积且伴有明显占位效应,或梗死灶外出血。
1.5 统计学处理 采用SPSS 16.0统计学软件,计数资料比较采用χ2检验,多因素分析中因素作为自变量采用多元Logistic逐步回归分析。检验水准α=0.05。
2 结 果
2.1 34例脑梗死患者静脉溶栓后继发脑出血现状分布及比较(表1)
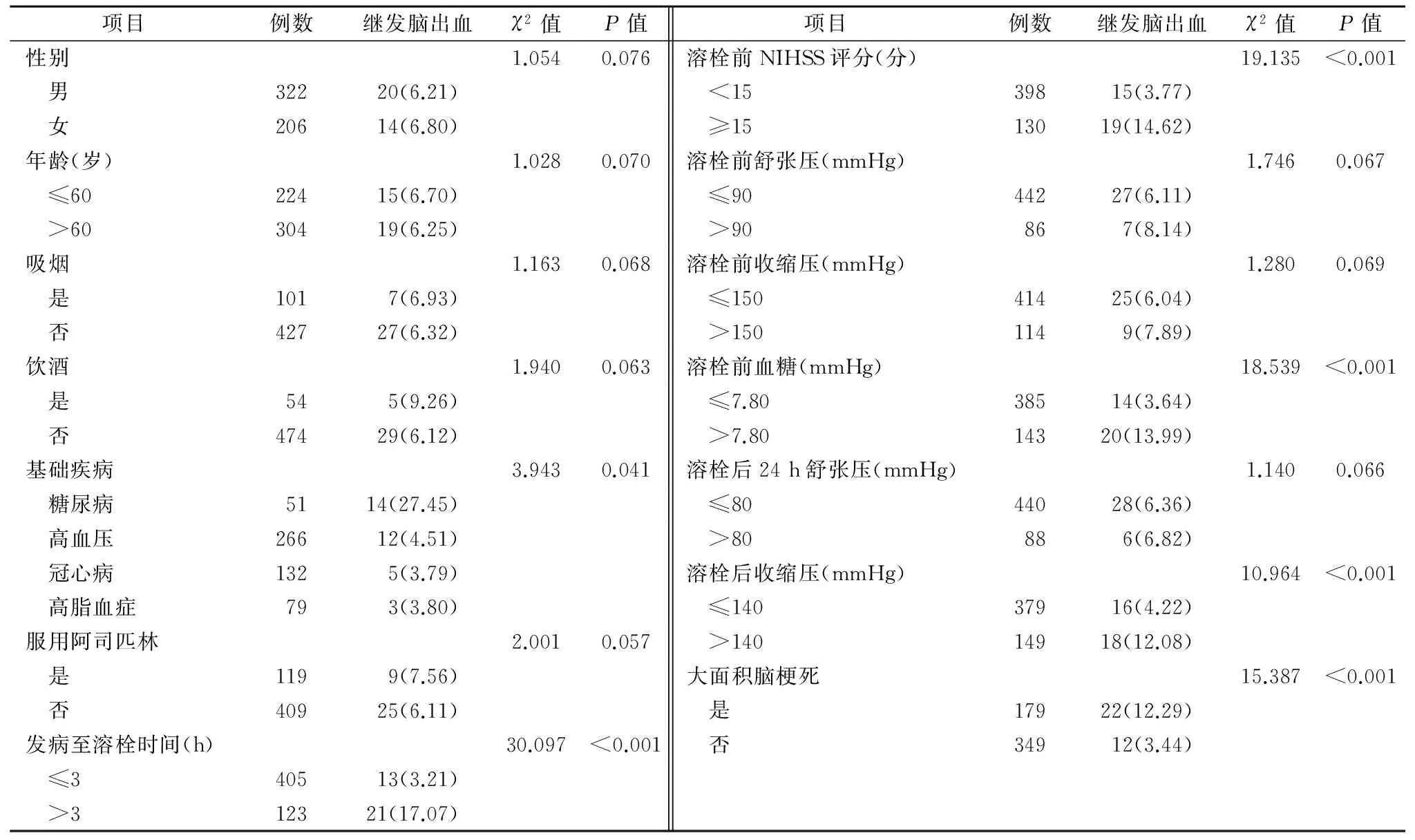
表1 34例脑梗死患者静脉溶栓后继发脑出血现状分布及比较 例(%)
2.2 脑梗死静脉溶栓后继发脑出血相关因素赋值表(表2)

表2 脑梗死静脉溶栓后继发脑出血相关因素赋值表
2.3 34例脑梗死患者静脉溶栓后继发脑出血多因素logistic回归分析 以患者静脉溶栓后继发脑出血作为因变量,糖尿病病史、发病至溶栓时间>3 h、溶栓前NIHSS评分≥5分、溶栓前血糖>7.8 mmol/L、溶栓后收缩压>140 mmHg和大面积脑梗死6项作为自变量,引入二分类Logistic回归模型中分析,筛查出上述指标均是脑梗死静脉溶栓后继发脑出血的高危风险因素。见表3。
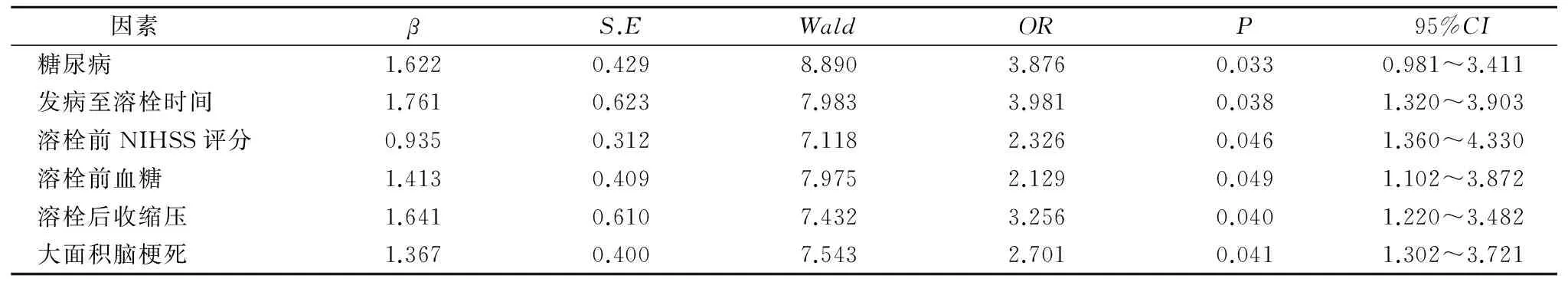
表3 34例脑梗死静脉溶栓后继发脑出血者多因素logistic回归分析
3 讨 论
急性脑梗死作为一种因各种原因所致的局部脑组织血液供应中断而引起的缺血性坏死,可对患者局部神经功能造成明显损伤且不可逆[7-8]。但研究显示介于脑梗死中心坏死区域与正常脑组织间存在一个缺血半暗带,而该区域神经细胞具有一定生存能力且呈可逆性,所以及时恢复相应区域血流灌注,有利于挽救缺血半暗带神经细胞,促使其功能恢复,从而防止进展性脑梗死发生[9-10]。因此,早期溶栓治疗作为一种能使阻塞血管再通、恢复脑血流灌注的方法,有助于改善和减轻因局部脑缺血所致的神经功能损伤,显著改善患者预后,所以被临床广泛使用。目前关于脑梗死溶栓通常采取静脉溶栓,药物以尿激酶、重组组织型纤溶酶原激活剂为代表且其效果得以肯定,但脑梗死静脉溶栓后继发的脑出血问题也日益受到关注和重视,包括溶栓治疗本身、接受溶栓时间以及溶栓药物剂量等[11-12]。因此,加强脑梗死静脉溶栓后继发脑出血现状调查及高危因素筛查,有助于保证用药安全、减轻神经细胞损伤等。本研究结果显示,随机抽取本地区脑梗死静脉溶栓患者528例,其中溶栓后继发脑出血者34例,出血转化率达6.44%,与部分文献报道的6.50%基本一致[13]。且本地区静脉溶栓继发脑出血者以存在糖尿病史、发病至溶栓时间>3 h、溶栓前NIHSS评分≥15分、溶栓前血糖>7.80 mmol/L、溶栓后收缩压>140 mmHg以及存在大面积脑梗死者溶栓后继发脑出血转化率明显升高,差异有统计学意义(P<0.05)。另外,以患者静脉溶栓后继发脑出血作为因变量,将糖尿病、发病至溶栓时间>3 h、溶栓前NIHSS评分≥15分、溶栓前血糖>7.8 mmol/L、溶栓后收缩压>140 mmHg和大面积脑梗死6项作为自变量,引入二分类Logistic回归模型,结果显示糖尿病、发病至溶栓时间>3 h、溶栓前NIHSS评分≥15分、溶栓前血糖>7.8 mmol/L、溶栓后收缩压>140 mmHg和大面积脑梗死是脑梗死静脉溶栓后继发脑出血的独立风险因素。分析其原因,可能与以下机制有关:(1)存在糖尿病史以及溶栓前高血糖可加重动脉壁缺氧与营养不良,造成糖原无氧酵解加速而易产生大量酸性代谢产物,从而加剧脑组织缺血性水肿、局部血管麻痹扩张、血管内皮损伤等[14],进而增加溶栓后血液外渗,引起出血转化,所以对于此类患者应于溶栓前积极控制血糖水平,减少出血转化机率。(2)发病至溶栓时间越长所致的梗死面积越大;NIHSS评分越高,尤其是大面积脑梗死后,通常会伴有脑水肿,造成周围脑组织受压明显,易引起血液瘀滞、局部pH值下降,长时间缺氧导致毛细血管通透性增加,缺血坏死和内皮细胞损伤严重,而新的毛细血管尚未发育健全,溶栓后可引起压迫损伤的血管重建灌注,在正常血流压力冲击下易引起血液外渗或血管破裂而转化为脑出血[15]。(3)溶栓后收缩压升高可增加血管内皮受损程度,引起血管内皮玻璃样改变,从而造成血管通透性增加;静脉溶栓后血流灌注,在血流压力作用下,导致血液外渗或血管破裂而转化为脑出血。
总而言之,脑梗死静脉溶栓后继发脑出血现状不容乐观,存在一定风险,而积极掌握和早期识别脑出血转化高危因素,有助于重点防控,从而降低脑梗死静脉溶栓后继发脑出血率、提高溶栓质量,促进患者早日康复。
[1] 李 丽.脑梗死静脉溶栓治疗后出血性转化及其预后的危险因素分析[J].中西医结合心脑血管病杂志,2015,13(6):837-839.
[2] Schmitz ML,Simonsen CZ,Hundborg H,et al.Acute ischemic stroke and long-term outcome after thrombolysis:nationwide propensity score-matched follow-up study[J].Stroke,2014,45(10):3070-3072.
[3] Shirakawa M,Yoshimura S,Yamada K,et al.Endovascular treatment for acute ischemic stroke:consideration from recent randomized trials[J].Interventional neurology,2015,3(4):115-121.
[4] 王健楠,南光贤.脑梗死出血性转化的相关因素[J].中国老年学杂志,2015,35(20):5976-5978.
[5] 李 丽.脑梗死静脉溶栓治疗后出血性转化及其预后的危险因素分析[J].中西医结合心脑血管病杂志,2015,13(6):837-839.
[6] 陈祖芝,梅文丽,任志霞,等.急性脑梗死静脉溶栓后症状性脑出血的危险因素研究进展[J].中国实用神经疾病杂志,2017,20(2):119-121.
[7] Song D,Cho AH.Previous and recent evidence of endovascular therapy in acute ischemic stroke[J].Neurointervention,2015,10(2):51-59.
[8] 田 洪,刘 磊,郝 磊,等.急性脑梗死后出血性转化 48 例临床特点分析[J].重庆医学,2015,44(2):183-185.
[9] 吴 军,福 婷.急性脑梗死患者尿激酶静脉溶栓治疗后脑出血性转化的相关因素分析[J].现代中西医结合杂志,2016,25(25):2758-2864.
[10]Bejot Y,Daubail B,Giroud M.Epidemiology of stroke and transient ischemic attacks:Current knowledge and perspectives[J].Revue Neurologique,2016,172(1):59-68.
[11]秦 琳,周其达,邹锡良,等.血压变异对急性脑梗死静脉溶栓患者出血转化的影响[J].中华临床医师杂志,2013,7(12):5603-5605.
[12]Berkhemer OA,Fransen PS,Beumer D,et al.A randomized trial of intraarterial treatment for acute ischemic storke[J].The New England Journal of Medicine,2015,372(1):11-20.
[13]Goyal M,Demchuk AM,Menon BK,et al.Randomized assessment of rapid endovascular treatment of ischemic stoke[J].The New England Journal of Medicine,2015,372(11):1019-1030.
[14]Gattringer T,Enzinger C,Fischer R,et al.IV thrombolysis in patients with ischemic stoke and alcohol abuse[J].Neurology,2015,85(180):1592-1597.
[15]朱润秀,袁 军,李 攀,等.急性脑梗死静脉溶栓后脑出血转化的相关因素分析[J].北京医学,2016,38(5):429-432.
(本文编辑 崔兰英)
Analysisoncurrentstatusandhighriskfactorsofsecondarycerebralhemorrhageaftercerebralinfarctionintravenousthrombolysis
WANTing,XUQian-yu,XUZun-bao
(Panyu District Central Hospital, Guangzhou 511400)
Objective:To discuss the current status and high risk factors of secondary cerebral hemorrhage after cerebral infarction intravenous thrombolysis.Methods:Selected 528 patients with cerebral infarction intravenous thrombolysis in our region from February 2015 to February 2017 to understand the general data, clinical performance, laboratory indicators, treatment method, auxiliary examination of patients included in the cerebral infarction intravenous thrombolysis. Dichotomy Logistic regression model was introduced to analyze the high risk factors of secondary cerebral hemorrhage after cerebral infarction intravenous thrombolysis, and their correlation was researched.Results:There were 34 having secondary cerebral hemorrhage after cerebral infarction intravenous thrombolysis, with a conversion rate of 6.44%. Through comparison in the same group in history of diabetics, time from onset to thrombolysis>3h, score of NIHSS ≥15 before thrombolysis, blood glucose before thrombolysis >7.8 mmol/L, systolic pressure after thrombolysis >140 mmHg and secondary cerebral hemorrhage conversion rate of patients with large area of cerebral infarction, the difference was statistically significant (P<0.05). The patients' secondary cerebral hemorrhage after intravenous thrombolysis as the dependent variable, and history of diabetics, time from onset to thrombolysis>3 h, score of NIHSS ≥15 before thrombolysis, blood glucose before thrombolysis >7.8 mmol/L, systolic pressure after thrombolysis >140 mmHg and large area of cerebral infarction as the independent variables were introduced in the Dichotomy Logistic regression model for analysis, and the result showed that all indicators above were the independent risk factors of secondary cerebral hemorrhage after cerebral infarction intravenous thrombolysis.Conclusion:The current status of secondary cerebral hemorrhage after cerebral infarction intravenous thrombolysis is far from being optimistic, with certain risks, while mastering the high risk factors of cerebral hemorrhage conversion actively and identifying them early could help the key prevention and control, so as to reduce the rate of secondary cerebral hemorrhage after cerebral infarction intravenous thrombolysis, improve the thrombolysis quality and promote the patients’ early rehabilitation.
Cerebral infarction;Intravenous thrombolysis;Cerebral hemorrhage;High risk factors
511400 广州市 广州市番禺区中心医院神经内科
万婷:女,本科,护师
2017-05-20)

