小尾寒羊与新吉细毛羊羊毛及毛囊性状比较研究
张立春,孙福亮,金海国,曹 阳,魏 天,朴庆林,张明新
(1.吉林省农业科学院畜牧分院,吉林公主岭 136100;2.延边大学农学院,吉林延吉 130021)
小尾寒羊与新吉细毛羊羊毛及毛囊性状比较研究
张立春1,孙福亮2,金海国1,曹 阳1,魏 天1,朴庆林1,张明新1
(1.吉林省农业科学院畜牧分院,吉林公主岭 136100;2.延边大学农学院,吉林延吉 130021)
为进一步验证小尾寒羊与新吉细毛羊毛用性状与毛囊性状差异。本研究选择9月龄小尾寒羊与新吉细毛羊母羊各8只,在相同饲养环境下测定毛用性状及毛囊性状并分析两者间的差异,最后用定量PCR方法检测不同月份2个品种绵羊毛囊周期分子的表达变化趋势。结果表明:小尾寒羊在主要毛用性状,包括产毛量(GFW)、毛细度(FD)、拉伸长度(SL)、卷曲度及油脂率等大部分指标均极显著低于新吉细毛羊(P<0.01);组织切片法测定小尾寒羊与新吉细毛羊毛囊制表显示,小尾寒羊毛囊密度、S/P值等极显著低于新吉细毛羊(P<0.01),但在皮肤厚度、初级毛囊、次级毛囊毛乳头直径等显著高于新吉细毛羊;毛囊周期标记分子定量PCR显示,不同季节小尾寒羊与新吉细毛羊LEF1和TGF-β1基因总体变化趋势相同,但小尾寒羊变化更为剧烈,说明气候等外界因素对小尾寒羊毛囊周期影响大于新吉细毛羊。本研究证明小尾寒羊与新吉细毛羊的毛用性状、毛囊性状存在极显著差异,TGF-β1为进一步探讨小尾寒羊与新吉细毛羊毛用性状表型差异分子遗传基础研究奠定基础。
新吉细毛羊;小尾寒羊;羊毛性状;毛囊性状
小尾寒羊广泛分布于我国北方地区,以其生长速度快、产羔率高而闻名,被广大养殖户所喜爱,是北方地区优势品种。亦有研究机构或养殖企业将小尾寒羊与当地绵羊杂交以提高杂交绵羊的产羔率,改良绵羊产羔率的同时也带来杂交绵羊毛用性状和肉质性状明显退化的趋势[1]。其原因在于小尾寒羊毛属于典型的两型毛,同时品种改良过程中从未将毛用性状提高作为主要育种目标,致使小尾寒羊毛用性状几十年来未有明显提高[2]。新吉细毛羊是吉林省农业科学院与新疆畜牧科学院牵头于20世纪80年代育成的细毛羊品种[3],21世纪以来相关育种机构一致致力于新吉细毛羊毛用性状选育提高工作,超细型新吉细毛羊品系及其他相关超细型品系已通过国家品种鉴定委员会通过,于2014年正式命名为苏博美丽奴羊[4]。苏博美丽奴羊毛用性能各项指标极为出色,成年雄性羊产毛量大于5 kg,雌性成年羊大于2.5 kg,毛长不低于8 cm,毛细度小于19 μm[5]。尽管小尾寒羊与新吉细毛羊在毛用性状上存在差异被人们普遍接受,但目前尚无直接比较2个品种羊毛用性状差异的报道。更为重要的是小尾寒羊与新吉细毛羊毛用性状表型差异为探索毛囊形成发育与毛用性状遗传基因研究提供理想动物模型。为进一步验证小尾寒羊与新吉细毛羊毛用性状及毛囊性状的差异性,本实验对2个品种羊进行了系统研究,进一步确证了小尾寒羊与新吉细毛羊表型差异的显著性,为进一步研究毛用性状遗传基础奠定基础。
1 材料与方法
1.1 实验动物与样品采集 本实验动物为9个月龄雌性新吉细毛羊和小尾寒羊母羊各8只,其中新吉细毛羊为吉林省农业科学院畜牧科学分院新近选育的超细型新品系,小尾寒羊为市售纯种小尾寒羊。实验周期为上年9月至当年9月。羊毛性状测定样品采集自6月份剪毛季节,毛囊性状测定皮肤组织样品采集自上年10月,采集部位为肩胛后皮肤。毛囊周期测定样品选择每2个月采集肩甲后皮肤样品,浸入RNAlater液中,-80℃保存。
1.2 主要试剂 RNAlater购置于QIAGEN公司、Trizol购自于Invitrogen公司;pMD18-T 载体,RNasefreeDNaseI,Agarose Gel DNA Purification Kit及ExTaq酶系统均购自大连宝生物公司;定量PCR试剂Light cycler 480 SYBR Green I master购自于罗氏公司。
1.3 羊毛性状及毛囊性状测定 羊毛性状参照传统方法进行,主要测定指标包括产毛量、净毛率、毛细度、拉伸长度、卷曲度和油脂率。毛囊性状主要采用组织切片,HE染色法进行。样品采集后经4%多聚甲醛固定、脱水、浸蜡、包埋,分别选择延毛囊方向横切与纵切,最后经HE染色,具有刻度显微镜观察测量,记录毛囊各组织结构的测量数据,毛囊性状测定指标主要包括皮肤厚度、毛囊密度、毛囊直径(皮脂腺部位)、毛乳头直径、次级毛囊与初级毛囊比(S/P值)。2个品种差异比较采用两独立样本t检验。
1.4 RNA提取与引物设计 毛囊周期QRT-PCR首先采用液氮研磨,Trizol法提取总RNA。cDNA合成前总RNA用RNasefreeDNaseI处理确保不存在DNA污染,cDNA合成反应参照PrimeScript反转录试剂盒合成一链cDNA。目标基因定量PCR引物设计采用Oligo 7.0软件。以β-actin基因作为内参引物,具体引物信息参见表1。
1.5 毛囊周期QRT-PCR检测 定量PCR采用LightCycle 480 II定量PCR仪。反应为20 μL体系:ddH2O为8.6 μL,cDNA 模板稀释10倍后添加1 μL,Lightcycler 480 SYBR Green I master 10 μL,浓度为10 μmol/L的正、反引物各0.2 μL。循环条件:95℃变性15 min,40个循环,条件为94℃ 15 s,62℃ 30 s,扩增结束后进行产物熔解曲线分析。每个品种检测3个个体,每个样品重复进行3次。检测结果利用2-△△Ct法进行数据分析并绘制柱形图。2个品种间皮肤组织基因表达差异比较采用独立样本t检验进行。
2 实验结果
2.1 小尾寒羊与新吉细毛羊毛用性状比较分析 由表2可见,新吉毛样在产毛量,拉伸长度、卷曲度和油脂率等极显著高于小尾寒羊(P<0.01),纤维直径呈现极显著减低,说明新吉细毛羊在毛用性状方面全方位优于小尾寒羊,唯一不存在极显著差异的指标是净毛率,表现为小尾寒羊净毛率显著高于新吉细毛羊(P<0.05)。说明新吉细毛羊毛吸收裹扎灰尘的能力大于小尾寒羊羊毛,该结果与细毛羊毛长更长、密度更高、卷曲度更大存在一定的关联性。
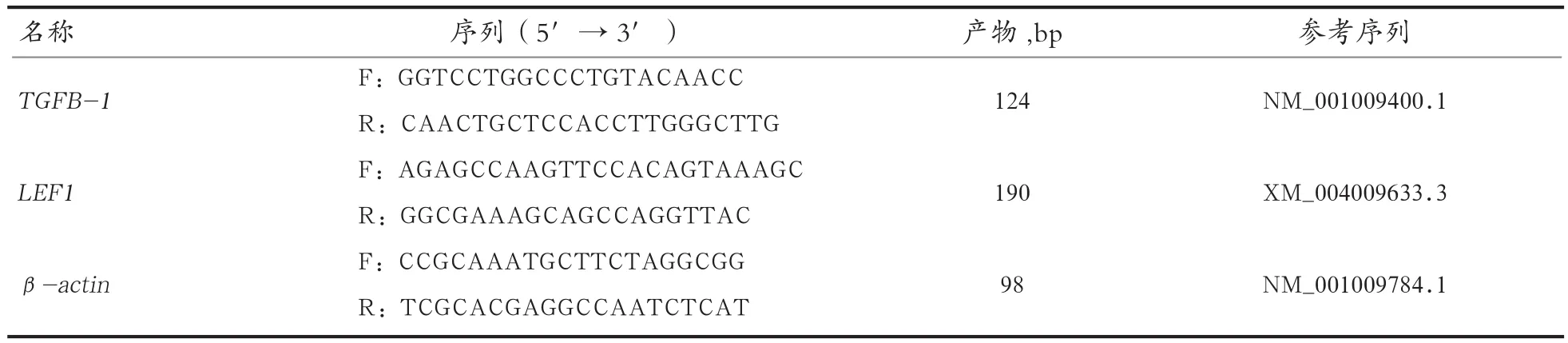
表 1 引物序列信息及扩增产物
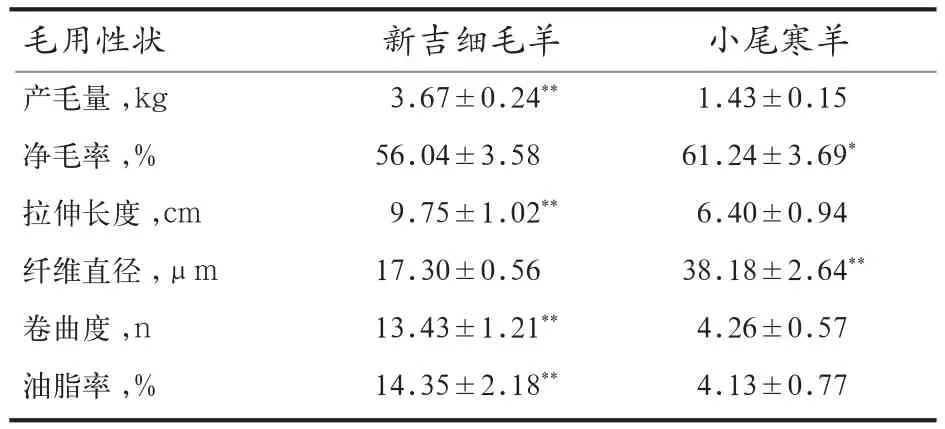
表 2 新吉细毛羊与小尾寒羊产毛用性状比较分析
2.2 小尾寒羊与新吉细毛羊毛囊性状比较分析 由表3发现,小尾寒羊在皮肤厚度、初级毛囊和次级毛囊毛乳头直径均极显著大于新吉细毛羊(P<0.01),而新吉细毛羊毛囊密度及S/P值极显著大于小尾寒羊(P<0.01)。上述统计结果可通过皮肤组织切片进行宏观验证(图1)。从2个品种绵羊皮肤组织切片中可以发现,新吉细毛羊皮肤组织中毛囊密度更高,无论初级毛囊还是次级毛囊直径均更小,毛囊从指间结缔组织明显少于小尾寒羊。毛囊丛中小尾寒羊初级与次级毛囊差异较为明显,且S/P值明显低于新吉细毛羊。新吉细毛羊毛囊从中初级毛囊与次级毛囊则较难分辨,毛囊之间也极为紧凑,呈现出均匀分布的态势。从皮肤毛囊组织特性比较分析可以得出,作为毛品质及产量更优的新吉细毛羊在毛囊性状方面同样与小尾寒羊存在显著差别,提示毛囊性能与羊毛性状间存在必然的联系。

表 3 新吉细毛羊与小尾寒羊毛囊状比较分析
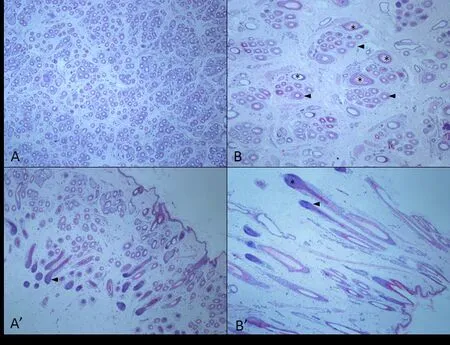
图1 小尾寒羊与新吉细毛羊皮肤组织切片(40×)
2.3 小尾寒羊与新吉细毛羊毛囊周期比较分析 为鉴定小尾寒羊与新吉细毛羊毛囊组织是否在毛囊周期上存在差异,采集不同上述2个品种绵羊时间点皮肤毛囊组织样品。通过定量PCR方法检测2个品种绵羊毛囊周期标记基因TGF-β1和LEF1基因在不同时间点的相对表达变化,间接推测2个品种羊是否存在周毛囊周期差异。2个品种羊均以2月份表达水平为参照,LEF1基因相对定量检测发现,2个品种羊均呈现表达降低后逐渐恢复至升高的变化趋势(图2)。其中新吉细毛羊变化趋势较为一致,呈现4月份较2月份减低后逐渐恢复,至8月份已略高于2月份表达水平,在后期种也呈现上升的趋势,至12月份达到表达顶峰,是2月份表达水平的1.8倍。如果全年串联可以看出,LEF1基因呈现出波浪式的动态变化趋势,这与其与毛囊退行休止期高表达的特征相一致。小尾寒羊LEF1基因则相对复杂,主要除总体趋势从4月份呈现表达水平逐渐上升的趋势外,主要表现为在10月份出现一个明显的回落,
12月又达到峰点。尽管LEF1基因表达存在季节性变化的趋势,但总体表达变化并不大,表达最高点的12月也仅仅为对照2月的1.8倍左右。横向比较两品种羊皮肤组织LEF1基因表达差异发现,各时间节点LEF1基因表达并不存在显著性差异(P>0.05)。
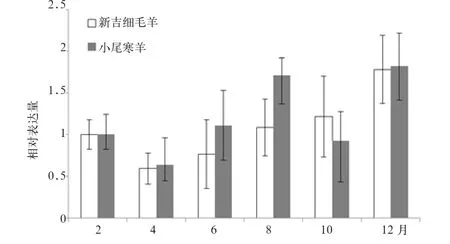
图2 不同月份小尾寒羊与新吉细毛羊LEF1基因定量PCR检测
TGF-β1基因在2个品种中表达随季节变化呈现更加剧烈的变化趋势(图3)。不同季节新吉细毛羊皮肤 TGF-β1表达仅在8月份和12月份呈现高表达趋势,分别为2月份表达水平的10.4、3.2倍。小尾寒羊则在4、8、10月呈现高表达趋势,表达水平依次为2月份的3.0、44.1、2.7倍。尤其是在8月份呈现出极端上调表达的趋势,这种趋势与新吉细毛羊呈现类似的趋势,但幅度更大。不同时间点2个品种羊皮肤TGF-β1基因表达差异分析发现,8月份和12月份呈现出显著性变化(P<0.05),提示8月份可能是毛囊周期变化重要的节点。小尾寒羊与新吉细毛羊不同变化趋势同时也提示2个品种羊TGF-β1基因在毛囊周期过程中分子功能存在一定的差异性。
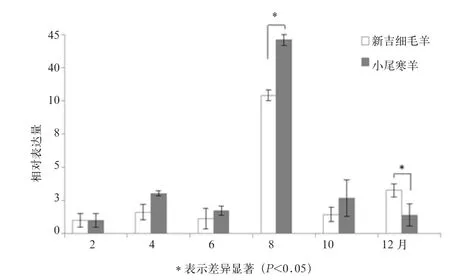
图3 不同月份小尾寒羊与新吉细毛羊TGF-β1基因定量PCR检测
3 讨 论
小尾寒羊繁殖性能优势明显,多用于改良地方绵羊提升产羔率。也是绵羊繁殖性能基础性研究的重要实验动物[6-7]。小尾寒羊较其他肉羊品种比较在产肉量、肉质品质等指标上劣势同样明显,因此小尾寒羊也作为肌肉发育或肉质品质鉴定的对照[8]。在毛用性状方面,小尾寒羊不仅仅产毛量低,品质也属于典型的劣质毛,只能用于毛毡等低端纺织品。新吉细毛羊则在选育过程中不断强调毛用性状的选育提高[9]。不同选择方向致使两者在毛用性状表型上的差距呈现出极端的两极化发展趋势。为探讨毛性状成因及毛囊功能活性研究提供天然研究对象。本文基于此出发点,对小尾寒羊与新吉细毛羊毛用性状、毛囊性状与毛囊周期进行了系统比较研究,结果证明2个品种绵羊在毛用性状和毛囊性状存在极端显著差异,但在毛囊周期上差异不大。
纵向比较不同时期小尾寒羊毛用性状测量数据发现小尾寒羊产毛性能并未有明显提升[10],其原因在于毛用性状并非小尾寒羊品种改良的主要目标。本研究结果表明,超细型新吉细毛羊毛用性状各项指标则始终处于较高强度的人工选择下,致使2个品种毛用性状差异越来越大。这种极端的毛用性状表型差异最直接的原因在于2个品种羊毛囊组织结构、性能与数量的显著差异,尤其表现为毛囊密度,S/P值及毛乳头直径等关键指标上。事实上临床经验及皮肤组织切片还能发现,2个品种绵羊皮肤致密程度、皮肤温度、皮肤毛细血管密度等方面均存在差异,主要表现为小尾寒羊皮肤组织致密性更高,温度和毛细血管密度更低。一方面原因在于小尾寒羊最初主要在华北地区养殖,年均气温较高所致,而细毛羊主要生活于东北、内蒙及新疆等地,年均气温更低。不同生活环境与人工选择的双重作用下,致使小尾寒羊毛用性状与毛囊性状呈现出日渐分离的趋势。
毛囊是一类重要的可自我更新的微小器官[11]。毛囊周期分为生长期、休止期和退形期,毛囊周期更替对毛发结构性状具有根本性影响。毛囊周期受到复杂的分子信号通路所控制[12]。不同物种毛囊周期存在显著差异,以山羊为例,山羊一个毛囊周期基本为1年,与气温即日照时长等自然状况更迭相吻合。由于绵羊受到人工选择的程度更高,绵羊尤其是细毛羊毛囊周期基本在2年以上,其中生长期被尽可能延长,以提高羊毛产量。为比较小尾寒羊与新吉细毛羊毛囊周期,本研究采用QRT-PCR法,对2个品种绵羊不同季节皮肤组织中TGF-β1和LEF1基因表达水平进行检测,结果发现不同季节间TGF-β1和LEF1基因表达存在较为明显的波动,表现出TGF-β1较LEF1基因波动性更强,小尾寒羊较新吉细毛羊2个基因表达变化更加剧烈的特征,一方面证实2个基因作为毛囊周期标志分子的可能性,另一方面也证实2个品种绵羊毛囊周期分子表达的差异性提示毛囊周期可能并未完全一致[13-14]。有报道证明,小鼠TGF-β1基因在毛囊生长后期及退形期前期高表达,通过抑制毛囊角质细胞增殖从而促进毛囊从生长期进入休止期[13]。而传统观点认为每年8月份开始为山羊新一轮毛囊周期的开始,而本实验中无论小尾寒羊还是新吉细毛羊,8月份正处于20月龄左右,理论上尚处于上一个毛囊周期,组织切片检测显示毛囊处于生长期,提示绵羊毛囊周期控制机制可能与小鼠存在某种程度的差异性。作为Wnt信号通路重要的调节分子,LEF1基因只在生长期毛囊组织呈现高表达[14],LEF1基因在毛囊周期中的表达特性是其成为毛囊周期分子鉴定的基础,但从小尾寒羊与新吉细毛羊毛囊组织LEF1基因表达趋势中并不能明显区分毛囊处于具体时期,进一步说明在绵羊毛囊周期与小鼠等物种存在一定的差异性。本研究同样发现,小尾寒羊与新吉细毛羊2个基因表达模式与藏绵羊比较发现存在相似性,同时也存在一定差异[15]。可能的原因在于两者毛囊数量、结构存在较大的差异性,这也可能是两者在产毛性能上存在较大差别的物质基础。
[1] 柳存. 德美与小尾寒羊杂交一代的生产性能和毛纤维品质研究[J]. 安徽农业科学, 2014, 42(27):9393‐9394.
[2] 王晓清, 杨莉, 刘炯. 内蒙古小尾寒羊毛性能研究[J]. 轻纺工业与技术, 2013, 42(4):21‐23.
[3] 张明新, 王春昕, 徐兴海, 等. 新吉细毛羊选育概况与羊毛分级拍卖示范[J]. 中国畜禽种业, 2007, (2):17‐20.
[4] 徐丽. 超细型细毛羊新品种——苏博美利奴羊[J]. 农村百事通, 2015, (12):43‐44.
[5] 柳楠, 田可川, 石国庆, 等. 苏博美利奴羊核心群级进杂交不同世代对产毛性状影响的研究[J]. 中国畜牧杂志, 2015, 51(15):6‐10.
[6] Miao X, Luo Q. Genome‐wide transcriptome analysis between small‐tail Han sheep and the Surabaya fur sheep using high‐throughput RNA sequencing[J]. Reprod Camb Engl, 2013, 145(6):587‐596.
[7] Miao X, Qin Q L X. Genome‐wide transcriptome analysis of mRNAs and microRNAs in Dorset and Small Tail Han sheep to explore the regulation of fecundity[J]. Mol Cell Endocrinol, 2015, 402:32‐42.
[8] Sun L, Bai M, Xiang L, et al. Comparative transcriptome profiling of longissimus muscle tissues from Qianhua Mutton Merino and Small Tail Han sheep[J]. Sci Rep, 2016, 6:33586.
[9] 王蕾, 张明新, 王春昕, 等. 新吉细毛羊羊毛品质分析[J].中国草食动物科学, 2012, 418‐419.
[10] 邹继业, 徐廷生. 河南小尾寒羊羊毛品质分析报告[J]. 豫西农专学报, 1992, (1):27‐30.
[11] Alonso L, Fuchs E. The hair cycle[J]. J Cell Sci, 2006, 119(3):391‐393.
[12] Stenn K S, Paus R. Controls of hair follicle cycling[J]. Physiol Rev, 2001, 81(1):449‐494.
[13] Foitzik K, Lindner G, Mueller‐Roever S, et al. Control of murine hair follicle regression (catagen) by TGF‐beta1 in vivo[J]. FASEB J Off PublFed Am Soc Exp Biol, 2000, 14(5):752‐760.
[14] Zhang Y, Yu J, Shi C Y, et al. LEF1 Contributes to the dif f erentiation of bulge stem cells by nuclear translocation and cross‐talk with the notch signaling pathway[J]. Int J Med Sci, 2013, 10(6):738‐746.
[15] Liu G B, Liu R Z, Li Q Q, et al. Identif i cation of microRNAs in wool follicles during anagen, catagen, and telogen phases in tibetan sheep[J]. PLoS One, 2013, 8(10):e77801.
S827.2
A
10.19556/j.0258-7033.2017-09-052
2017-03-28;
2017-05-18
国家863计划(2013AA102506)
张立春(1977-),男,黑龙江嫩江人,副研究员,博士,研究方向为动物生物技术,E-mail:zhang_lich@163.com

