湖羊miR-29a、miR-125b、miR-487b不同生长时期组织表达谱初步分析
王 健,巩佳昕,刘 念,徐 颖,祁 琪,杨灵芝,沈露露,房兴堂*,李 军
(1.江苏师范大学生命科学学院,江苏徐州 221116;2.江苏师范大学科文学院,江苏徐州 221116;3.睢宁县陇西养羊专业合作社,江苏睢宁 221200)
湖羊miR-29a、miR-125b、miR-487b不同生长时期组织表达谱初步分析
王 健1,巩佳昕2,刘 念1,徐 颖1,祁 琪1,杨灵芝1,沈露露1,房兴堂1*,李 军3
(1.江苏师范大学生命科学学院,江苏徐州 221116;2.江苏师范大学科文学院,江苏徐州 221116;3.睢宁县陇西养羊专业合作社,江苏睢宁 221200)
本研究旨在探究miR-29a、miR-125b、miR-487b在湖羊不同生长时期各组织中的表达情况,以了解它们在湖羊肌肉发育中的作用。通过实时荧光定量PCR检测发现,miR-29a在湖羊不同生长时期中差异表达,并在各组织中有着不同的表达模式,其中在背最长肌中的表达显著高于其他肌肉组织和内脏组织;miR-125b只在胎羊和成年羊心肌和背最长肌中的表达相对容易检测,并且在成年羊中的表达明显低于胎羊。结果表明:miR-125b在湖羊的生长发育过程中表达量下调;miR-487b在湖羊胎羊的不同组织中都有相应的表达,并且在肌肉组织中的表达明显高于其他组织,而在成年羊的相对应的组织中表达量都呈现下调趋势,且背最长肌、腿肌和胸肌的下调趋势与胎羊相应的组织都有显著差异。
湖羊;miR-29a;miR-125b;miR-487b;表达谱
湖羊是我国太湖流域的重要经济型家畜之一,是皮肉兼用型的优良绵羊品种,有着性早熟、常年发情、每年两胎、一胎多只羔羊、生长发育周期短等诸多优良特性。肌肉是动物机体的重要组成部分,其中骨骼肌大约占机体总重量的40%[1-2]。骨骼肌细胞来源于胚胎的中胚层和胚胎的外胚层,经分化形成块状样的组织。在动物骨骼肌发育过程中,来源于体节的细胞经过增殖、终端分化等过程,之后形成具有多核的肌纤维[3],该过程受到各种信号通路以及内部环境改变的调控,导致特异性转录因子的激活以及随后相关基因表达的重编程。
MicroRNAs(miRNAs)是非编码的RNA的家族之一,大约由22个核苷酸组成,它们在转录后水平发挥着调控基因表达的作用。miRNAs通过与靶基因的3'非编码区发生作用,使基因表达沉默或者抑制靶基因的表达活性的过程,已经被证实参与动物机体发育的多个过程,包括组织的形成、器官的发育以及一些细胞学过程,比如细胞凋亡、细胞周期调控和信号分子的转运等过程,并发挥着至关重要的作用[4-5]。很多调控肌肉发育方面的肌肉特异性miRNAs被先前许多的研究所鉴定和表征,相比之下,目前研究最热的miRNAs是microRNA-1或microRNA-206、microRNA-133、microRNA-208和microRNA-499家族,它们调控包括在肌源性转录因子作用下的肌肉卫星细胞和成肌细胞的增殖和分化等肌肉生成的基本过程[6]。
同时,近年来许多研究表明,很多非肌肉特异性microRNAs通过与成肌因子相互作用也是调控肌肉发育所必需的,miR-29a、miR-125b和miR-487b在调控肌肉发育方面有相关的功能。在肌肉发育期间,YY1蛋白通过抑制肌肉发育后期分化基因,如α-肌动蛋白、肌酸蛋白、肌球蛋白重链II-b基因的合成,进而抑制肌肉细胞的分化,miR-29a可以直接结合并作用于YY1基因的3'非编码区(UTR),减少YY1的抑制作用,从而促进肌细胞的分化[7]。miR-125b,一个新发现的肌源性microRNA,在肌肉生成的过程中表达量下降,并负调控体外培养的C2C12成肌细胞的分化[8]。miR-487b是一个肌肉分化相关的新microRNA,它的功能很大程度上也还是未知的,而且仅有极少数的研究报道其在肌肉发育相关的作用。湖羊作为肉用绵羊的品种之一,研究其肌肉发育的调控机制极其重要。目前,microRNA对湖羊肌肉发育影响的研究报道不多。本实验在前人研究基础上,拟用实时荧光定量PCR技术,分别检测miR-29a、miR-125b、miR-487b在湖羊胎羊和成年羊心、肝、脾、肺、肾、肠、背最长肌、腿肌、胸肌、脂肪10个组织中的相对表达量,为研究湖羊的肌肉发育和相关调控机制提供理论依据。
1 材料与方法
1.1 实验动物 本实验从徐州市某湖羊养殖场,分别采取3只健康湖羊成年羊和胎羊的心、肝、脾、肺、肾、肠、背最长肌、腿肌、胸肌、脂肪10个组织。用经过高压灭菌之后的0.9%生理盐水,清洗去除血污和其他杂质,用经过高压灭菌处理过的锡箔纸包好后置于事先准备好的液氮罐中,迅速带回实验室开展实验。
1.2 引物设计与合成 依据miRbase(http://www. mirbase.org/)已收录并公布的绵羊miRNA-29a、miR-125b和miR-487b的成熟序列,序列号分别为MIMAT0014967、MIMAT0014971、MIMAT001 9295设计相应的反转录引物和实时荧光定量PCR引物。由生物工程(上海)股份有限公司合成用于反转录实验的引物和荧光定量PCR的引物,并用Primer BLAST和Bio XM 2.6等进行引物分析。引物详见表1。
1.3 RNA的提取和反转录 用RNAiso Plus试剂,按照Trizol法原理提取湖羊胎羊、成年羊的心、肝、脾等组织的总RNA。用Nanodrop 2000C分光光度计检测湖羊各组织的总RNA浓度和纯度(D260/ D280和OD260/OD230)。测完各组织总RNA浓度之后,用1%琼脂糖凝胶电泳检测所提取的相应组织总RNA的完整性。
根据PrimeScript™ RT reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒的说明书将提取的各组织总RNA反转录成cDNA。反应的总体系为20 μL:2 μL 5xgDNA Eraser Buffer,2 μg的总RNA,1 μL gDNA Eraser,用RNase Free H2O加至10 μL ,注意维持低温操作环境,最好在冰盒上操作,混匀后放入PCR仪器中42℃2 min。2 min后,暂停上述反应,在该反应液中依次加入1 μL Prime Script RT Enzyme Mix I,1 μL RT Prime Mix,1 μL miRNA(miR-29a,miR-125b,miR-487b)反转录特异性引物,4 μL 5×Prime Script Buffer 2,3 μLRNase Free H2O(可提前按相应的使用量配好分装),继续上述的PCR反应,37℃ 15 min,85℃ 5 s,4℃ 10 s。反应结束后将反转录所得的cDNA储存于-20℃备用,若要长久使用,则需置于-80℃冰箱。

表1 MicroRNA的反转录和实时荧光定量PCR引物
1.4 实时荧光定量PCR 实时荧光定量PCR的总反应体系为15 μL:SYBR Premix Ex TaqTMII试剂7.5 μL,Rox Reference Dye 0.3 μL,cDNA模板0.6 μL,上、下游引物各0.6 μL,ddH2O 5.4 μL。使用ABI Step OnePlus实时荧光定量PCR仪进行定量分析实验,每个样品的表达量均以各组织18S核糖体RNA的表达量为参照,各个组织间的相对表达以心脏为参照进行比对。PCR反应程序为95℃进行预变性30 s;95℃变性10 s,60℃退火1 min,共进行40个循环,循环结束之后对熔解曲线进行相关分析。每个组织进行3次技术性重复,且每进行1次实验都设空白管作为对照。
1.5 统计分析 采用2-△△Ct法对实时荧光定量PCR仪的数据进行处理、计算各组织Ct值并分析miR-29a、miR-125b、miR-487b在湖羊胎羊和成年羊组织之间的相对表达量。实验结果经IBM SPSS Statistics 22软件进行均值、单因素方差、多重比较等统计分析,并使用GraphPad Prism5软件作图分析,各个组织3个miRNA的相对表达量以平均值±标准差表示。
2 结 果
2.1 总RNA的质量检测 Nanodrop 2000C分光光度计测定总RNA纯度,OD260/OD280均在1.95~2.05,说明提取的各组织总RNA样品质量较高。随后用浓度为1%的琼脂糖凝胶电泳检测总RNA条带完整性,28S和18S 2条带清晰明亮,5S条带较暗,依稀可以看出,可用于后续的实验(图1)。

图1 总RNA条带检测电泳图
2.2 荧光定量PCR产物特异性分析 通过对定量实验熔解曲线分析,miR-29a、miR-125b、miR-487b及18S核糖体RNA基因的熔解温度分别为80.37、80.67、80.37、83.35℃,且这3个microRNA和内参18S的熔解曲线都呈单一峰,没有引物非特异性峰(图2)。

图2 湖羊各组织基因溶解曲线
2.3 miR-29a、miR-125b和miR-487b 在湖羊胎羊和成年羊各组织中的表达谱 如图3所示,miR-29a在胎羊时期各组织中都有表达,其中在背最长肌中的表达量最高,为5.82,与在心肌中表达量差异极显著(P<0.01);其次,miR-29a在肺、脾和肝的表达量也相对较高,依次为3.54、2.69和1.93,与在心肌中的表达量相比,它们之间表达量差异分别达到极显著(P<0.01)和显著水平(P<0.05);脂肪和肾的表达量为0.79和0.66(P>0.05);肠、腿肌和胸肌的表达量为0.28、0.23和0.26(P<0.05)。miR-29a在成年羊的背最长肌中表达量最高,为1.78,与心肌的表达量差异极显著(P<0.01);脾、肺的表达量为0.59和0.64(P>0.05);肝、肾、肠、腿肌、胸肌和脂肪的表达量依次为0.04、0.19、0.04、0.38、0.16和0.10(P<0.05)。在不同生长发育时期的湖羊各个组织中,miR-29a在湖羊胎羊和成年羊的背最长肌中的表达相比其他组织都很高,分别为5.82和1.78,其中miR-29a在湖羊胎羊背最长肌中的表达量最高。

图3 miR-29a在湖羊胎羊和成年羊各组织中的相对表达情况
如图4所示,在胎羊的各个组织中,miR-125b在背最长肌中的表达量最高,值为2.38,其次为肺和腿肌,分别为0.31和0.23,均与心肌的表达量差异极显著(P<0.01);miR-125b在肝等其他组织中的表达量较低。在成年羊的各组织中,背最长肌、腿肌和胸肌的表达量依次为0.82、0.12和0.11,肝、脾等组织的表达量相比心肌值很低。从2个时期的湖羊各组织相对表达量可以看出,miR-125b在背最长肌中的表达量较其他组织中的表达量都很高,且miR-125b在胎羊背最长肌中的表达高于成年羊。
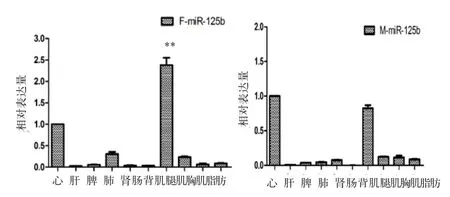
图4 miR-125b在湖羊胎羊和成年羊各组织中的相对表达情况
如图5所示,miR-487b在湖羊胎羊的各个组织中都有表达,其中在背最长肌中的相对表达量最高,为16.92,与心肌中表达量差异极显著(P<0.01);肠、腿肌、胸肌和脂肪的相对表达量依次为9.18、10.04、7.52和9.60(P<0.01);肝、脾的相对表达量分别为2.72、4.62(P<0.05);肺、肾的相对表达量为1.15、1.48(P>0.05)。在成年羊的各个组织中,miR-487b也是在背肌中的表达量最高,为2.23(P<0.01);脾、肺、肾、腿肌、胸肌的表达量分别为0.21、0.40、0.75、0.33、0.16。miR-487b在成年羊的肝、肠和脂肪组织中的表达量很低,与胎羊相比表达量明显减少;在胎羊和成年羊的背肌中,miR-487b的表达量都很高,且在胎羊背肌中的表达量比成年羊的表达量高出7倍。

图5 miR-487b在湖羊胎羊和成年羊各组织中的相对表达情况
2.4 3个不同的miRNA在湖羊胎羊和成羊时期的相对表达量分析 将miR-487b在湖羊胎羊心组织中的表达量看成1。从图6可以看出,miR-487b、miR-29a和miR-125b在湖羊胎羊肌肉相关组织中有着高表达量,其中miR-487b在胎羊脂肪中也有相对较高的表达(P<0.01);此外,miR-487b、miR-29a和miR-125b在胎羊肝组织的表达量较其他组织相比均处在显著水平(P<0.05);同样,将miR-487b在湖羊成年羊心组织中的表达量看成1,如图7所示,miR-487b和miR-125b在成年羊背肌中高表达,分别处在极显著水平(P<0.01)和显著水平(P<0.05),而miR-29a在成年羊背肌中的表达与心肌相比较差异不显著(P>0.05)。
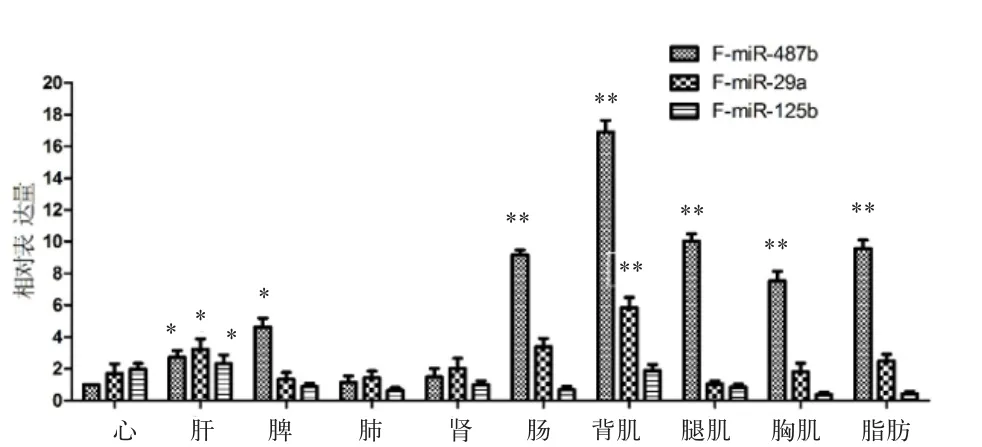
图6 3个不同的miRNA在湖羊胎羊组织中的相对表达情况
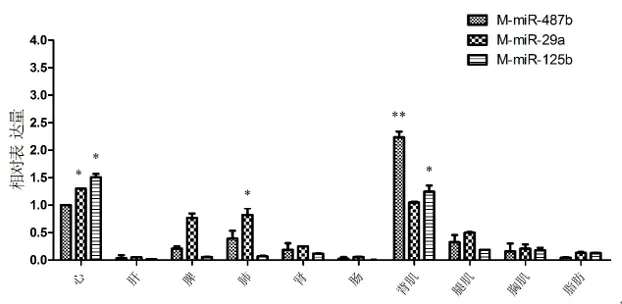
图7 3个不同的miRNA在湖羊成年羊组织中的相对表达情况
3 讨 论
目前,关于miRNAs参与调控哺乳动物肌肉增殖和分化的研究越来越多,并且揭示了许多miRNAs的靶基因和生长发育相关的调控因子的功能。在骨骼肌发育的过程中,一些miRNAs在骨骼肌细胞特异性表达,并在分化的过程中有着差异性表达[9]。许多调控肌肉组织发育的特异性miRNA,除了功能熟知的miR-1、miR-133、miR-206家族以外,miR-486、miR-499等肌肉特异性miRNA也在调控肌肉的发育过程中发挥着不可或缺作用[10-12]。然而,许多非肌肉特异性miRNAs在此过程中也发挥着关键作用,比如miRNA-378、miR-214、miR-148a、miR-374b、miR-29a、miR-125b等,肌肉发育相关的基因如MyF6、Ezh2、MEF2、 Mef2A和YY1,都受这些非肌肉特异性miRNAs调控;IGFII、Cdc25A等其他基因也被证实受这些miRNAs调控,在肌肉发育过程中发挥着作用。在增殖的成肌细胞中,NF-κB基因负调控肌纤维相关基因的表达。NF-κB基因在转录水平肌球蛋白轻链、肌球蛋白重链基因和α-肌动蛋白等肌纤维相关基因在增殖未分化的成肌细胞中活力 ,使其沉默。YY1作为一个转录抑制因子,可以在未分化的成肌细胞中抑制肌球蛋白重链IIb和α-肌动蛋白基因的活力,并且NF-κB基因可以通过调控YY1基因来发挥抑制作用[13]。YY1基因是MiR-29a的靶基因,miR-29a的高表达,可以抑制YY1基因的活性,从而促进成肌细胞向肌纤维分化。miR-125家族有2个成员,分别是miR-125a和miR-125b,它们在老鼠的大脑组织中表达量较高,然而在除了大脑以外的其他组织中也可以检测到miR-125b的表达。miR-125b可以直接作用于IGF-II基因——肌生成过程中关键基因,调控着骨骼肌的生成;miR-125b还在调控山羊皮肤组织被毛生长过程中发挥着重要作用[14]。miR-487b作为一个新的miRNA,在分化的C2C12细胞中表达下调,并且在C2C12细胞中,转染合成过表达的miR-487b能显著减少成肌分化因子的表达。这3个miRNAs在大型哺乳动物中的功能研究相对较少,很多研究都是建立在小鼠的成肌细胞系(C2C12)的基础上,其中,尤其是对miR-487b在哺乳动物中的相关功能的研究更少。
湖羊作为重要的经济性家畜之一,研究其生长发育包括肌肉发育的相关调控机制至关重要。从本实验结果可知,miR-29a和miR-125b在肌肉组织中的表达量高于其他非肌肉组织,其中尤其是在胎羊的肌肉组织中,这与Wang等[15]和韦伟等[16]的研究结果一致。miR-487b也在一些研究中,预测通过作用于胰岛素受体底物基因来修复和调控骨骼肌发育[17-18]。miR-29a、miR-125b和miR-487b调控湖羊肌肉发育的研究甚少,本实验通过荧光定量PCR检测miR-29a、miR-125b以及miR-487b在不同时间湖羊的不同组织中表达,发现这3个miRNA在湖羊胎羊组织中的表达量都明显高于在湖羊成年羊组织中的表达量,可以推测出这3个miRNA在湖羊的成长发育过程中发挥着作用,并且在背肌组织中都有着相对较高的表达量;在湖羊胎羊时期,miRNA-29a、miR-125b和miR-487b在肌肉组织中的相对表达量都高于其他非肌肉组织,与许多前人的研究结果相一致,并且在胎羊组织中的表达量均大于在成年羊组织中的表达量,其中,在胎羊背肌组织中表达量最高。miR-487b尤为突出,不仅在胎羊以及成年羊的组织中呈现差异性表达,而且不同年龄段的时空差异性表达显著,其在成年羊肌肉组织中的表达量明显下调,推测它或许参与湖羊肌肉细胞的增殖和分化过程,并在湖羊的生长发育过程中发挥着重要的调控作用,同时miR-29a和miR-125b在胎羊各组织中的表达高于成年羊,间接说明它们在调控湖羊发育过程中发挥着不可或缺的作用。
4 结 论
miR-29a在湖羊胎羊组织中的表达明显多于成年羊组织,且背肌中表达量最高;miR-125b只在心肌和背肌组织中检测到明显的表达,其他组织的表达趋势不明显;miR-487b在湖羊胎羊的肌肉组织和脂肪组织中的表达量较高,比较不同生长时期的湖羊发现,在成年羊的肌肉组织中表达趋势明显下调,可以间接推测miR-487b在调控湖羊胎羊肌肉发育相关的过程中发挥着重要的调控作用;且这3个miRNA在湖羊胎羊到成年羊的生长过程中,体现出时空差异性表达,并有下调表达的趋势。这些实验结果,可以为后续的筛选和研究调控湖羊肌肉发育的miRNAs提供重要的参考依据。
[1] Bartel D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281‐297.
[2] Guller I, Russell A P. MicroRNAs in skeletal muscle: their role and regulation in development, disease and function[J]. J Physiol, 2010, 588(21): 4075‐4087.
[3] Buckingham M. Skeletal muscle formation in vertebrates[J]. Curr Opin Genet Dev, 2001, 11(4): 440‐448.
[4] Bartel D P. MicroRNAs: target recognition and regulatory functions[J]. Cell, 2009, 136(2): 215‐233.
[5] Bushati N, Cohen S M. MicroRNA functions[J]. Annu Rev Cell Dev Biol, 2007, 23: 175‐205.
[6] Anderson C, Catoe H, Werner R. MIR‐206 regulates connexin43 expression during skeletal muscle development[J]. Nucleic Acids Res, 2006, 34(20): 5863‐5871.
[7] Wang X H, Hu Z, Klein J D, et al. Decreased miR‐29 suppresses myogenesis in CKD[J]. J Am Soc Nephrol, 2011, 22(11): 2068‐2076.
[8] Ge Y, Sun Y, Chen J. IGF‐II is regulated by microRNA‐125b in skeletal myogenesis[J]. J Cell Biol, 2011, 192(1):69‐81.
[9] Luo W, Nie Q H, Zhang X Q. MicroRNAs involved in skeletal muscle dif f erentiation[J]. J Genet Genomics, 2013, 40(3): 107‐116.
[10] Chen J F, Mandel E M, Thomson J M, et al. The role of microRNA‐1 and microRNA‐133 in skeletal muscle proliferation and differentiation[J]. Nat Genet, 2006, 38(2):228‐233.
[11] Dai Y, Wang Y M, Zhang W R, et al. The role of microRNA‐1 and microRNA‐206 in the proliferation and dif f erentiation of bovine skeletal muscle satellite cells[J].In Vitro Cell Biol Anim, 2016, 52(1):27‐34.
[12] Small E M, O’Rourke J R, Moresi V, et al. Regulation of PI3‐kinase/Akt signaling by muscle‐enriched microRNA‐486[J]. Proc Natl Acad Sci USA, 2010, 107(9):4218‐4223.
[13] Wang H, Hertlein E, Bakkar N, et al. NF‐κB regulation of YY1 inhibits skeletal myogenesis through transcriptional silencing of myofibrillar genes[J]. Mol Cell Biol, 2007, 27(12):4374‐4387.
[14] 曲海娥. miR‐125b在细毛羊与绒山羊皮肤组织中表达差异及其靶基因的筛选与鉴定[D].长春: 吉林大学, 2014.
[15] Wang H, Garzon R, Sun H, et al. NF‐kB–YY1–miR‐29 Regulatory Circuitry in Skeletal Myogenesis and Rhabdomyosarcoma[J]. Cancer Cell, 2008, 14(5): 369‐381.
[16] 韦伟. MIR‐29和MIR‐195/497调节骨骼肌生长发育的功能研究[D]. 武汉: 华中农业大学, 2013.
[17] Long Y C, Cheng Z, Copps K D, et al. Insulin receptor substrates Irs1 and Irs2 coordinate skeletal muscle growth and metabolism via the Akt and AMPK pathways[J]. Mol Cell Biol, 2011, 31(3): 430‐431.
[18] Katase N, Terada K, Suzuki T, et al. MiR‐487b, miR‐3963 and miR‐6412 delay myogenic differentiation in mouse myoblast‐derived C2C12 cells[J]. BMC Cell Biol, 2015,16(1):1‐11.
Tissue Expression Pattern Analysis of miR-29a, miR-125b and miR-487b in the Dif f erent Growth Period of Hu Sheep
WANG Jian1, GONG Jia‐xin2, LIU Nian1, XU Ying1, QI Qi1, YANG Ling‐zhi1, SHEN Lu‐lu1, FANG Xing‐tang1*, LI Jun3
(1.College of Life Science, Jiangsu Normal University, Jiangsu Xuzhou 221116,China; 2. Kewen College, Jiangsu Normal University, Jiangsu Xuzhou 221116, China; 3. Longxi Sheep Raising Rofessional Cooperatives of Suining Country, Jiangsu Suining 225009, China)
The aim of this study is to explore the expression of miR‐29a, miR‐125b and miR‐487b in the tissues of dif f erent growth period of Hu sheep and to understand how they play functions in the Hu sheep development. Real‐time quantitative PCR (qRT‐PCR) was used to fi nd that the expression of miR‐29a is diverse in dif f erent tissues in two growth period of Hu sheep. The expression of miR‐29a in the longissimus dorsi muscle is higher than other muscle tissues and visceral tissue obviously. The expression of miR‐125b can only be easily detected in the heart and longissimus dorsi in the fetal Hu sheep, the expression of miR‐125b in mature Hu sheep is lower than the fetal. It indicated that the expression of miR‐125b is reducing in the growth and development of Hu sheep. The miR‐487b was expressed in dif f erent tissues in the fetal Hu sheep and the expression of it is more high in the muscle tissue than other tissues. While in the mature sheep, the expression of miR‐487b is down regulation. In addition, the expression of miR‐487b is down‐regulating in the longissimus dorsi muscle, legs and pectoral muscles markedly.
Hu sheep;miR‐29a;miR‐125b;miR‐487b;Expression prof i le
S827.2
A
10.19556/j.0258-7033.2017-09-042
2017-02-06;
2017-02-28
江苏省科技计划项目(BN2016014、BN201502 7);徐州市科技计划项目(KC15N0013、KC16NX073);江苏省高等学校大学生创新创业训练计划项目(201510320041Z);江苏师范大学生科院大创项目(201603003);江苏师范大学校科研基金一般项目(11XLB04)
王健(1992-),男,江苏盐城人,在读硕士生,研究方向为动物生物化学与分子生物学, E-mail:1030616289@qq.com
*通讯作者:房兴堂,E-mail:xtfang@163.com

