3个杂交水稻亲本成熟期种子内生细菌多样性研究
李南南, 黎 妮, 曹艳花, 张 欣, 肖 明,刘 洋,*, 王伟平,4,*
(1.湖南杂交水稻研究中心 杂交水稻国家重点实验室, 湖南 长沙 410125;2.中国食品发酵工业研究院 中国工业微生物菌种保藏管理中心, 北京 100015;3.上海师范大学 生命与环境科学学院, 上海 200234;4.南方粮油作物协同创新中心, 湖南 长沙 410128)

3个杂交水稻亲本成熟期种子内生细菌多样性研究
李南南1,2,3, 黎 妮1, 曹艳花2, 张 欣2, 肖 明3,*,刘 洋2,*, 王伟平1,4,*
(1.湖南杂交水稻研究中心 杂交水稻国家重点实验室, 湖南 长沙 410125;2.中国食品发酵工业研究院 中国工业微生物菌种保藏管理中心, 北京 100015;3.上海师范大学 生命与环境科学学院, 上海 200234;4.南方粮油作物协同创新中心, 湖南 长沙 410128)
通过传统微生物培养方法,对成熟期的杂交水稻亲本“深08S”、“和620S”及“16A007”种子内生细菌群落结构多样性进行分析。实验表明,处于成熟期的杂交水稻亲本种子内生细菌群落结构具有多样性。“深08S”种子内生细菌含40个分类操作单元(operational taxonomic units, OTU),分属Firmicutes、Proteobacteria、Actinobacteria及Bacteroidetes类群,其中,第一优势菌属为Rhizobium,丰度为15.83%,第二优势菌属为Bacillus,第三优势菌属为Sphingomonas和Curtobacterium。“和620S”种子内生细菌含20个OTU,分属Firmicutes、Proteobacteria及Actinobacteria类群,其中,第一优势菌属为Curtobacterium,丰度为25.33%,第二和第三优势菌属分别为Microbacterium和Pantoea。“16A007”种子内生细菌含24个OTU,分属Firmicutes、Proteobacteria及Actinobacteria类群,其中,第一优势菌属为Pantoea,丰度为35.00%,第二优势菌属和第三优势菌属分别为Micrococcus和Pseudomonas。相比处于灌浆期的水稻种子内生细菌,成熟期的水稻种子内生细菌更丰富,种类更多。由研究可见,种子内生细菌的种类随种子成熟度而变化,成熟期的水稻种子具有丰富的内生菌资源,可为开发新的植物益生菌剂奠定基础,且水稻种子内生细菌的组成与水稻品种有一定的关系。
杂交水稻亲本; 成熟期; 种子内生细菌; 可培养方法; 群落多样性
植物内生细菌是十分重要的内生菌资源,能在健康植物组织内定殖,通过多种作用影响植物生长和发育,与植物建立和谐联合关系[1],其中对植物的直接促生作用包括产吲哚-3-乙酸(IAA)、赤霉素及细胞分裂素等植物生长调节物质促进植物生长发育[2-3]及生物固氮等;对植物的间接促生作用主要是植物内生细菌的生防作用包括通过分泌抗生物质、竞争生态位及竞争营养物质等起到生防作用[4-5];诱导植物系统抗性(induce systematic resis-tance, ISR)来提高宿主植物抗病害能力[6]。随着植物微生态学的深入研究,人们逐步认识到植物内生细菌的重要有益生物学作用。大量实验证实植物种子的表面及内部均有丰富的微生物群落[7]。目前,已报道的植物内生细菌分属54个属,已超过129 种,包括革兰氏阳性菌和革兰氏阴性菌[8]。
水稻是世界三大粮食作物之一,我国水稻种植面积居世界第二位,对国家的粮食安全和国民经济起着举足轻重的作用。研究表明,水稻中的内生菌能够对水稻的生长起到直接或间接促进作用[9-14]。目前,与植物相联合细菌的研究报道越来越多,但主要集中于根和根际内生菌的研究,对与种子联合的内生菌的研究还相对较少[15-18]。国内外对水稻的研究主要集中于不同品种水稻内生菌与品系之间关系[19]及内生菌与宿主植物或根际土壤微生物的作用[20],而有关水稻不同生长期的水稻植株内生菌群落结构的多态性研究报道甚少,尤其是有关水稻种子内生菌群落结构的多态性研究报道更少。本课题组曾采用传统分离培养方法,对处于灌浆期的杂交水稻亲本“深08S”、“和620S”及“16A007”种子内生细菌群落结构多样性进行了研究,获得了一批内生细菌及优势菌属。本研究以成熟期的相同水稻亲本“深08S”、“和620S”及“16A007”种子为研究对象,采用传统培养方法对其内生细菌群落结构多样性进行研究,以获得丰富的水稻种子内生细菌资源,为筛选生防促生作用明显、拮抗谱较广且定殖能力良好的有益细菌奠定基础,同时揭示内生细菌群落结构的多态性,进一步了解种子内生细菌群落结构与水稻生长发育的关系,为深入探讨内生细菌与水稻的相互作用机制和发掘植物益生内生菌奠定基础。
1 材料和方法
1.1 实验材料
1.1.1水稻种子的采集
样品为湖南杂交水稻研究中心提供的杂交水稻两系不育系亲本“深08S”、“和620S”及恢复系亲本“16A007”种子,取材时期为成熟期(2016年4月18日),采自湖南杂交水稻研究中心海南南繁试验基地,4 ℃保存。
1.1.2培养基及试剂
LA、TSA和NA成品培养基,购于北京陆桥公司;细菌基因组DNA提取试剂盒及PCR相关试剂购于TIANGEN公司;PCR引物由北京诺赛生物公司合成。
1.2 实验方法
1.2.1样品表面灭菌
先用无菌水清洗水稻种子,待种子晾干后,依次用70%乙醇浸泡3 min,次氯酸钠溶液(2.5%有效Cl-)浸泡5 min,70%乙醇浸泡30 s,最后用无菌水淋洗5次,在无菌条件下晾干;取最后一次淋洗水120 μL涂于LB平板上,28 ℃恒温培养72 h,检测表面灭菌效果。表面灭菌彻底的种子用于实验。
1.2.2内生细菌的分离与纯化
水稻种子内生细菌群落多样性研究采用传统分离培养技术。取5.0 g表面灭菌彻底的水稻种子用无菌研钵研磨成粉末,采用梯度稀释法制备稀释倍数为1×10-2到1×10-4的系列稀释液。每一梯度稀释液分别取100 μL涂布于TSA、LA、NA平板上,每个处理组设置3个平行,30 ℃培养3天后根据平板上菌落的形态(表面光泽度、透明度、大小、颜色、形状、边缘整齐度等)随机挑取具有代表性单菌落,纯化后4 ℃保存备用,同时保存于中国工业微生物菌种保藏中心(CICC)。
1.2.3内生细菌的16S rDNA序列分析
采用细菌基因组DNA提取试剂盒提取细菌基因组DNA。用正向引物27F(5′-AGAGTTTCATCTGGCTCAG-3′)和反向引物1492R(5′-GGTTACCTTGTTACGACTT-3′)扩增细菌16S rDNA。PCR反应体系(50 μL):DNA模板3 μL、10×buffer 5 μL、dNTP(2.5 mmol/L)4 μL、Taq酶(5 U/L)0.25 μL、引物27F(10 mmol/L)1 μL、引物1492R(10 mmol/L)1 μL,最后用ddH2O补足至50 μL。PCR反应程序:94 ℃预变性5 min,94 ℃变性1 min,55 ℃复性1 min,72 ℃延伸1 min,30个循环后72 ℃延伸10 min。用1%琼脂糖凝胶电泳检测PCR扩增产物。PCR产物用ABI 3730型DNA测序仪进行测序(ABI,USA)。将测序得到的结果在EzTaxon server 2.1进行比对,确定与已知序列同源关系,经比对序列相似性达到98.65% 以上归为同一个种[21]。
2 结果与分析
利用传统分离培养方法从成熟期的杂交水稻亲本“深08S”、“和620S”及“16A007”种子中分别挑取120、75和100株细菌,分别有40,20和24个代表菌株(见表1至表3)。将代表菌株序列信息提交到GenBank,登录号为KX212108~KX212189。
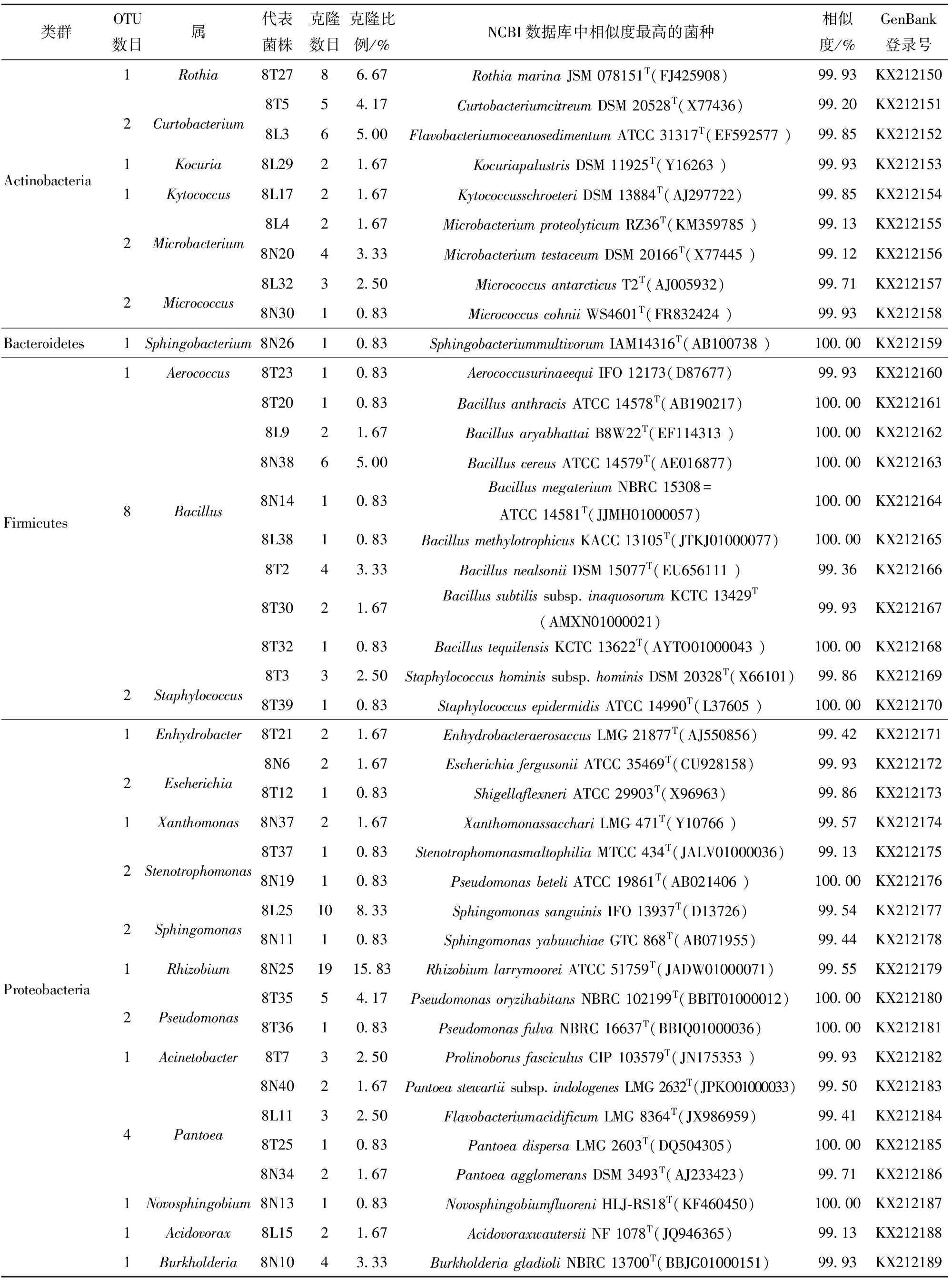
表1 杂交水稻不育系“深08S”种子内生细菌分布

表2 杂交水稻不育系“和620S”种子内生细菌分布
对数据统计分析发现,成熟水稻种子内生细菌群落具有多样性,见表4。由表1和表4可知,“深08S”种子内生细菌群落分属4个类群Proteobacteria类群(63个克隆,52.52%)、Actinobacteria(33个克隆,27.50%)、Firmicutes(23个克隆,19.15%)及Bacteroidetes(1个克隆,0.83%),其中Proteobacteria包含19个OTU,Actinobacteria包含9个OTU,Firmicutes包含11个OTU,Bacteroidetes包含1个OTU。该群落分属22个属,优势属(丰度)为Rhizobium(15.83%)、Bacillus(14.99%)、Sphingomonas(9.17%)及Curtobacterium(9.17%)。由表2和表4可知,“和620S”种子内生细菌群落分属3个类群Proteobacteria类群(40个克隆,53.34%)、Actinobacteria(31个克隆,41.32%)及Firmicutes(4个克隆,5.34%),其中Proteobacteria包含12个OTU,Actinobacteria包含6个OTU,Firmicutes包含2个OTU。该群落分属12个属,优势属(丰度)为Curtobacterium(25.33%)、Microbacterium(15.99%)及Pantoea(11.99%)。由表3和表4可知,“16A007”种子内生细菌群落属3个类群Proteobacteria类群(71个克隆,71.00%)、Actinobacteria(25个克隆,25.00%)及Firmicutes(4个克隆,4.00%),其中Proteobacteria包含14个OTU,Actinobacteria包含6个OTU,Firmicutes包含4个OTU,Bacteroidetes包含1个OTU。该群落分属14个属,优势属为Pantoea(35.00%)、Micrococcus(11.00%)及Pseudomonas(8.00%)。
“深08S”、“和620S”和“16A007”成熟种子有共同的内生菌属,如Rhizobium是“深08S”的第一优势菌属,也是“和620S”和“16A007”的并列第四优势菌属;Curtobacterium是“和620S”的第一优势菌属,是“深08S”的并列第三优势菌属,也是“16A007”的并列第四优势菌属;Pantoea是“16A007”的第一优势菌属,是“和620S”的第三优势菌属,也是“深08S”的并列第四优势菌属。除Rhizobium、Curtobacterium和Pantoea外3个水稻亲本种子也有其他共同内生菌属,如Bacillus、Sphingomonas、Microbacterium、Pseudomonas、Xanthomonas等。而Novosphingobium、Sphingobacterium、Acidovorax、Kytococcus、Kocuria、Escherichia菌属只从“深08S”成熟种子分离得到,Luteibacter、Paenibacillus只从“和620S”种子分离得到。
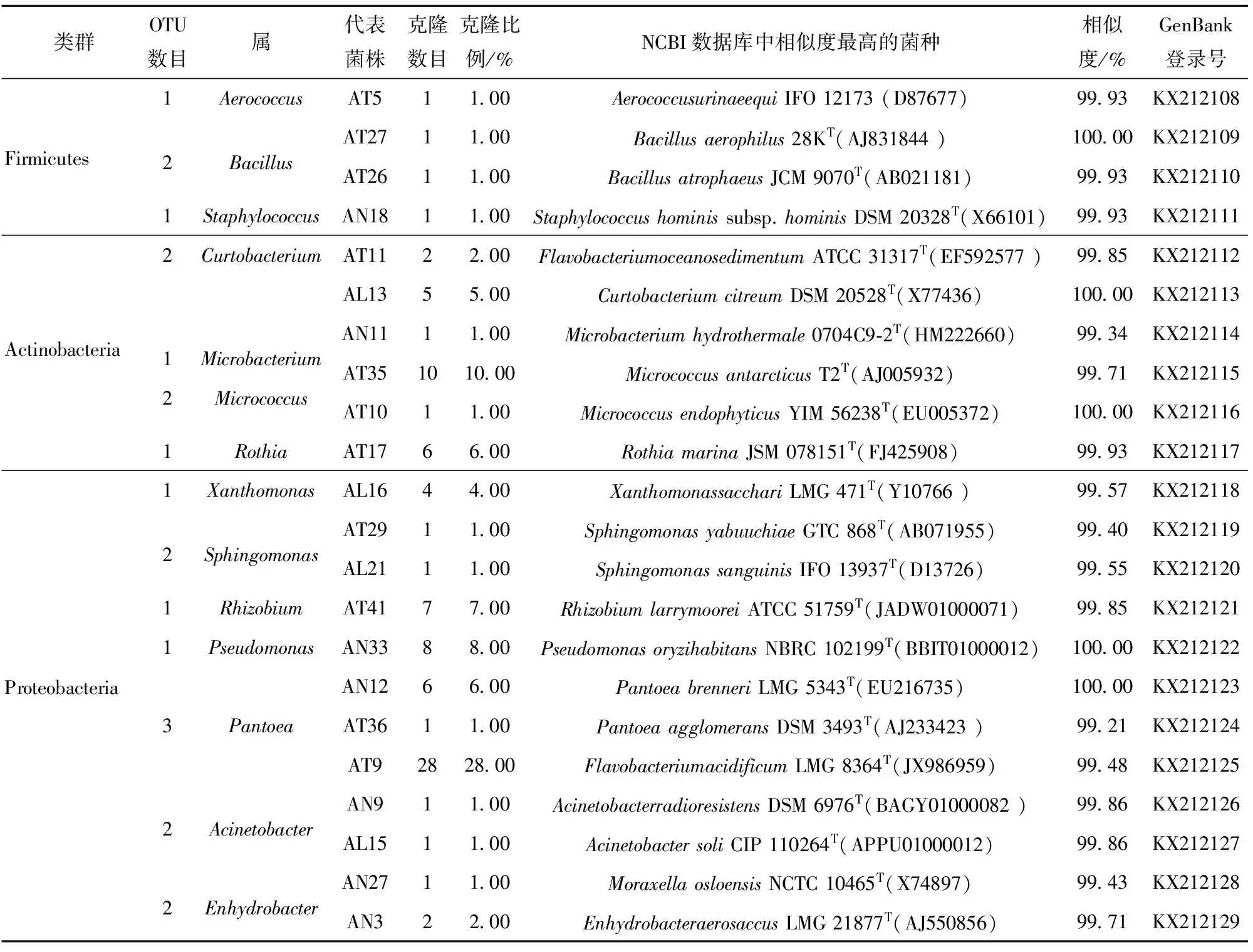
表3 杂交水稻恢复系“16A007”种子内生细菌分布
本实验中的成熟水稻亲本种子内生优势菌种存在差异。“深08S”种子内生细菌第一优势菌种是RhizobiumlarrymooreiATCC 51759T(JADW01000071),第二优势菌种是Sphingomonassanguinis,第三优势菌种是Rothiamarina。“和620S”种子内生细菌第一优势种为Curtobacteriumcitreum,第二优势菌种是Microbacteriumhydrothermale,第三优势菌种是Rhizobiumlarrymoorei。“16A007”种子内生细菌第一优势菌种为Flavobacteriumacidificum,第二优势菌种为Micrococcusantarcticus,第三优势菌种为Pseudomonasoryzihabitans。
“深08S”、“和620S”和“16A007”成熟种子存在共同的内生菌种。Pseudomonasoryzihabitans是“16A007”的第三优势菌种,是“和620S”和“深08S”的并列第五优势菌种;Rhizobiumlarrymoorei是“16A007”的第四优势菌种,是“和620S”的第三优势菌种,也是“深08S”的第一优势菌种;Rothiamarina是“深08S”的第三优势菌种,也是“16A007”的并列第五优势菌种;Curtobacteriumcitreum是“和620S”的第一优势菌种,也是“深08S”的并列第五优势菌种;Sphingomonassanguinis是“深08S”的第二优势菌种,也是“和620S”并列第五优势菌种。
3 讨 论
植物内生菌是一类非常重要的资源,现已成为植物学、微生物学、植物保护学及作物育种学等多学科研究的热点[8]。自然界中存在约100万种植物内生菌[22],但如此庞大的内生菌群至今被发现的还不到总数的15%[23]。目前在各种农作物中发现超过54个属129种以上的内生细菌,还有很多潜在的内生细菌未被发现[24-25]。目前,己报道的水稻内生细菌种类为33属64种[26]。水稻种子表面及其内部存在丰富的微生物群落资源,是多种有益微生物和病原菌的传递载体。本研究以优异杂交水稻亲本“深08S”、“和620S”及“16A007”种子为研究对象,通过传统微生物培养方法,对其处于成熟期的种子内生细菌群落多样性进行研究,旨在探究种子形成后种子内生细菌群落结构的特点及多样性,拟获得一批有益的内生菌资源,为开发新的植物益生菌剂奠定资源基础,同时揭示同一水稻材料种子形成不同时期内生细菌群落的相关性。

表4 杂交水稻亲本种子内生优势菌属及其丰度分析汇总Tab.4 Comparison of dominant genera from three seed samples of hybrid rice parents %
研究结果发现,处于成熟期的杂交水稻亲本种子内生细菌群落结构具有多样性。成熟种子“深08S”种子内生细菌分属Proteobacteria、Actinobacteria、Firmicutes及Bacteroidetes 4个类群,22个菌属,具有40个OTU,前3个优势菌属分别为Rhizobium(15.83%)、Bacillus(14.99%)、Sphingomonas(9.17%)及Curtobacterium(9.17%);“和620S”种子内生细菌分属Firmicutes、Proteobacteria及Actinobacteria 3个类群,12个菌属,具有20个OTU,前3个优势菌属分别为Curtobacterium(25.33%)、Microbacterium(15.99%)及Pantoea(11.99%);“16A007”种子内生细菌分属Firmicutes、Proteobacteria及Actinobacteria 3个类群,14个菌属,具有24个OTU,前3个优势菌属分别为Pantoea(35.00%)、Micrococcus(11.00%)及Pseudomonas(8.00%)。
本课题组曾对处于灌浆期的上述杂交水稻亲本种子内生细菌群落结构的多样性研究,发现灌浆期“深08S”种子内生细菌分属Proteobacteria及Bacteroidetes 2个类群,5个菌属,具有6个OTU,前3个优势菌属分别为Pantoea(52.04%)、Pseudomonas(31.63%)及Rhizobium(10.20%);“和620S”种子内生细菌分属Proteobacteria及Actinobacteria类群,5个菌属,具有10个OTU,前4个优势菌属分别为Pantoea(69.02%)、Pseudomonas(18.32%)、Rhizobium(5.64%)及Sphingomonas(5.64%)。“16A007”种子内生细菌分属Proteobacteria 1个类群,6个菌属,具有11个OTU,前3个优势菌属分别为Pseudomonas(45.12%)、Pantoea(41.46%)及Sphingomonas(6.10%)。
从实验结果可以看出成熟期的杂交水稻亲本种子分离获得的种子内生菌群落种类更多,内生菌群落更具有多样性。研究表明同一水稻品种不同时期菌群种类、内生优势菌属及其丰度均存在一定差异,内生细菌的种类、优势菌属及其丰度随种子成熟度而变化;不同水稻品种同一时期菌群种类、内生优势菌属及其丰度均存在一定差异,种子内生菌的组成与品种有一定的关系。同一植物不同生长时期的环境不同,会影响植物内生菌群落结构及其多样性的变化[27]。种子作为植物个体发育的一个特定阶段,含有淀粉、脂类和蛋白质等物质,为微生物的生长和繁殖提供了丰富的营养物质,种子内部营养成分及其变化对与种子联合的细菌群落具有重要的影响,种子的营养成分与其相联合的细菌可能存在一定相关性[28],特别是在种子发育过程中,淀粉等营养物质的积累和水分含量的变化会直接影响与其联合的细菌的群落结构组成[7]。不同水稻品种同一时期环境、气候条件等相同,内生菌种类、内生优势菌属及其丰度的差异,与品种有一定的关系,表明基因型能够影响内生细菌群落结构。本课题组曾开展了杂交稻种子及其亲本内生细菌群落多样性研究,发现不同基因型的杂交稻种子内生细菌优势菌群、丰度等均存在一定差异,并且与其亲本有一定的相关性[28-30]。
本研究利用传统分离培养方法对成熟期的杂交水稻亲本“深08S”、“和620S”及“16A007”种子内生细菌群落多样性进行研究,为进一步挖掘植物与内共生细菌间的互作关系提供参考依据;同时,也为进一步挖掘种子形成不同时期内生细菌群落的相关性提供了参考依据。实验分离获得丰富的水稻种子内生细菌资源,为筛选生防促生作用明显、拮抗谱较广且定殖能力良好的植物益微菌剂奠定资源基础。
致谢:中国食品发酵工业研究院中国工业微生物菌种保藏管理中心程池教授在本研究工作中提供了指导与帮助,在此特表示衷心感谢。
[1] 孙占斌,袁行方,王音娴,等. 黄瓜初花期与结瓜期叶片可培养内生细菌多样性研究[J]. 微生物学通报, 2012(6):764-772. SUN Z B, YUAN X F, WANG Y X, et al.Diversity of culturable entophytic bacteria in cucumber leaves at blossoming and fruiting stages[J]. Microbiology China, 2012(6): 764-772.
[2] KLOEPPER J W, BEAUCHAMP C J. A review of issues related to measuring colonization of plant roots by bacteria[J]. Canadian Journal of Microbiology, 1992(38): 1219-1232.
[3] 文才艺, 吴元华, 田秀玲. 植物内生菌研究进展及其存在的问题[J]. 生态学杂志, 2004, 23(2): 86-91. WEN C Y, WU Y H, TIAN X L. Recent advances and issues on the endophyte[J]. Chinese Journal of Ecology, 2004, 23(2):86-91.
[4] MURTY M G, LADHA J K. Influence ofAzospirilluminoculation on the mineral uptake and growth of rice under hytroponicconditions[J]. Plant Soil, 1988(108): 281-285.
[5] 阎孟红, 蔡正求, 韩继刚, 等. 植物内生细菌在防治植物病害中应用的研究[J]. 生物技术通报, 2004(3): 8-12. YAN M H, CAI Z Q, HAN J G, et al. The applied research of endophytic bacteria in biological control of plant disease[J]. Biotechnology Bulletin, 2004(3): 8-12.
[6] 何红, 邱思鑫, 胡方平, 等. 植物内生细菌生物学作用研究进展[J]. 微生物学杂志, 2004, 24(3): 40-45. HE H,QIU S X,HU F P,et al. Advance in biologicaleffects of endophytic bacteria[J]. Journal of Microbiology, 2004, 24(3):40-45.
[7] NELSON E B. Microbial dynamics and interactions in the spermosphere[J]. Annual Review of Phytopathology, 2004(42): 271-309.
[8] 徐亚军. 植物内生菌资源多样性研究进展[J]. 广东农业科学, 2011(24): 149-152. XU Y J. Research progress on pesources diversity of plant endophytes[J]. Guangdong Agricultural Sciences, 2011(24): 149-152.
[9] GAIERO J R, MCCALL C A, THOMPSON K A, et al. Inside the rootmicrobiome: bacterial root endophytes and plant growth promotion[J]. American Journal of Botany, 2013, 100(9): 1738-1750.
[10] 庞发虎, 杜瑞卿, 王坦, 等. 小麦内生细菌促生菌株的筛选及其影响小麦生长的因子的相关性分析[J]. 中国农业大学学报, 2016(1):8-21. PANG F H, DU R Q, WANG T, et al .Screening of wheat growth-promoting entophytic bacterial strains and correlation analysis of factors influencing wheat growth[J]. Journal of China Agricultural University, 2016(1):8-21.
[11] 姜晓宇, 高菊生, 徐凤花, 等. 水稻种子内生细菌多样性及其分泌植物生长素能力的测定[J]. 微生物学报, 2013, 53(3): 269-275. JIANG X Y, GAO J S, XU F H, et al. Diversity of endophytic bacteria in rice seeds and their secretion of indole acetic acid[J]. Acta Microbiologica Sinica, 2013, 53(3): 269-275.
[12] 傅晓方. 玉米内生固氮菌的分离鉴定及其对小麦幼苗的促生效应研究[D]. 西安:西北农林科技大学, 2011. FU X F. Isolation and identification of endophytic diazotrophic bacteria from maize and their effect on wheat seedling growth[D].Xi’an:Northwest Sci-Tech University of Agriculture and Forestry, 2011.
[13] 沈德龙, 冯永君, 宋未. 内生成团泛菌YS19对水稻乳熟期光合产物在旗叶、穗分配中的影响[J]. 自然科学进展, 2002, 12(8): 863-865. SHEN D L, FENG Y J, SONG W. Effects of endophyticPantoeaagglomerans YS19 on the distribution of photosynthate in flag leaves and spikelets in milky stage of rice[J]. Progress in Natural Science, 2002, 12(8): 863-865.
[14] CHI F, SHEN S, CHENG H, et al. Ascending migration of endophyticrhizobia, from roots to leaves, inside rice plants and assessment of benefits to rice growth physiology[J]. Applied and Environmentalmicrobiology, 2005, 71(11): 7271-7278.
[15] ADAMS P D, KLOEPPER J W.Effect of host genotype on indigenous bacterial endophytes of cotton (GossypiumhirsutumL.)[J]. Plant and Soil, 2002, 240(1): 181-189.
[16] SIMON H M, SMITH K P, DODSWORTH J A, et al. Influence of tomato genotype on growth of inoculated and indigenous bacteria in the spermosphere[J]. Applied and Environmental Microbiology, 2001, 67(2): 514-520.
[17] NEAL J L, LARSON R I, ATKINSON T G. Changes in rhizosphere populations of selected physiological groups of bacteria related to substitution of specific pairs of chromosomes in spring wheat[J]. Plant and Soil, 1973, 39(1): 209-212.
[18] CANKAR K, KRAIGHER H, RAVNIKAR M,et al. Bcterialendophytes from seeds of Norway spruce (PiceaabiesL. Karst)[J]. FEMS Microbiology Letters, 2005(244): 341-345.
[19] 胡桂萍,尤民生,刘波,等.水稻茎部内生细菌及根际细菌与水稻品种特性的相关性[J]. 热带作物学报,2010,31(6):1026-1030. HU G P, YOU M S, LIU B, et al. Study on the diversity of the endophytic bacteria and rhizosphere bacteria in rice[J]. Chinese Journal of Tropical Crops, 2010,31(6):1026-1030.
[20] WANG D,YANG S,TANG F,et al. Symbiosis specificity in thelegume-rhizobial mutualism[J]. Cellular Microbiology,2012,14(3):334-342.
[21] MINCHEOL K,HYUN-SEOK O,SANG-CHEOL P, et al. Towards a taxonomic coherence between average nucleotide identity and 16S rRNA gene sequence similarity for species demarcation of prokaryotes[J]. International Journal of Systematic and Evolutionary Microbiology, 2014(64): 346-351.
[22] GUO B, WANG Y, SUN X, et al. Bioactive natural products from endophytes: a review[J]. Biochem Microbiol, 2008, 44(2): 136-142.
[23] 江军山,张鑫.产抗菌活性物质植物内生菌的研究进展[J]. 安徽农业科学, 2010, 38(22) : 11704-11705. JIANG J S, ZHANG X. Recent advance on endophytes produeing antibacterial active substances[J].Journal of Anhui Agricultural Sciences, 2010, 38(22): 11704-11705.
[24] 徐玲玲,单庆红,郭斌.植物内生菌研究进展及应用展望[J].安徽农业科学.2013,41(13): 5641-5643. XU L L, SHAN Q H, GUO B. Endophytes research progress and application prospect[J]. Journal of Anhui Agricultural Sciences. 2013, 41(13): 5641-5643.
[25] 邹文欣,谭仁祥.植物内生菌研究新进展[M].植物学报.2001,43(9):881-892. ZOU W X, TAN R X. Recent advances on endophyte research[M]. Journal of Integrative Plant Biology, 2001, 43(9): 881-892.
[26] 王雪君.转Bt基因水稻对内生菌群落结构和多样性的影响研究[D].海口:海南大学,2015. WANG X J. The effects of transgenic Bt rice on the community structure and biodiversity of endophytes[D]. Haikou: Hainan University, 2015.
[27] 王雪君,贾瑞宗,郭运玲,等.水稻4个生长时期茎部可培养内生菌多样性分析[J]. 热带作物学报,2015(6):1078-1085. WANG X J, JIA R Z, GUO Y L, et al. Diversity of culturable endobacterial communities in rice (OryzasativaL.) stem at different growth stages[J]. Chinese Journal of Tropical Crops, 2015(6):1078-1085.
[28] 邹媛媛,刘琳,刘洋,等.不同水稻品种种子固有细菌群落的多样性.植物生态学报[J]. 2012, 36(8): 880-890. ZOU Y Y, LIU L, LIU Y, et al. Diversity of indigenous bacterial communities inOryzasativaseeds of different varieties[J]. Chinese Journal of Plant Ecology, 2012, 36(8):880-890.
[29] 刘琳,刘洋,宋未.杂交水稻种子固有细菌群落多样性探究[J].生物技术通报, 2009(1): 95-99. LIU L, LIU Y, SONG W. Indigenous bacterial community diversity in hybrid rice (OryzasativaL.) seed[J]. Biotechnology Bulletin, 2009(1): 95-99.
[30] 刘洋,赵燃,黎妮,等.超级杂交水稻种子内生细菌群落结构及其多样性[J].食品与发酵工业,2016(1):31-36. LIU Y, ZHAO R, LI N, et al. Diversity of endophytic bacterial communities in seeds of super hybrid rice (OryzasativaL.)[J]. Food and Fermentation Industries, 2016(1):31-36.
(责任编辑:李 宁)
DiversityofEndophyticBacterialCommunitiesinThreeParentalSeedsofHybridRice(OryzasativaL.)atMaturityStage
LI Nannan1, 2, 3, LI Ni1, CAO Yanhua2, ZHANG Xin2, XIAO Ming3,*, LIU Yang2,*, WANG Weiping1,4,*
(1.StateKeyLaboratoryofHybridRice,HunanHybridRiceResearchCenter,Changsha410125,China;2.ChinaCenterofIndustrialCultureCollection(CICC),ChinaNationalResearchInstituteofFoodandFermentationIndustries,Beijing100015,China;3.CollegeofLifeSciences,ShanghaiNormalUniversity,Shanghai200234,China; 4.SouthernRegionalCollaborativeInnovationCenterforGrainandOilCropsinChina,Changsha410128,China)
The objective of this study was to investigate the endophytic bacterial communities in the seeds of three rice (“Shen 08S”, “He 620S” and “16A007”) in maturity stage. Experimental results showed that the parental seeds of hybrid rice had diversity of the bacterial community structure at maturity stage. The endophytic bacterial communities in “Shen 08S” included 40 OTUs, they were belonged to Firmicutes,Proteobacteria,Actinobacteria and Bacteroidetes, among them, the abundance of the first dominant bacteriumRhizobiumwas 15.83%, the second and third dominant bacterium wasBacillus, the third dominant bacterium wasSphingomonasandCurtobacterium; The endophytic bacterial communities in “He 620S” included 20 OTUs, they were belonged to Firmicutes,Proteobacteria and Actinobacteria, the abundance of the first dominant bacteriumCurtobacteriumwas 25.33%,the second and third dominant bacterium wasMicrobacteriumandPantoea, respectively; the endophytic bacterial communities in “16A007” included 24 OTUs, belong to Firmicutes,Proteobacteria and Actinobacteria, the abudance of the first dominant bacteriumPantoeawas 35.00%, the second and third dominant bacterium wasMicrococcusandPseudomonas, respectively.From this study, we found that the endophytic bacteria species in the seeds changed with seed maturation, and the seeds in maturity stage were richer in endophytes resources, which can lay the foundation for the development of new microbial inoculants, and the endophytic bacterial community structure has certain relevance in the seeds of hybrid rice which are genetically related.
parent of hybrid rice; maturity stage; seed endophytic bacteria; culture-independent method; bacterial diversity
10.3969/j.issn.2095-6002.2017.04.008
2095-6002(2017)04-0056-09
李南南,黎妮,曹艳花,等. 3个杂交水稻亲本成熟期种子内生细菌多样性研究[J]. 食品科学技术学报,2017,35(4):56-64. LI Nannan, LI Ni, CAO Yanhua, et al. Diversity of endophytic bacterial communities in three parental seeds of hybrid rice (OryzasativaL.) at maturity stage[J]. Journal of Food Science and Technology, 2017,35(4):56-64.
2016-05-25
杂交水稻国家重点实验室开放课题基金(2014KF06);公益性行业(农业)科研专项—中国超级稻重点区域目标产量高效育种技术集成与示范(201403002);北京市科技新星计划项目(Z141105001814095)。
李南南,女,硕士研究生,研究方向为微生物区系分析与分类鉴定;
TS201.3
: A
*肖 明,男,教授,博士,主要从事微生物与植物的相互作用与微生物分子生物学方面的研究,通信作者;
*刘 洋,男,高级工程师,博士,主要从事微生物分类鉴定与植物内生菌方面的研究,通信作者;
*王伟平,男,副研究员,博士,主要从事水稻育种与种子学方面的研究,通信作者。

