HIF-1α和Rac1在肝细胞癌中的表达及其意义
王云雀,黄湘壹
(1.武汉理工大学校医院,湖北 武汉 430070;2.南华大学附属第二医院,湖南 衡阳 421001)
HIF-1α和Rac1在肝细胞癌中的表达及其意义
王云雀1,黄湘壹2
(1.武汉理工大学校医院,湖北 武汉 430070;2.南华大学附属第二医院,湖南 衡阳 421001)
目的探讨缺氧诱导因子-1α(HIF-1α)和Ras相关的C3肉毒底物1(Racl)在肝细胞癌中的表达及其临床意义。方法选取正常肝组织20例、肝硬化组织42例及肝细胞癌组织58例,应用免疫组织化学链霉菌抗生物素蛋白-过氧化物酶连结法检测组织中HIF-1α和Racl蛋白的表达,分析其表达与临床病理特征的关系,并结合临床资料进行分析。结果HIF-1α主要为胞核或胞浆着色,Rac1为胞浆着色。HIF-1α蛋白在正常肝组织中的阳性表达率为0.0%(0/20),肝硬化组织为45.2%(19/42),原发性肝癌组织为81.0%(47/58),其中高分化阳性表达率为53.3%,中分化为83.3%,低分化为100.0%。HIF-1α蛋白在原发性肝癌发生、发展中的表达依次升高(P<0.05)。且原发性肝癌组织中HIF-1α蛋白表达与淋巴结转移有关。Rac1蛋白表达在正常肝组织中的阳性表达率为0.0%(0/20),癌旁肝硬化组织为40.5%(17/42),原发性肝癌组织为77.6%(45/58),其中高分化阳性表达率为60%,中分化为73%,低分化为94.7%。Rac1蛋白在肝癌发生、发展中的表达依次升高(P<0.05)。肝癌组织Rac1蛋白表达与淋巴结转移有关。HIF-1α蛋白的阳性表达率与Rac1蛋白的阳性表达率呈正相关(P<0.05)。结论HIF-1α、Rac1与原发性肝癌癌变及进展有关,联合检测两者蛋白的表达有助于判断肝癌的病变程度及预后。
原发性肝癌;缺氧诱导因子-1α;Ras相关的C3肉毒底物1;免疫组织化学法
近年来研究显示,缺氧诱导因子1α(hypoxia inducible factor1,HIF1α)[1-4]、Ras相关的C3肉毒底物 1(ras-related C3 botulinum toxin substrate 1,Rac 1)[5-8]在许多肿瘤组织中异常表达。通过一系列信号传导,HIF-1α、Rac1在肿瘤组织中发挥多种生物学作用,促进新生血管的形成,参与肿瘤的发生、侵袭及转移。HIF-1α、Racl与肝癌共同关系的研究尚未见报道,本研究利用免疫组织化学法检测HIF-1α、Racl蛋白在肝癌中的表达,探讨HIF-1α、Racl与肝癌发生、发展的相关性,为探讨新的肝癌诊断和治疗靶点提供理论依据。
1 资料与方法
1.1 研究对象
随机选取2009年1月-2014年12月南华大学附属第二医院病理科原发性肝癌组织石蜡包埋标本58例(男性39例,女性19例)、癌旁肝硬化组织石蜡包埋标本42例(男性31例,女性11例),癌旁非硬化组织石蜡包埋标本20例(男性13例,女性7例)。其中,年龄27~71岁,平均49.2岁。58例肝癌患者术前未接受放、化疗,未使用任何抗肿瘤药物。组织学分级根据世界卫生组织2003年肿瘤细胞分化程度分类标准:低分化癌19例,中分化癌24例,高分化癌15例。TNM分期根据国际妇产科协会2000年修订的标准:Ⅰ期22例,Ⅱ期24例,Ⅲ期8例,Ⅳ期4例。淋巴结转移分类:无淋巴结转移37例,有淋巴结转移21例。上述蜡包埋标本置于10%甲醛溶液固定,经脱水、透明、浸蜡、包埋后4μm连续切片,进行苏木精-伊红染色法(hematoxylineosin staining,HE)和免疫组织化学法染色。上述所有患者的诊断经1或2位经验丰富的高级职称病理医师证实。
1.2 免疫组织化学法
采用免疫组织化学Envision二步法试剂盒(丹麦DAKO公司)检测,操作步骤如下:60℃烘烤切片2 h,石蜡切片、脱蜡、水化,90℃微波抗原热修复2 min,依次滴加30 ml/L双氧水H2O2室温下灭活内源性过氧化物酶10 min;STAT3、p-STAT3鼠抗人一抗(分别1∶100,1∶150稀释)(美国Santa Cruz公司),4℃保存16 h;聚合物增强剂(Envision自带)室温孵育20 min;酶标抗鼠/兔聚合物(Envision自带)室温孵育25 min;DAB(江苏苏州碧云天有限公司)显色。阴性对照组中以PBS(江苏苏州碧云天有限公司)代替一抗。
1.3 结果判定
HIF-1α和Rac1的结果判定标准:HIF-1α的阳性表达为细胞核或胞浆被染成浅黄色、棕黄色或黄褐色颗粒。Racl蛋白阳性表达主要位于肿瘤细胞的细胞质中,呈浅黄色或深黄色。
按染色强度计分:无染色为0分,轻度染色为1分,中度染色为2分,强染色为3分;按阳性染色细胞百分率计分:阳性细胞数≤10%为0分,阳性细胞数11%~25%为1分,阳性细胞数26%~50%为2分,阳性细胞数>50%为3分。然后将2类计分结果的乘积分为以下等级:0分为(-),1~2分为(+),3~4分为(++),5~6分为(+++)。设定(+)~(+++)为阳性表达,(-)为阴性表达。
1.4 统计学方法
数据处理采用SPSS 19.0统计软件,计数资料以率(%)表示,采用χ2检验,两两比较,校正检验水准α=0.0125,相关分析计算Spearman等级相关系数,P<0.05差异有统计学意义。
2 结果
2.1 HIF-1α、Racl在癌旁非硬化肝组织和原发性肝癌组织中的表达
免疫组织化学法结果显示,HIF-1α的阳性表达为细胞核或胞浆被染成浅黄色、棕黄色或黄褐色颗粒。癌旁非硬化、癌旁肝硬化及原发性肝癌3组组织中HIF-1α表达比较,经χ2检验,差异有统计学意义(χ2=41.945,P=0.000)(见表1)。癌旁非硬化、癌旁肝硬化及原发性肝癌组织中HIF-1α的阳性表达率分别为0.0%、45.2%和81.0%,原发性肝癌组织中HIF-1α高于癌旁肝硬化和癌旁非硬化肝组织(χ2=36.325和13.910,均P=0.000),癌旁肝硬化组织中HIF-1α表达高于癌旁非硬化肝组织(χ2=10.038,P=0.002)。
Racl蛋白阳性染色主要定位于肿瘤细胞的细胞质中,呈浅黄色或棕黄色。癌旁非硬化、癌旁肝硬化及原发性肝癌3组组织中Racl表达比较,经χ2检验,差异有统计学意义(χ2=35.167,P=0.000)(见表1)。癌旁非硬化、癌旁肝硬化及原发性肝癌组织中 Racl的阳性表达率分别为 0.0%、40.5%和77.6%,原发性肝癌组织中Racl高于癌旁肝硬化和癌旁非硬化肝组织(χ2=14.293和32.386,均P= 0.000),癌旁肝硬化组织中Racl表达高于癌旁非硬化肝组织(χ2=8.276,P=0.004)。
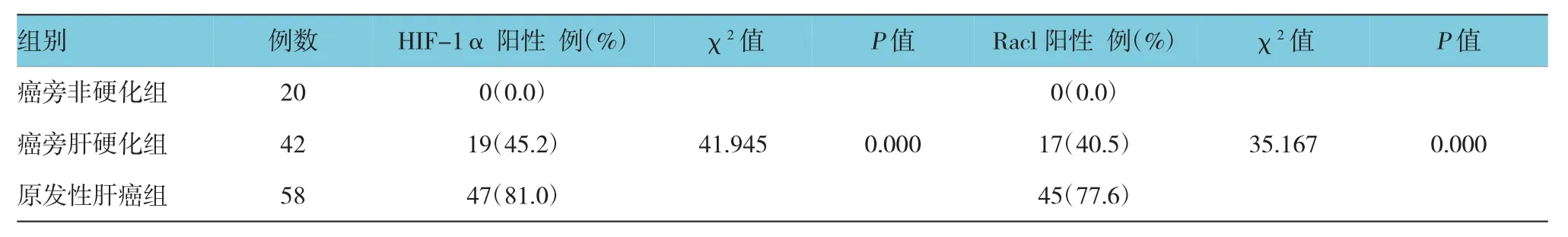
表1 3组H I F-1α、R ac1阳性率的比较
2.2 HIF-1α、Racl与原发性肝癌的组织学分级、分期及淋巴转移的关系
根据临床分期对患者进行分组,Ⅲ、Ⅳ期和Ⅰ、Ⅱ期原发性肝癌中,HIF-1α的阳性表达率分别为91.7%(11/12)和78.3%(36/46),经χ2检验,差异无统计学意义(χ2=0.749,P=0.291);Ⅲ、Ⅳ期和Ⅰ、Ⅱ期原发性肝癌中,Rac1的阳性表达率分别为91.7%(11/12)和73.9%(34/46),经χ2检验,差异无统计学意义(χ2=1.725,P=0.189)。见表2。
根据组织学分化程度对患者进行分组,低、中、高分化组HIF-1α的阳性表达率分别为100.0%(19/19)、83.3%(20/24)和53.3%(8/15),经χ2检验,差异有统计学意义(χ2=12.019,P=0.002)。低、中、高分化组Rac1的阳性表达率分别为94.7%(18/19)、75.0%(18/24)和53.3%(8/15),经χ2检验,差异有统计学意义(χ2=8.299,P=0.016)。见表2。

表2 不同病理特征的H IF-1α、Rac1蛋白表达阳性率比较
根据淋巴结状态对患者进行分组,无淋巴结转移组和淋巴结转移组HIF-1α的阳性表达率分别为70.3%(26/37)和100.0%(21/21),经χ2检验,差异有统计学意义(χ2=7.704,P=0.006),淋巴结转移组HIF-1α阳性表达率高于无淋巴结转移组;淋巴结转移组和无淋巴结转移组原发性肝癌中,Rac1的阳性表达率分别为67.6%(25/37)和95.2%(20/21),经χ2检验,差异有统计学意义(χ2=5.898,P=0.015),淋巴结转移组Rac1阳性表达率高于无淋巴结转移组。见表2。
2.3 在癌旁肝硬化组织和原发性肝癌组织中HIF-1α与R ac1表达的相关性
42例癌旁肝硬化组织组织中,Racl和HIF-1α蛋白共同表达阳性14例,共同表达阴性20例,采用Spearman等级相关性分析,Racl与HIF-1α蛋白的表达呈正相关(r=0.314,P=0.012)。见表3。

表3 癌旁肝硬化组织中HIF-1α与Rac1蛋白表达的关系 例
58例原发性肝癌组织中,Racl和HIF-1α蛋白共同表达阳性40例,共同表达阴性6例,采用Spearman等级相关性分析,Racl与HIF-1α蛋白的表达呈正相关(r=0.486,P=0.008)。见表4。
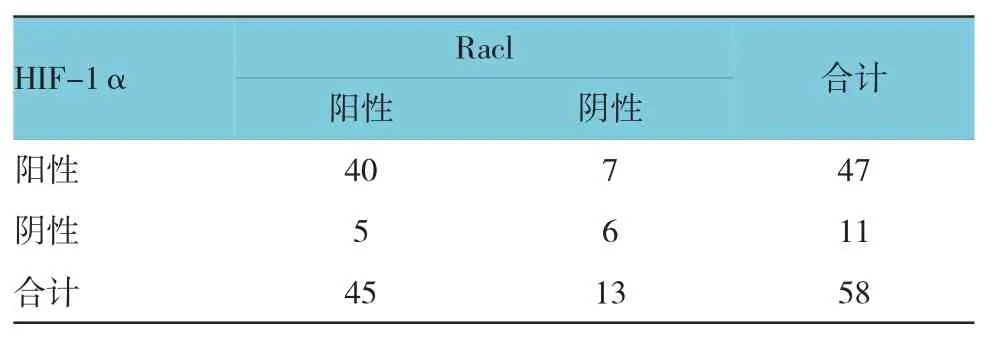
表4 原发性肝癌组织中H I F-1α与R ac1蛋白表达的关系例
3 讨论
肝癌是严重威胁我国人民群众健康的主要疾病之一。近年来,肝癌的发病率有明显上升趋势,且发病呈年轻化趋势。从正常肝组织到肝硬化直至原发性肝癌的演变与高危型HBV感染有关,但是一过性、单纯的HBV感染不足以引起细胞发生癌变,而且从病毒感染发展到肝癌要经历相当长的一段时间。由此可以推测肝癌的发生、发展是多个因素、多个环节共同作用的结果。近年来,一些研究发现HIF-1α、Rac1蛋白与肝癌关系密切。
HIF-1α尽管在正常氧浓度下也表达,但是很快可被泛素蛋白酶体系统所降解;而在缺氧状态时是血管生成的核心调控因子,其降解过程被阻断,导致HIF-1α在核内蓄积,与β蛋白亚基结合,形成有活性的HIF-1启动多种下游基因[3],至今已明确的靶基因有100余种,主要分为以下几类:①参与肿瘤细胞的增殖和凋亡的基因;②编码与肿瘤侵袭和转移相关蛋白的基因,如MMP;③参与血管发育、重塑与张力调节的基因等,如ⅠNOS、VEGF、EGF和uPA;④调节红细胞生成的基因,如EPO;⑤参与葡萄糖转运代谢及胶原合成的基因[9-11];⑥其他类基因:如肠三叶因子(肠黏膜屏障的保护因子)。由此可见,在上述诸多方面HIF-1α靶基因的编码产物发挥相当重要的作用。
肿瘤生长到特定时期,氧的供给不能满足肿瘤生长的需要,或因间质压力上升至肿瘤不成熟血管塌陷时,局部微环境处于缺氧状态,这是实体性肿瘤物理微环境的基本特征之一,可刺激宿主细胞和肿瘤细胞合成分泌促血管生成因子,促进局部新生血管形成。缺氧条件下HIF-1α启动多种下游基因,如胰岛素样生长因子21、胰岛素样生长因子22、血管内皮生长因子等[3,12-13],从而维持肿瘤细胞的能量供应,使细胞适应缺氧状态,促进肿瘤细胞的生长和分裂,而且可通过减少有氧代谢中反应性氧类对细胞DNA复制的破坏,促进肿瘤的增殖和转移。
大量免疫组织化学法证明,HIF-1α在人类多种肿瘤中表达增加,HIF-1α通过调节不同靶基因的转录活性及其自身的表达,参与肿瘤的增殖、凋亡、侵袭、转移等过程,其过度表达与恶性肿瘤的不良预后有关[14]。张咏梅等[15]对36例肺癌组织和12例癌旁组织采用RT-PCR、凝胶电泳半定量方法检测HIF-1α的表达,结果显示,HIF-1 mRNA在癌症组织中的表达高于癌旁组织,有淋巴结转移组和有远处转移组中的表达高于无淋巴结转移组和无远处转移组。SHI等[16]研究发现,HIF1通过促进QSOX1的表达有助于胰腺癌细胞的入侵。本实验研究结果也显示,HIF-1α蛋白在原发性肝癌组织中的表达高于癌旁肝硬化组织组织和癌旁非硬化组织,且原发性肝癌组织HIF-1α表达与浸润深度、淋巴结转移、临床分期相关。HIF-1α蛋白在癌旁非硬化组织、癌旁肝硬化组织及原发性肝癌组织中的表达率分别为0.0%(0/20),145.2%(17/42)和81.0%(47/58),其中肝癌Ⅲ、Ⅳ期阳性表达率高于Ⅰ、Ⅱ期(91.7%vs 78.3%),随着分化程度的降低阳性率升高(53.3%、83.3%和100%)。伴有淋巴结转移者阳性率高于不伴有淋巴结转移者,说明HIF-1α蛋白高表达的肝癌具有更强的侵袭能力,提示HIF-1α其过度表达可能与肝癌不良预后有关,对其表达程度的检测具有重要的生物学和临床价值。
Rac-1基因位于人染色体7p22,Rac1基因启动子富含GC碱基,具有管家基因的特征,其编码产物是小G蛋白Rho家族重要成员,有(Rac1、Rac2、Rac3)3个亚型。Rac1蛋白可广泛表达于机体各组织中,通过结合或水解GTP核苷酸,在GDP结合形式(失活状态)与GTP结合形式(激活状态)间相互转换[17]。肿瘤组织中,活性形式的Rac1蛋白参与通过调节细胞丝状伪足的生成和膜皱缩[17-19],调节肿瘤细胞的运动,影响肿瘤的生长。此外,Rac-1还通过增加细胞内超氧化物阴离子,可抑制肿瘤细胞发生凋亡[6],对肿瘤的发展、侵袭及转移发挥重要作用。
目前大多数实验表明,Rac1与人类恶性肿瘤的发生、发展关系密切,在多种恶性肿瘤中呈过表达。彭慧娟等[20]通过比较卵巢正常组织与卵巢良性浆液性囊腺瘤组织、卵巢浆液性腺癌组织中的Rac1蛋白的表达水平,发现Rac1可能影响细胞的增殖和细胞迁移能力从而促进肿瘤细胞的恶性生物行为,导致卵巢浆液性腺癌组织中Rac1蛋白表达水平高于卵巢良性浆液性囊腺瘤组织和卵巢正常组织;孙旭日等[21]应用免疫组织化学法检测Rac1、VEGF在43例肝细胞癌组织、43例癌旁肝组织及21例正常肝组织的表达,发现Rac1蛋白在肝细胞癌组织表达高于癌旁肝组织,可能是通过上调VEGF的表达促进肿瘤血管生成,参与肝细胞癌的侵袭、转移机制。田锐等[22]分别采用EDU和CCK-8方法检测Rac1对胰腺癌细胞增殖的影响,结果发现Rac1可以促进胰腺癌细胞的增殖。越来越多的报道证实,Rac1在肿瘤及其增殖、转移过程中发挥重要作用。本实验研究结果表明,在原发性肝癌组织中Rac1的表达高于癌旁非硬化组织,且与浸润深度、淋巴结转移、临床分期相关。癌旁硬化组织Rac1表达高于癌旁非硬化组织。Rac1蛋白在癌旁非硬化组织、癌旁硬化组织及原发性肝癌组织中的表达率分别为0.0%(0/20),40.5%(17/42)和77.6%(45/58),其中肝癌Ⅲ、Ⅳ期阳性表达率高于Ⅰ、Ⅱ期(91.7%vs 73.9%),随着分化程度的降低阳性率升高(60.0%、75.0%和94.7%)伴有淋巴结转移者阳性率为95.2%,高于不伴有淋巴结转移者(67.6%)。
在某些恶性肿瘤中存在HIF-1α和Rac1蛋白共同表达的情况。毕国斌等[23]应用免疫组织化学法检测63例人胃癌组织和40例癌旁组织标本中HIF-1α和Rac-1的表达,发现胃癌组织中HIF-1α和Rac-1的表达增加,与胃癌的侵袭性生物学行为密切相关,且表达呈正相关。DU等[24]研究发现,Rac1在人类乳腺癌中能激活促进HIF-1α的表达。本研究分析显示,HIF-1α与Rac1的表达在肝癌前病变及肝癌中呈正相关,提示HIF-1α与Rac1可能关系密切。
综上所述,HIF-1α和Rac1在肝癌前病变及原发性肝癌组织中的表达水平均增高,浸润深度越深,分化程度越低,表达水平越高。且在原发性肝癌组织中两者的表达呈正相关,提示在肝癌的病理演变过程中,HIF-1α与Rac1相互间可能存在协同调控作用,促进肝癌的进展和转移。分析两者协同作用的机制可能为肿瘤组织中Racl通过激活p38 MAPK活化HIF-1α末端活性区,提高HIF-1α的转录活性[25],且通过抑制VHL蛋白水平,Rac1可在低氧状态下增加HIF-1α的稳定性[26]。
总之,HIF-1α和Rac1的联合检测有助于评价原发性肝癌的生物学行为和预后,为早期诊断和治疗提供理论依据。
[1]JEMAL A,FORMAN D,BRAY F,et al.Global cancer statistics, 2012[J].Ca A Cancer Journal for Clinicians,2011,61(2):69-90.
[2]NJEI B,ROTMAN Y,DITAH I,et al.Emerging trends in hepatocellular carcinoma incidence and mortality[J].Hepatology,2015, 61(1):191-199.
[3]SEMENZAg L.Targeting HIF-1 for cancer therapy[J].Nat Rev Cancer,2003,3(10):721-732.
[4]BROWN J M.Exploiting the hypoxic cancer cell:mechanisms and therapeutic strategies[J].Mol Med Today,2000,6:157-162.
[5]GÓMEZD P T,BANDRÉS E,ESPINA C,et al.Differential expression of Rac1 identifies its targetgenes and its contribution to progression of colorectal cancer[J].International Journal of Biochemistry Cell Biology,2007,39(12):2289-2302.
[6]PERVAIZ S,CAO J,CHAO O S,et al.Activation of the RacGTPase inhibits apoptosis in human tumor cells[J].Oncogene, 2001,20(43):6263.
[7]LEE T K,POON R T,YUEN A P,et al.Rac activation is associated with hepatocellular carcinoma metastasis by up-regulation of vascular endothelialgrowth factor expression[J].Clinical Cancer Research an Official Journal of the American Association for Cancer Research,2006,12(17):5082.
[8]郝晓凤,惠延年,王雨生,等.Rac1和HIF-1在激光诱导小鼠脉络膜新生血管模型组织中的表达[J].眼科新进展,2007,27(6):401-404.
[9]KESWANI S C,BOSCH-MARCÉ M,REED N,et al.Nitric oxide preventsaxonal degeneration by inducingHIF-1-dependent expression of erythropoietin[J].Proc Natl Acad Sci USA,2011, 108(12):4986-4990.
[10]BAND M,JOEL A,HERNANDEZ A,et al.hypoxia-induced BNIP3 expression and mitophagy:in vivo comparison of the rat and the hypoxia-tolerant mole rat,spalax ehrenbergl[J].FASEB J,2009,23(7):2327-2335.
[11]JIANG H,FENG Y.Hypoxia-inducible factor 1α (HIF-1α) correlated with tumorgrowth and apoptosis in ovarian cancer[J]. International Journal ofgynecological Cancer,2006,16(1):405-412.
[12]PAN X Y,ZHANG Z H,WU L X,et al.Effect of HIF-1a/VEGF signaling pathway on plasma progesterone and ovarian prostaglandin F2a secretion during luteal development of pseudopregnant rats[J].Genetics Molecular Researchgmr,2015,14(3):8796-809.
[13]URANO N,FUJIWARA Y,DOKI Y,et al.Overexp ression of hypoxia-inducible factor-alpha in gastric adenocarcinoma[J].gastric Cancer,2006,9(1):44-49.
[14]周明利.HIF-1α与EMT在肿瘤中的作用及意义研究进展[J].中国普通外科杂志,2012,21(9):1132-1136.
[15]张咏梅.HIF-1α、GLUT 1、MRP 1和GST-π在非小细胞肺癌组织中的表达及意义[J].肿瘤,2008,28(3):263-267.
[16]SHI C Y,FAN Y,LIU B,et al.HIF1 Contributes to hypoxia-induced pancreatic cancer cells invasion via promoting QSOXI expression[J].Cell Physiol Biochem,2013,32(3):561-568.
[17]HEASMAN S J,RIDLEY A J.Mammalian hogTP ases:new insights into their functions from in vivo studies[J].Natev Mol Cell Biol,2008,9(9):690-701.
[18]RIDLEY A J,SCHWARTZ M A,BURRIDGE K,et al.Cell migration:integrating signals from front to back[J].Science,2003, 302(5651):1704-1709.
[19]DEL-POZO M A,ALDERSON N B,KlOSSES W B,et al.Integrins regulateac targeting by internalization of membrane domalns[J].Sclence,2004,303(5659):839-842.
[20]彭慧娟,张瑜,等.Rac1蛋白在卵巢癌组织中的表达及其对卵巢癌细胞株SKOV3增殖及迁移的作用[J].第三军医大学学报,2013, 35(13):1402-1405.
[21]孙旭日,李新丰,王伟,等.Rac1 VEGF在肝细胞癌中的表达和肿瘤血管形成关系[J].中国肿瘤临床,2013,40(4):212-216.
[22]田锐,郭兴军,江建新,等.Rac1对胰腺癌增殖的影响及其机制[J].世界华人消化杂志,2013,21(12):1070-1074.
[23]毕国斌,王子安,郭冰沁.HIF-1A和Rac-1在胃癌组织中的表达及临床意义[J].临床肿瘤学杂志,2010,15(2):109-113.
[24]DU J,XU R,HU Z,et al.PI3K and ERK-induced Rac1 activation mediates hypoxia-induced HIF-1α expression in MCF-7 breast cancer cells[J].PLoS One,2011,6(9):DOI:10.1371/journal. pone.0025213.
[25]HIROTA K,SEMENZAg L.Rac1 activity is required for the activation of hypoxia-inducible factor 1[J].J Blol Chem,200l, 276:21166-21172.
[26]TERENCE K,RONNlE T,ANTHONY P,et al.Rac activation is assoaciated with hepatocellular carcinoma metastasis by up-regulation of vascular endothelialgrowth factor expression[J]. Clin Canaer Res,2006,12(17):5082-5089.
(童颖丹 编辑)
Expressions of HIF-1α and Rac1 and their significance in hepatocellular carcinoma
Yun-que Wang1,Xiang-yi Huang2
(1.School Infirmary,Wuhan University of Technology,Wuhan,Hubei 430070,China;2.The Second Affiliated Hospital,University of South China,Hengyang,Hunan 421001,China)
ObjectiveTo explore the expressions of hypoxia inducible factor 1 (HIF-1α)and Rac1 proteins and their clinical significance in hepatocellular carcinoma.MethodsImmunohistochemistry streptavidinperoxidase (SP)method was used to detect the expressions of HIF-1αand Rac1 proteins in 58 cases of hepatocellular carcinoma,42 cases of hepatocirrhosis and 20 cases of normal liver tissues.The findings were analyzed on basis offollow-up information.MethodsThe cellularstaining pattern forHIF-1α was predominantly in the nuclei or cytoplasm,while Rac1 was positively expressed in the cytoplasm.The positive rates of HIF-1α in the normal liver tissues,the hepatocirrhosis tissue and the hepatocellular carcinoma were 0.0%(0/20),45.2%(19/42)and 81.0%(47/58)respectively,and there were significant differences among the threegroups(P<0.05).The expression of HIF-1α protein in the hepatocellular carcinoma was closely correlated with the histologicalgrade,TNMgrade and lymphatic metastasis(P<0.05).The positive rates of Rac1 in the normal liver tissues,the hepatocirrhosis tissue and the hepatocellular carcinoma were 0.0%(0/20), 40.5%(17/42)and 77.6%(45/58)respectively,and there were significant differences among thegroups(P<0.05). The expression of Rac1 protein in the hepatocellular carcinoma was closely correlated with the histologicalgrade,TNMgrade and lymphatic metastasis (P<0.05).Spearman rank correlation analysis revealed a positivecorrelation between HIF-1α and Rac1 expressions in the hepatocellular carcinoma(P<0.05).ConclusionsThe expressions of HIF-1α and Rac1 are related to the canceration and progress of hepatocellular carcinoma,their united application can be used to determine the degree and prognosis of hepatocellular carcinoma.
hepatocellular carcinoma;hypoxia inducible factor-1α;Ras-related C3 botulinum toxin substrate 1;immunohistochemistry
R735.7
A
2016-04-26
黄湘壹,E-mail:417354749@qq.com;Tel:13786494910
10.3969/j.issn.1005-8982.2017.20.016
1005-8982(2017)20-0076-06

