CEUS定量分析鉴别小肝癌分级
涂海斌,郭 佳,林健玲,陈志恒
(1.福建医科大学孟超肝胆医院超声科,福建 福州 350001;2.东方肝胆外科医院超声科,上海 200082)
CEUS定量分析鉴别小肝癌分级
涂海斌1,郭 佳2*,林健玲1,陈志恒2
(1.福建医科大学孟超肝胆医院超声科,福建 福州 350001;2.东方肝胆外科医院超声科,上海 200082)
目的探讨CEUS定量分析鉴别不同病理级别小肝癌的价值。方法回顾性分析112例经手术切除或穿刺活检病理证实为肝细胞癌(HCC)的患者资料,单个肿瘤最大径或2个最大肿瘤最大径之和≤3 cm。将112例按病理Edmondson分级不同分为高分化组(n=50,Edmondson分级Ⅰ、Ⅱ级)、中分化组(n=32,Ⅲ级)及低分化组(n=30,Ⅳ级)。应用Qontraxt超声定量分析软件分别测量肿瘤最大造影强度(TMAX)、肿瘤达到最大造影强度时周边组织造影强度(NT)、周边组织最大造影强度(NTMAX),并计算TMAX与NT的比值(TMAX/NT)和TMAX与NTMAX的比值(TMAX/NTMAX)。记录肿瘤初次显影时间、肿瘤显影达峰时间、肿瘤廓清时间,比较3组间的差异。结果高分化、中分化及低分化组间,TMAX、TMAX/NTMAX和肿瘤廓清时间差异有统计学意义(P均<0.05)。低分化组TMAXT TMAX/NTMAX最高、肿瘤廓清时间最短,高分化组TMAX和TMAX/NTMAX最低、肿瘤廓清时间最长。3组间NT、NTMAX、TMAX/NT、肿瘤初次显影时间、肿瘤显影达峰时间差异均无统计学意义(P均>0.05)。结论CEUS定量分析有助于鉴别不同病理级别小肝癌。
癌,肝细胞;超声检查;定量分析
肝细胞癌(hepatocellular carcinoma, HCC)是肝脏最常见的原发性恶性肿瘤[1-2],肝炎后肝硬化是肝癌发生的重要原因[3],肝炎肝硬化患者相对于无肝硬化患者罹患肝癌的风险率超过100倍[4-5]。尽管手术切除对小肝癌的治疗相对于肝动脉化疗栓塞术及射频消融的并发症较多,但手术切除具有较高的3年无瘤生存率,仍是目前治疗早期小肝癌的首选方法[6]。患者的一般情况、手术方式、术后护理及肿瘤病理等级等均与预后有关,其中肿瘤分级对预后具有重要影响,高分化肿瘤(Edmondson分级Ⅰ、Ⅱ级)较中分化(Edmondson分级Ⅲ级)和低分化(Edmondson分级Ⅳ级)肿瘤患者预后更好[7]。CEUS对检出肝脏恶性肿瘤具有更高的敏感度与特异度[8],现已广泛应用于肝脏良恶性肿瘤的鉴别诊断,然而对于恶性肿瘤的细化分级并未大规模应用。本研究拟应用超声定量分析软件Qontraxt分析不同病理分级小肝癌量化参数的差异,以期为临床提供更多有价值的信息。
1 资料与方法
1.1一般资料 回顾性分析2013年7月—2016年9月我院经手术切除或穿刺活检病理证实的112例小肝癌患者的资料,男74例,女38例,年龄19~83岁,中位年龄54岁。纳入标准:①首次发病且病理诊断为HCC的原发性肝癌患者;②单个肿瘤最大径或2个最大肿瘤最大径之和≤3 cm;③均于活检或术前1周内接受CEUS检查。排除标准:①继发性肝癌、胆管细胞癌及混合细胞癌患者;②原发性肝癌治疗后复发者;③CEUS检查前已接受肝癌的干预治疗,如经导管动脉化疗栓塞、射频消融、化疗、放疗等。112例患者共161个病灶,其中75例为单发病灶,25例为2个病灶,12例为3个病灶;肿瘤最大径0.65~3.00 cm,平均(1.92±1.00)cm。依据2015版原发性肝癌规范化病理诊断方案专家共识[9],分为高分化(Edmondson分级Ⅰ、Ⅱ级)组50例,中分化(Edmondson分级Ⅲ级)组32例,低分化(Edmondson分级Ⅳ级)组30例。
1.2仪器与方法
1.2.1CEUS检查 采用Esaote Mylab-90彩色超声诊断仪,4C1探头。超声造影剂采用声诺维(Bracco公司),以5 ml生理盐水稀释,充分振荡后经肘部浅静脉团注,剂量1.5~2.2 ml,后跟注5 ml生理盐水。对所有患者均行CEUS检查,将超声仪器调整为造影模式,选取可清晰显示肿瘤的切面,嘱患者平静呼吸,注射造影剂的同时开启视频存储器,每个病灶观察时间持续5 min。
1.2.2定量分析 采用Qontraxt超声定量分析软件对CEUS图像进行分析。选取可清楚显示病灶的造影图像,于肿瘤造影显示较清晰的部位及与肿瘤同一深度且周边无大血管的肝实质内选取ROI,软件自动测量ROI内肿瘤最大造影强度(maximum intensity of tumour, TMAX)、肿瘤达到最大造影强度时周边组织造影强度(nontumour's intensity, NT)、周边组织最大造影强度(maximum intensity of nontumour, NTMAX),记录肿瘤初次显影时间、肿瘤显影达峰时间、肿瘤廓清时间,计算TMAX与NT的比值(TMAX/NT)及TMAX与NTMAX的比值(TMAX/NTMAX)。
1.3统计学分析 采用SPSS 19.0统计分析软件。计量资料以±s表示。3组间患者性别比较采用χ2检验,患者年龄、TMAX、NT、NTMAX、肿瘤初次显影时间、肿瘤显影达峰时间、肿瘤廓清时间、TMAX/NT及TMAX/NTMAX值比较采用Kruskal-WallisH秩和检验。如3组间比较差异有统计学意义,则以Bonferroni校正概率调整显著性水平,采用两独立样本的Wilcoxon秩和检验进行两两比较。以P<0.05为差异有统计学意义。
2 结果
高分化、中分化及低分化组患者临床资料及超声定量分析指标比较见表1。3组间比较,TMAX、TMAX/NTMAX及肿瘤廓清时间差异有统计学意义(P均<0.05),组间两两比较差异均有统计学意义(P均<0.05)。其中低分化组TMAX和TMAX/NTMAX最高,高分化组TMAX和TMAX/NTMAX最低,且低分化组和中分化组TMAX/NTMAX均>1(图1),而高分化组TMAX/NTMAX<1(图2);低分化组肿瘤廓清时间最短(图3),高分化组肿瘤廓清时间最长(图4)。

表1 高分化、中分化及低分化组患者临床资料及超声定量分析指标比较
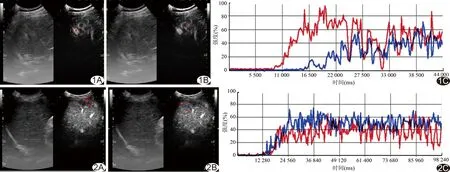
图1 患者男,49岁,中分化组,Edmondson分级Ⅲ级,CEUS定量分析 A.红色方块为肿瘤组织; B.蓝色方块为周边正常肝组织; C.肿瘤组织与正常肝组织造影强度对比,肿瘤组织TMAX>NTMAX 图2 患者男,55岁,高分化组,Edmondson分级Ⅱ级,CEUS定量分析 A.红色方块为肿瘤组织; B.蓝色方块为周边正常肝组织; C.肿瘤组织与正常肝组织造影强度对比,肿瘤组织TMAX 图3 患者男,81岁,低分化组,Edmondson分级Ⅵ级 A~D.分别为造影21、37、80、120 s时的CEUS图像,可见肿瘤与周边组织相比呈“快进快出”的表现,注射造影剂37 s后肿瘤回声持续低于周边组织 图4 患者男,65岁,高分化组,Edmondson分级Ⅱ级 A~D.分别为造影22、44、77、139 s时CEUS图像,可见肿瘤与周边组织相比呈“快进慢出”的表现,注射造影剂132 s后肿瘤回声较周边组织低 肝癌的预后与患者的年龄、肝功能储备、是否有肝硬化及肝硬化的严重程度、术后病理分级、有无微血管癌栓等因素有关。其中病理分级可对预后起重要作用,高分化、中分化及低分化HCC患者的5年生存率、无瘤生存率差异均有统计学意义[10-11]。目前只有穿刺活检可于术前获得准确的病理结果,但因其为有创检查,临床应用受限。因CEUS实时、可重复及低风险且诊断效能与增强CT、MRI相似[12-13]等优点,近年来临床应用逐渐推广。本研究发现,不同分化等级的小肝癌间TMAX差异有统计学意义(P<0.001),高分化肿瘤TMAX最低,其次为中分化肿瘤,低分化肿瘤TMAX最高。分析原因主要为:①各分化等级的肿瘤内微血管密度不同,已有研究[14]发现在CD34阳性的肝癌患者中,造影峰值强度与肿瘤微血管密度呈明显的正相关,低分化肿瘤内微血管密度最高,高分化肿瘤微血管密度最低,造影剂填充于肿瘤微血管内的含量越高,造影强度越高;低分化肿瘤内微血管密度最高,造影剂含量最多,因此导致低分化肿瘤TMAX最高;②与肝癌的进展过程有关,肝癌的发生常由异型增生结节逐步发展而来,分化等级越低异型性越明显,高分化者异型性较低,肿瘤组织内尚残存部分小梁结构,但正常肝窦组织缺失,新生滋养血管较少,门静脉供血减少,而动脉供血尚未发育完全,导致其TMAX最低且低于NTMAX;中分化及低分化肿瘤血供发育较完全,供血较周边组织丰富,因此肿瘤内造影剂含量较高,导致其TMAX高于高分化肿瘤及NTMAX;③不同分化等级的肿瘤供血血管及造影剂行程不同,中、低分化肿瘤主要由肝动脉供血,造影剂由前臂静脉回流至右心房,经肺循环到达左心后经主动脉进入肝动脉,直接滋养肿瘤组织;高分化肿瘤主要由门静脉供血,造影剂由前臂静脉回流至右心房,经肺循环到达左心后经主动脉进入肠系膜上动脉,而后经肠系膜上静脉及脾静脉回流汇合为门静脉后滋养肿瘤组织;造影微泡可能在这一过程中发生损毁,导致中分化及低分化肿瘤TMAX高于高分化肿瘤。此外,本研究结果显示高分化肿瘤TMAX/NTMAX<1,而中、低分化肿瘤TAMX/NTMAX>1,考虑其亦由肝癌的进展过程所致。 本研究还发现高分化、中分化及低分化组肿瘤廓清时间差异有统计学意义(P<0.001),且分化等级越高,廓清时间越长,与Boozari等[15-16]的研究结果相符。其原因可能由于高分化病灶滋养血管增生较少,且末端不交通或交通支发育不完善,动静脉瘘发生较少,导致造影后微泡无法经交通静脉回流而滞留于残存肝血窦,廓清时间延长。而中、低分化肿瘤滋养血管及动静脉瘘较丰富,红细胞在未到达肿瘤细胞前即经瘘口流出,导致微泡在病灶的滞留时间大幅缩短,也是低分化病灶易发生缺血坏死的原因之一。 既往研究[17-18]多对不同肿瘤造影强度间的差异进行比较,少见肿瘤造影强度与正常组织造影强度间相关关系的研究。本研究计算TMAX/NTMAX比值,发现高分化组该比值<1,中分化及低分化组>1,并且低分化组TMAX/NTMAX最高,中分化组次之,提示该比值可能对肿瘤分化程度具有一定的提示意义。 本研究的不足:未对TMAX/NTMAX的诊断效能进行评价,将在今后的研究中进一步完善。 总之,本研究将CEUS与分析软件相结合,发现不同分化等级的原发性小肝癌的超声定量分析指标有所不同,有助于为临床诊断提供有价值的信息。 [1] Jemal A, Bray F, Center MM, et al. Global cancer statistics. CA Cancer J Clin, 2011,61(2):69-90. [2] Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer, 2010,127(12):2893-2917. [3] Raffetti E, Fattovich G, Donato F. Incidence of hepatocellular carcinoma in untreated subjects with chronic hepatitis B: A systematic review and meta-analysis. Liver Int, 2016,36(9):1239-1251. [4] Do AL, Wong CR, Nguyen LH, et al. Hepatocellular carcinoma incidence in noncirrhotic patients with chronic hepatitis B and patients with cirrhosis of all etiologies. J Clin Gastroenterol, 2014,48(7):644-649. [5] Sherman M. Hepatocellular carcinoma:Epidemiology, surveillance, and diagnosis. Semin Liver Dis, 2010,30(1):3-16. [6] Guo W, He X, Li Z, et al. Combination oftransarterial chemoembolization (TACE) and radiofrequency ablation (RFA) vs surgical resection (SR) on survival outcome of early hepatocellular carcinoma: A meta-analysis. Hepatogastroenterology, 2015,62(139):710-714. [7] Jin J, Jung HY, Lee KH, et al. Nuclearexpression of hepatitis B virus X protein is associated with recurrence of early-stage hepatocellular carcinomas: Role of viral protein in tumor recurrence. J Pathol Transl Med, 2016,50(3):181-189. [8] 郭君,梁媛,严剑英,等.实时超声造影鉴别诊断肝脏良、恶性病变.中国医学影像技术,2008,24(9):1434-1437. [9] 中国抗癌协会肝癌专业委员会,中华医学会肝病学分会肝癌学组,中国抗癌协会病理专业委员会,等.原发性肝癌规范化病理诊断指南(2015版).临床与实验病理学杂志,2015,31(3):241-246. [10] Poon RT, Ng IO, Fan ST, et al. Clinicopathologic features of long-term survivors and disease-free survivors after resection of hepatocellular carcinoma: A study of a prospective cohort. J Clin Oncol, 2001,19(12):3037-3044. [11] Huang S, Huang GQ, Zhu GQ, et al. Establishment and validation of SSCLIP scoring system to estimate survival in hepatocellular carcinoma patients who received curative liver resection. PLoS One, 2015,10(6):e0129000. [12] Dietrich CF, Kratzer W, Strobe D, et al. Assessment of metastatic liver disease in patients with primary extrahepatic tumors by contrast-enhanced sonography versus CT and MRI. World J Gastroenterol, 2006,12(11):1699-1705. [13] Sangiovanni A, Manini MA, Iavarone M, et al. The diagnostic and economic impact of contrast imaging techniques in the diagnosis of small hepatocellular carcinoma in cirrhosis. Gut, 2010,59(5):638-644. [14] Wang Z, Tang J, An L, et al. Contrast-enhanced ultrasonography for assess-ment of tumor vascularity in hepatocellular carcinoma. J Ultrasound Med, 2007,26(6):757-762. [15] Boozari B, Soudah B, Rifai K, et al. Grading of hypervascular hepatocellular carcinoma using late phase of contrast enhanced sonography-a prospective study. Dig Liver Dis, 2011,43(6):484-490. [16] Bhayana D, Kim TK, Jang HJ, et al. Hypervascular liver masses on contrast-enhanced ultrasound: The importance of washout. AJR Am J Roentgenol, 2010,194(4):977-983. [17] Pei XQ, Liu LZ, Xiong YH, et al. Quantitative analysis of contrast-enhanced ultrasonography: Differentiating focal nodular hyperplasia from hepatocellular carcinoma. Br J Radiol, 2013,86(1023):20120536. [18] Li R, Yuan MX, Ma KS, et al. Detailed analysis of temporal features on contrast enhanced ultrasound may help differentiate intrahepatic cholangiocarcinoma from hepatocellular carcinoma in cirrhosis. PLoS One, 2014,9(5):e98612. QuantitativeanalysisofCEUSinstagingofsmallhepatocellularcarcinoma TUHaibin1,GUOJia2*,LINJianling1,CHENZhiheng2 (1.DepartmentofUltrasound,MengChaoHepatobiliaryHospitalofFujianMedicalUniversity,Fuzhou350001,China; 2.DepartmentofUltrasound,ShanghaiEasternHepatobiliarySurgeryHospital,Shanghai200082,China) ObjectiveTo investigate the value of CEUS quantitative analysis in diagnosis of different pathological stages of small hepatocellular carcinoma (HCC).MethodsData of 112 patients with HCC confirmed by surgical or biopsy were analyzed retrospectively. All the diameter of single tumor or the sum of the largest two lesions in multiple tumors were within 3 cm. Three groups were classified based on the Edmonson stage: High differentiation group (n=50, stage Ⅰ or Ⅱ), median differentiation group (n=30, stage Ⅲ), low differentiation group (n=32, stage Ⅳ). Qontraxt ultrasound imaging analysis software was utilized to measure CEUS parameters, including the maximum intensity of tumor (TMAX), nontumor's intensity (NT), maximum intensity of nontumor (NTMAX), appear time, time to peak, washout time, and the ratio of TMAX/NT and TMAX/NTMAX were calculated. The differences among the three groups was compared by statistics test.ResultsThe values of TMAX, TMAX/NTMAX and washout time were statistically different among the three groups (allP<0.05). The maximum values of TMAX, TMAX/NTMAX and the shortest washout time were found in the low differentiation group. And the minimum values of TMAX, TMAX/NTMAX and the longest washout time were found in the high differentiation group. There were no statistical differences of NT, NTMAX, TMAX/NT, appear time and time to peak among the three groups (allP>0.05).ConclusionThe quantitative parameters of CEUS is helpful in distinguishing different Edmonson stage of small HCC. Carcinoma, hepatocellular; Ultrasonography; Quantitative analysis 涂海斌(1986—),男,福建福州人,硕士,医师。研究方向:肝胆疾病的超声诊断与治疗。E-mail: 523100661@qq.com 郭佳,东方肝胆外科医院超声科,200082。E-mail: jia_guo@163.com 2017-03-30 [ ] 2017-07-09 10.13929/j.1672-8475.201703049 R735.7; R445.1 A 1672-8475(2017)09-0543-05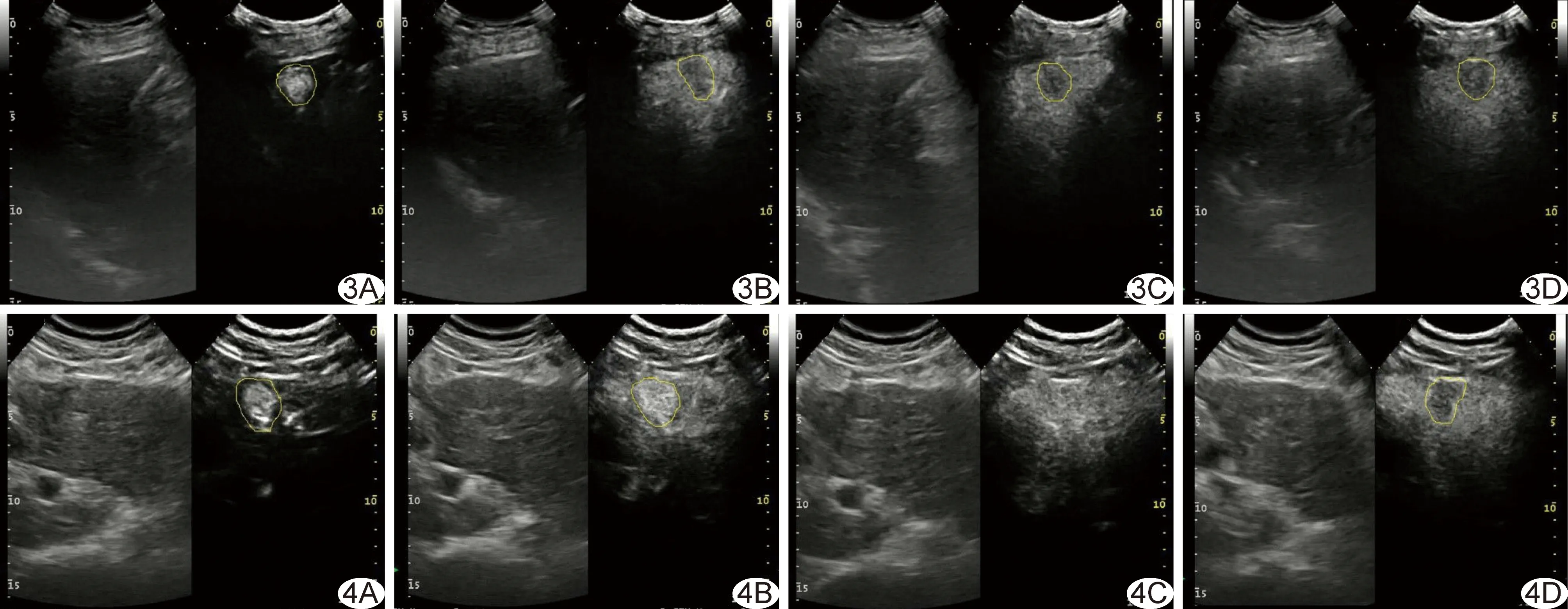
3 讨论

