HPLC法同时测定风湿定片中甘草酸和欧前胡素的含量
曾上敏,秦斯民,曹华玲
(广东食品药品职业学院,广东 广州 510520)
HPLC法同时测定风湿定片中甘草酸和欧前胡素的含量
曾上敏,秦斯民,曹华玲
(广东食品药品职业学院,广东 广州 510520)
建立HPLC同时测定风湿定片中甘草酸和欧前胡素含量的方法。采用反相高效液相色谱法,色谱柱为Diamonsil-C18柱(250 mm×4.6 mm,5 μm),流动相为乙腈-0.05%甲酸水溶液,梯度洗脱,流速为1.0 mL·min-1,检测波长为254 nm,柱温为25℃。甘草酸在0.92~18.4 μg·mL-1(r=0.9996),欧前胡素在0.496~9.92 μg·mL-1(r=0.9998)范围具有良好的线性关系;平均回收率甘草酸为98.5%,RSD为2.97%(n=6);欧前胡素为99.4%,RSD为1.20%(n=6)。本方法准确,操作简便、重复性好,可用于风湿定片的质量控制。
风湿定片;HPLC;甘草酸;欧前胡素
风湿定片是由八角枫、白芷、徐长卿、甘草4味中药组成,具有散风除湿,通络止痛之功效。用于风湿阻络所致的痹病,症见关节疼痛;风湿性关节炎,类风湿关节炎,肋神经痛,坐骨神经痛见上述证候者[1]。2015年版中国药典(一部)对风湿定片中徐长卿的主要成分丹皮酚进行了含量测定,鉴别采用薄层鉴别法[1]。同时,也有文献报道采用HPLC法测定风湿定片中毒藜碱的含量[2]。白芷和甘草也是该制剂的主要成分,药典中未对白芷和甘草的主要成分欧前胡素和甘草酸进行含量测定[3-4],也未见国内有采用HPLC法对风湿定片中欧前胡素和甘草酸的含量进行单独或同时测定的文献报道。为更全面评价风湿定片的质量,本研究建立了HPLC法同时测定风湿定片中甘草酸和欧前胡素2个有效成分含量的方法,为风湿定片的质量控制提供参考。
1 仪器与试药
LC-15C高效液相色谱仪(日本岛津公司,包括LC-15C双元泵, SPD-15C紫外检测器,SIL-10AF自动进样器,LC-solution工作站。Mettler AE-240电子分析天平;超纯水器(Millipore);超声波清洗器(KQ-400DB,昆山市超声仪器有限公司)。
甘草酸铵对照品(批号:110731-201619,含量以93.0%计,每1mg甘草酸铵相当于0.9795mg甘草酸)、欧前胡素(批号:110826-201415),由中国药品生物制品检定所提供;风湿定片(陕西君碧莎制药有限公司,批号为20110801、20111001、20120601);乙腈为色谱纯,其它试剂均为分析纯,水为超纯水。
2 实验方法
2.1 色谱条件
色谱柱:Diamonsil -C18(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.05%甲酸水溶液(B),梯度洗脱0~10min,35%A;10~15min,35%A→45%A;15~20min,45%A→55%A;20~30min,55%A。流速:1.0mL·min-1;检测波长:254 nm;柱温:25℃;进样量:10 μL。
2.2 混合对照品溶液的制备
分别精密称取甘草酸铵及欧前胡素对照品适量,置10 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,制成含甘草酸及欧前胡素分别为0.46 mg·mL-1、0.248 mg·mL-1的混合对照品储备溶液。精密量取混合对照品储备液5 mL,置50 mL量瓶中,加甲醇稀释至刻度,摇匀,即得混合对照品溶液。
2.3 供试品溶液的制备
取本品10片,研细,精密称取细粉0.20 g,置于50 mL量瓶中,加75%甲醇适量超声处理30min,冷却,定容至至刻度,摇匀,滤过,即得[5-6]。
2.4 阴性对照品溶液制备
按处方比例模拟制作缺白芷或甘草的阴性对照品,按2.3项下方法制得阴性对照品溶液。
3 实验结果
3.1 系统适用性试验


A:对照品 B:样品 C:缺甘草阴性对照品;D缺白芷阴性对照品
按2.1项下色谱条件,分别取混合对照品溶液、供试品溶液、阴性对照品溶液10 μL进样。在此条件下,甘草酸和欧前胡素的理论板数大于4000,样品、对照品、阴性对照品色谱图见图1。
3.2 线性关系考察
精密吸取“2.2”项下混合对照品溶液0.5、1、2、5、10 mL,置25 mL量瓶中,分别甲醇稀释至刻度,摇匀,制备成甘草酸浓度为0.92、1.84、3.68、9.20、18.4μg·mL-1及欧前胡素浓度为0.496、0.992、1.984、4.96、9.92μg·mL-1系列混合对照品溶液。按2.1项下色谱条件进样测定,以浓度C(μg.mL-1)为横坐标,峰面积Y为纵坐标,计算回归方程:甘草酸Y=2.2066×105C-8.6503×104,r=0.9996,在0.92~18.4 μg·mL-1内有良好线性关系;欧前胡素Y=1.02128×105C+5.4336×104,r=0.9998,在0.496~9.92 μg·mL-1内有良好的线性关系。
3.3 精密度试验
精密吸取混合对照品溶液10 μL,连续进样6次,甘草酸和欧前胡素峰面积的RSD分别为1.08%和0.96%,表明仪器精密度良好。
3.4 重复性试验
取同一批号样品6份,按2.3项下方法制备供试品溶液,按 2.1项下色谱条件进行测定,甘草酸和欧前胡素平均含量分别为2.1646 mg·g-1和0.2876 mg·g-1,RSD分别为1.29%和1.12%,表明方法重复性良好。
3.5 稳定性试验
取0、2、4、6、8、12、24 h供试品溶液,按2.1项下色谱条件进行测定,记录峰面积,结果甘草酸和欧前胡素峰面积RSD分别为1.45%和1.35%,供试品溶液在24 h内稳定。
3.6 加样回收试验
精密称取6份风湿定片(批号20110801)样品置于50 mL量瓶中,每份约0.1 g,分别加入一定量的甘草酸铵和欧前胡素对照品,按2.3项下方法制备供试品溶液,结果见表1。

表1 风湿定片中甘草酸和欧前胡素加样回收率试验结果
3.7 样品测定
分别精密称取0.2 g三批风湿定片样品,每批3份,按2.3项下方法制备供试品溶液,照2.1项下色谱条件测定,对三批风湿定片中甘草酸和欧前胡素进行含量测定,结果见表2。
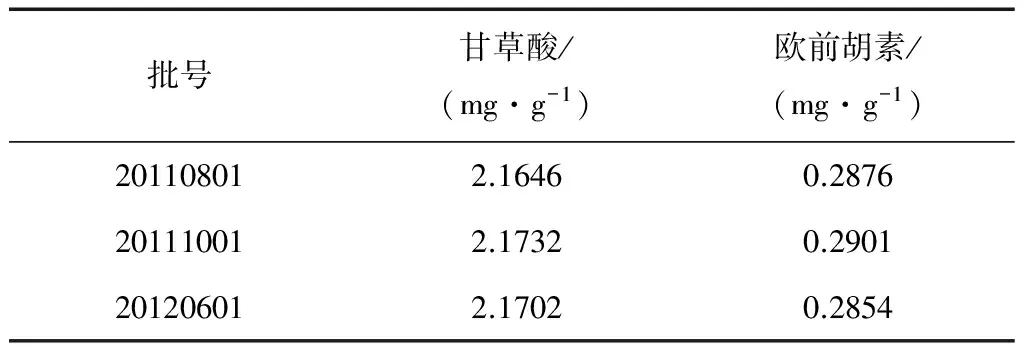
表2 三批风湿定片中甘草酸和欧前胡素的含量
4 讨论
4.1 检测波长的选择
采用紫外扫描发现甘草酸在250 nm和360 nm有最大紫外吸收,欧前胡素最大吸收波长有300、254、248 nm,选择254 nm进行检测时两种化合物的峰面积及峰高值均较大且各峰峰形良好,基线平稳,分离较好,因此选择254 nm为检测波长。
4.2 流动相的选择
在流动相的选择中,选择了甲醇-水、甲醇-0.05%甲酸水溶液、甲醇-0.1%甲酸水溶液乙腈-水、乙腈-0.05%甲酸水溶液及乙腈-0.1%甲酸水溶液系统进行比较,发现乙腈-0.05%甲酸水溶液为流动相时目标化合物色谱峰对称性好且基线平稳,因此最终确定以乙腈-0.05%甲酸水溶液为流动相[7-8]。
4.3 提取方法的选择
在提取方法的选择上,以《中国药典》2015年版一部甘草和白芷[含量测定]项下样品的提取条件为参考,分别对提取超声时间及提取溶剂进行优化[9-10]。考察了50%甲醇、75%甲醇、甲醇及50%乙醇、75%乙醇、无水乙醇分别在超声15min、30min、45min及60min对2个成分的影响,当采用75%甲醇作为提取溶剂,超声30min是提取效率较高[11-12],再延长提取时间两种化合物的量并没有明显差异,因此选择提取条件为75%甲醇超声提取30min。
本研究采用高效液相色谱法,建立了同时测定风湿定片中甘草酸和欧前胡素含量的方法,该方法简便、快速、准确度高,重复性好,为评价风湿定片的质量提供依据。
[1]中国药典委员会.中国药典一部[S].北京:化学工业出版社,2015:686-687.
[2]梁从庆,李书渊,房志坚. HPLC 法测定风湿定片中毒藜碱的含量[J]. 中药新药与临床药理,2004,15(4):268-270.
[3]席海为,马 强,李 强,等.HPLC 同时测定都梁滴丸中阿魏酸、5-甲氧基补骨脂素、欧前胡素和异欧前胡素[J]. 中国实验方剂学杂志,2011,17(16) : 81-85.
[4]郑立红,李卫敏,陈志峰,等.不同产地白芷中欧前胡素的含量测定[J]. 世界中医药,2012,7(1) : 79-80.
[5]毕晓黎,罗文汇,胥爱丽,等.超高效液相测定白芷配方颗粒中欧前胡素和异欧前胡素的含量[J]. 中国实验方剂学杂志,2012,18(10) : 140-142.
[6]Liao J M,Zhu Q A, Lu H J, et al. Effects of totalcoumarins of Cnidium monnieri on bone density andbiomechanics of glucocorticoids-induced osteoporosis inrats[J].Acta Pharmcologica Sinica,1997,18(6):519-521.
[7]杨小花,胡 晓. 欧前胡素与异欧前胡素的药理学研究进展[J]. 南昌大学学报,2012,52(3):95- 100.
[8]何 丹,杨 林,张景勍. UPLC 法测定元胡止痛胶囊中欧前胡素和异欧前胡素的含量[J]. 分析实验室,2013,32(10) : 87-90.
[9]倪 琳,杨 锡,陈朝晖,等. HPLC 测定元胡止痛滴丸中延胡索乙素含量[J]. 中国中医药信息杂志,2010,18(12) : 64-65.
[10]冯海龙,黄丹丹,聂 晶. HPLC 法测定元胡止痛颗粒中欧前胡素的含量[J]. 中国药师,2012,15(10) : 1407-1408.
[11]余宇燕,张红艳,卢 玲,等. HPLC 法测定元胡止痛颗粒中延胡索乙素的含量[J]. 福建中医药大学学报,2012,22(4): 34-36.
[12]柯仲成,程子洋. HPLC 法测定元胡止痛栓中延胡索乙素含量[J]. 辽宁中医药大学学报,2013,15(3): 47-48.
(本文文献格式:曾上敏,秦斯民,曹华玲 .HPLC法同时测定风湿定片中甘草酸和欧前胡素的含量[J].山东化工,2017,46(11):98-100,103.)
Simultaneous Determination of Glycyrrhizic Acid and Imperatorin in Fengshiding Tablets by HPLC
ZengShangmin,QinSimin,CaoHualing
(Guangdong Food and Drug Vocational College,Guangzhou 510520,China)
To establish a method for determinate Glycyrrhizic acid and Imperatorin in Fengshiding Tablets by HPLC simultaneously.The Diamonsil-C18(250 mm×4.6 mm, 5μm) chromatographic column was used with a mobile phase of acetonitrile-0.05% formic acid by gradient elution, the detection wavelength was at 254 nm, the column temperature was 25℃, and the flow rate was 1.0 mL·min-1.The linear ranges of Glycyrrhizic acid and Imperatorin were 0.92~18.4 μg·mL-1(r=0.9996), 0.496~9.92 μg·mL-1(r=0.9998) respectively. Average recoveries of two components were 98.5% with RSD 2.97% and 99.4% with RSD 1.20% respectively.The method was simple, sensitive and repeatable, could be used for the quality control of Fengshiding Tablets.
Fengshiding tablets; HPLC; glycyrrhizic acid; imperatorin
2017-03-31
曾上敏(1988—),男,助教,从事药物制剂方面的研究。
O657.7
A
1008-021X(2017)11-0098-03

