松墨天牛中性肽链内切酶2基因的鉴定与表达
陈敬祥,程 杰,林 同
(华南农业大学 林学与风景园林学院,广州 510640)
松墨天牛中性肽链内切酶2基因的鉴定与表达
陈敬祥,程 杰,林 同
(华南农业大学 林学与风景园林学院,广州 510640)
为了探讨M13家族中的中性肽链内切酶2基因在昆虫中的表达特性,以松墨天牛为研究对象,从cDNA文库中筛选到松墨天牛中性肽链内切酶2基因,命名为 MaNep2 (GenBank:KU245762)。该序列长为2 471 bp,其中编码序列为2 280 bp,共编码759个氨基酸。由此预测的蛋白质二级结构主要由α-螺旋与无规则卷曲组成,其次是延伸链与β-转角。 MaNep2基因编码蛋白定位于细胞质,为跨膜蛋白,跨膜区长度为23个氨基酸(C25LTLSTAVAFVIGISLVVALATV47),并存在一个低复杂度区域:I423SAGSLSIASGAL435。通过DNAMAN软件比对发现MaNep2与山松甲虫和赤拟谷盗同源性最高,为82%,且存在4个保守结构域序列:NAFY(553-556)、HEITH(594-598)、ENIAD(656-660)、CXXW(756-759);用MEGA4.0构建系统发育树,显示松墨天牛与山松甲虫处在同一分支。qPCR分析表明: MaNep2的表达与松墨天牛的变态发育相关,各虫态不间断表达,幼虫期表达表现先上升后下降,化蛹期间表达表现为先下降后上升,羽化期间表达表现为先上升后下降,并在初羽化的成虫中表达量达到最大值;幼虫和成虫头部表达量最高,且在马氏管中均有表达;成虫的足、翅、触角和卵巢中也都有表达。
松墨天牛;中性肽链内切酶2;cDNA文库;RT-qPCR
松墨天牛(Monochamusalternatus)又名松天牛、松褐天牛,在中国大部分地方均有分布,是林业上重要的蛀干害虫,寄主主要包括黑松、马尾松、思茅松等。幼虫钻蛀衰弱树干和大枝条,取食其韧皮部与木质部,进而切断输导组织,使水分和养分运输受阻,造成树木成片枯死;成虫啃食嫩枝补充营养,导致树势衰弱,同时体内能携带成千上万的松材线虫,这些松材线虫对松树能产生极其严重的病害——松材线虫萎蔫病(Bursaphelenchusxylophilus),严重影响生态与经济[1-2]。
中性肽链内切酶(Neprilysin,Nep)属于 M13 锌金属蛋白酶家族,是一种Ⅱ型整合细胞膜糖蛋白[3],并在细胞膜外有活性位点[4]。首次在肾脏中发现并命名[5],可以通过水解作用使一些活性肽的生理功能失活,比如:速激酶(tachykinins)[6]、缓激酶(bradykinin)[7]和钠尿肽(natriuretic peptides)[8]。Nep在脊椎动物与无脊椎动物中都是一种很重要的酶。研究表明Nep 参与了多种生理进程,尤其对动物神经肽酶水平的调控起着重要的作用[9]。在蝗虫脑部的突触膜中检测到大量的类Nep肽链内切酶活性,这对调控其神经肽、神经递质、神经调节质的合成与释放是非常重要的[10]。与Nep有着高度同源性的新颖金属肽酶Nep2(Neprilysin 2)被鉴定为是一种可溶性糖蛋白[11]。脑啡肽酶(enkephalin)是Nep的一种底物,同样也能被Nep2水解,暗示两种蛋白具有相似的酶学特性[12]。Nep的转录抑制剂同样也能作用于Nep2[13]。对神经肽酶的调控作用与Nep类似[10]。尽管有着高度相似性,但功能也不完全一样。比如,对促性腺激素(gonadotropin)和 肠促胰酶肽( cholecystokinin)的水解作用分别处于不同水解位点,并且水解效率也不同[13]。
本研究从松墨天牛 cDNA 文库中克隆出 Nep2基因同源序列,经Blast比对分析,推测其为 Nep2基因。对其进行生物信息学及表达分析,旨在为开展昆虫 Nep2基因研究提供分子信息和参考,为深入研究昆虫 Nep2基因功能奠定基础。
1 材料与方法
1.1 材 料
1.1.1 供试昆虫 松墨天牛幼虫采自广东省河源市桂山林场,参照徐金华等[14]人工饲养条件,幼虫置于暗室的人工气候箱中饲养至蛹、成虫。饲养条件:温度为23~26 ℃,RH为70%~75%,遮光(幼虫和蛹),光周期L∶D=12∶12(成虫)。
1.1.2 主要试剂 E.Z.N.A.TM Total RNA Kit Ⅱ总 RNA 提取试剂盒购自 OMEGA 公司,PrimeScript○RRT reagent Kit With gDNA Eraser 反转录试剂盒和SYBR Premix ExTaqTM实时荧光定量试剂盒购自 TaKaRa 公司。
1.2 方 法
1.2.1 RNA的提取及 cDNA的合成 取松墨天牛各龄幼虫、蛹和初羽化成虫置于液氮中研磨成粉末状,参照E.Z.N.ATM Total RNA Kit Ⅱ总RNA提取试剂盒说明书提取总RNA。用琼脂糖凝胶电泳(10 g/L)与微量紫外分光光度计(Nanodrop 2000)分别检测其质量和浓度,检测合格后放入-70 ℃低温冰箱保存,备用。参照PrimeScript○RRT reagent Kit With gDNA Eraser 反转录试剂盒说明书步骤进行合成第一链cDNA,cDNA用于qPCR的反应模板,-20 ℃保存,备用。
1.2.2 基因克隆 从已构建的松墨天牛cDNA文库中[15]克隆出 Nep2基因。
1.2.3 生物信息学分析 用 NCBI 在线工具 ORF finder (http://www.ncbi.nlm.nih.gov/gorf/gorf.html)搜索开放阅读框, SignalP 4.0 Server(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽,ProtScale 程序分析疏水性,NetPhos(http://www.cbs.dtu.dk/services/NetPhos/)和Ne-tNGlye(http://www.cbs.dtu.dk/ser-vices/NetNGlyc/)分别预测磷酸化修饰位点与N-糖基化修饰位点,SubLoc v1.0软件(http://www.bioinfo.tsinghua.edu.cn/SubLoc/)预测亚细胞定位,TMHMM 分析蛋白质跨膜结构域(http://www.cbs.dtu.dk/services/TMH-MM/),SMART 软件(http://smart.embl-heidel berg.de/)分析蛋白质功能结构域,COILS Server(http://embnet.vital-it.ch/software/ COILS_form.html)预测卷曲螺旋,SOPMA 软件(http:// npsa-pbil.ibcp.fr/cgi-bin/secpred_sopma.pl)预测二级结构,SWISSMODEL 软件,预测三级结构和同源建模。
1.2.4 同源序列比对和系统发育树 从NCBI数据库中检索并下载昆虫 Nep2基因编码序列 (表1),用 DANMAN软件进行多序列同源性比对,用 Clustal X和MEGA 4.0软件构建系统发育树(NJ法)。
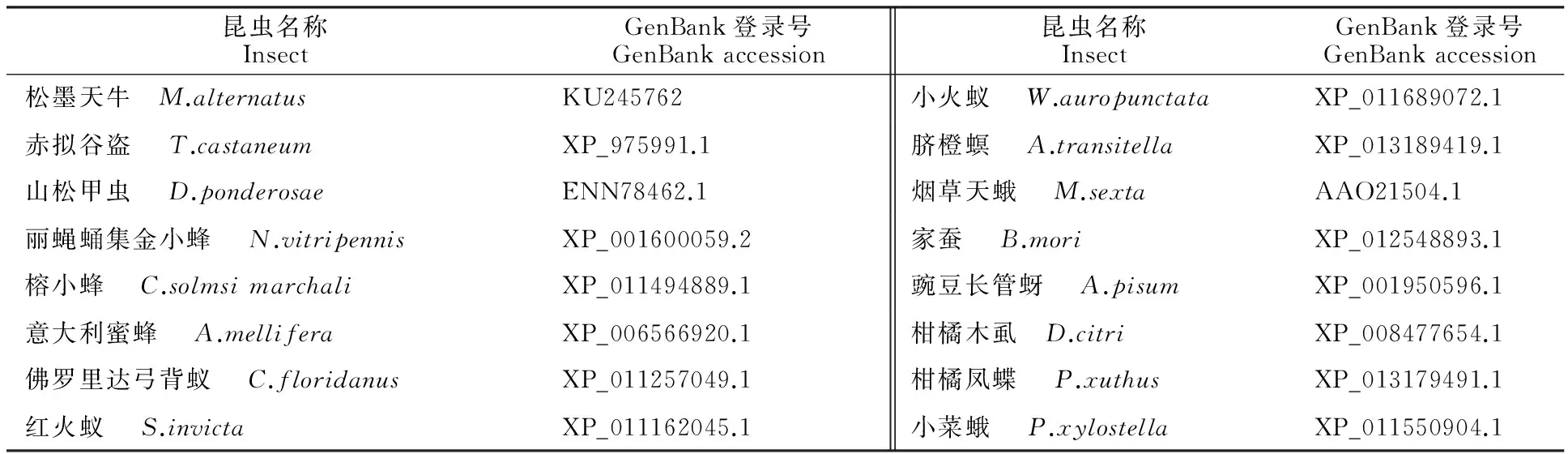
表1 参与Nep2氨基酸序列比对的16种昆虫Table 1 Sixteen species of insects participating in Nep2 amino acid sequence alignment
1.2.5 基因表达 用RT-qPCR(SYBR Green) 检测基因的表达量。所用引物:上游,GTCGTCAGCGTGCCCTCTTA;下游,CCTCTCGTTCCGTCCTT。SYBR○RPremix ExTaqTM实时荧光定量试剂盒反应体系(20 μL):SYBR Premix 10 μL,ddH2O 7.2 μL,上下游引物各0.4 μL,cDNA 2 μL。反应程序:95 ℃ 预变性 5 min; 95 ℃ 解链10 s,60 ℃ 延伸20 s, 共40 个循环。在LightCycler480 荧光定量 PCR 仪上进行RT-qPCR反应,每个cDNA样品做3个复孔,反应结束后分别采集目标基因和内参基因(β-actin)的Ct平均值,定量结果使用 2-ΔΔCt法计算。用 SPSS 18.0 软件的 Duncan’s单因素方差分析法(ANOVA)对荧光定量所得数据进行统计分析。
2 结果与分析
2.1 基因序列分析
从松墨天牛cDNA文库中筛选1条具有完整 ORF 的序列,在 NCBI 的核酸序列数据库中进行Blast 程序同源性比对,鉴定为松墨天牛 Nep2基因,命名为 MaNep2(GenBank:KU245762),其开放阅读框长度为 2 280 bp,共编码 759个氨基酸(图1),推测的编码蛋白分子质量为 87.21 ku, 等电点pI为 5.69,不稳定系数为40.86,脂肪系数为81.17。用ProtScale对蛋白进行疏水性分析,发现该蛋白氨基酸大部分为亲水性的,说明此蛋白为亲水蛋白。信号肽预测结果表明该蛋白无信号肽;磷酸化修饰位点预测结果为:有丝氨酸磷酸化位点17个,苏氨酸磷酸化位点11个,酪氨酸磷酸化位点10个, N-糖基化修饰位点7个。
丝氨酸(Ser)、苏氨酸(Thr)、酪氨酸(Tyr)磷酸化位点分别以三角形、圆形、方形标注;N-糖基化位点以黑体标注;跨膜区用方框标注;1个低复杂度区域用阴影标注;终止密码子TAG用星号标注。
Serine phosphorylation sites,Threonine phosphorylation sites,Tyrosine phosphorylation sites,N-Glycosylation sites and transmembrane domain are underlined with triangles,round,square,bold and box respectively.One low complexity region is highlighted in shadow.Stop codon is marked with an asterisk.
图1 MaNep2 基因序列全长及推导的氨基酸序列
Fig.1 Nucleotide and deduced amino acid sequences of MaNep2
2.2 功能结构域、跨膜结构和亚细胞定位预测
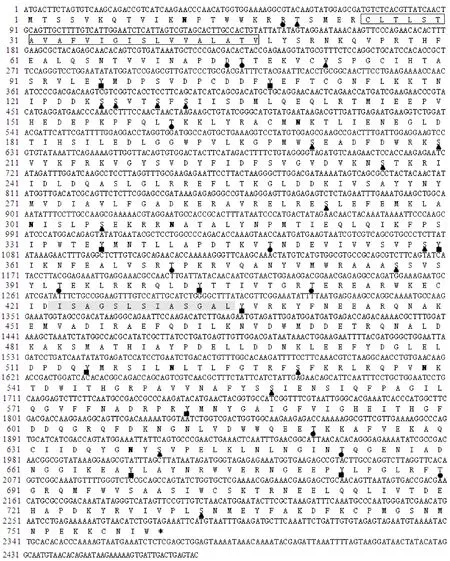
通过NCBI中保守域数据库(Conserved Domain Data)对MaNep2蛋白进行功能结构域分析,该蛋白属于锌谷氨酸蛋白超基因家族中M13家族成员。有11个活性位点(active site):N553A554V591H594E595H598E656A699A700H721R727,其中H594、H598和E656为3个Zn结合位点(Zn binding site)(图2)。跨膜结构预测结果表明该蛋白为跨膜蛋白,有3个由外到内、5个从内到外的螺旋结构,跨膜区长度为23个氨基酸(C25LTLSTAVAFVIGISLVVALA TV47)(图1)。通过SubLoc v1.0软件在线预测MaNep2蛋白在细胞中的位置,结果表明定位在细胞质的可能性最大,为56%,据此推测MaNep2蛋白可能定位于细胞质中。
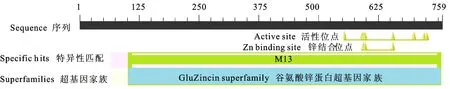
图2 MaNep2蛋白结构域的预测Fig.2 Predicted domains in MaNep2
2.3 二级和三级结构
由软件SOPMA对MaNep2蛋白进行二级结构预测,结果显示该蛋白的二级结构由α-螺旋、无规则卷曲、延伸链和β-转角组成,分别占44.4%、31.49%、15.42%和8.7%。由此可推测MaNep2蛋白的主要二级结构元件为α-螺旋和无规则卷曲。运用SWISS-MODEL进行同源建模,结果同样显示此基因编码蛋白主要由α-螺旋与无规则卷曲组成,该预测结果与其二级结构预测的结果一致(图3)。
2.4 同源序列比对及系统发育树
MaNep2与赤拟谷盗、山松甲虫蛋白同源性最高,为82%;与膜翅目、鳞翅目和同翅目的其他13种昆虫同源性为60%~70%(表2)。通过MaNep2与其他15种昆虫的序列比对发现,Nep2蛋白存在4个保守序列,即NAFY、HEITH、ENIAD、CXXW(X表示任意氨基酸)[16](图4)。基于MEGA 4.0软件构建的系统发育树显示:松墨天牛与山松甲虫处于同一分支,与同源性分析的结果一致(图5)。
2.5 MaNep2基因的表达
MaNep2在各虫态中不间断表达,在卵中表达量最低,幼虫期表达量先上升后下降,在3龄幼虫(L3)中达到峰值,为卵的34.3倍;化蛹期间表达量表现为先下降后上升,过渡态蛹(P0)中最低,为卵的6.19倍,在第1天蛹(P1)中的表达量迅速增加到卵的15.78倍;蛹期表达量在第10天蛹(P10)中达到最高值,为20.39倍;羽化阶段表达量表现为先上升后下降,在过渡态成虫(A0)迅速增加到峰值,为卵的75.06倍,之后成虫第1天(A1)迅速下降为21.00倍(图6)。 MaNep2在成虫各部位中均有表达,其中在头部表达量最高,为对照的26.17倍,其次是马氏管、触角和足,分别为对照的11.47、11.24和10.56倍,三者差异不显著(P>0.05)(图7-A)。在幼虫头、体壁、马氏管和脂肪体中的表达量分别为对照的1.38、0.87、0.30和0.11倍,表达差异显著(P<0.05)(图7-B)。
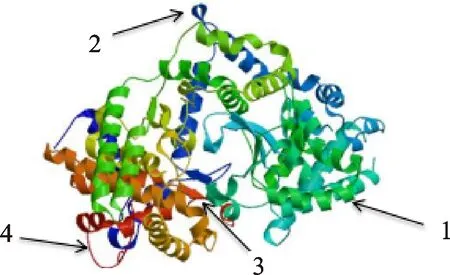
图中1、2、3、4表示α-螺旋、β-转角、β-折叠、无规则卷曲。
1,2,3,and 4 represent alpha helix,beta turn,beta-pleated sheet and random curl,respectively.
图3 MaNep2三维结构预测
Fig.3 Three-dimensional structure of MaNep2
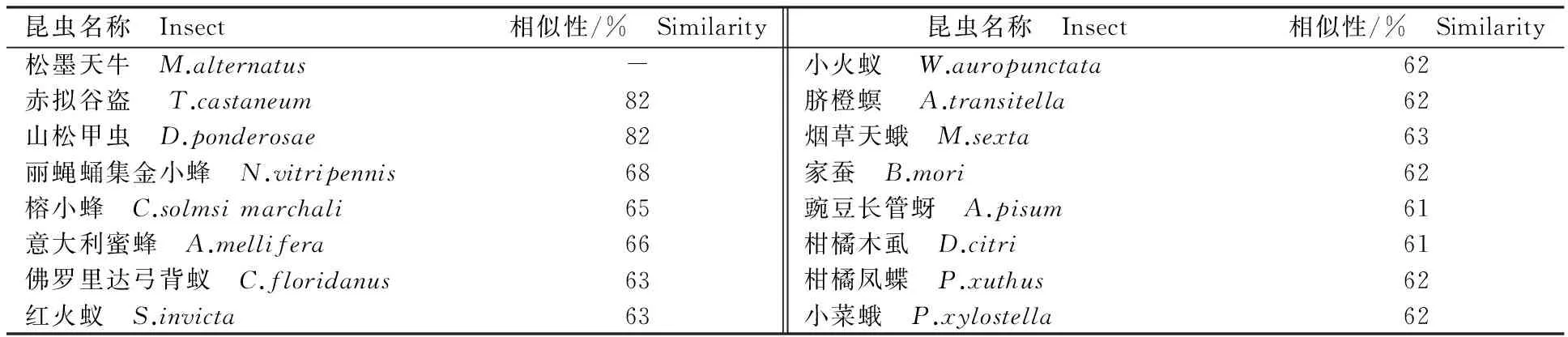
表2 Nep2氨基酸序列同源性比对结果Table 2 Amino acids homology alignment results of Nep2
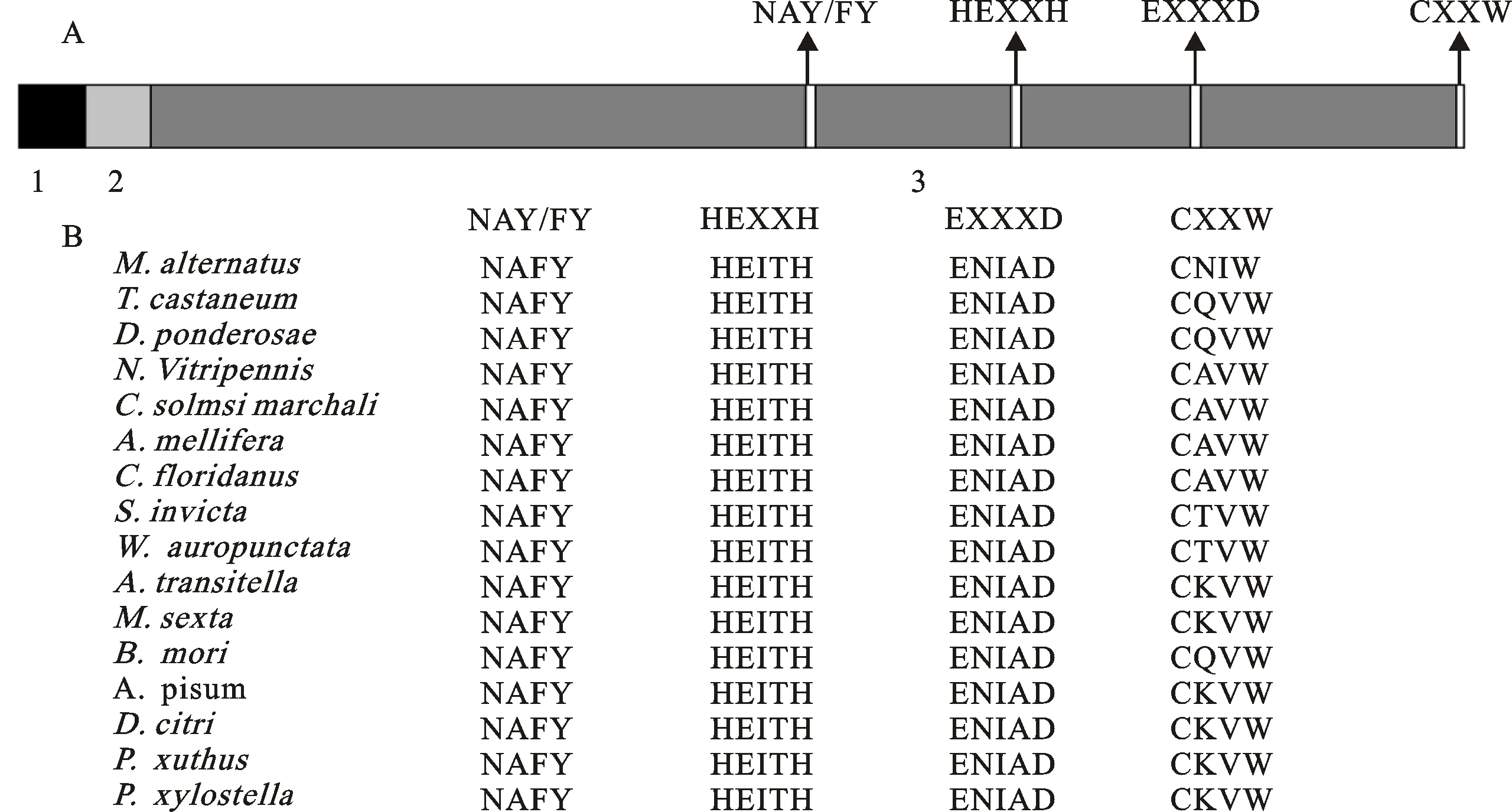
A. 1、2和3分别表示胞质区、跨膜区和胞外区; NAY/FY、HEXXH、EXXXD 和CXXW表示M13家族中Nep亚家族(Neps)的4个保守区域;B.不同昆虫的Nep2保守域序列同源比对图。
A.1,2 and 3 represent cytoplasmic domain,transmembrane domain and extracellular domain,respectively,and four conserved domains are NAY/FY,HEXXH,EXXXD and CXXW in Nep subfamily subject to M13 family;B.Conserved domain sequence alignment of Nep2 fromM.alternatusand other insects.
图4 Neps序列原理图(A)与Nep2保守区域序列比对图(B)
Fig.4 The principle diagram of the sequence in Neps(A) and conserved domain sequence alignment of Nep2 fromM.alternatusand other insects(B)
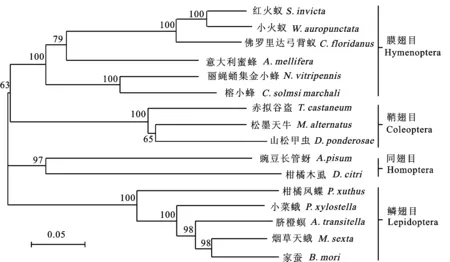
图5 基于昆虫Nep2氨基酸序列构建的系统发育树Fig.5 Phylogenetic relationships based on Nep2 amino acids from insects

数据为“平均数±标准误”;柱上不同字母表示差异显著(P E.卵 Egg; L1-L5.幼虫1龄-5龄 1-5 instar larvae; P0.过渡态蛹 0 d-1 d pharate pupae; P1-P10.蛹第1天-第10天 1 d-10 d pupae; A0.过渡态成虫 0 d-1 d pharate adults; A1-A3.成虫第1天-第3天 1 d-3 d adults. 图6 MaNep2基因在松墨天牛各虫态中的表达 Fig.6 The expression level of MaNep2 in development stages ofM.alternatus CK1.1日龄成虫 1 d adults; CK2.5龄幼虫 Fifth instar larvae; HE.头部 Head; AN.触角 Antennae; FO.足 Foot; WI.翅 Wing; AB.腹部 Abdomen; MT.马氏管 Malpighian tubule; MG.中肠 Midgut; OV.卵巢 Ovary; BW.体壁 Body wall; FB:脂肪体 Fat body. 图7 MaNep2基因在松墨天牛成虫(A)和幼虫(B)不同部位的表达 Fig.7 The expression level of MaNep2 in the adults(A) and larvae(B) ofM.alternatus M13家族成员蛋白结构均包含一个短的N端胞质区,跨膜区,长的C端胞外区,并存在两个典型保守Zn结合区域:HEXXH、EXXXD(X表示任意氨基酸)。在HEXXH保守序列中,其中两个组氨酸形成了两个Zn配体,谷氨酸与其他残基同底物结合和催化有关[17];另一个EXXXD保守序列中,谷氨酸形成第3个Zn配体,并且此位点的谷氨酸是Nep属于谷氨酸锌蛋白超基因家族的依据[13]。本研究预测 MaNep2为跨膜蛋白,包括N端胞质区(1-24)、跨膜区(25-47)和C端胞外区(48-759)(图4)。同样存在两个典型M13家族蛋白保守Zn结合区域:HEITH(594-598)和ENIAD(656-660),共同形成3个Zn配体,这对于肽链内切酶来说是非常重要的,在不同的序列中该位点有显著变化,可能暗示活性的缺失[18]。除此之外,发现另外两个保守域:NAFY(553-556)对于该蛋白与底物的结合密切相关[17],主要影响底物P1和P1′位点间的肽键形成方向[19]; CNIW(756-759)可能与蛋白折叠和成熟相关[17]。因此,推测 MaNep2属于M13家族成员。 低复杂度区域(Low-complexity regions,LCRs)广泛存在真核生物蛋白中[20-21],主要由单个氨基酸或者是一段短的氨基酸重复组成[22]。大部分LCRs是高度不稳定的,或重组,或丢失[23]。在本研究中,MaNep2蛋白存在1个LCR,位于423-435位氨基酸(ISAGSLSIASGAL),它的存在可能会通过促进自身表型的变化来适应环境的变化[24],同时也可能会促进新蛋白序列的形成[22]。 类Nep活性物质广泛存在无脊椎动物中[25]。在果蝇胚胎[26]、幼虫翅原基提取物[27]和幼虫、成虫头部的神经元[5]中检测到类似Nep活性物质。本研究中发现, MaNep2在松墨天牛各虫态、幼虫各组织和成虫各部位均有表达,推测松墨天牛体内 Nep2的生物活性与其正常生长发育相关。 Nep2对于许多动物的神经肽酶水平调控起重要的作用[13],比如:水螅[28]、线虫[29]神经发育,毒害人神经的β淀粉肽合成与分解[30]。Bland 等[10]通过过度表达果蝇的 Nep2发现:过度表达会导致果蝇非正常的攀爬行为——螺旋式;相比野生果蝇,要花费10倍的时间才能走出趋性迷宫。表明过度表达 Nep2会导致神经控制行为发生紊乱,而脑是昆虫全身最重要的神经联络中心,是统一控制协调昆虫行为和内部生理机能的主要机构。本研究中荧光定量分析表明: MaNep2在头部表达量较高,特别是成虫头部,为对照的26.17倍;同时在足、翅以及触角中表达也较高。由此可能暗示 MaNep2的表达对于松墨天牛脑神经发育及其支配的行为至关重要。 Nep2在果蝇幼虫、成虫的马氏管和成虫生殖器中的表达表明其同肾脏与生殖功能相关[31]。本研究也发现 MaNep2在松墨天牛幼虫和成虫马氏管及成虫卵巢中均有表达,暗示其与肾脏和生殖功能相关。Neps与昆虫变态有关,例如,在蜕皮激素的影响下,果蝇翅原基会出现类似Nep的活性物质,导致成虫结构形成[13]。 MaNep2表达模式显示在松墨天牛卵、幼虫期和蛹期中不间断表达,幼虫期表达量明显高于卵,特别是在第2、3龄幼虫中的表达量,分别为卵的33.82、34.3倍,暗示 MaNep2可能参与2、3龄幼虫的相关神经肽的合成与释放[10]。在蛹期里包括神经系统在内的各个系统不断进行更新改造,羽化时相关系统基本完成,之后逐渐完善[32-33]。本研究中,在初羽化的成虫中其表达量达到了峰值,而后逐渐下降,推测 MaNep2参与神经系统的发育与完善。在初蛹化的第1天蛹中表达量显著上升,在初羽化的成虫中其表达量达到了峰值,而后急剧下降,这表明 MaNep2对松墨天牛的全变态发育可能发挥着重要的作用。 综上,本研究克隆出松墨天牛中性肽链内切酶2基因( MaNep2),对其进行生物信息学分析,并在mRNA转录水平分析 MaNep2在松墨天牛各虫态中的动态表达特点及重要器官、组织中的表达特性,旨在为研究 MaNep2在松墨天牛的生理功能方面提供参考。下一步,将运用RNAi技术使 MaNep2基因表达沉默后,研究该基因对松墨天牛全变态发育的影响。 Reference: [1] 王玲萍.松墨天牛生物学特性的研究[J].福建林业科技,2004,31(3):23-26. WANG L P.Study on the biological characteristic ofMonochamusalternatusHope[J].JournalofFujianForestryScienceandTechnology,2004,31(3):23-26(in Chinese with English abstract). [2] 张心团,赵和平,樊美珍,等.松墨天牛生物学特性的研究进展(综述)[J ].安徽农业大学学报,2004 ,31(2):156-157. ZHANG X T,ZHAO H P,FAN M ZH,etal.The research progress of biological characteristics inMonochamusalternatus(review) [J].JournalofAnhuiAgriculturalUniversity,2004 ,31(2 ):156-157(in Chinese). [3] 刘婷婷,葛漫丽,王继红,等.中性肽链内切酶( CD10)生理功能研究进展[J].现代生物医学进展,2014,14(9):1766-1768. LIU T T,GE M L,WANG J H,etal.Neutral endopeptidase(CD10) physiological function research progress[J].ProgressinModernBiomedicine,2014,14(9):1766-1768(in Chinese with English abstract). [4] BLAND N,THOMAS J N,SHIRRAS A,etal.Expression of NEP2,a soluble neprilysin-like endopeptidase,during embryogenesis inDrosophilamelanogaster[J].Peptides,2007,28(1):127-135. [5] IKEDA K,EMOTO N,RAHARJO SB,etal.Molecular identification and characterization of novel membrane-bound metalloprotease,the soluble secreted form of which hydrolyzes a variety of vasoactive peptides[J].JournalofBiologicalChemistry,1999,274(45):32469-32477. [6] SIVITER R J,COAST G M,WINTHER A M,etal.Expression and functional characterization of aDrosophilaneuropeptide precursor with homology to mammalian preprotachykinin A[J].JournalofBiologicalChemistry,2000,275(30):23273-23280. [7] SIVITER R J,NACHMAN R J,DANI M P,etal.Peptidyl dipeptidases(Ance and Acer) ofDrosophilamelanogaster:major differences in the substrate specificity of two homologs of human angiotensin I-converting enzyme[J].Peptides,2002,23(11):2025- 2034. [8] SPANIER B,STURZENBAUM S R,HOLDEN-DYE L M,etal.Caenorhabditiselegansneprilysin NEP-1:an effector oflocomotion and pharyngeal pumping[J].JournalofMolecularBiology,2005,352(2):429-437. [9] BAWAB W,ALOYZ R S,CRINE P,etal.Identification and characterization of a neutral endopeptidase activity inAplysiacalifornica[J].BiochemicalJournal,1994,296(Pt 2)(2):459-465. [10] BLAND ND,ROBINSON P,THOMAS J E,etal.Locomotor and geotactic behavior ofDrosophilamelanogasterover-expressing neprilysin 2[J].Peptides,2009,30(3):571-574. [11] KENNY A J,FULCHER I S,RIDGWELL K,etal.Microvillar membrane neutral endopeptidases[J].ActaBiologicaEtMedicaGermanica,1981,40(10-11):1465-1471. [12] TURNER A J,ISAAC R E,COATES D.The neprilysin(NEP) family of zinc metalloendopeptidases:genomics and function[J].Bioessays,2001,239(23):261-269. [13] BARRETT A J,RAWLINGS N D,WOESSNER J F.Handbook of Proteolytic Enzymes[M].London:Elsevier Academic Press,2004:419-436. [14] 徐金华,黄秀凤,徐华潮,等.松墨天牛室内人工饲养及其生物学特性观察[J].浙江林业科技,2009,29(4):86-88. XU J H,HAUNG X F,XU H CH,etal.Rearing and biological properties ofMonochamusalternatus[J].JournalofZhejiangForestryScienceandTechnology,2009,29(4):86-88(in Chinese with English abstract). [15] 韦春梅,罗琳琳,吴华俊,等.松墨天牛幼虫cDNA文库的构建及EST分析[J].基因组学与应用生物学,2014,33(1):113-120. WEI CH M,LUO L L,WU H J,etal.cDNA library construction and EST analysis ofMonlchamusalternatuslarvae[J].GenomicsandAppliedBiology,2014,33(1):113-120(in Chinese with English abstract). [16] SITNIK J L,FRANCIS C,HENS K,etal.Neprilysins:an evolutionarily conserved family of metalloproteases that play important roles in reproduction inDrosophila[J].Genetics,2014,196(3):781-797. [17] CONSORTIUM F B.The FlyBase database of theDrosophilagenome projects and community literature[J].NucleicAcidsResearch,2002,31(1):85-88. [18] LAMANGO N S,ISAAC R E.Metabolism of insect neuropeptides:properties of a membrane-bound endopeptidase from heads ofMuscadomestica[J].InsectBiochemistry&MolecularBiology,1993,23(7):801-808. [19] LAURENT V,SALZET M.Metabolism of angiotensins by head membranes of the leechTheromyzontessulatum[J].FebsLetters,1996,384(2):123-127. [20] GHADDAR G,RUCHON A F,CARPENTIER M,etal.Molecular cloning and biochemical characterization of a new mouse testis soluble-zinc-metallopeptidase of the neprilysin family[J].BiochemicalJournal,2000,347(Pt 2):419-429. [21] GREEN H,WANG N.Codon reiteration and the evolution of proteins[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1994,91(10):4298-4302. [22] GOLDING G B.Simple sequence is abundant in eukaryotic proteins[J].ProteinScienceAPublicationoftheProteinSociety,1999,8(6):1358-1361. [23] TOLLRIERA M,RADTRILLA N,MARTYS F,etal.Role of low-complexity sequences in the formation of novel protein coding sequences[J].MolecularBiologyandEvolution,2011,29(3):883-886. [24] ELLEGREN H.Microsatellites:simple sequences with complex evolution[J].NatureReviewsGenetics,2004,5(6):435-445. [25] KASHI Y,KING D G.Simple sequence repeats as advantageous mutators in evolution[J ].TrendsinGenetics,2006,22(5):253-259. [26] BUTLER M J,JACOBSEN T L,CAIN D M,etal.Discovery of genes with highly restricted expression patterns in theDrosophilawing disc using DNA oligonucleotide microarrays[J].Development,2003,130(4):659-670. [27] CARSON J A,TURNER A J.Beta-amyloid catabolism:roles for neprilysin(NEP) and other metallopeptidases? [J].JournalofNeurochemistry,2002,81(1):1-8. [28] ISAAC R E.Neuropeptide-degrading endopeptidase activity of locust(Schistocercagregaria) synaptic membranes[J].BiochemicalJournal,1988,255(3):843-847. [29] CARPENTIER M,GUILLEMETTE C,BAILEY J L,etal.Reduced fertility in male mice deficient in the zinc metallopeptidase NL1[J].Molecular&CellularBiology,2004,24(10):4428-4437. [30] OEFNER C D,ARCY A,HENNIG M,etal.Structure of human neutral endopeptidase(Neprilysin) complexed with phosphoramidon[J].JournalofMolecularBiology,2000,296(2):341-349. [31] LEVIN E R.Endothelins[J].NewEnglandJournalofMedicine,1995,333(6):356-363. [32] KIRYU-SEO S,SASAKI M,YOKOHAMA H,etal.Damage-induced neuronal endopeptidase(DINE) is a unique metallopeptidase expressed in response to neuronal damage and activates superoxide scavengers[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2000,97(8):4345-4350. [33] WILLIAMS D W ,TRUMAN J W.Remodeling dendrites during insect metamorphosis[J].JournalofNeurobiology,2005,64(1):24-33. (责任编辑:郭柏寿 Responsible editor:GUO Baishou) Identification and Expression of Neprilysin 2 Gene inMonochamusalternatus(Coleoptera:Cerambycidae) CHEN Jingxiang,CHENG Jie and LIN Tong (College of Forestry and Landscape Architecture,South China Agricultural University,Guangzhou 510640,China) To explore the expression characteristics of Neprilysin 2 gene from M13 family in insects,Neprilysin 2 gene named MaNep2 (GenBank:KU245762) was filtrated from cDNA library ofMonochamusalternatus.The sequence of MaNep2 is 2 471 bp in length,containing a 2 280 bp open reading frame (ORF) encoding 759 amino acids.The predicted secondary structure of MaNep2 is mainly composed of alpha helix and random curl,followed by a beta turn and extension chain.Subcellular localization analysis showed Neprilysin 2 is in cytoplasm.The transmembrane of Neprilysin 2 (C25LTLSTAVAFVIGISLVVALATV47) was 23 amino acids in length.A low-complexity region(LCR ,I423SAGSLSIASGAL435)was found. MaNep2 showed the highest homology with the Neprilysin 2 gene fromTriboliumcastaneumandDendroctonusponderosae,respectively (82%) through amino acids sequence multiple alignment.There are four conserved domains,i.e.NAFY(553-556),HEITH(594-598),ENIAD(656-660)and CXXW(756-759)in MaNep2.Phylogenetic tree built by MEGA4 indicatedM.alternatusandD.ponderosaeare in the same branch.RT-qPCR analysis showed that MaNep2 is expressed in each insect stage continuously,which is associated with development ofM.alternatus.Expression level declined after rising in larval stage,rising after falling during the period of pupation,falling after rising during the period of eclosion,and reached the maximum amount in 0d-1d pharate adults.The expression level of MaNep2 is the highest in heads of larvae and adults. MaNep2 is also expressed in malpighian tubes of larvae and is in feet,wings,antennae and ovaries of adults. Monochamusalternatus;Neprilysin 2;cDNA library;RT-qPCR 2016-09-27 Returned 2017-03-21 The National Natural Science Foundation of China (No.31470653); the Natural Science Foundation of Guangdong Province (No.2015A030313416). CHEN Jingxiang,male,master.Research area:insect molecular biology.E-mail:2441430459@qq.com LIN Tong,male,Ph.D,professor.Research area:insect molecular biology.E-mail:lintong@scau.edu.cn 日期:2017-08-18 2016-09-27 2017-03-21 国家自然科学基金(31470653);广东省自然科学基金(2015A030313416)。 第一作者:陈敬祥,男,硕士,从事昆虫分子生物学研究。E-mail:2441430459@qq.com 林 同,男,教授,博士,主要从事昆虫分子生物学研究。E-mail:lintong@scau.edu.cn Q966 A 1004-1389(2017)08-1239-09 网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170818.0939.036.html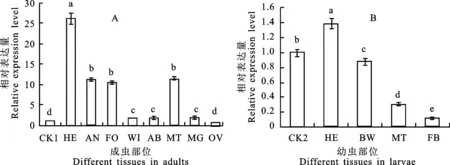
3 讨 论

