叉头框M1在结直肠癌中的表达及临床意义
陆 明,胡孔旺,王宜文,李 昊,曹立宇
叉头框M1在结直肠癌中的表达及临床意义
陆 明1,胡孔旺1,王宜文1,李 昊2,曹立宇2
目的 探讨叉头框M1(FOXM1)在结直肠癌中的表达及与临床病理特征、预后的关系。方法 采用免疫组化SP法检测297例结直肠癌组织和80例对应癌旁正常组织中FOXM1的表达;Western blot法检测20例新鲜结直肠癌组织及对应癌旁组织中FOXM1的表达。结果 FOXM1在结直肠癌组织中的阳性率(70.97%)显著高于癌旁组织(17.50%,P<0.01);FOXM1表达与结直肠癌浸润深度、淋巴结转移、脉管内癌栓转移、远处转移和TNM分期有关(P<0.05);与患者年龄、性别、肿瘤部位、大小、分化程度、CEA、CA199等无关(P>0.05)。结直肠癌组织中FOXM1蛋白相对表达量(0.855±0.063)明显高于相应癌旁组织(0.150±0.041,P<0.01)。FOXM1阳性患者的3年生存率明显低于阴性患者(P<0.01),且FOXM1为结直肠癌预后的独立性危险因素。结论 FOXM1蛋白在结直肠癌组织中过表达,且与患者临床病理特征、预后等因素有关,可能在结直肠癌的发生、转移等过程中起重要作用,有望成为结直肠癌新的肿瘤标志物和潜在的治疗靶点。
结直肠肿瘤;叉头框M1;免疫组织化学;Western blot法;预后
结直肠癌是临床上常见的消化道恶性肿瘤,现阶段我国结直肠癌的发病率和病死率均仅次于肺癌、胃癌、肝癌、食管癌,位居恶性肿瘤的第5位,且逐年呈上升和年轻化趋势[1]。目前结直肠癌的治疗仍以手术为主,术后辅予放、化疗,但其疗效一般,国内患者确诊后5年生存率仍低于50%,尤其对于有远处转移的患者缺乏有效的治疗措施,其5年生存率不足10%;即使是病理同一级别的患者,予以同种手术及辅助放、化疗等治疗方案,患者预后也不同[2]。因此,寻找准确的结直肠癌特异性标志物进行精准靶向治疗具有重要意义。FOXM1是FOX家族的重要成员之一,由一长约110个氨基酸的进化上高度保守的DNA结合域构成,称为“叉头框结构”或“翼状螺旋结构”,与肿瘤发生、发展密切相关,特异性表达于增殖期细胞中,是一个典型的与细胞增殖相关的转录因子,在细胞增殖、周期调节、细胞分化、DNA损伤修复、血管生成和细胞凋亡等过程中起重要作用[3-4]。FOX家族另一成员FOXO1也被证实在结直肠癌发生、发展过程中发挥重要作用[5]。本文采用免疫组化和Western blot法检测结直肠癌组织和癌旁正常组织中FOXM1的表达,并随访患者的术后3年生存率,分析FOXM1表达与临床病理参数和预后的相关性。
1 材料与方法
1.1 临床资料 收集2012年1月~2013年12月安徽医科大学第一附属医院行手术治疗且资料完整的结直肠癌患者297例(表1),术前患者均未行放、化疗,且无其他合并症;所选样本年龄24~88岁,中位年龄61岁,男性176例,女性121例。按AJCC(2010)分期标准:Ⅰ期44例,Ⅱ期124例,Ⅲ期98例,Ⅳ期31例。另选取其中80例远离癌组织中心5 cm以上的结直肠癌旁组织作为对照。术后所有组织标本均经10%中性福尔马林固定,常规脱水,石蜡包埋,4 μm厚连续切片。随访自手术后开始,截止时间为2016年12月。另收集2016年11~12月间行手术治疗且术前也未行放化疗、无其他合并症的结直肠癌患者的术后新鲜癌组织20例及相对应的癌旁正常组织行Western blot检测。
1.2 方法
1.2.1 免疫组化 运用免疫组化SP法检测结直肠癌组织和癌旁正常组织中FOXM1的表达,主要操作步骤如下:用二甲苯和乙醇将组织石蜡切片脱蜡至水化;PBS清洗完全后加入EDTA稀释液置入微波炉中进行抗原修复;后滴加适量内源性过氧化物酶封闭液封闭10 min;滴加一抗稀释液(抗体浓度1 ∶150,购自Abcam公司)40~50 μL,4 ℃过夜;第2天,37 ℃复温30 min后滴加适量二抗工作液(PV6000试剂盒,购自北京中杉金桥公司),置37 ℃孵育18 min;清洗完毕后滴加DAB显色工作液显色,镜下控制显色时间,染色完毕后迅速加入蒸馏水终止染色;苏木精轻度复染,中性树脂封固;由两位副高以上病理科医师双盲阅片,独立评分。
1.2.2 Western blot 各取适量组织加裂解液和PMSF匀质裂解后反复离心取上清液提取蛋白;用BCA法行蛋白浓度检测;后放入100 ℃水浴锅中煮5 min使蛋白变性;配制10%SDA-PAG凝胶,每孔中加适量蛋白和Loading Buffer混合液,垂直电泳分离;电泳分离完全后将含FOXM1和内参GAPDH的胶段切下转移到PVDF膜上;5%脱脂奶粉封闭60 min;加入20 mL FOXM1一抗稀释液(抗体浓度1 ∶300,购自Abcam公司)和20 mL GAPDH一抗稀释液(抗体浓度1 ∶3 000,购自北京中杉金桥公司)4 ℃过夜,次日洗膜完全后,加入二抗稀释液(抗体浓度1 ∶3 000,购自博奥森公司)室温孵育1 h;膜洗完全后,用ECL发光液进行显影。
1.3 结果判定 免疫组化结果根据切片中阳性肿瘤细胞数占所有肿瘤细胞的百分比和阳性肿瘤细胞的着色强度来判断评分。(1)按阳性细胞数评分:无阳性细胞为0分,阳性细胞数﹤25%为1分,25%~50%为2分,50%~75%为3分,>75%为4分;(2)按着色强度评分:肿瘤细胞无着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。将两项得分结果相乘:0~3分为(-),4~5分为(+),6~7分为(),≥8分为();(0~+)为阴性,(~)为阳性。Western blot结果用Image J行灰度分析,以目的蛋白灰度值与内参GAPDH灰度值的比值记为其相对表达量,以±s表示。
1.4 统计学方法 采用SPSS 16.0软件进行统计学分析,计数资料采用χ2检验或Fisher精确检验;计量资料采用t检验;生存分析和生存曲线使用Kaplan-Meier和Log-rank检验分析;患者预后多因素相关分析采用Cox比例风险回归模型。P<0.05为差异有统计学意义。
2 结果
2.1 FOXM1在结直肠癌组织中的表达 FOXM1在结直肠组织中主要表达于细胞核和细胞质(图1),在结直肠癌组织中的阳性率(70.97%,198/279)高于癌旁正常组织(17.50%,14/80),差异有统计学意义(χ2=61.903,P<0.001)。随着肿瘤浸润越深、淋巴结转移数目越多、伴随脉管内癌栓转移和远处转移、TNM分期越晚,FOXM1阳性率也相应越高(P<0.05);但与患者年龄、性别、肿瘤部位、肿瘤大小、分化程度、CEA、CA199等因素无关(P>0.05,表1)。
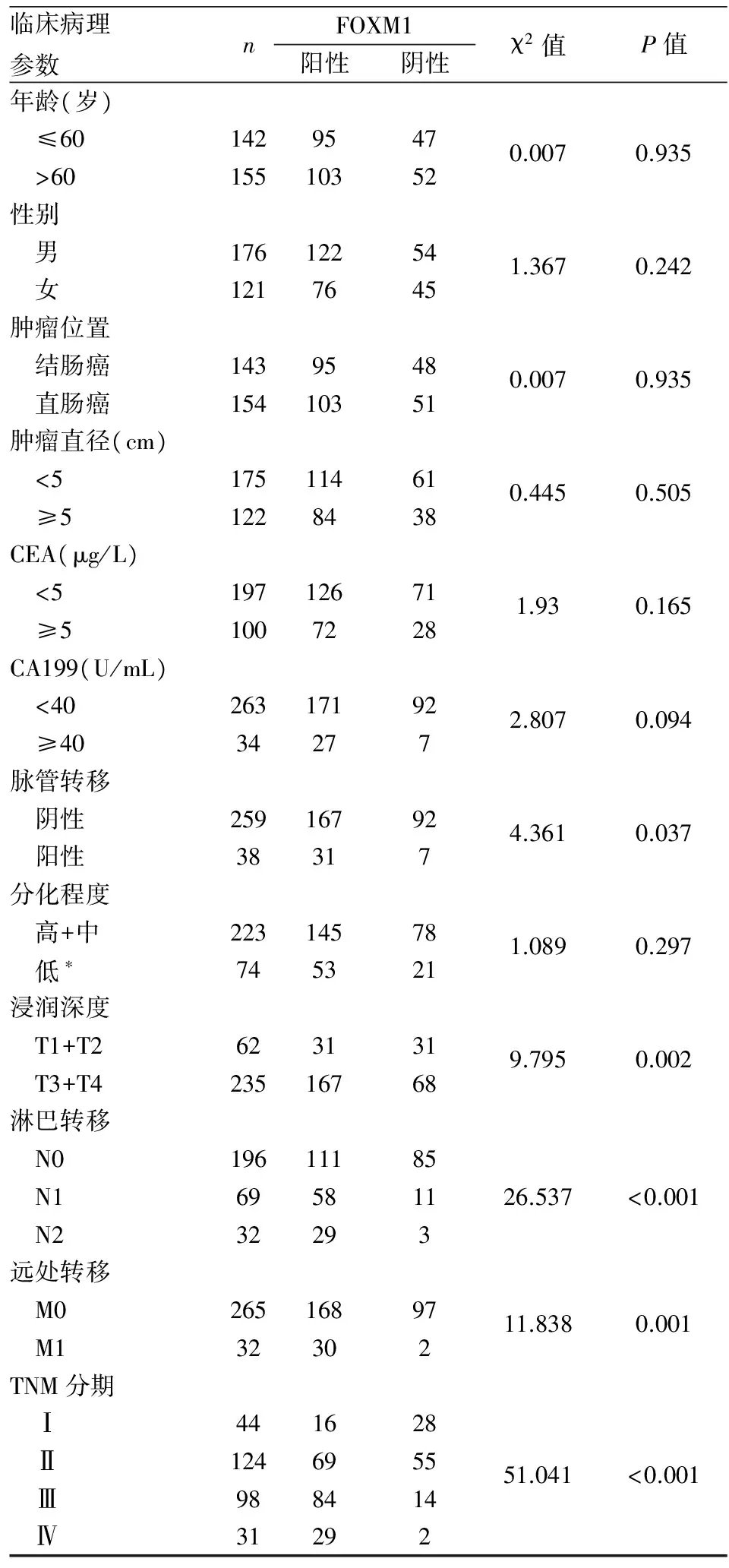
表1 FOXM1表达与结直肠癌患者临床病理特征的关系
*包括低分化、黏液腺癌、印戒细胞癌
2.2 Western blot法检测结直肠癌及癌旁组织中FOXM1蛋白的表达 20例结直肠癌组织中FOXM1蛋白的平均相对表达量为0.855±0.063,癌旁正常组织的平均相对表达量为0.150±0.041,结直肠癌组织中的相对表达量明显高于癌旁组织,两者差异有统计学意义(t=13.886,P=0.005,图2)。
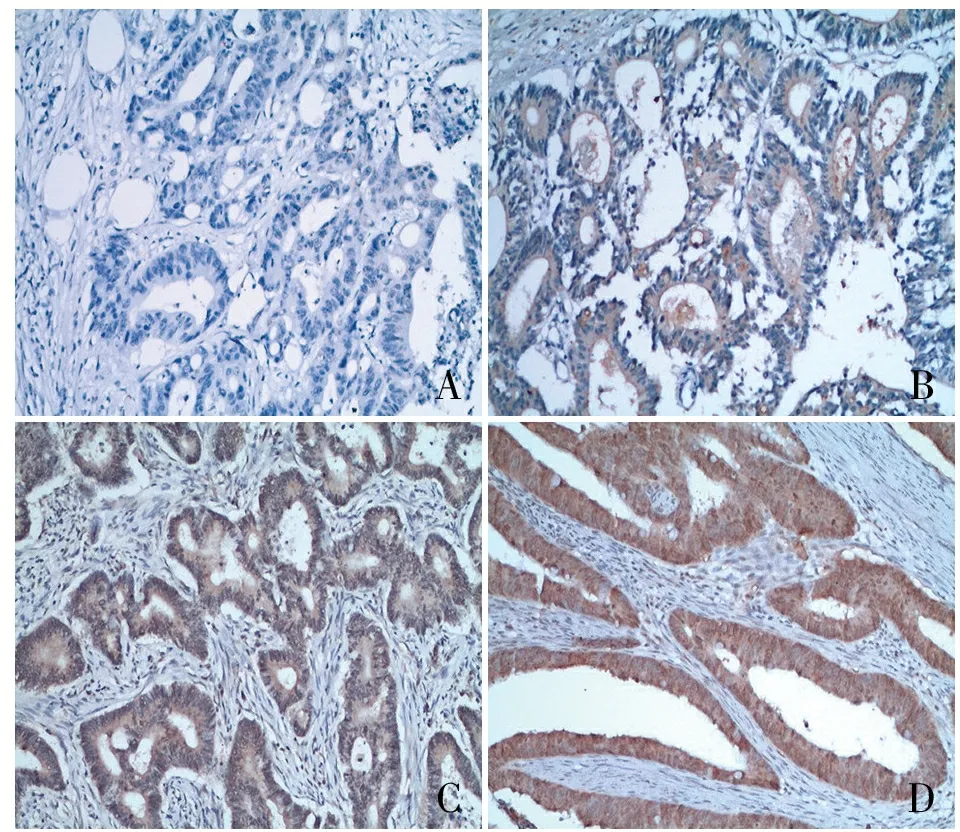
ABCD
图1 FOXM1在结直肠癌中的表达:A.0;B.+;C.;D.,SP法

图2 FOXM1蛋白在结直肠癌组织和癌旁组织中的表达
2.3 FOXM1表达与结直肠癌3年生存率的关系 所有患者的3年总体生存率为74.41%。FOXM1阳性者的3年生存率为65.15%;FOXM1阴性者的3年生存率为92.92%;FOXM1阳性者的生存率明显低于阴性者(χ2=25.636,P<0.01)。Cox回归分析发现,肿瘤分化程度、远处转移、TNM分期、CEA、CA199、FOXM1阳性等为影响结直肠癌患者预后的独立危险因素(P<0.05,表2,图3)。

图3 FOXM1蛋白表达与结直肠癌患者3年总生存率的关系
3 讨论
结直肠癌的发生、发展是多基因参与的病理转变过程,包括原癌基因(如K-RAS、c-myc、EGFR等)的激活和抑癌基因(如APC、DCC、p53等)的失活等[6]。因此从基因水平探索结直肠癌的生物学特性,寻找肿瘤诊断标志物和治疗靶点对结直肠癌的预防与治疗具有重大的临床意义。FOXM1是一种原癌基因,其功能大多是通过转录激活下游分子的表达来影响细胞周期实现的,在静止期或未分化细胞中表达较低,当细胞被激活重新进入细胞周期时表达增加[3]。研究表明FOXM1参与肿瘤发生的多种信号途径如在G1/S期过程中诱导p21及p27等周期调节蛋白的降解,促进细胞进行不断的循环周期,使RAS-MEK-MAPK信号通路处于持续激活状态,从而明显加强了癌细胞增殖能力[7];另外FOXM1也可通过激活PI3K/Akt、EGFR、NF-κB、Notch等信号通路的作用促进肿瘤的生成[8-11]。
FOXM1是人类恶性肿瘤中表达上调最频繁的基因之一,与肿瘤的发生、发展密切相关,在子宫颈癌、胃癌、食管癌、肝细胞癌等多种恶性肿瘤组织中均存在高表达[12-15],且与肿瘤分期和恶性侵袭性密切相关。同样FOXM1可通过加速结直肠癌细胞周期的进程,促进结直肠癌的发生、发展。如Li等[16]发现,FOXM1表达与肿瘤浸润深度、区域淋巴结转移、TNM分期、预后和转移密切相关,且FOXM1阳性患者更易引起血管、神经的侵犯。Uddin等[17]发现,FOXM1在结直肠癌中的阳性率为66%,且与患者病理分化程度和反应肿瘤增殖性标志物如Ki-67和MMP-9密切相关,但与患者TNM分期及预后无明显相关性。唐慧等[18]通过对结直肠癌癌组织、结直肠腺瘤组织和正常结直肠组织进行免疫组化分析

表2 结直肠癌患者总生存率的预后影响因素单因素和多因素分析
发现:FOXM1在正常结直肠黏膜、结直肠腺瘤组织、结直肠癌组织中的阳性率分别为66.67%、94.00%、81.58%,三组相比差异有统计学意义(P<0.05);且推测FOXM1在结直肠腺瘤组织中异常高表达提示FOXM1基因可能参与结直肠腺瘤癌变过程,其过表达在结直肠腺瘤阶段就已开始。
本组297例结直肠癌行免疫组化检测,发现在结直肠癌中,肿瘤浸润深、有淋巴结转移、有脉管转移等情况下,即肿瘤恶性程度越高FOXM1的阳性率亦越高,表明FOXM1可能具有促进结直肠癌的发生、发展、转移等作用。另有文献报道,FOXM1能够调控MMP-2和MMP-9的表达,而MMP-2和MMP-9在降解细胞外基质及基膜中发挥重要作用,与肿瘤的侵袭性和转移性密切相关[19];另外FOXM1能与VEGF的启动子结合从而转录调控VEGF的表达,参与肿瘤血管的生成,且VEGF在肿瘤的淋巴结和血行转移过程中起重要作用[20];Park等[21]通过建立转基因小鼠模型,发现FOXM1参与肿瘤的上皮-间质转换、肿瘤细胞转移、侵袭及转移前靶器官微环境的形成等。本组通过对结直肠癌患者的3年随访并对结果行生存分析得出FOXM1阳性者的预后明显差于阴性者(P<0.01),Cox多因素生存回归分析得出FOXM1表达为结直肠癌预后的独立危险因(P=0.005),可能由于原癌基因FOXM1的阳性率越高,通过调节MMP-2、MMP-9和VEGF等因子的表达从而促进肿瘤侵袭转移等过程,进而使结直肠癌的恶性程度越高,从而影响此类患者的预后生存时间。在其他多种恶性肿瘤中FOXM1阳性者预后也同样差于阴性者[22],因此对FOXM1进行术前检测对在结直肠的诊断治疗等过程具有重要的意义。
综上所述,FOXM1过表达与结直肠癌的临床病理特征及预后密切相关,在肿瘤发生、发展等过程中起重要作用,由此FOXM1可作为结直肠癌诊断和治疗上的一种新分子标志物,有望成为结直肠癌患者治疗上新的靶向位点。
[1] Chen W, Zheng R, Baade P D,etal. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[2] Brenner H, Kloor M, Pox C P. Colorectal cancer[J]. Lancet, 2014,383(9927):1490-1502.
[3] Alvarez-Fernandez M, Medema R H. Novel functions of FoxM1: from molecular mechanisms to cancer therapy[J]. Front Oncol, 2013,3:30.
[4] Halasi M, Gartel A L. FOX(M1) news-it is cancer[J]. Mol Cancer Ther, 2013,12(3):245-254.
[5] 蔡 玮, 赵凤辉, 梁小芹, 等. 结直肠腺瘤及腺癌组织中FOXO1表达及其临床意义[J].临床与实验病理学杂志, 2016,32(9):1009-1013.
[6] Budinska E, Popovici V, Tejpar S,etal. Gene expression patterns unveil a new level of molecular heterogeneity in colorectal cancer[J]. J Pathol, 2013,231(1):63-76.
[7] Ma R Y, Tong T H, Leung W Y,etal. Raf/MEK/MAPK signaling stimulates the nuclear translocation and transactivating activity of FOXM1[J]. Methods Mol Biol, 2010,647:113-123.
[8] Chen Y, Wang B C, Xiao Y. PI3K: a potential therapeutic target for cancer [J]. J Cell Physiol, 2012,227(7):2818-2821.
[9] Francis R E, Myatt S S, Krol J,etal. FoxM1 is a downstream target and marker of HER2 overexpression in breast cancer[J]. Int J Oncol, 2009,35(1):57-68.
[10] Peng S L. Interplay between the NF-kappaB and forkhead transcription factors [J]. Cell Death Differ, 2005,12(7):699-701.
[11] Wang Z, Li Y, Ahmad A,etal. Down-regulation of Notch-1 is associated with Akt and FoxM1 in inducing cell growth inhibition and apoptosis in prostate cancer cells[J]. J Cell Biochem, 2011,112(1):78-88.
[12] Chen H, Wang J, Yang H,etal. Association between FOXM1 and hedgehog signaling pathway in human cervical carcinoma by tissue microarray analysis[J]. Oncol Lett, 2016,12(4):2664-2673.
[13] Li X X, Qiu W S, Liu B,etal. Forkhead box transcription factor 1 expression in gastric cancer: FOXM1 is a poor prognostic factor and mediates resistance to docetaxel [J]. J Transl Med, 2013,11(1):204.
[14] Takata A, Takiguchi S, Okada K,etal. Clinicopathological and prognostic significance of FOXM1 expression in esophageal squamous cell carcinoma [J]. Anticancer Res, 2014,34(5):2427-2432.
[15] Shang R, Pu M, Li Y,etal. FOXM1 regulates glycolysis in hepatocellular carcinoma by transactivating glucose transporter 1 expression[J]. Oncol Rep, 2017,37(4):2261-2269.
[16] Li D, Wei P, Peng Z,etal. The critical role of dysregulated FOXM1-PLAUR signaling in human colon cancer progression and metastasis[J]. Clin Cancer Res, 2013,19(1):62-72.
[17] Uddin S, Ahmed M, Hussain A,etal. Genome-wide expression analysis of Middle Eastern colorectal cancer reveals FOXM1 as a novel target for cancer therapy[J]. Am J Pathol, 2011,178(2):537-547.
[18] 唐 慧, 郭 强, 朱 军, 等. FOXM1在结直肠腺瘤和结直肠癌组织中的异常表达及意义[J]. 肿瘤防治研究, 2011,38(10):1197-1200.
[19] Wen N, Wang Y, Wen L,etal. Overexpression of FOXM1 predicts poor prognosis and promotes cancer cell proliferation, migration and invasion in epithelial ovarian cancer[J]. J Transl Med, 2014,12(1):134.
[20] Kuda M, Kohashi K, Yamada Y,etal. FOXM1 expression in rhabdomyosarcoma: a novel prognostic factor and therapeutic target[J]. Tumour Biol, 2016,37(4):5213-5223.
[21] Park H J, Gusarova G, Wang Z,etal. Deregulation of FoxM1b leads to tumour metastasis[J]. EMBO Mol Med, 2011,3(1):21-34.
[22] Xu X S, Miao R C, Wan Y,etal. FoxM1 as a novel therapeutic target for cancer drug therapy[J]. Asian Pac J Cancer Prev, 2015,16(1):23-29.
Expression of FOXM1 in colorectal carcinoma and its clinical significance
LU Ming1, HU Kong-wang1, WANG Yi-wen1, LI Hao2, CAO Li-yu2
(1DepartmentofGastrointestinalSurgery,2DepartmentofPathology,theFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230022,China)
Purpose To investigate the expression of forkhead box M1 (FOXM1) in human colorectal cancer(CRC) tissues, and to analyze the correlation between its expression and clinicopathological parameters and prognosis of CRC. MethodsThe expression of FOXM1 was examined in 297 cases of CRC tissues and 80 cases of normal peritumoral tissues by immunohistochemistry of SP. Western blot was used to detect the expression of FOXM1 in 20 cases of fresh CRC tissues and the corresponding normal peritumoral tissues. Results The expression of FOXM1 was significantly higher in CRC tissues (60.6%) compared with normal peritumoral tissues ( 17.50%,P<0.01). The positive expression of FOXM1 was related to the depth of invasion, lymph node metastasis, intravascular cancer embolus, distant metastasis and TNM stage (P<0.05). However, there was no correlation with age, sex, tumor location, tumor size, tumor differentiation degree, CEA and CA199 (P>0.05). The relative expression levels of FOXM1 protein was also significantly higher in CRC tissues (0.855±0.063) compared with corresponding normal peritumoral tissues (0.150±0.041,P<0.01). The 3-year overall survival of CRC patients with FOXM1 expression was significantly lower than that of patients without FOXM1 expression (P<0.01), and FOXM1 is an independent prognostic factor for CRC. Conclusion The overexpression of FOXM1 protein in CRC tissues correlate with the clinicopathological characteristics and prognosis. FOXM1 may play an important role in the occurrence and metastasis of CRC, and it may be a new tumor marker and potential therapeutic target for CRC.
colorectal neoplasms; FOXM1; immunohistochemistry; Western blot; prognosis
安徽省省级质量工程项目(2016jxtd061)、安徽医科大学第一附属医院2015度新技术项目(2-22)、安徽医科大学第一附属医院2014后备人才项(20148)
安徽医科大学第一附属医院1胃肠外科、2病理科,合肥 230022
陆 明,男,硕士研究生。E-mail: pwluming@126.com 胡孔旺,男,博士,主任医师,副教授,硕士生导师,通讯作者。E-mail: hukw@sina.com
时间:2017-8-20 15:27 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170820.1527.005.html
R 735.2
A
1001-7399(2017)08-0847-06
10.13315/j.cnki.cjcep.2017.08.005
接受日期:2017-06-27

