显微镜下结肠炎2例
刘爱玲 周炜洵 王春耀 吕 红*中国医学科学院 北京协和医学院 北京协和医院消化内科(00730) 病理科
·病例分析与个案报道·
显微镜下结肠炎2例
刘爱玲1周炜洵2王春耀1吕 红1*
中国医学科学院 北京协和医学院 北京协和医院消化内科1(100730) 病理科2
腹泻; 结肠炎,淋巴细胞性; 结肠炎,胶原性; 诊断; 治疗
病例1:患者女性,42岁,因“间断腹泻18年,加重伴呕吐2个月”于2010-09-16就诊于北京协和医院。18年前因进食生冷食物出现腹泻,为黄色水样便,量约300~500 mL/次,每日5~6 次,因夜间腹泻而影响睡眠,伴脐周胀痛,便后缓解,无黏液脓血便,无发热。外院曾考虑“胃肠炎”、“肠易激综合征(IBS)”,予止泻等对症治疗后好转。此后间断发作类似腹泻,每1~2周1次。此次就诊前2个月进食剩菜后出现腹泻加重,伴恶心、呕吐。外院予蒙脱石散、洛哌丁胺等止泻治疗,效果不佳。此次发病以来体质量下降约15 kg。既往史无殊。
入院查体:体温36.5 ℃,脉搏70次/min,呼吸20次/min,血压 110/70 mm Hg(1 mm Hg=0.133 kPa),体质指数(BMI)16.9 kg/m2。体型消瘦,浅表淋巴结未及肿大,心肺无异常,触诊腹韧,中上腹深压痛,无反跳痛、肌紧张,肝脾未触及,肠鸣音5次/min,双下肢无水肿。实验室检查:血、尿、粪常规正常,粪苏丹Ⅲ染色阴性;电解质:Na+135 mmol/L,Cl-107 mmol/L,Ca2+2.43 mmol/L,K+3.2 mmol/L;肝肾功能、血脂、凝血功能、心肌酶谱、甲状腺功能正常;红细胞沉降率(ESR)、C反应蛋白(CRP)正常;感染指标:粪便细菌/真菌培养、寄生虫、悬滴试验、难辨梭菌毒素均阴性,T-SPOT.TB阴性,抗HIV抗体阴性;免疫指标:抗核抗体(ANA)、抗中性粒细胞胞质抗体(ANCA)、抗酿酒酵母抗体(ASCA)、抗可提取性核抗原(ENA)抗体、抗麦胶蛋白抗体、抗网硬蛋白抗体、抗肌内膜抗体、免疫球蛋白+补体均阴性;肿瘤指标:CA242、CEA、AFP、CA19-9、CA724均阴性;血清胃泌素正常;尿D-木糖吸收试验1.2 g/5 h(正常参考值:>1.2 g/5 h);血浆-粪便溶质差32 mmol/L H2O (正常参考值:<50 mmol/L H2O)。5 h胃排空排出30%(正常参考值:≥50%),24 h胃肠通过时间(GITT)排出0%(正常参考值:≥45%),提示非动力性腹泻。禁食后腹泻未见改善。生长抑素受体闪烁显像未见异常。结肠镜检查:未见明显异常(图1);活检病理:小肠(回肠末端)黏膜慢性炎,固有层纤维组织增生且有较多淋巴细胞浸润(>20个/100个上皮细胞)(图2)。病理表现符合淋巴细胞性结肠炎(lymphocytic colitis, LC),LC诊断明确。
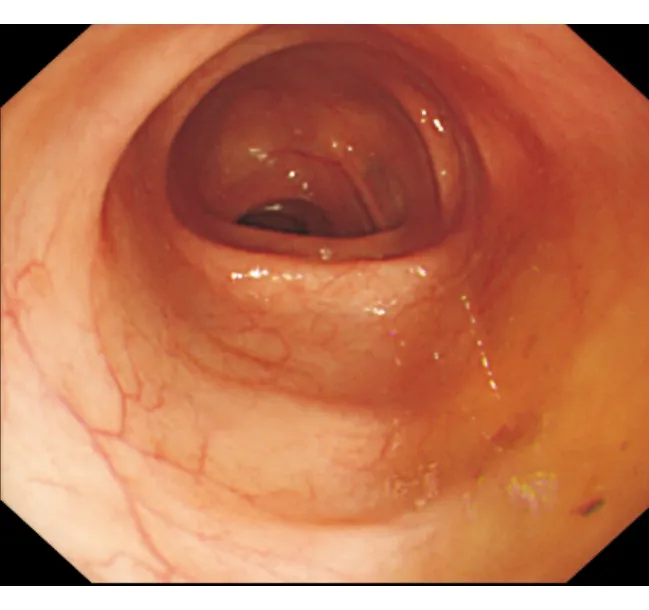
图1 病例1结肠镜检查未见明显异常
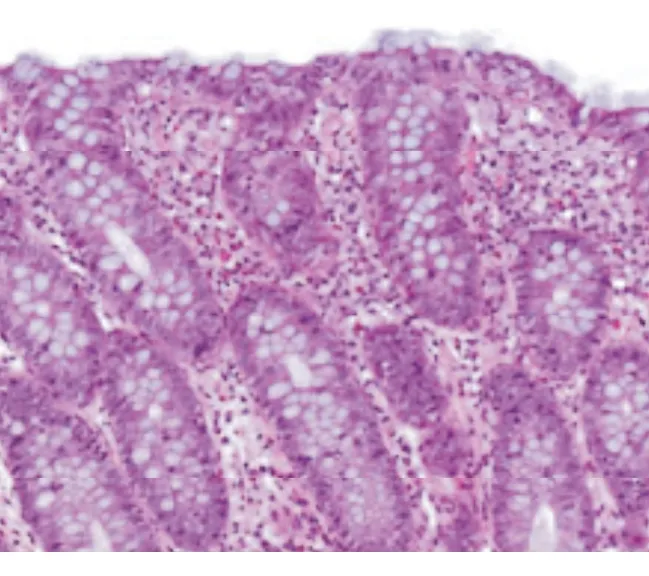
图2 病例1小肠黏膜固有层淋巴细胞浸润(HE染色,×400)
确诊后予口服美沙拉嗪 1 g qid,因效果不佳而改用泼尼松50 mg qd,患者腹泻次数减少,解黄色糊状便,每日2~3次。泼尼松规律减量后再次出现腹泻,加量后复好转,考虑激素依赖。2015年2月再次入院,调整治疗为泼尼松40 mg qd、硫唑嘌呤50 mg qd,腹泻好转。末次随诊时间为2015年3月,患者因出现社区获得性肺炎而停用硫唑嘌呤,经抗感染治疗后,继续泼尼松减量,患者一般情况可,无腹痛、发热等,解黄色糊状便,每日2~3次。
病例2:患者女性,41岁,因“腹泻2月余”于2010-10-28就诊于北京协和医院。2个月前进食后出现腹泻,为黄色水样便,每日10余次,量约2 000 mL/d,伴腹胀、脐周绞痛,便后腹痛减轻,无恶心、呕吐、发热等。外院考虑“胃肠炎”,予禁饮食、补液、蒙脱石散、生长抑素治疗,患者出现腹痛、腹胀、呕吐,排气、排便停止,随后出现咳嗽、发热、血压下降、意识淡漠,考虑“麻痹性肠梗阻,肺部感染,感染性休克”,收入北京协和医院内科重症监护病房。予亚胺培南、万古霉素、更昔洛韦等抗感染以及胃肠减压、气管插管、扩容补液、血管活性药物等治疗后,逐渐恢复自主排便、自主呼吸,血压稳定,拔除气管插管后转入消化内科病房。患者进食后仍有腹泻,性质同前。既往史无殊。
入院查体:体温36.8 ℃,脉搏100 次/min,呼吸22次/min,血压110/70 mm Hg。心肺无异常,左下腹压痛,无反跳痛、肌紧张,肠鸣音5次/min。实验室检查:血、尿常规正常,粪隐血(+),苏丹Ⅲ染色(+);肝肾功能、胰酶、甲状腺功能正常;ESR 23 mm/h,CRP 24.8 mg/L;感染指标:粪便细菌/真菌培养、难辨梭菌毒素均阴性;免疫指标:ANA、ANCA、抗双链DNA(dsDNA)抗体、抗ENA抗体、免疫球蛋白+补体均阴性;肿瘤指标:CEA、CA125、Hu-Yo-Ri抗体均阴性;尿D-木糖吸收试验0.2 g/5 h。结肠镜检查:进镜至回肠末端10 cm 处,见小肠绒毛变薄,血管纹理清晰(图3);活检病理:小肠(回肠末端)黏膜急、慢性炎,伴淋巴组织增生,未见隐窝脓肿,上皮下胶原层增厚>10 μm(图4)。病理表现符合胶原性结肠炎(collagenous colitis, CC)。CC诊断明确。
确诊后予口服美沙拉嗪1 g qid,因效果不佳而改用泼尼松50 mg qd, 患者逐渐过渡至正常饮食, 排便频率减至1~2 次/d,为黄色成形便,进食后无不适。病情好转后出院,之后未随诊。
讨论:显微镜下结肠炎(microscopic colitis, MC)是以慢性水样腹泻为主要表现、结肠镜下肉眼观察结肠黏膜大致正常而活检病理检查可见特异性改变的一组临床病理综合征,主要包括CC和LC两个亚型。临床医师常因对MC缺乏认识而造成漏诊和误诊。本文报道2例MC,以期提高其诊治水平。
近年来MC发病率呈上升趋势,逐渐引起人们的重视。据文献报道,MC占慢性腹泻病因的10%~15%,西方国家CC和LC发病率分别为1.1~5.2/10万和3.1~5.5/10万。MC好发于60岁以上的人群,女性多见[1-2],但约25%的患者确诊时年龄小于45岁。本文报道的2例患者均为女性,年龄分别为42岁和41岁。MC是慢性腹泻的重要原因,但我国对其报道较少,仅有个案报道或样本量较小的回顾性研究,尚无相关流行病学数据。原因可能在于国内常规认为慢性腹泻患者如结肠镜检查肉眼观察无异常发现则无需行活检病理检查,致使部分MC漏诊。MC的病因和发病机制不明,目前认为可能与肠道黏膜异常免疫、感染、自身免疫性疾病、吸烟、人类白细胞抗原(HLA)基因多态性、药物[非甾体消炎药(NSAIDs)、质子泵抑制剂(PPIs)等]、胆汁酸吸收异常等因素有关[1]。本文2例患者均无特殊用药史和吸烟史,发病原因不明。
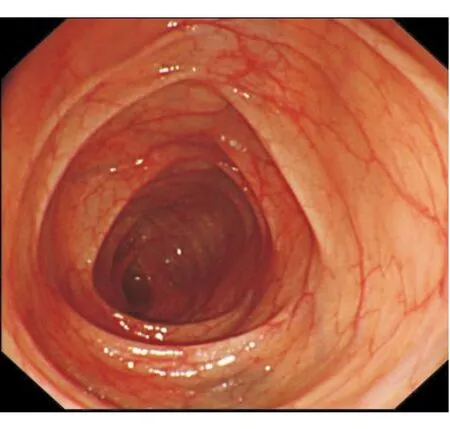
图3 病例2结肠镜检查见小肠绒毛变薄
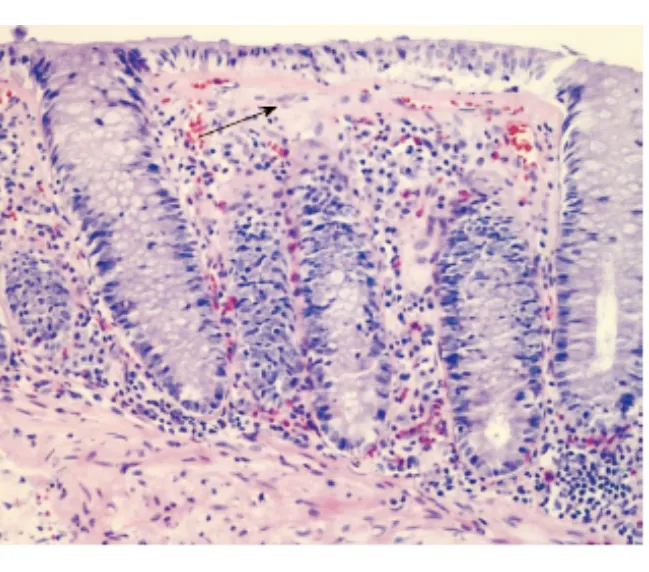
图4 病例2小肠黏膜上皮下胶原层增厚(HE染色,×400)
MC临床表现缺乏特异性,以慢性或间歇性水样腹泻为主,程度轻重不一,大多起病隐匿,但约40%为急性起病。患者每日腹泻4~9次,少数情况下可超过15次,或达到2 000 mL/d,可伴腹痛、里急后重、便失禁、消瘦等,肠外表现包括关节炎、关节痛、结膜炎等。30%~50%的MC患者可合并其他自身免疫性疾病,包括乳糜泻、Ⅰ型糖尿病、桥本甲状腺炎、类风湿关节炎等。实验室检查无特异性,可有贫血、ESR增快,约半数患者可有自身抗体阳性,包括类风湿因子(RF)、ANA、抗线粒体抗体(AMA)、ANCA、ASCA、抗甲状腺过氧化物酶(TPO)抗体等。少数患者可因肠道丢失蛋白质引起低白蛋白血症。MC腹泻的机制尚未完全明确,目前认为分泌性和渗透性腹泻同时存在[3]。本文2例患者均表现为水样腹泻,伴腹痛、腹胀,无肠外表现,未合并其他自身免疫性疾病,实验室检查结果无特异性。病例1病程长,慢性起病,D-木糖吸收试验结果为正常临界值,禁食后腹泻未见改善,血浆-粪便溶质差<50 mmol/L H2O,支持分泌性腹泻;病例2病程较短,急性起病,粪苏丹Ⅲ染色阳性,D-木糖吸收试验检测值降低,考虑小肠吸收不良,支持渗透性腹泻。
MC的诊断主要依靠内镜和活检病理检查。内镜下肉眼观察结肠黏膜正常,或仅表现为红斑、水肿。多数情况下,HE染色和其他传统染色如Masson染色、Van Gieson胶原纤维染色结果足以确诊MC[2]。主要组织病理学特征为肠上皮下和固有层内CD8+T细胞浸润,伴或不伴黏膜结构轻度破坏,其中CC指连续的上皮下胶原层异常增厚超过10 μm(正常值为3~7 μm);LC指表面上皮内淋巴细胞(IELs)数量增加,诊断标准为>20个IELs /100个上皮细胞。本文2例患者均经内镜活检病理检查确诊。
因MC病变严重程度由近及远逐渐减轻,故右半结肠活检阳性率较高。目前对活检部位和数目尚未达成共识。美国胃肠病学会指出,应于升结肠、横结肠、降结肠、乙状结肠、直肠多点取活检,每处取2~4块活检,以提高诊断率[4]。
MC需与引起慢性腹泻的其他原因进行鉴别,如腹泻型IBS(IBS-D)、炎症性肠病早期、乳糜泻等。Abboud等[5]的一项前瞻性研究显示,38%~58%的MC患者符合IBS诊断标准,故符合IBS诊断标准不足以排除MC。本文2例患者中,病例1曾被误诊为胃肠炎和IBS,长期未获得病因针对性的治疗,患者生活质量受到严重影响。因此对于高度怀疑MC的患者(年龄>50岁,夜间腹泻,近期开始服药或合并自身免疫性疾病),如经IBS对症治疗无效,应考虑MC并行结肠活检。
MC治疗的目标是达到临床缓解(每日排便<3次或1次 水样便),提高生活质量[4]。建议停用NSAIDs等与MC相关的药物,提倡戒烟。已确诊MC的患者首选口服布地奈德治疗以诱导临床缓解[4],如布地奈德使用不便,可改用泼尼松或泼尼松龙。一项以人群为基础的队列研究[6]显示,MC患者对泼尼松的完全应答率显著低于布地奈德(52.9%对82.5%),停药后复发率高。对于激素耐药的MC患者,可考虑加用免疫抑制剂(硫唑嘌呤、6-巯基嘌呤、甲氨蝶呤等),有效率约为50%。洛哌丁胺、次水杨酸铋、考来烯胺、美沙拉嗪等属于二线药物,对于症状较轻的MC患者可优先选用。对于腹泻量大造成水电解质紊乱的患者,可短期使用生长抑素类似物如奥曲肽等以控制症状,但应注意需缓慢减量至停药,以防突然停药后腹泻复发甚至加重。对于难治性病例,可考虑使用抗肿瘤坏死因子(TNF)抗体如英夫利昔单抗(infliximab)、阿达木单抗(adalimumab)或行回肠造口术[1]。本文2例患者使用蒙脱石散、洛哌丁胺、生长抑素等止泻无效,美沙拉嗪效果亦不佳,改用泼尼松后达到临床缓解。病例1出现激素依赖,加用硫唑嘌呤治疗后好转。
综上所述,MC临床和结肠镜表现无特异性,确诊依靠内镜活检病理结果,因其症状持续、易复发而严重影响患者生活质量,应引起临床医师的重视。对于难治性慢性腹泻患者,需考虑MC可能并及时行结肠镜检查,活检应于多部位取材,强调全科医师、消化科医师、内镜医师和病理医师合作,以利于早期诊断和治疗。
1 Park T, Cave D, Marshall C. Microscopic colitis: A review of etiology, treatment and refractory disease[J]. World J Gastroenterol, 2015, 21 (29): 8804-8810.
3 Bürgel N, Bojarski C, Mankertz J, et al. Mechanisms of diarrhea in collagenous colitis[J]. Gastroenterology, 2002, 123 (2): 433-443.
4 Nguyen GC, Smalley WE, Vege SS, et al; Clinical Guidelines Committee. American gastroenterological associ-ation institute guideline on the medical management of microscopic colitis[J]. Gastroenterology, 2016, 150 (1): 242-246.
5 Abboud R, Pardi DS, Tremaine WJ, et al. Symptomatic overlap between microscopic colitis and irritable bowel syndrome: a prospective study[J]. Inflamm Bowel Dis, 2013, 19 (3): 550-553.
6 Gentile NM, Abdalla AA, Khanna S, et al. Outcomes of patients with microscopic colitis treated with corti-costeroids: a population-based study[J]. Am J Gastroenterol, 2013, 108 (2): 256-259.
(2017-04-19收稿;2017-05-08修回)
Microscopic Colitis: Report of 2 Cases
LIUAiling1,ZHOUWeixun2,WANGChunyao1,LÜHong1.
1DepartmentofGastroenterology,2DepartmentofPathology,PekingUnionMedicalCollegeHospital,PekingUnionMedicalCollege,ChineseAcademyofMedicalSciences,Beijing(100730)
LÜ Hong, Email: honglv2006@hotmail.com
Diarrhea; Colitis, Lymphocytic; Colitis, Collagenous; Diagnosis; Therapy
10.3969/j.issn.1008-7125.2017.08.016
*本文通信作者,Email: honglv2006@hotmail.com

