Fe3O4/CeO2复合材料催化降解橙黄G的效能及降解途径
张晓薇, 甘国强
1.辽宁工程技术大学环境科学与工程学院, 辽宁 阜新 123000 2.东北大学资源与土木工程学院, 辽宁 沈阳 110819 3.中国科学院沈阳应用生态研究所, 辽宁 沈阳 110016
Fe3O4/CeO2复合材料催化降解橙黄G的效能及降解途径
张晓薇1,2, 甘国强3
1.辽宁工程技术大学环境科学与工程学院, 辽宁 阜新 123000 2.东北大学资源与土木工程学院, 辽宁 沈阳 110819 3.中国科学院沈阳应用生态研究所, 辽宁 沈阳 110016
为研究磁性纳米Fe3O4/CeO2复合材料在高浓度难降解有机废水处理中的应用,利用共沉淀法制备Fe3O4/CeO2复合材料,并将其作为非均相类Fenton催化剂降解橙黄G染料废水,利用单因素法优化出最佳降解工艺,同时利用TOF-MS/MS(飞行时间质谱)检测降解中间产物,推测出可能降解途径. 结果表明,当Ce/Fe为1∶1(质量比)时制备的Fe3O4/CeO2复合材料催化效果最佳. 最佳降解工艺条件:初始pH为2.0,温度为30 ℃,H2O2投加量为30 mmol/L,Fe3O4/CeO2复合材料的投加量为2.0 g/L,初始ρ(橙黄G)为50 mg/L. 在最佳降解工艺条件下反应120 min后,橙黄G去除率为96.2%,TOC去除率为65.0%,Fe3O4/CeO2复合材料至少可重复利用6次. 研究显示,橙黄G降解主要有三条可能的降解途径,包括偶氮键断裂、偶氮键与苯环断开、脱磺酸基、羟基化以及开环等过程,共检测出八种可能的降解中间产物,主要有苯胺、苯酚、萘酚以及羧酸等.
Fe3O4/CeO2; 橙黄G; 类芬顿法; 降解效能; 降解途径

非均相类Fenton法成本低、效益高、毒性低及工艺简单,最重要的是催化剂回收简单,不会产生二次污染,是一种具有实际应用价值的处理工艺[5- 6]. 磁性纳米材料在水处理方面具有优良的吸附性和催化活性,并且超顺磁性使其在实际工艺中具有很强的操作性,二者结合,将磁性纳米材料作为非均相类Fenton催化剂,是一种新型的水处理工艺,值得深入研究[7- 8]. 磁性纳米Fe3O4/CeO2复合材料是一种新型高效的非均相类Fenton催化剂,被作为类Fenton催化剂用于降解高浓度难降解有机废水,这种材料催化活性高、重复利用性优良、易于分离,没有二次污泥产生. XU等[9- 10]利用共沉淀法合成磁性纳米Fe3O4/CeO2复合材料,并且将其作为类Fenton催化剂用于对氯苯酚及三氯苯酚废水的降解. 结果表明,Fe3O4/CeO2复合材料是一种性能优良的非均相催化剂,并且Ce能够促进Fe3O4中铁的溶解,进而催化类Fenton反应速率[11],同时Ce能够连接起Fe2+与Fe3+的循环,增大反应中铁的利用率. 催化反应过程如式(1)~(7)所示.
Fe2++H2O2+H+→Fe3++ ·OH+H2O
(1)
Fe3++H2O2→Fe2++HO2· +H+
(2)
Fe3++HO2· →Fe2++O2+H+
(3)
(4)
(6)
·OH+目标物→降解产物
(7)
近年来,国内对Fe3O4/CeO2复合材料的研究越来越多,孙正男等[12]将Fe3O4/CeO2用于降解3,4-二氯三氟甲苯;胡晓丹等[13]利用Fe3O4/CeO2用于降解氧氟沙星,取得良好效果. 笔者前期研究中利用浸入氧化共沉淀法合成磁性纳米Fe3O4/CeO2复合材料,将其用于橙黄G染料废水催化降解中,表现出良好的催化性能[14]. 众所周知,降解中间产物的鉴定是污水催化降解研究中最重要的环节之一,因此,该研究利用飞行时间质谱(TOF-MS/MS)定性鉴别分析了橙黄G的降解中间产物,进而推测出了可能的降解途径,以期为Fe3O4/CeO2复合材料在难降解有机废水处理中的应用提供理论基础.
1 材料与方法
1.1试剂与仪器
橙黄G(95%)、CeO2(20~30 nm)、FeSO4·7H2O、Fe2(SO4)3、H2O2、NH3·H2O、NaOH、HCl、无水乙醇、正丁醇均为标准分析纯. 乙腈、甲醇、甲酸、娃哈哈纯净水均为标准色谱纯.
XevoTM G2飞行时间质谱仪(美国Waters公司),Waters ACQUITY超高效液相色谱仪(美国Waters公司),Waters- 2414傅里叶变换红外光谱仪(美国Waters公司),X′Pert Pro粉末X射线衍射仪(荷兰PANalytical公司),SSX- 550扫描电子显微镜(日本Shimadzu公司),MPMS- 7磁性测量系统(美国Quantum Design公司),UV- 2450型紫外可见分光光度计(日本岛津),AUW120D分析天平(日本岛津),TOC- 4200测定仪(日本岛津),JJ- 1A数显测速电动搅拌机(江苏荣华仪器制造有限公司),KQ5200 DE超声仪(上海汉克科学仪器有限公司),DK-S26型电热恒温水浴锅(上海森信实验仪器有限公司).
数据处理与图谱解析主要利用MassLynx V4.1、Origin 8和Excel 2010等软件完成.
1.2Fe3O4/CeO2复合材料的制备
称取2.0 g纳米CeO2,置于500 mL三颈烧瓶中,加入100 mL 1.0 mol/L的NH3·H2O溶液,80 ℃水浴加热,搅拌分散0.5 h. 缓慢滴加50 mL 0.8 mol/L的FeSO4·7H2O溶液(溶剂为1.0% HCl),搅拌反应0.5 h,得黑色悬浮液. 将该悬浮液用磁铁分离,固体用纯水洗至中性,再用无水乙醇洗3遍,真空干燥24 h,得到Ce/Fe(质量比,下同)为1∶1的Fe3O4/CeO2复合材料,研磨,备用.
1.3Fe3O4/CeO2复合材料的表征
采用FTIR(Fourier Transform Infrared,傅里叶变换红外光谱)、XRD(X-ray Diffraction,X射线衍射)、SEM(Scanning Electron Microscope,扫描电子显微镜)、VSM(Vibrating Sample Magnetometer,振动样品磁强计)、XPS(X-ray Photoelectron Spectroscopy, X射线能谱)对Ce/Fe为1∶1的Fe3O4/CeO2复合材料进行形貌、结构及磁性能进行表征.
1.4降解试验
准确量取pH为2.0的50.0 mg/L的橙黄G使用液50 mL,置于150 mL锥形瓶中,加入0.1 g Fe3O4/CeO2复合材料,置于摇床上,空气浴30 ℃加热. 向锥形瓶内滴加H2O2溶液至c(H2O2)为30 mmol/L,开始反应. 每隔5、10、20、40、60、80、120 min取样5 mL,加入0.1 mL 0.3 mmol/L的正丁醇,清除溶液中的·HO,停止反应. 用磁铁吸附分离溶液中的复合材料,478 nm下测定溶液吸光度,根据标曲计算浓度. 材料回收后,经纯水洗至中性,再用无水乙醇洗3遍,真空干燥24 h,研磨,重复利用.
1.5分析测定
1.5.1标准曲线
配制5.0、10.0、20.0、30.0、40.0 mg/L的橙黄G系列标准溶液,分别调节pH为1.0、2.0、3.0、4.0、5.0、6.0,在478 nm下测定吸光度. 以标准溶液的浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得到回归方程.
1.5.2降解中间产物分析
色谱柱:Waters ACQUITY HSS C18小柱(2.1 mm×100 mm,1.8 μm,Waters,Milford,MA,USA). 流动相A为0.1%甲酸-水溶液,流动相B为乙腈;洗脱梯度:0~4.0 min为10%~30%(B),4.0~15 min为30%~65%(B). 流速为0.5 mL/min;柱温为35 ℃;进样量为2 μL;锥孔电压为45 eV;碰撞能为20~40 V;源温度为130 ℃;扫描范围(m/z)为100~1 000;扫描方式为正离子模式.
ρ(总溶解铁离子)和ρ(Fe2+)采用1,10-邻菲罗啉显色法[15- 16]测定;c(H2O2)采用碘量法[17]测定.
2 结果与讨论
2.1Fe3O4/CeO2复合材料的表征
2.1.1傅里叶变换红外光谱分析

图1 Fe3O4/CeO2复合材料的FTIR图谱Fig.1 FTIR pattern of Fe3O4/CeO2 composite
2.1.2扫描电子显微镜
由图2可见,Fe3O4/CeO2复合材料是由均匀规则的球型或类球型纳米粒子组成,粒径分布为20~40 nm;材料有团聚现象,这主要是由于材料具有一定磁性,在用大磁力的磁铁分离时会使材料发生团聚[22]所致.

图2 Fe3O4/CeO2复合材料的扫描电镜图Fig.2 SEM image of Fe3O4/CeO2 composite
2.1.3X射线衍射
图3为纳米Fe3O4/CeO2复合材料的X射线衍射图. 与国际粉末衍射标准联合会出版的PDF标注卡片Fm- 3m(227),JCPDS no.74- 0748对比得知,衍射角(2θ)为30.0°、35.4°、43.1°、53.5°、57.0°和62.6°处的衍射峰属于Fe3O4尖晶石结构[23];在衍射角为28.30°、33.10°、47.36°、56.24°、59.26°、69.30°、76.80°、79.31°和88.68°出现的衍射峰分别归属于二氧化铈立方体萤石结构[24]〔Fm- 3m(225),JCPDS no.34- 0394〕.
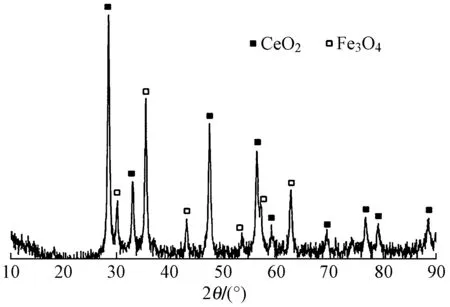
图3 Fe3O4/CeO2复合材料的X射线衍射图Fig.3 XRD pattern of Fe3O4/CeO2 composite
2.1.4振动样品磁强
由图4可见,材料为零剩磁和零磁矫顽力,说明纳米Fe3O4/CeO2复合材料具有超顺磁性[25]. 并且该纳米材料的磁饱和强度为16.0 emu/g,说明溶液中的材料可以很容易的用磁铁分离出来,满足实际应用需要.

图4 Fe3O4/CeO2复合材料的磁化强度曲线Fig.4 Magnetization curve of Fe3O4/CeO2 composite
2.1.5X射线能谱
由图5可见,结合能为902.5 eV处为Ce 3d峰,710.5 eV处为Fe 2p峰,529.94 eV处为O 1s峰. 并且由XPS表征结果可知,反应前,材料表面含有5.45%的Fe元素、2.35%的Ce元素、30.48%的O元素及61.72%的C元素. 而反应后材料表面含有17.4%的Fe元素、4.07%的Ce元素、43.38%的O元素及35.14%的C元素. 材料表面的C元素主要因为材料具有吸附性,在清洗材料时用到了无水乙醇,使得材料吸附着一定量的有机物[26]. 此外反应前后材料表面Fe、Ce、O元素的含量增加,C元素的含量减小. 这可能是因为反应后的材料由于铁的消耗,导致材料的结构发生变化,其对乙醇的吸附性能减小,导致反应后材料在相同的处理下表面有机物的总量减小,而C含量的大幅减小,导致Fe、Ce、O元素的含量增加.
油红O染色方法参照Ramirez等的染色方法[9],每个浓度组取生长至L4末期的线虫,用M9缓冲液将平板中的线虫洗脱于离心管中,转速为1500 r/min离心2 min去上清,重复洗脱三次;加入体积分数为60%的异丙醇,使线虫脱水,15 min后洗去异丙醇溶液;加入油红O染色30 min,用M9反复冲洗6次;将线虫转移到NGM平板上,随机挑取20只线虫置于载玻片上,显微镜下观察拍照。

图5 Fe3O4/CeO2复合材料的X射线能谱分析Fig.5 XPS pattern of Fe3O4/CeO2 composite
2.2降解工艺条件优化
2.2.1Ce/Fe对降解速率的影响
在初始pH为2.0、温度为30 ℃、H2O2投加量为30 mmol/L、Fe3O4/CeO2复合材料的投加量为2.0 g/L、初始ρ(橙黄G)为50 mg/L、反应时间为120 min的条件下,考察了Ce/Fe分别为1∶2、1∶1和2∶1(质量比,下同)时Fe3O4/CeO2复合材料的催化性能,结果如图6(a)所示. 由图6(a)可见,当Ce/Fe为1∶1时橙黄G降解速率最好,并与Ce/Fe为1∶2时的结果差别不大,但与2∶1 组的差别较大. 笔者研究发现,CeO2在反应过程中起到促进铁溶解以及加快·OH产生速率的作用. 当复合材料中CeO2含量太少时,其催化作用不明显,反应主要靠Fe3O4自身的溶解,分解H2O2产生·OH,因此反应较慢. 当CeO2含量过多时,CeO2自身分解H2O2产生·OH的速率较慢,而Fe3O4含量过少,也就是活性点位过少,导致产生·OH的速度过慢. 因此,后续试验及表征过程均使用Ce/Fe为1∶1的复合材料.
2.2.2溶液初始pH对降解速率的影响
在初始温度为30 ℃、H2O2投加量为30 mmol/L、Fe3O4/CeO2复合材料的投加量为2.0 g/L、初始ρ(橙黄G)为50 mg/L、反应时间为120 min的条件下,初始溶液pH分别为1.0、2.0、3.0、4.0、5.0、6.0时橙黄G的降解速率如图6(b)所示. 由图6(b) 可见,随着pH由6.0降至2.0,橙黄G的降解速率一直增大;当pH由2.0继续降至1.0时,染料的降解速率反而降低. 这可能是由于在过酸的条件下,磁性纳米Fe3O4/CeO2复合材料不稳定所致. 因此,该研究选择溶液初始pH为2.0.
2.2.3材料投加量对降解速率的影响
在初始pH为2.0、温度为30 ℃、H2O2投加量为30 mmol/L、初始ρ(橙黄G)为50 mg/L、反应时间为120 min条件下,Fe3O4/CeO2复合材料的投加量分别为0.5、1.0、2.0、4.0 g/L时橙黄G的降解情况如图6(c)所示. 由图6(c)可见,Fe3O4/CeO2复合材料的投加量由0.5 g/L增至2.0 g/L,橙黄G的降解速率呈增大趋势. 但当投加量增至4.0 g/L时,降解速率反而降低,这可能是由于投加量过大时,Fe3O4/CeO2复合材料容易团聚、分散性不好造成的. 因此,该研究选择Fe3O4/CeO2复合材料的投加量为2.0 g/L.
2.2.4H2O2投加量对降解速率的影响
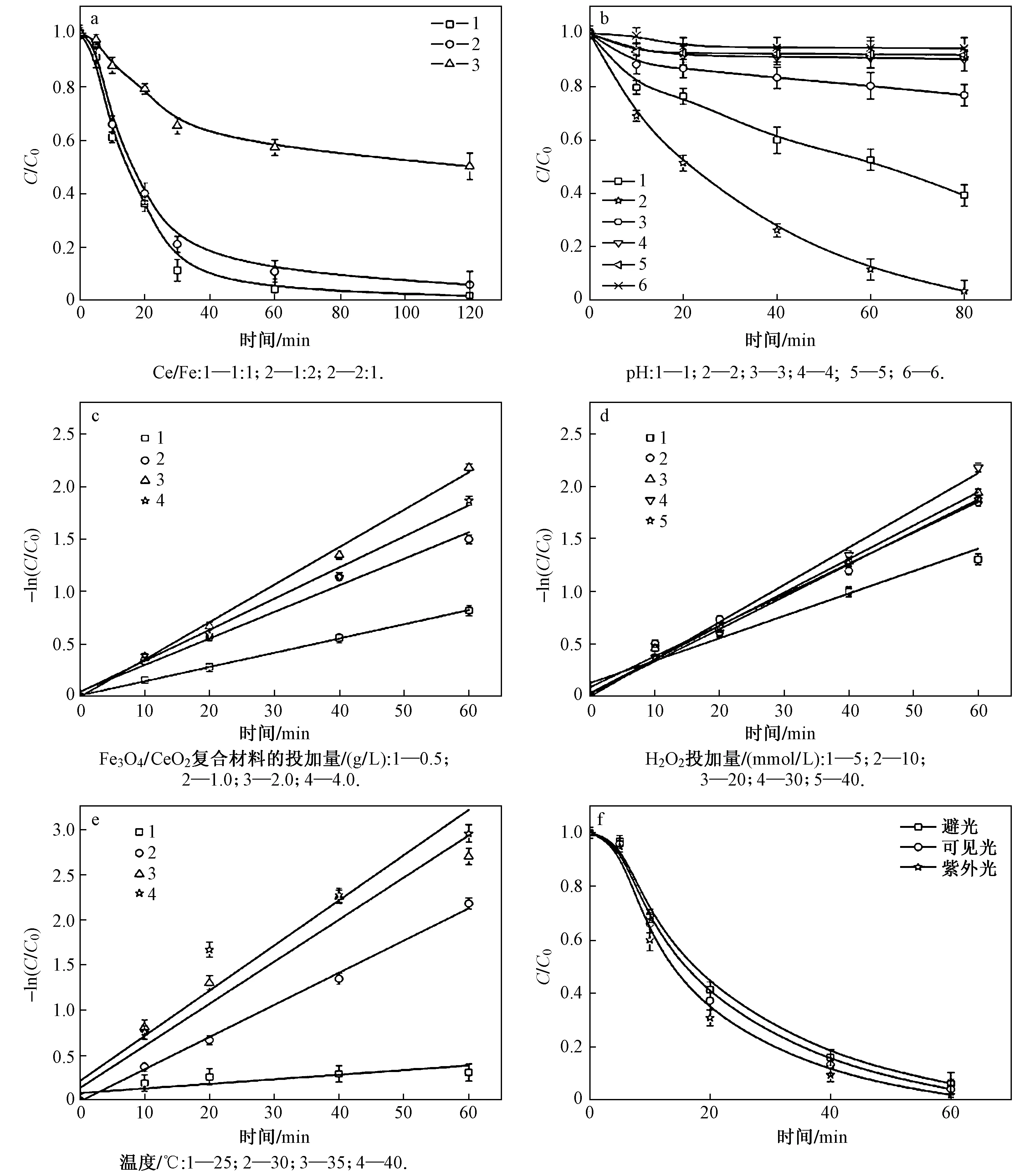
注:C和C0分别为反应过程中及初始时刻的ρ(橙黄G).图6 Fe3O4/CeO2复合材料降解橙黄G的工艺优化Fig.6 Factorial optimization of OG degradation by Fe3O4/CeO2 composite
在初始pH为2.0、温度为30 ℃、Fe3O4/CeO2复合材料的投加量为2.0 g/L、初始ρ(橙黄G)为50 mg/L、反应时间为120 min条件下,H2O2投加量分别为5、10、20、30、40 mmol/L时橙黄G的降解速率的变化如图6(d)所示. 由图6(d)可见,随着H2O2投加量的增加橙黄G的降解速率呈递增趋势,当H2O2投加量增至40 mmol/L时,橙黄G降解速率反而有所减小,这可能是由于过量的H2O2会消耗反应中产生的·OH所致. 因此,该研究选择H2O2投加量为30 mmol/L.
2.2.5温度对降解速率的影响
在初始pH为2.0、H2O2投加量为30 mmol/L、Fe3O4/CeO2复合材料的投加量为2.0 g/L、初始ρ(橙黄G)为50 mg/L、反应时间为120 min条件下,反应温度分别控制为25、30、35、40 ℃时橙黄G的降解速率的变化如图6(e)所示. 由图6(e)可见,随反应温度的升高,降解速率增大,但是温度过高会增加处理成本,因此,该研究选择反应温度为30 ℃.
2.2.6光照对降解速率的影响
在初始pH为2.0、温度为30 ℃、H2O2投加量为30 mmol/L、Fe3O4/CeO2复合材料的投加量为2.0 g/L、初始ρ(橙黄G)为50 mg/L、反应时间为120 min条件下,避光、可见光照射、紫外光照射时橙黄G的降解速率如图6(f)所示. 由图6(f)可见,光照对反应速率影响不大. 故在反应过程中无需刻意考虑光照因素.
综上,得出最佳降解工艺条件:初始pH为2.0,温度为30 ℃,H2O2投加量为30 mmol/L,Fe3O4/CeO2复合材料的投加量为2.0 g/L,初始ρ(橙黄G)为50 mg/L. 反应120 min后橙黄G降解率为96.2%.
2.3溶液中溶解的Fe、Ce及H2O2含量的变化
最优工艺条件下溶液中溶解的Fe、Ce含量如图7所示. 由图7可见,最初30 min内,ρ(Fe2+)快速增大,随后逐渐降低,120 min时ρ(Fe2+)由5.6 mg/L降至3.2 mg/L. 这主要是因为在上升期,H2O2能够促进Fe2+的释放;而在下降期,Ce4+和H2O2将Fe2+氧化成Fe3+,导致ρ(Fe2+)降低. 在整个反应过程中,ρ(总溶解铁离子)持续增大,反应结束时为23.4 mg/L,约占材料中铁含量的3.6%. 在溶液中未检测到Ce,进一步验证了橙黄G的降解反应主要是由溶液中溶解的Fe2+和Fe3+催化进行,而CeO2的作用是促进Fe3O4中铁的溶解,加快降解反应速率[9,14]. 反应结束时c(H2O2)降至17.6 mmol/L. 表明H2O2的利用率较高.

图7 降解反应过程中总溶解铁离子、Fe2+以及H2O2浓度的变化Fig.7 Concentration variation of dissolved iron,ferrousion and H2O2 in solution during OG degradation
2.4降解途径考察
众所周知,类芬顿法降解有机物主要是利用催化剂体系产生·OH,利用·OH的强氧化性氧化降解水中的有机物,但·OH会无选择性的攻击化合物的每个部位,所以非均相类芬顿法催化降解橙黄G的途径很复杂[27]. 文献[28- 31]报道主要有三条降解途径:偶氮键断裂、偶氮键与苯环断开和脱磺酸基,降解中间产物主要有苯胺、苯酚、萘酚以及羧酸等. 该研究通过TOF-MS/MS分析推测了橙黄G催化降解中间产物,以确定其可能的降解途径. 在该研究条件下,检测到八种降解中间产物,其m/z分别为 335.315 4〔tR(飘移时间)=8.6 min〕、364.313 6(tR=9.2 min)、280.283 0(tR=7.2 min)、207.185 8(tR=4.3 min)、320.300 7(tR=7.8 min)、194.187 0(tR=3.8 min)、226.185 8(tR=3.3 min)、198.132 0(tR=3.1 min). 结合文献,推测这8种物质可能的分子式分别为C10H9O8S2N、C10H8O9S2N2、C16H12O3N2、C10H9O4N、C10H8O8S2、C10H8O4、C10H8O6以及C8H6O6. 由此,推测可能的降解途径有三种(见图8).
途径1,橙黄G的偶氮键断裂生成苯胺和C10H9O8S2N,C10H9O8S2N脱磺酸基生成C10H9O4N,进而羟基化生成C10H8O4;途径2,橙黄G苯环与偶氮集团之间的C—N键断裂,生成C10H8O9S2N2, C10H8O9S2N2羟基化生成C10H8O8S2,进而脱磺酸基后生成C10H8O4;途径3,橙黄G脱磺酸基生成C16H12O3N2,进而偶氮键断裂加羟基生成C10H9O4N,同样的C10H9O4N羟基化生成C10H8O4. 最后,C10H8O4羟基化生成C10H8O6,C10H8O6的萘环被氧化断裂生成C8H6O6,最后苯环进一步氧化开环生成小分子羧酸,最终矿化为CO2和H2O.
2.5矿化度考察
在降解过程中,ρ(TOC)是一个重要指标,它直接反映的是水中有机物的含量. 如图9所示,反应前2 h 内TOC去除率快速增至47%,随着反应的继续进行,TOC去除率增速减慢,到12 h时达到65.0%. 因此,在该非均相类芬顿催化过程中,橙黄G并没有完全催化降解成CO2和H2O,而是部分仍以小分子有机物形式存在. 但是在120 min时,偶氮键基本完全断裂. 众所周知,偶氮键的断裂会降低橙黄G的生物毒性[32],因此,Fe3O4/CeO2复合材料的非均相催化可以用作预废水处理工艺,以降低废水的生物毒性,增加废水的可生化性.
2.6材料重复利用性考察
Fe3O4/CeO2复合材料的重复利用性考察结果如图10所示. 随着材料的重复利用次数的增多,在最优条件下,橙黄G的降解率逐渐降低,可能的原因是随着使用次数的增多,材料表面的铁含量越来越少,导致材料的催化活性降低. 然而,在第6次重复使用时,染料的降解率仍为90.4%. 这表明Fe3O4/CeO2复合材料具有优良的重复利用性.

图8 橙黄G可能的降解途径Fig.8 Proposed reaction pathway for the degradation of OG
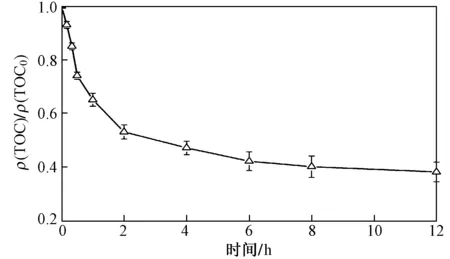
图9 最优条件下橙黄G降解过程中溶液ρ(TOC)的变化Fig.9 Concentration variation of TOC in solution during OG degradation under optimal reaction conditions

图10 Fe3O4/CeO2复合材料重复使用8次时橙黄G降解率Fig.10 The degradation of OG for eight runs of reused catalyst of Fe3O4/CeO2 composite
3 结论
a) 利用共沉淀法制备了Fe3O4CeO2复合材料,该复合材料是由均匀规则的球型或类球型纳米粒子组成,粒径分布为20~40 nm,磁饱和强度为16.0 emug,材料表面Fe占5.45%,Ce占2.35%,O占30.48%,C占61.72%.
c) 由飞行时间质谱定性鉴别分析结果表明,橙黄G降解主要有三条可能降解途径,包括偶氮键断裂、偶氮键与苯环断开、脱磺酸基、羟基化以及开环等过程,共检测出八种可能的降解中间产物,主要有苯胺、苯酚、萘酚以及羧酸等.
[1] MESQUITA I,MATOS L C,DUARTE F,etal.Treatment of azo dye-containing wastewater by a Fenton-like process in a continuous packed-bed reactor filled with activated carbon[J].Journal of Hazardous Materials,2012,237(238):30- 37.
[2] 吴祖望,杨威.21世纪20年代我国的染料工业与染料学科展望[J].染料与染色,2007,44(1):1- 4. WU Zuwang,YANG Wei.A propect for dyestuff industry and dyestuff science in China in 2020[J].Dyestuffs and Coloration,2007,44(1):1- 4.
[3] ZHANG Xingwang,FU Jianliang,ZHANGYi,etal.A nitrogen functionalized carbon nanotube cathode for highly efficient electrocatalytic generation of H2O2in Electro-Fenton system[J].Separation & Purification Technology,2008,64(1):116- 123.
[4] HAQUE M M,SMITH W T,WONG D K.Conducting polypyrrole films as a potential tool for electrochemical treatment of azo dyes in textile wastewaters[J].Journal of Hazardous Materials,2015,283(283):164- 170.
[5] RAMIREZ J H,MALDONADO-H DAR F J,P REZ-CADENAS A F,etal.Azo-dye orange II degradation by heterogeneous Fenton-like reaction using carbon-Fe catalysts[J].Applied Catalysis B:Environmental,2007,75(3/4):312- 323.
[6] JAMALLUDDIN N A,ABDULLAH A Z.Fe incorporated mesocellular foam as an effective and stable catalyst:effect of Fe concentration on the characteristics and activity in Fenton-like oxidation of acid red B[J].Journal of Molecular Catalysis A:Chemical,2016,414:94- 107.
[7] SUN Shengpeng,LEMLEY A T.p-nitrophenol degradation by a heterogeneous Fenton-like reaction on nano-magnetite:process optimization,kinetics,and degradation pathways[J].Journal of Molecular Catalysis A:Chemical,2011,349(1):71- 79.
[8] XU Lejin,WANG Jianlong.Fenton-like degradation of 2,4-dichlorophenol using Fe3O4magnetic nanoparticles[J].Applied Catalysis B:Environmental,2012,123/124(30):117- 126.
[9] XU Lejin,WANG Jianlong.Magnetic nanoscaled Fe3O4/CeO2composite as an efficient Fenton-like heterogeneous catalyst for degradation of 4-chlorophenol[J].Environmental Science & Technology,2012,46(18):10145- 10153.
[10] XU Lejin,WANG Jianlong.Degradation of 2,4,6-trichlorophenol using magnetic nanoscaled Fe3O4/CeO2composite as a heterogeneous Fenton-like catalyst[J].Separation & Purification Technology,2015,149(2):55- 64.
[11] HECKERT E G,SEAL S,SELF W T.Fenton-like reaction catalyzed by the rare earth inner transition metal cerium[J].Environmental Science & Technology,2008,42(13):5014- 5019.
[12] 孙正男,杨琦,纪冬丽,等.纳米Fe3O4/CeO2-H2O2非均相类Fenton体系对3,4-二氯三氟甲苯的降解[J].环境科学,2015,36(6):2154- 2160. SUN Zhengnan,YANG Qi,JI Dongli,etal.Degradation of 3,4-dichlorobenzotrifluoride by Fe3O4/CeO2-H2O2heterogeneous Fenton-like systems[J].Environmental Science,2015,36(6):2154- 2160.
[13] 胡晓丹,周志伟,张伟,等.磁性纳米CeO2/Fe3O4非均相Fenton反应催化降解氧氟沙星[J].无机材料学报,2016(6):613- 620. HU Xiaodan,ZHOU Zhiwei,ZHANG Wei,etal.Heterogeneous Fenton Reaction for Degradation of Ofloxacin withMagnetic CeO2/Fe3O4[J].Journal of Inorganic Materials,2016(6):613- 620.
[14] GAN Guoqiang,LIU Juan,ZHU Zhixi,etal.A novel magnetic nanoscaled Fe3O4/CeO2composite prepared by oxidation-precipitation process and its application for degradation of Orange G in aqueous solution as Fenton-like heterogeneous catalyst[J].Chemosphere,2016,168:254- 263.
[15] TAMURA H,GOTO K,YOTSUYANAGI T,etal.Spectrophotometric determination of iron(II) with 1,10-phenanthroline in the presence of large amounts of iron(III)[J].Talanta,1974,21(4):314- 318.
[16] PHAM A L,LEE C,DOYLE F M,etal.A silica-supported iron oxide catalyst capable of activating hydrogen peroxide at neutral pH values[J].Environmental Science & Technology,2009,43(23):8930- 8935.
[17] KAVITHA V,PALANIVELU K.The role of ferrous ion in Fenton and photo-Fenton processes for the degradation of phenol[J].Chemosphere,2004,55(9):1235- 1243.
[18] PANAHI-KALAMUEI M,ALIZADEH S,MOUSAVI-KAMAZANI M,etal.Synthesis and characterization of CeO2nanoparticles via hydrothermal route[J].Journal of Industrial & Engineering Chemistry,2015,21(11):1301- 1305.
[19] LU Wensheng,SHEN Yuhua,XIE Anjing,etal.Green synthesis and characterization of superparamagnetic Fe3O4nanoparticles[J].Journal of Magnetism & Magnetic Materials,2010,322(13):1828- 1833.
[20] 马占营,姚秉华,张萍.双亲性w/o-SiO2-void-TiO2中空核壳微球的合成及表征[J].无机材料学报,2014,29(4):364- 370. MA Zhanying,YAO Binghua,ZHANG Ping,etal.Preparation and Characterization of Amphiphilicw/o-SiO2-void-TiO2Core-shell Microspheres[J].Journal of Inorganic Materials,2014,29(4):364- 370.
[21] 方继敏,李山虎,龚文琪,等.五氯苯酚在赤铁矿表面吸附的红外光谱研究[J].光谱学与光谱分析,2009,29(2):318- 321. FANG Jimin,LI Shanhu,GONG Wenqi,etal.FTIR study of adsorption of PCP on hematite surface[J].Spectroscopy and Spectral Analysis,2009,29(2):318- 321.
[22] JIANG Jizhou,ZOU Jing,ZHU Lihua,etal.Degradation of methylene blue with H2O2activated by peroxidase-like Fe3O4magnetic nanoparticles.[J].Journal of Nanoscience & Nanotechnology,2011,11(6):4793- 4799.
[23] LI Guiyin,JIANG Yuren,HUANG Kelong,etal.Preparation and properties of magnetic Fe3O4-chitosan nanoparticles[J].Journal of Alloys & Compounds,2008,466(12):451- 456.
[24] WANG Zhenling,QUAN Zewei,LIN Jun.Remarkable changes in the optical properties of CeO2nanocrystals induced by lanthanide ions doping[J].Inorganic Chemistry,2007,46(13):5237- 5242.
[25] LOPEZ J A,GONZ LEZ F,BONILLA F A,etal.Synthesis and characterization of Fe3O4magnetic nanofluid[J].Revista Latinoamericana de Metalurgia y Materiales,2010,30(30):60- 66.
[26] ZHOU Li,DENG Huiping,WAN Junli,etal.A solvothermal method to produce RGO-Fe3O4hybrid composite for fast chromium removal from aqueous solution[J].Applied Surface Science,2013,283(20):1024- 1031.
[27] SUN Shenpeng,ZENG Xia,LI Chun,etal.Enhanced heterogeneous and homogeneous Fenton-like degradation of carbamazepine by nano-Fe3O4H2O2with nitrilotriacetic acid[J].Chemical Engineering Journal,2014,244:44-49.
[28] ALMEIDA L C,SILVA B F,ZANONI M V.Photoelectrocatalyticphotoelectro-Fenton coupling system using a nanostructured photoanode for the oxidation of a textile dye:kinetics study and oxidation pathway[J].Chemosphere,2015,136(3):63- 71.
[29] CAI Meiqiang,JIN Micong,WEAVERS L K.Analysis of sonolytic degradation products of azo dye Orange G using liquid chromatography-diode array detection-mass spectrometry[J].Ultrasonics Sonochemistry,2011,18(5):1068- 1076.
[30] MADHAVAN J,GRIESER F,ASHOKKUMAR M.Degradation of Orange-G by advanced oxidation processes[J].Ultrasonics Sonochemistry,2009,17(2):338- 343.
[31] MEETANI M A,RAUF M A,HISAINDEE S,etal.Mechanistic studies of photoinduced degradation of Orange G using LCMS[J].RSC Advances,2011,1(3):490- 497.
[32] BOKARE A D,CHIKATE R C,RODE C V,etal.Iron-nickel bimetallic nanoparticles for reductive degradation of azo dye Orange G in aqueous solution[J].Applied Catalysis B:Environmental,2008,79(3):270- 278.
OG Degradation Efficiency and Pathway Using Fe3O4/CeO2Composite
ZHANG Xiaowei1,2, GAN Guoqiang3
1.College of Environmental Science and Technology, Liaoning Technical University, Fuxin 123000, China 2.College of Resources and Civil Engineering, Northeastern University, Shenyang 110819, China 3.Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, China
In recent years, environmental pollution has become more and more serious. High concentration refractory organic wastewater is highly toxic and difficult to decompose. Therefore, developing a new high efficient wastewater treatment process is extremely urgent. Fe3O4/CeO2composite was synthesized using the co-precipitation method. The composite was used for the degradation of Orange G as Fenton-like heterogeneous catalyst. The process parameters were investigated by the single factor experiment. The degradation intermediate products were determined by TOF-MS/MS. The possible degradation pathway of OG by heterogeneous Fenton-like process was attained. The results indicated that the optimal conditions were pH value 2.0, H2O2concentration 30 mmol/L, initial dye concentration 50 mg/L, catalyst dosage 2.0 g/L and temperature 30 °C. Under the optimal conditions, the degradation percentage of OG was 96.2% within 120 min, and the TOC removal rate was 65.0%. Mass spectrometry analysis results showed that the OG degradation was mainly through three possible degradation pathways, including the process of azo bond rupture, desulfonation, hydroxylation and ring opening process. Eight possible degradation intermediate productions were measured, including aniline, phenol, naphthol and carboxylic acid.
Fe3O4/CeO2; Orange G; Fenton-like; degradation efficiency; degradation pathway
2017-01-14
:2017-05-21
辽宁省教育厅项目(L2014143)
张晓薇(1978-),女,辽宁阜新人,讲师,主要从事水处理技术和矿山环境工程研究,zhangxiaowei780312@163.com.
X703.5
:1001- 6929(2017)09- 1455- 09
ADOI:10.13198/j.issn.1001- 6929.2017.02.75
张晓薇,甘国强.Fe3O4/CeO2复合材料催化降解橙黄G的效能及降解途径[J].环境科学研究,2017,30(9):1455- 1463.
ZHANG Xiaowei,GAN Guoqiang.OG degradation efficiency and pathway using Fe3O4/CeO2composite[J].Research of Environmental Sciences,2017,30(9):1455- 1463.

