三种药物对猪传染性胸膜肺炎的疗效研究
文/河南省沁阳市动物卫生监督所 杨凡凡
三种药物对猪传染性胸膜肺炎的疗效研究
文/河南省沁阳市动物卫生监督所 杨凡凡
为了及时治疗猪传染性胸膜肺炎,现选择3种药物进行对比试验。选用患传染性胸膜肺炎的病仔猪60头,随机分为6组,分别用氟苯尼考、远征配尼霉素、复方新诺明、氟苯尼考+ 远征配尼霉素、氟苯尼考+ 复方新诺明进行治疗。结果表明,各组的治愈率依次为80%、60%、70%、80%、90%,以氟苯尼考和复方新诺明联合应用效果最好。
猪;传染性胸膜肺炎;氟苯尼考;远征配尼霉素;复方新诺明
传染性胸膜肺炎(porcine contagious pleuropneumoniae,PCP)是由胸膜肺炎放线杆菌(APP)引起的一种猪的高度传染性呼吸道疾病,各个年龄段的猪均易感染,且常与巴氏杆菌等混合感染。急性感染时病猪死亡率可达100%,慢性感染时病猪常成为APP的无症状携带者,其生长发育和其他生产性能受到严重影响。该菌还可引起仔猪后躯麻痹,造成饲料报酬降低及药物防制费用增加,给生猪养殖业造成巨大损失。该病流行广泛,自Patison等[1]于1975年首次报道猪传染性胸膜肺炎后,该病已在世界许多国家广泛流行。英国、美国、阿根廷、瑞典、西班牙和荷兰等国均先后流行此病。20世纪80年代后,随着我国集约化、工厂化养猪程度的不断提高,进出口贸易的日益增强,该病在我国开始流行并呈不断上升趋势,给我国的养猪业造成了极大的经济损失。现今,猪传染性胸膜肺炎已列为危害世界养猪业的三大呼吸道疾病之一[2],具有高发病率和死亡率。随着我国养殖集约化程度的提高,该病的危害也越来越严重。
猪胸膜肺炎放线杆菌是对猪有高度宿主特异性的呼吸道寄生物。本病菌主要位于坏死的肺部病变部和扁桃体中。急性感染的病例整个呼吸道黏膜含菌量达106/mL以上,可随鼻液、痰液和飞沫扩散传播;慢性病例携带的病原主要存在于肺和扁桃体,而鼻腔中很少[3]。病猪和带菌猪是主要传染源,无症状无病变隐性带菌猪较常见。据Loftager(1993)报道[4],生前无症状猪127头,宰后有胸膜肺炎病变猪81头,73%从肺中分离到本菌。急性感染幸存者成为带菌者。当猪吸入带菌猪排出的带菌小液滴后就容易引发感染。急性暴发感染时可以从一个猪栏跳跃到另一个猪栏,说明较远距离的气溶胶传播或通过来往人员、车辆均可进行传播。本病也可经引种考虑不细而传播,也可经配种传播。猪场暴发急性胸膜肺炎时,往往会造成大批猪只死亡,仅一小部分存活下来。存活下来的大多数猪只的肺部会留下病灶,为其他病原菌的侵入创造了有利的条件,肺部的粘连区会影响猪的正常呼吸功能,致使猪呼吸困难,从而引起猪的增重速度减慢。随着养猪业的进一步发展,人们对猪的免疫越来越重视,急性胸膜肺炎在猪场暴发的情况也不多见,但是由于胸膜肺炎放线杆菌可以引起隐性感染,从而使其成为病原携带者,当猪群免疫水平下降时,可以引起本病的暴发。
目前在猪场,细菌和病毒性疾病普遍存在,并且多混合感染。猪胸膜肺炎往往与猪瘟、伪狂犬病、喘气病、蓝耳病、圆环病毒2型感染等混合发生,给该病的防制带来了很大困难。使用药物治疗一般很不理想,特别是混合感染,疫苗预防因该病病原血清型复杂、疫苗价格高也受到了限制。因此对于猪胸膜肺炎在防制上应坚持预防为主,采取综合性防制措施,除改善猪场饲养管理外,抗菌药物的使用必须从以治疗用药转向预防用药,在猪发病高峰期以前用药,主动控制细菌性原发疾病。
本试验根据猪传染性胸膜肺炎的流行特点、临床表现和剖检症状,选取氟苯尼考、远征配尼霉素、复方新诺明、氟苯尼考+远征配尼霉素、氟苯尼考+复方新诺明5种方法[5]和空白组做对比试验,以筛选出治疗猪传染胸膜肺炎的最佳药物,为临床指导用药提供科学依据。
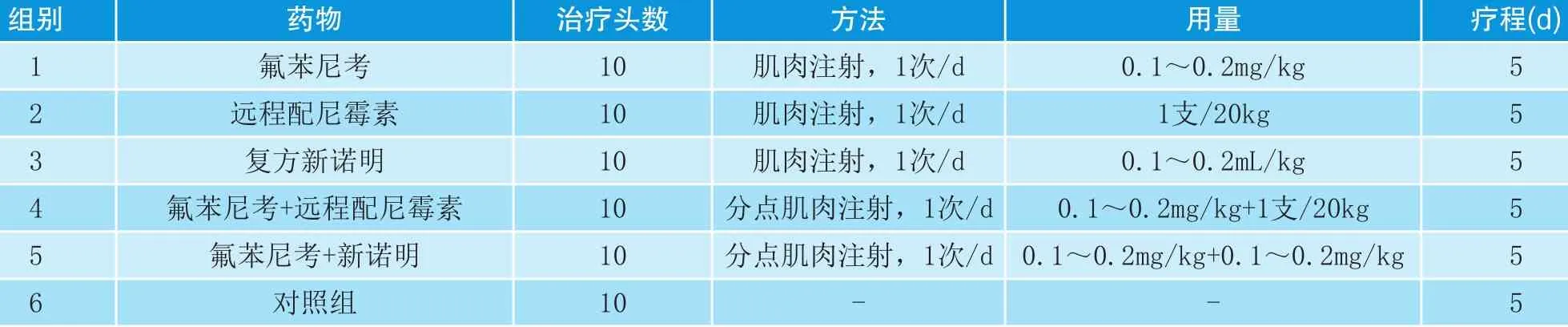
表1 不同药物的给药方法
1 材料和方法
1.1 试验动物
60头患传染性胸膜肺炎的4月龄仔猪由焦作市沁阳一规模养殖专业合作社提供。
1.2 试验药品
氟苯尼考注射液(南昌科王兽药厂生产)、远征配尼霉素注射液(河北远征药业股份有限公司生产,每支含普鲁卡因青霉素50万IU,硫酸双氢链霉素25万IU)、复方新诺明注射液(洛阳汉德生物技术开发服务中心生产)。
1.3 方法
1.3.1 试验分组 将60头患病猪随机分成6组,试验组5组,对照组1组,每组10头。第1组用氟苯尼考治疗,第2组用远征配尼霉素治疗,第3组用复方新诺明治疗,第4组用氟苯尼考+远征配尼霉素治疗,第5组用氟苯尼考+复方新诺明治疗,第6组对照不用任何药物(见表1)。
1.4 判定标准
1.4.1 临床表现 5d后,采用临床基本检查方法,对试验组和对照组进行观察。
1.4.2 剖检变化 5d后对试验组和对照组进行剖解,观察其呼吸器官各部位等的变化并详细记录。
1.4.3 实验室检查 5d后,对试验组和对照组的死亡猪进行剖检,采取心包液及肺组织的病料进行细菌培养,并涂片革兰氏或美兰染色镜检。
1.4.4治疗标准 治疗标准体温正常,心跳、呼吸状态、精神、食欲、耳鼻及体侧皮肤颜色恢复正常,口腔和鼻腔无分泌物流出,无咳嗽者为治愈。体温基本正常,心跳、精神、食欲欠佳,耳鼻及体表颜色、呼吸状态等接近正常,口腔和鼻腔仍有少量分泌物存在,偶有咳嗽者为有效。病猪经过治疗后,症状不见减轻者为无效[6]。
1.4.5 疗效观察 用药期间每天要检查和记录猪的精神、食欲死亡情况,统计死亡数,以统计治愈率;用药后观察病猪临床症状有无好转。
2 结果
2.1 临床观察
对照组:5组病猪均表现精神萎顿,食欲减退或废绝,呼吸极度困难;常站立或呈犬坐姿势,张口呼吸,咳嗽或间歇性咳嗽;耳鼻及体侧皮肤发绀,口腔和鼻腔流出淡红色、泡沫样液体;有的病猪,食欲不振、消瘦、生长迟缓,饲料利用率低;有时跛行,关节肿大[7](如图1)。
试验组:经过5d的连续治疗,第1、4、5试验组猪的病情都得到基本控制,到第5d,精神食欲行为等均恢复正常(如图2);而第2、3试验组猪的病情在给药第5d还是没有得到很好的控制,仍然是呼吸困难,张口呼吸,咳嗽等症状,甚至出现死亡的情况。

图1 未用药的病猪

图2 治愈的猪
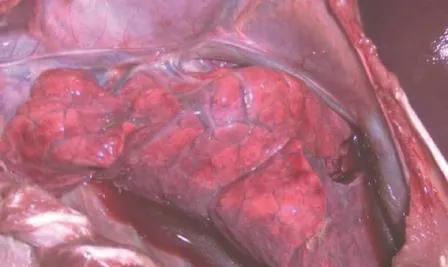
图3 肺的病变
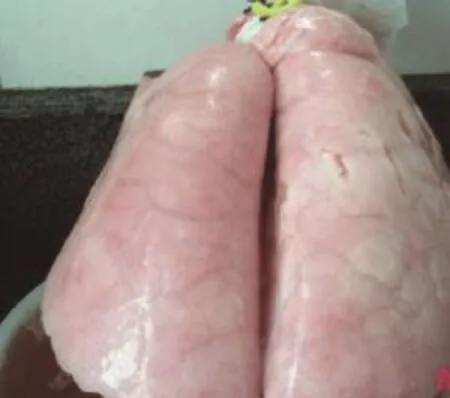
图4 正常的肺
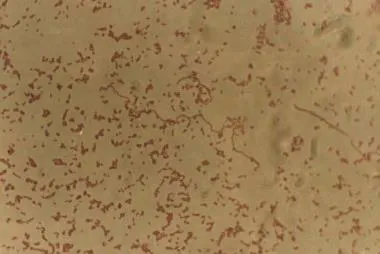
图5 革兰氏染色
2.2 剖检现象
对照组:肺肿大,肺膈叶充血、出血,切面坚实呈红色肉样变,并有纤维素样物与胸膜粘连,在靠近肺门的主支气管周围可见到界限清晰的血性突变区,胸腔内有血样液体,气管、支气管内有泡沫状血色胶样液体,脾表面有紫红色出血点。肝脏质脆易碎;小肠臌气;全身各主要淋色结肿大,切面外翻,充血出血[8](如图3)。
试验组:用药后死亡猪的剖检结果表明,死亡猪均为后期危重病猪,且多为小猪因呼吸困难而引起的窒息死亡,肺的病变情况基本恢复正常(如图4)。
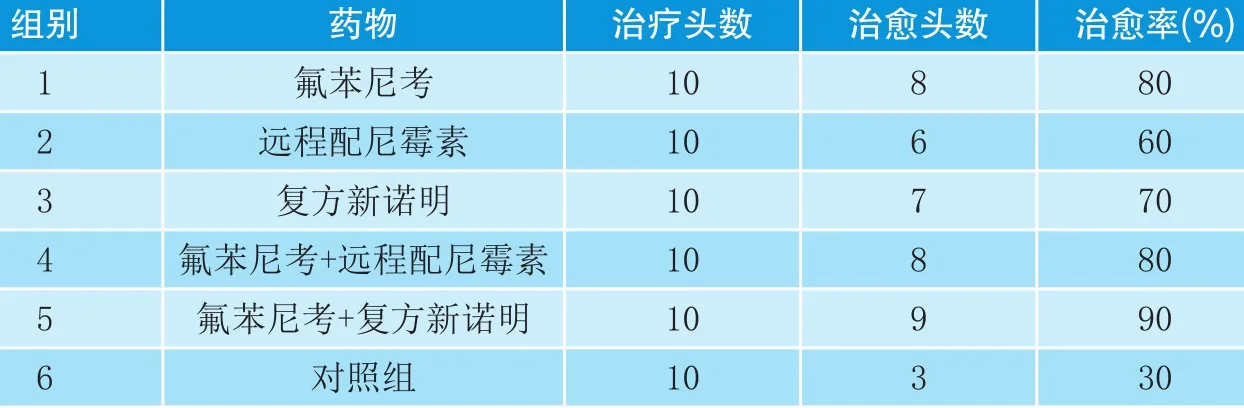
表2 疗效观察
2.3 实验室检查
对照组:心包液及肺组织在血平板上培养24h均可看到β溶血、直径约0.5mm的光滑、隆起的透亮菌落。菌体大小约(0.2~0.4)μm×(0.4~1.0)μm。革兰氏染色不定,但多呈革兰氏阴性,单在、成双或链状的球菌的呈长丝状[9]。
电镜下可看到菌体呈椭圆形,外层为较厚的荚膜,菌体两端荚膜外各有1~2个球形小泡样结构,菌体周边有数十余根直的刚性菌毛。另外可看到细长杆状,外有较薄黏液层的杆状菌存在(如图5)。
试验组:同上述的操作程序,结果观察到在组织培养基中有少数或无菌落的形成。
2.4 疗效观察
见表2。
3 分析与讨论
3.1 药物对猪传染性胸膜肺炎的治疗效果
目前,生产上对猪传染性胸膜肺炎的治疗意见不一,治疗方法和用药也各不相同。李彬[10]认为,猪胸膜肺炎放线杆菌对青霉素、氨苄青霉素、四环素、磺胺类药物都敏感。而侯安祖[11]认为,猪胸膜肺炎放线杆菌对氨苄青霉素、氯霉素、四环素、链霉素和磺胺类药物具有抗药性。而笔者试验所用的药物,氟苯尼考是氯霉素的第3代产品,其克服了氯霉素导致再生障碍性贫血的缺陷及第2代甲砜霉素抗菌谱窄,易产生耐药性的问题,并具有药效长达48h,抗菌力强、残留低、吸收快、穿透力强、组织药物浓度高,能透过血脑屏障等特点。远征配尼霉素对革兰氏阴性菌具有很强的杀灭作用,复方新诺明不仅具有杀灭放线杆的作用,同时还具有杀灭附红细胞体和抗病毒的作用。试验中第5组治愈率为90%,治疗效果最佳,说明氟苯尼考与复方新诺明具有较强的协同作用。有文献报道[12],氟苯尼考治疗猪传染性胸膜肺炎的有效率在97%以上。但笔者试验第1组用氟苯尼考的有效率为80%;第2组治愈率为60%,疗效最差;说明猪胸膜肺炎放线杆菌对远征配尼霉素具有一定的耐药性。
3.2 猪传染性胸膜肺炎病对不同年龄猪的致病特点
猪胸膜肺炎放线杆菌病主要侵害体重30~60kg的中猪[13]。但本猪场发病的猪在各种年龄段都有。调查显示,小猪的死亡率最高,中猪的发病率最高,大猪和成年母猪的发病率和死亡率都较低。说明大猪和成年母猪对疾病的抵抗力较小猪和中猪强。但在调查的试验中,大猪的治愈率为最高,小猪的治愈率最低。目前,猪病较复杂,猪传染性胸膜肺炎常与其他疾病混合感染,宜采用综合治疗方法。
3.3 猪传染性胸膜肺炎的防控措施
①在引种时做好严格检疫,以防引入阴性感染猪和带菌猪。引进种猪时要从无病猪场购买,对购入的种猪进行隔离饲养,并做血清学检测,阳性猪全部淘汰,只有确认为阴性猪才可引入作种猪使用。②要采用“全进全出”方式饲养,使每批猪生产在时间上拉开5~7d的间隔以进行隔离消毒,可有效切断传播途径。③改善饲养管理,做好猪场防暑降温和防寒保温工作,每天做好通风换气保持舍内空气清新,尽量减少各种应激因素的影响,控制好各种诱发因素,防止该病的发生。④坚持消毒制度。对猪舍、猪栏、猪圈、用具、通道及环境定期进行彻底消毒。⑤做好免疫预防工作。对猪瘟、伪狂犬病、高致病蓝耳病等常发危害大的疾病作好免疫预防,特别对引发猪呼吸道综合征的一些主要免疫抑制性疫病更应做好控制,以减轻这些病原体对肺脏的侵害和对免疫器官防御功能的破坏,从而提高猪群肺脏对呼吸道病原体感染的抵抗力,有利于防止该病的发生。⑥做好药物预防。在本病的高发期可在饲料中按要求添加敏感抗生素进行预防,猪场可使用质量较好的兽药制剂进行预防[14]。
4 小结
本试验采用了3种药物进行猪传染性胸膜肺炎疗效对比试验,试验结果表明,这些药均能降低死亡率,其中,氟苯尼考+复方新诺明治疗猪传染性胸膜肺炎效果最好,氟苯尼考、复方新诺明、氟苯尼考+远征配尼霉素的治疗效果次之,远征配尼霉素单独使用时效果最差,同时也表明猪胸膜肺炎放线杆菌对远征配尼霉素具有一定的耐药性。
[1] [美]斯特劳,[加]阿莱尔,[美]蒙加林,[英]泰勒主编;赵德明,张中秋,沈建中主译.猪病学[M].8版,北京:中国农业大学出版社.2000:357~367.
[2] Gram T, Ahrens P, Andreasen M, et al. An Actinobacillus pleuropneumoniae PCR typing system based on the apx and omlA genesevaluation of isolates from lungs and tonsils of pigs[J]. Veterinary Microbiology, 2000,75(1):43~57.
[3] 杨自军,赵书科,熊元生,等.猪传染性胸膜肺炎的诊断[J].河南农业科学,2004(11):36~38.
[4] Loftager M K, Eriksen L, Aasted B, et al. Protective immunity following immunisation of pigs with aerosol of Actinobacillus pleuropneumoniae serotype[J].Res Vet Sci, 1993,55:281~286.
[5] 张立昌.猪传染性胸膜肺炎研究进展[J].养猪,2001(1):40~42.
[6] 张立昌.猪传染性胸膜肺炎研究进展[J].养猪,2001(1):42~45.
[7] 黄金海,李建强,王英珍,等.猪胸膜肺炎放线杆菌的分离与鉴定[J].中国兽医科学,2002(2):65~67.
[8] 唐文渊,梁润泽.传染性胸膜肺炎的防制[J].国外畜牧学-猪与禽,2004(2):34~35.
[9] 骆永泉,邓绍基.氟苯尼考防治猪传染性胸膜肺炎与连球菌病效果观察[J].养猪, 2004(2):53.
[10] 李彬.猪嗜血杆菌病临床诊治报告[J].辽宁畜牧兽医,2000(6):16~17.
[11] 侯安祖.猪接触性传染性胸膜肺炎.猪病诊断与防治[M].北京:中国农业科技出版社,2000:233~244.
[12] 吴清明.兽医传染病学[M].北京:中国农业大学出版社.2001:355~358.
[13] 李晓华,杨小燕.猪胸膜肺炎放线杆菌的分离鉴定[J].中国兽医科技,2003(5):49~51.
[14] 何启盖,吴斌,吴信明,等.接触传染性胸膜肺炎的防制现状[J].华中农业大学学报,2000,33(7):58~62.

