人工老化处理对大麦种子萌发早期淀粉及淀粉酶活性的影响
王 凤 齐军仓 郭亚南 郑许光 龚 磊 王少玉 陈阿龙 黄湘怡 李忠豪 宋瑞娇
(石河子大学农学院,石河子 832003)
人工老化处理对大麦种子萌发早期淀粉及淀粉酶活性的影响
王 凤 齐军仓 郭亚南 郑许光 龚 磊 王少玉 陈阿龙 黄湘怡 李忠豪 宋瑞娇
(石河子大学农学院,石河子 832003)
采用高温高湿人工老化处理的方法,探究老化处理对大麦种子淀粉粒及萌发早期淀粉含量和淀粉酶活性的影响。研究表明:人工老化处理未改变大麦种子胚乳淀粉粒的基本形态特征,但使萌发72 h的种子胚乳中小淀粉粒逐渐增加,大淀粉粒逐渐减少,且大淀粉粒表面赤道凹槽和小孔明显减少;随着老化时间的延长,大麦种子内支链淀粉和直链淀粉的含量均呈增加的趋势,α-淀粉酶、β-淀粉酶和极限糊精酶活性均呈降低的趋势,且老化15 d与对照相比,淀粉含量和淀粉酶活性差异均达到显著水平。老化使淀粉酶活性降低,淀粉粒酶解减缓,从而导致大麦种子萌发早期淀粉的分解受到抑制。
大麦 人工老化 萌发早期 淀粉分解
种子老化不仅影响其萌发和幼苗生长,也会影响植株后期的生长、产量及籽粒品质。目前,研究发现老化会影响种子内可溶性糖、蛋白质等贮藏物质含量的变化[1-2]。大麦作为啤酒生产的主要原料,淀粉是其主要的贮藏物质,约占种子干重的64%左右,其中包括30%左右的直链淀粉和70%左右的支链淀粉。淀粉在大麦胚乳中以淀粉粒的形式存在,且大小差别较大,Kang等[3]将大麦淀粉粒分为大、小2种类型,而Takeda等[4]将大麦淀粉粒分为A、B、C(即大、中、小)3种类型,但由于B和C型淀粉粒大小差别较小,且二者的发生发育相似,故在观察结构时很难将B、C型淀粉粒明显区分开[5]。目前,麦类种子淀粉和胚乳淀粉粒的超微结构研究集中在种子发育的早期[6-9],但是老化处理对大麦种子萌发过程中的淀粉及其超微结构研究鲜见报道。
大麦种子淀粉的降解以淀粉酶水解途径为主,淀粉磷酸化途径为辅。其中,淀粉水解途径的降解需要α-淀粉酶(EC 3.2.1.1)、β-淀粉酶(EC 3.2.1.2)、极限糊精酶(EC 3.2.1.41)等的共同作用[10]。α-淀粉酶是内切型淀粉酶,也是淀粉水解的起始酶,分解直链淀粉生成麦芽糖和麦芽三糖,而分解支链淀粉则生成麦芽糖、麦芽三糖和α-糊精,大麦种子萌发过程中α-淀粉酶活性呈增加的趋势[11-12]。β-淀粉酶是外切淀粉酶,不能分解支链淀粉的分支点,淀粉经β-淀粉酶分解的产物是麦芽糖和α-糊精,β-淀粉酶活性水平在整个种子萌发过程中均要高于α-淀粉酶活性[13-14]。但是,淀粉不能被α-淀粉酶和β-淀粉酶完全降解,必须有极限糊精酶的参与才能彻底降解为可发酵的糖。极限糊精酶具有高度的特异性,专门水解支链淀粉和分支糊精中的α-1,6糖苷键,作用的产物是直链淀粉,在萌发过程中,极限糊精酶活性逐渐增强,但其含量远低于其他水解酶[15]。然而,老化对于大麦种子淀粉分解过程中催化、调控其水解的一系列酶的研究鲜见报道。
本研究采用高温高湿人工加速老化法,对大麦种子进行老化处理,研究老化处理对大麦种子胚乳淀粉粒及萌发早期淀粉含量和淀粉酶活性的影响,以期揭示大麦种子老化劣变对淀粉代谢产生的影响。
1 材料与方法
1.1 试验材料
选用2014年7月石河子大学试验站收获的春性二棱皮大麦甘啤4号、垦啤7号、P12-8和9810种子作为试验材料,种子收获后保存于15 ℃种子库3~6个月备用[16]。
1.2 种子人工老化处理
采用高温高湿法[17],略作修改。将RP-250A型智能人工气候培养箱分5层,中间3层架子铺上尼龙网,预先将所有培养箱的内部、白瓷盘以及尼龙网等用75%乙醇消毒。用40 cm×30 cm白瓷盘盛满蒸馏水置于培养箱的最上层和最底层,将培养箱温度调至40 ℃,平衡1 d,待培养箱内的温湿度稳定在40 ℃、80%相对湿度。次日,分别将各品种种子单层平铺于培养箱中间3层,之后每隔0、3、6、9、12、15 d后取出种子并及时适量补水。最后,将老化处理后的种子置于室温下自然风干,待其含水量降至原始水平后进行相关试验。
1.3 萌发处理及取样
参照《国际种子检验规程》规定的大麦种子发芽条件,采用发芽盒纸上法。从干种子吸水12 h开始至发芽(72 h),每隔12 h取样1次,共取样6次,各3次重复。
1.4 淀粉粒的提取
大麦胚乳淀粉粒的提取参照Peng等[18]的方法,并略作修改。随机选取萌发72 h的大麦种子50粒,剥去种胚、根和芽,在10 mL 蒸馏水中研磨。将混合物转入50 mL离心管,4 000 g离心5min。移去沉淀上部的黄色胶状物,过60目筛,并将沉淀悬浮在10 mL H2O中。将悬浮液平铺在15 mL 80% (m/V)的氯化铯水溶液上(氯化铯的体积是悬浮液体积的2~3倍),4 000 g离心5 min,移去上清液。重复2次上述氯化铯离心步骤。用10 mL漂洗缓冲液洗沉淀3~4次,再用水和丙酮漂洗沉淀各3~4次。常温干燥沉淀,将干燥的淀粉研磨成细粉,过100目筛,储存于-20 ℃备用。
1.5 淀粉粒的观察
淀粉粒类型的变化采用荧光显微镜(Olympus BX51,Japan)观察[19],淀粉粒表观特性采用扫描电镜(Hitachi S570,Japan)观察,加速电压3~15 kV。各处理3次重复,每个处理观察10个视野,取平均值。
1.6 淀粉含量的测定
淀粉含量采用双波长法测定[20],略作修改。
采用Hitachi U-3900紫外分光光度计测定淀粉提取液的吸光度值。确定直链淀粉测定波长λ1为554 nm,参比波长λ2为490 nm;支链淀粉测定波长λ3为542 nm,参比波长λ4为713 nm。各处理3次重复。
1.7 淀粉酶活性的测定
淀粉酶活性采用3,5-二硝基水杨酸测定还原糖的方法[21]。淀粉酶活力的定义为1 min由底物催化生成1 mg还原糖的酶量为1个酶活力单位(U)。极限糊精酶提取[22]与测定根据爱尔兰Megazyme公司试剂使用说明,各处理3次重复。
1.8 数据分析
利用Excel进行数据处理,SPSS 18.0进行方差分析和相关性分析,SigmaPlot 10.0作图。
2 结果与分析
2.1 人工老化对大麦种子胚乳淀粉粒的影响
2.1.1 人工老化对大麦种子胚乳淀粉粒类型的影响
本研究采用Kang等[3]的方法,将淀粉粒分为大、小2类,即将B和C型统称为小淀粉粒,A型称为大淀粉粒。不同品种大麦对照种子在萌发72 h时,胚乳存在大和小2种类型的淀粉粒,且以大淀粉粒为主,小淀粉粒较少。但是随着老化时间的延长,各品种种子胚乳中小淀粉粒逐渐增加,大淀粉粒逐渐减少。经统计分析,老化15 d甘啤4号、垦啤7号、

表1 不同活力水平的大麦种子萌发早期胚乳淀粉粒的类型(n=30)
注:不同小写字母表示不同老化天数下差异达显著水平(P<0.05)。
P12-8和9810种子胚乳大淀粉粒与对照相比减少了16.44%、15.85%、30.20%、37.46%,差异达到显著水平;老化15 d甘啤4号、垦啤7号、P12-8、9810种子胚乳小淀粉粒与对照相比增加了292.09%、285.46%、453.83%、347.21%,差异达到显著水平(表1)。
2.1.2 人工老化对大麦种子胚乳淀粉粒表观特性的影响
由图1可知,所有处理的大麦种子胚乳的基本形态无明显差异,大淀粉粒为盘状,小淀粉粒为球状。未经老化的甘啤4号种子胚乳大淀粉粒赤道出现凹槽和小孔,并被水解成大小不同的空洞,而垦啤7号、P12-8和9810种子胚乳大淀粉粒出现了较明显的赤道凹槽和小孔。随着老化时间延长,各品种的种子胚乳淀粉粒赤道凹槽和小孔明显减少,老化15 d后,各品种大麦种子胚乳淀粉粒表面则较光滑。

注:a为甘啤4号,b为垦啤7号,c为P12-8,d为9810;1~4分别为CK、老化3、9、15 d,箭头所指为淀粉粒表面的赤道凹槽和微孔。 图1 人工老化处理对大麦种子萌发72 h胚乳淀粉粒表观特性的影响(1 000×)
2.2老化对萌发早期大麦种子淀粉质量分数的影响
2.2.1 老化对萌发早期大麦种子支链淀粉质量分数的影响
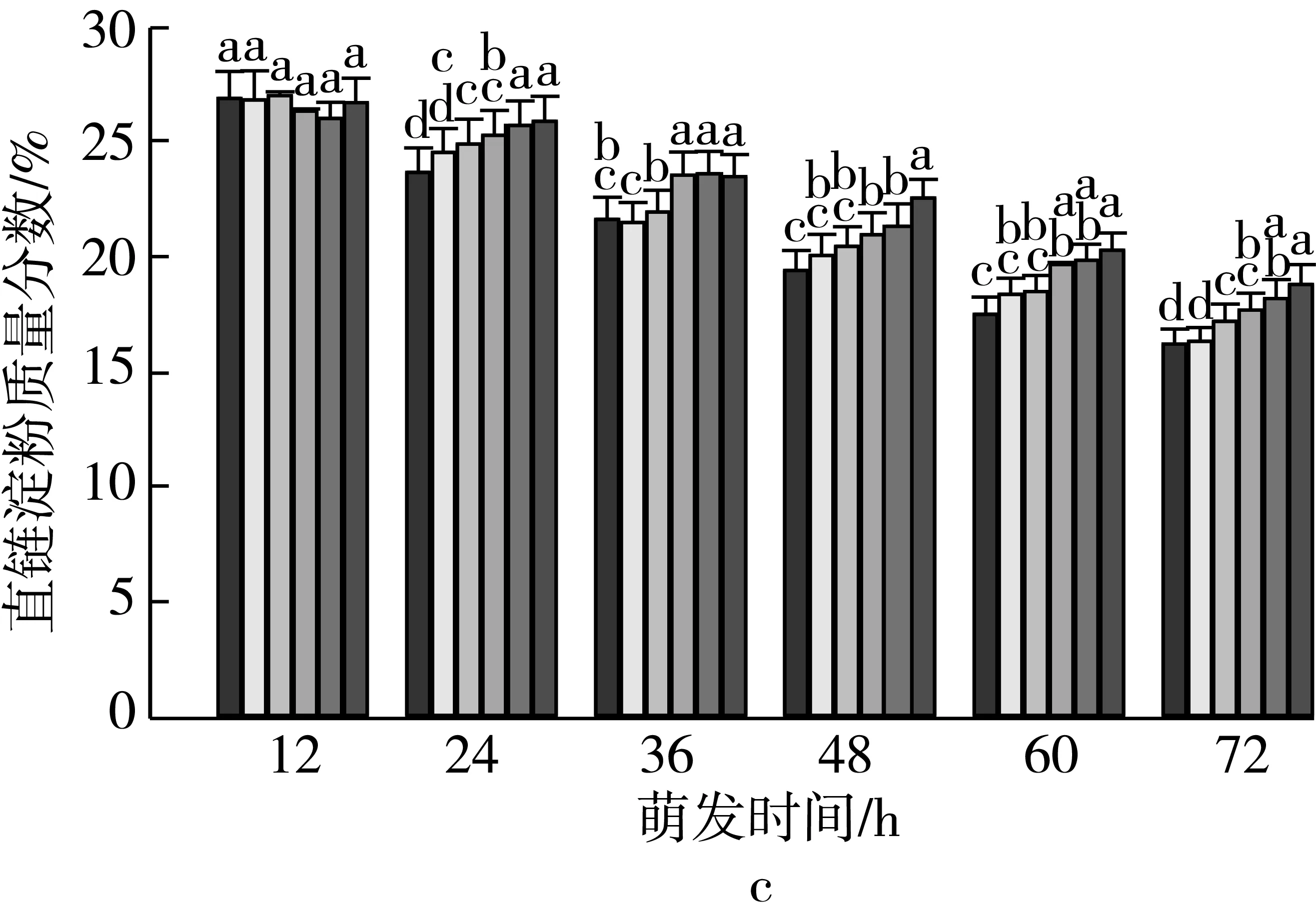
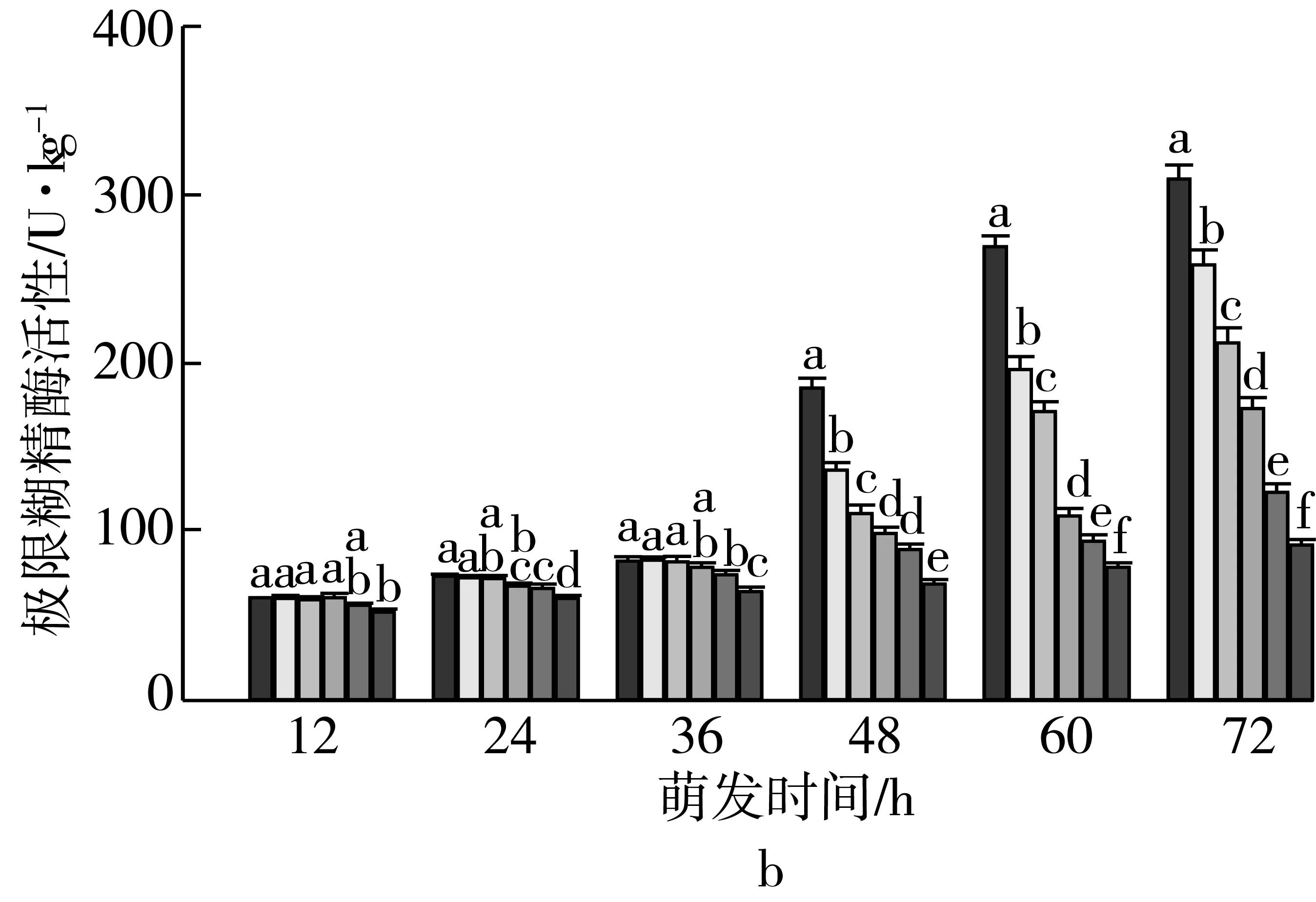
由图2可知,4个品种各处理种子萌发12 h时,支链淀粉质量分数差异无统计学意义。随着老化时间的延长,各品种种子内支链淀粉质量分数与对照相比分别逐渐增加。老化15 d,萌发72 h时的甘啤4号、垦啤7号、P12-8、9810种子内支链淀粉质量分数与对照相比分别增加了9.93%、18.01%、20.21%、21.98%,差异达到显著水平,而且萌发72 h时,垦啤7号老化处理间(除12、15 d)差异均达到显著水平。萌发48~72 h时,甘啤4号种子内支链淀粉分解较其他3个品种更少。

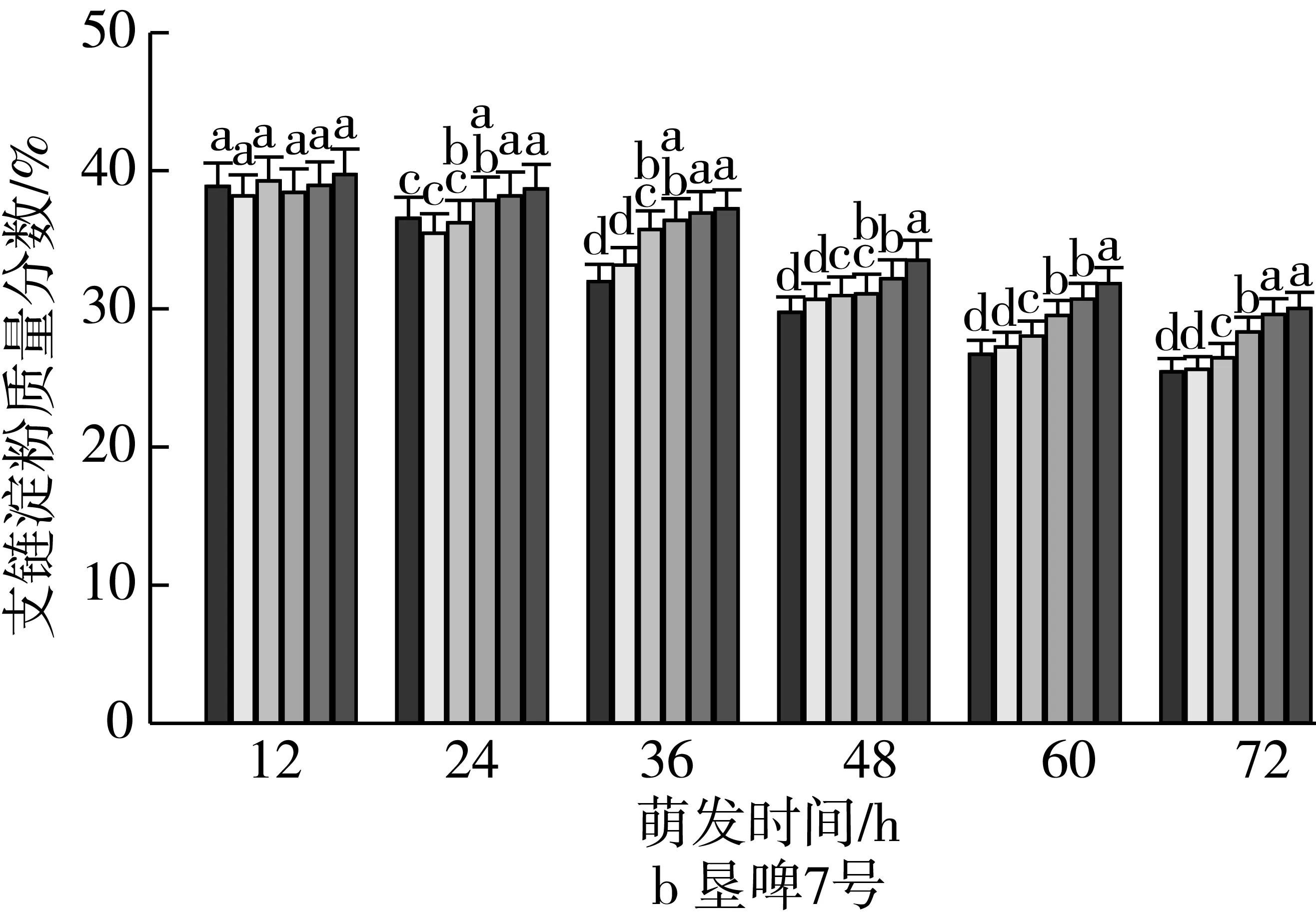
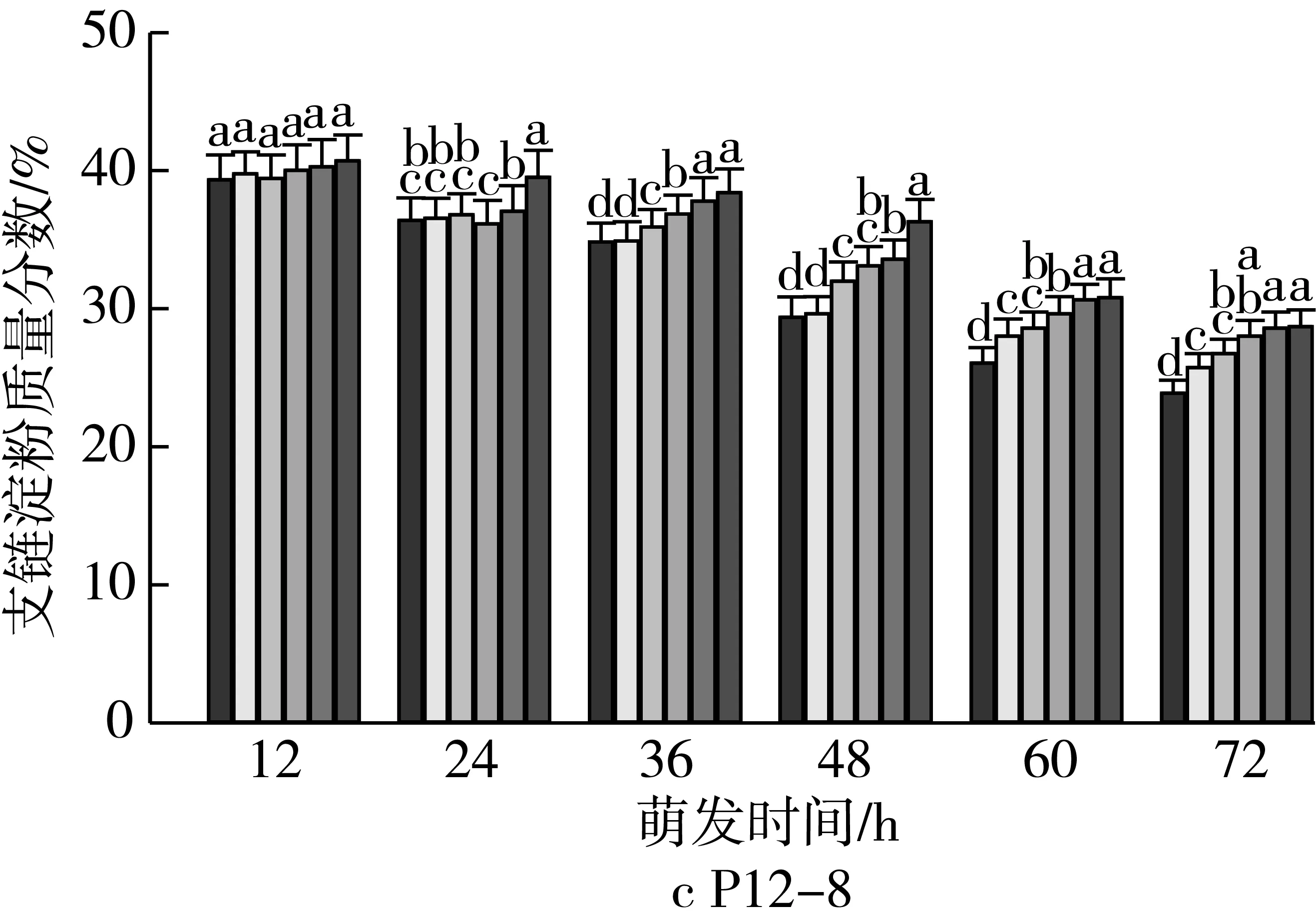
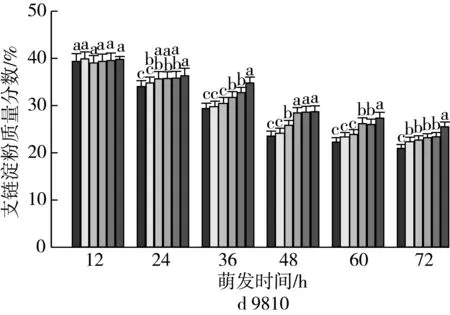
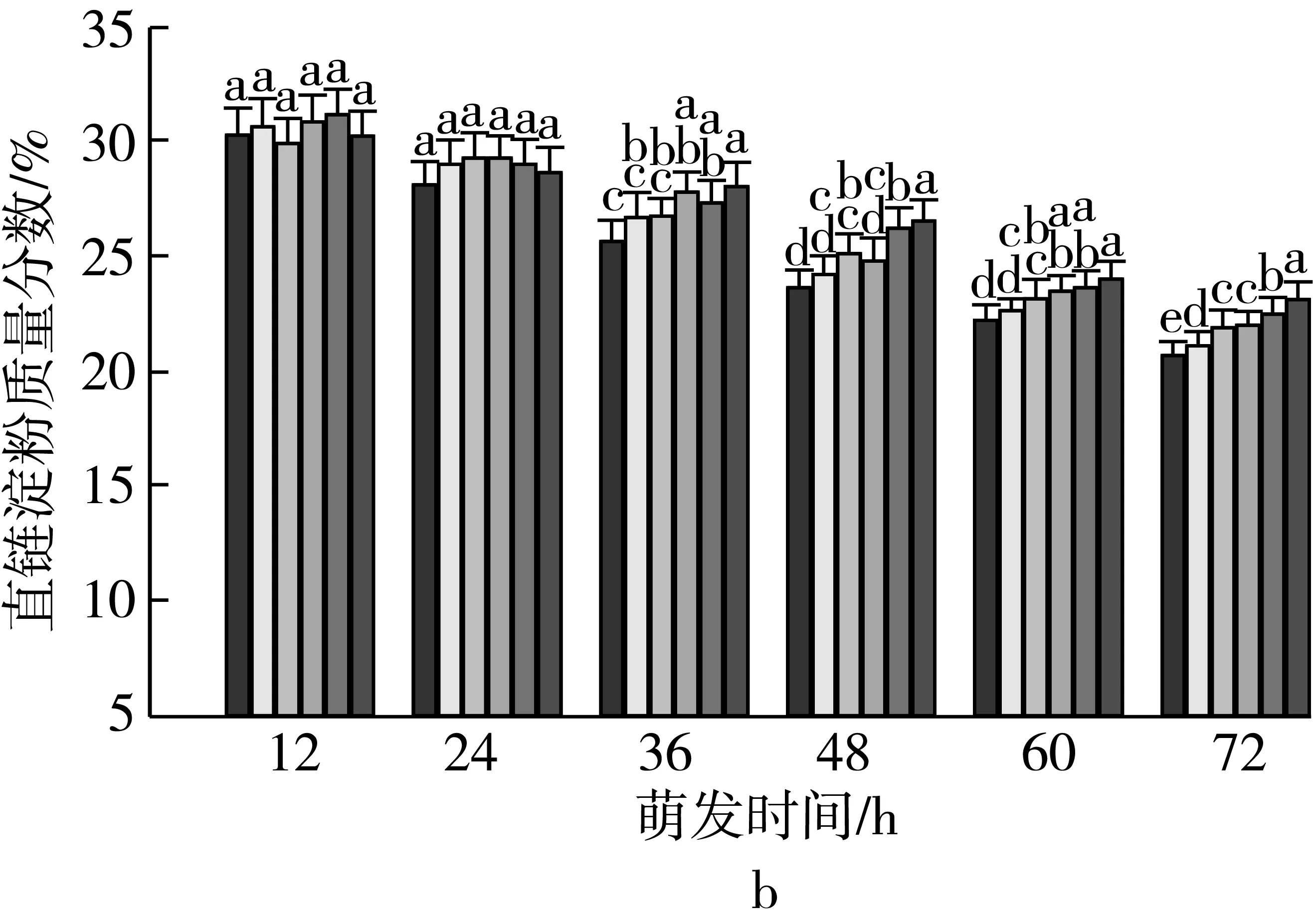
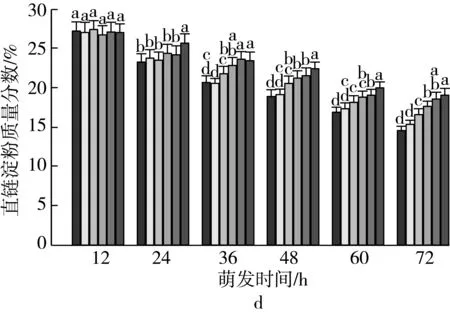
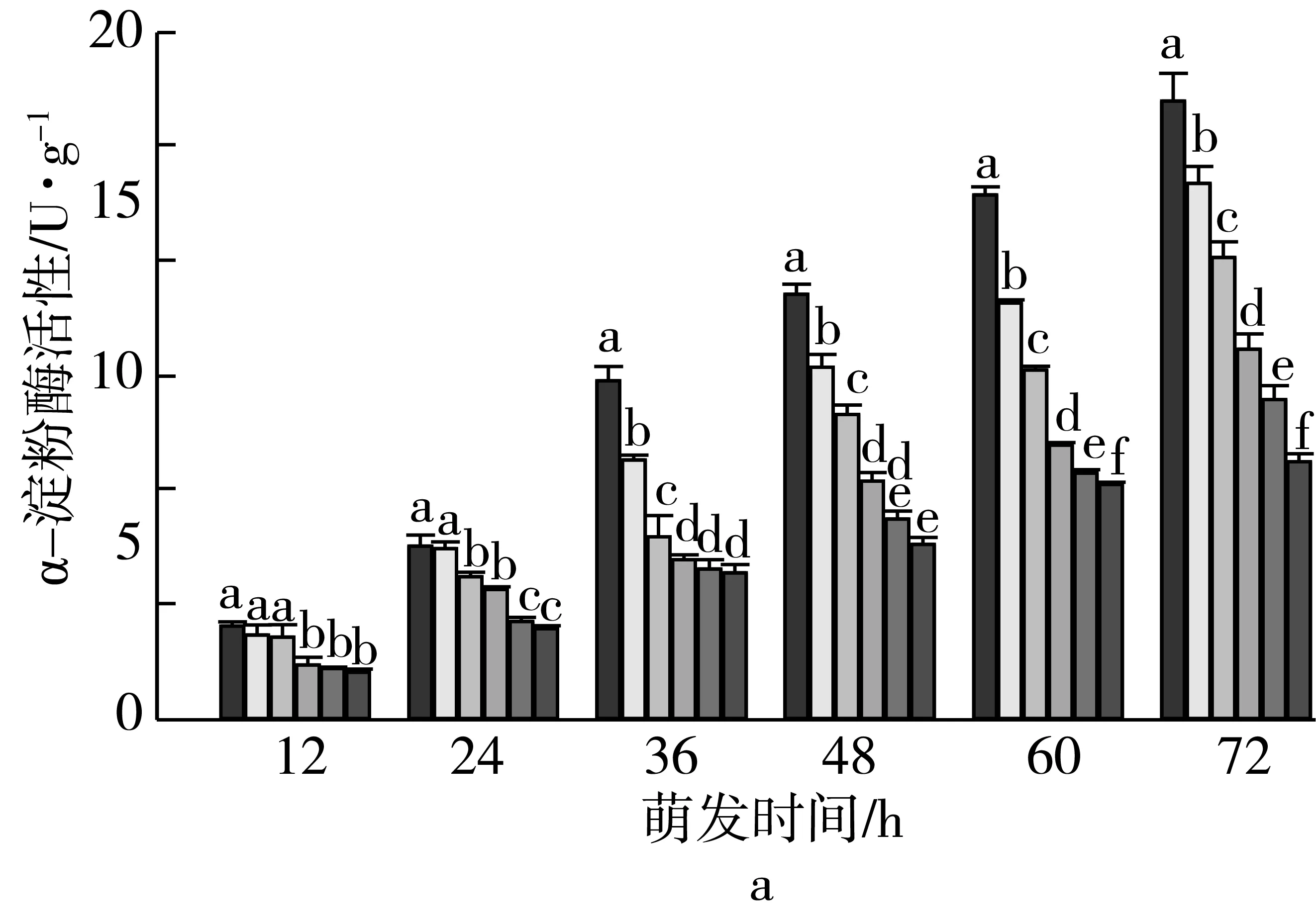
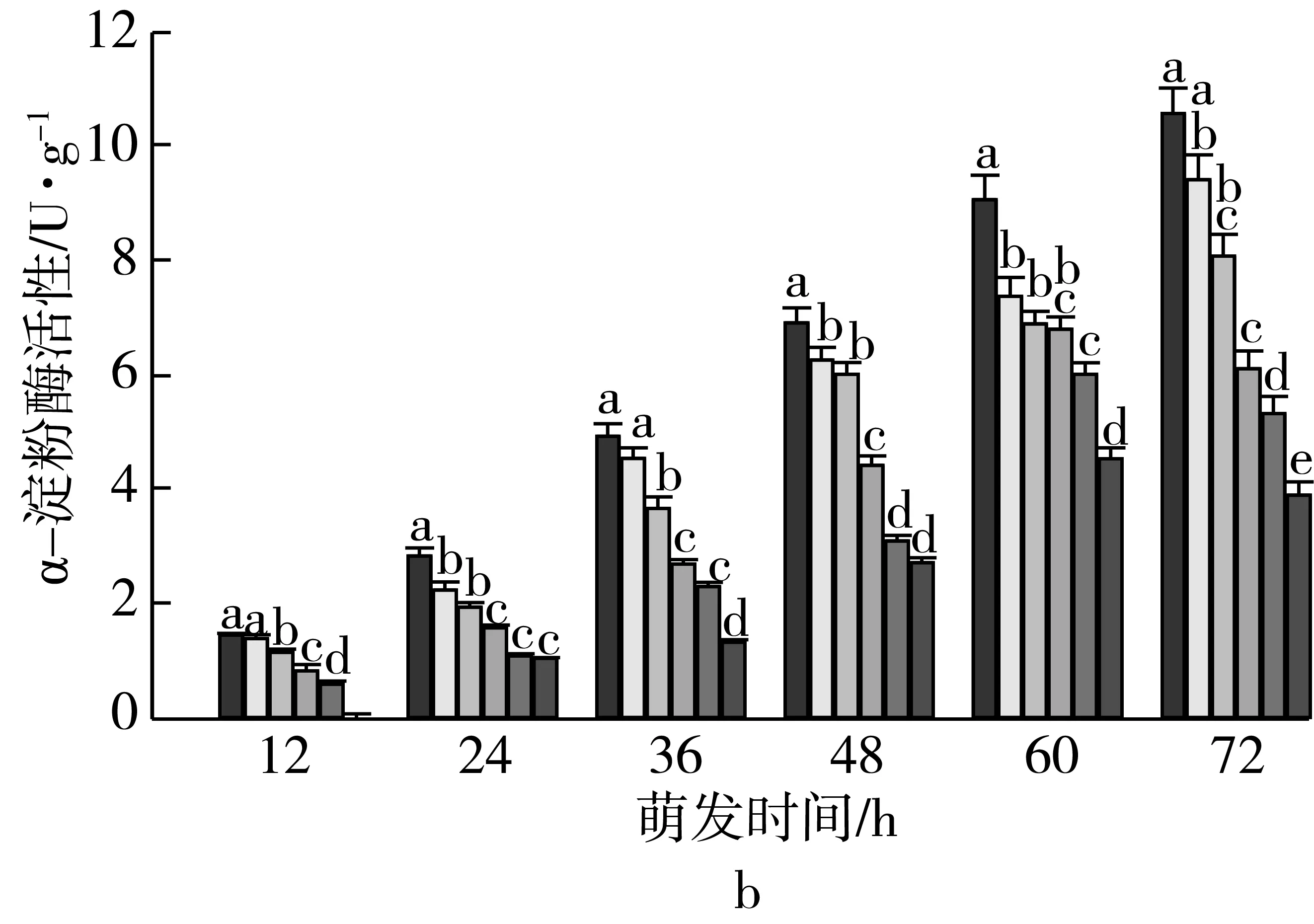
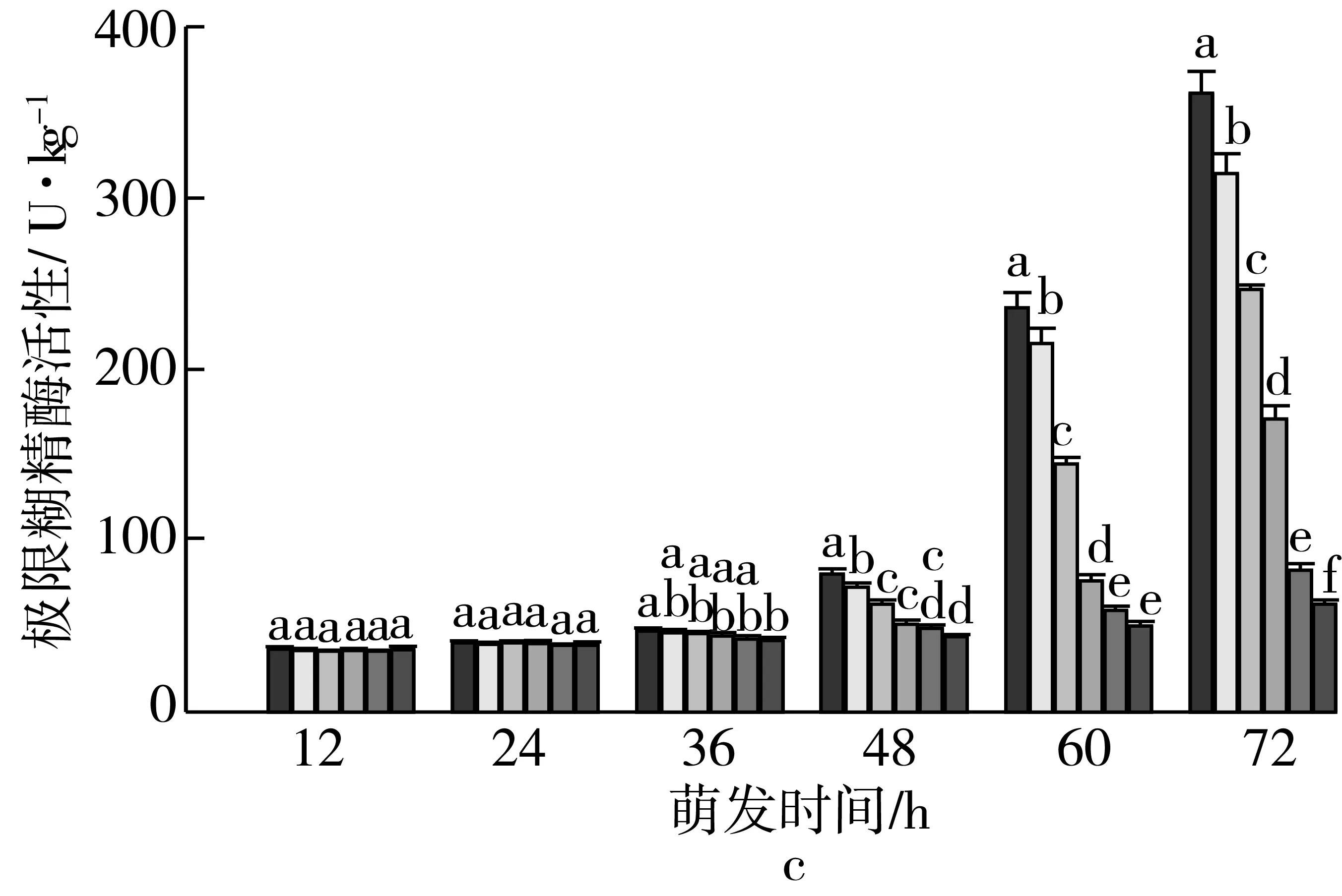
注:不同颜色的柱形从左到右依次为CK、老化3、6、9、12、15 d;不同小写字母表示不同老化天数下差异达显著水平(P 2.2.2 老化对萌发早期大麦种子直链淀粉质量分数的影响 由图3可知,垦啤7号各老化处理种子在萌发12~24 h时,直链淀粉质量分数与对照相比差异无统计学意义。随着老化时间延长,各品种种子内直链淀粉质量分数与对照相比分别逐渐增加。老化15 d,萌发72 h时的甘啤4号、垦啤7号、P12-8、9810种子内直链淀粉质量分数与对照相比分别增加了28.88%、15.38%、16.08%、30.89%,差异达到显著水平。老化15 d的P12-8种子在萌发48~72 h,其支链淀粉分解较其他3个品种更少。 图3 老化对萌发早期大麦种子直链淀粉质量分数的影响 2.3 老化对萌发早期大麦种子淀粉酶活性的影响 2.3.1 老化对萌发早期大麦种子α-淀粉酶活性的影响 由图4可知,随着老化程度的加深,α-淀粉酶活性逐渐降低。老化15 d的垦啤7号种子在萌发12 h时未检测到α-淀粉酶活性,甘啤4号、垦啤7号、P12-8、9810种子内检测到了少量低活力值的α-淀粉酶,各老化处理与对照相比差异无统计学意义。不同老化水平的甘啤4号种子在萌发24 h时,α-淀粉酶活性与对照相比差异达到显著水平,且不同老化处理间差异达到显著水平。老化15 d的甘啤4号、垦啤7号、P12-8、9810种子在萌发72 h时,种子内α-淀粉酶活性与对照相比分别降低了58.39%、44.11%、48.68%、49.96%,差异达到显著水平。 图4 人工老化对萌发早期大麦种子α-淀粉酶活性的影响 2.3.2 老化对萌发早期大麦种子β-淀粉酶活性的影响 由图5可知,随着老化程度的加深,β-淀粉酶活性逐渐降低。4个品种各处理的种子在萌发12 h时,均检测到了低活力值的β-淀粉酶。各品种老化9 d的种子在萌发在萌发24~72 h时,β-淀粉酶活性显著低于对照。老化15 d的甘啤4号、垦啤7号、P12-8、9810种子在萌发72 h时,β-淀粉酶活性与对照相比分别降低了50.99%、37.40%、58.52%、53.77%,差异达到显著水平。 图5 人工老化对萌发早期大麦种子β-淀粉酶活性的影响 2.3.3 老化对萌发早期大麦种子极限糊精酶活性的影响 由图6可知,随着老化程度的加深,极限糊精酶活性逐渐降低。老化15 d,萌发12 h的甘啤4号和垦啤7号种子内极限糊精酶活性与对照相比,差异达到显著水平,而P12-8和9810种子内极限糊精酶活性与对照相比,无显著差异。萌发12~36 h,4个品种种子内极限糊精酶活性缓慢增加,萌发36 h以后,甘啤4号和垦啤7号种子内极限糊精酶活性迅速增加,而萌发48 h以后,甘啤4号和垦啤7号种子内极限糊精酶活性迅速增加。老化15 d,萌发72 h时的甘啤4号、垦啤7号、P12-8、9810种子内极限糊精酶活性与对照相比分别降低了77.52%、70.33%、82.59%、68.60%,差异达到显著水平。 图6 人工老化对萌发早期大麦种子极限糊精酶活性的影响 3.1 人工老化对淀粉的影响 种子吸水后,其糊粉层和盾片上皮层会合成一系列水解酶,这些酶分泌到淀粉胚乳中,分解细胞壁与贮藏的淀粉[23]。萌发过程中,胚乳淀粉粒的直径逐渐变小,其表面赤道凹槽和小孔部分更易被酶解,总淀粉粒的酶解效率和大淀粉粒含量呈正相关[24]。本研究发现,未经老化处理的各品种大麦种子在萌发72 h时,胚乳均有大、小淀粉粒,且以大淀粉粒为主,大淀粉粒较少。但是随着老化程度加深,各品种种子胚乳中小淀粉粒逐渐增加,大淀粉粒逐渐减少,说明,老化处理会导致大麦种子胚乳大、小淀粉粒的数目发生变化。同时,还发现老化处理后大淀粉粒为盘状,小淀粉粒为球状,这与银永安等[25]和韦存虚等[5]报道的结果相似。但是,随着老化时间延长,种子胚乳大淀粉粒赤道凹槽和小孔明显减少,老化15 d后,各品种大麦种子胚乳淀粉粒表面则较光滑,由此表明,老化处理未改变大麦胚乳淀粉粒的基本形态特征,但对其表观特性有一定影响。此外,本研究发现同一萌发时间,老化程度越深,4个品种种子内支链淀粉和直链淀粉的质量分数均增加的趋势,这与蔡秋华等[26]在水稻上研究相似。究其原因,可能是随着老化程度的加深,淀粉酶的合成或释放过程受到影响,使淀粉酶的活性受到抑制,从而导致胚乳淀粉粒分解延缓,支链淀粉和直链淀粉的质量分数增加。 3.2 人工老化对淀粉酶的影响 α-淀粉酶、β-淀粉酶和极限糊精酶的活性在萌发大麦种子中均呈增加趋势[16],而老化会引起种子内酶活力改变。本研究发现,在相同萌发时间,老化处理后的大麦种子中α-淀粉酶的酶活性呈降低的趋势。这可能是由于随着老化程度的加深,大麦种子糊粉层中α-淀粉酶的合成过程受到影响,或是糊粉层细胞壁释放α-淀粉酶的过程受到了抑制[27]。其次,研究发现老化程度越深,β-淀粉酶的酶活性呈降低的趋势,而且将α-淀粉酶与β-淀粉酶活性变化趋势进行比较,β-淀粉酶活性降低的趋势更明显。这可能是自由态β-淀粉酶发生了部分降解或失活[28],或是蛋白酶介导的种子萌发束缚态β-淀粉酶的释放过程受阻[29]。此外,随着老化程度的加深,极限糊精酶的活性呈降低的趋势,该酶主要作用是水解被α-淀粉酶和β-淀粉酶联合降解淀粉后形成的较小的分支寡糖,其活性可能受α-淀粉酶和β-淀粉酶活性的降低的影响。还有大麦种子在萌发过程中合成的极限糊精酶与种子中的不可溶性物质结合形成无活性的形式,而成熟种子胚和胚乳中存在含量较高的极限糊精酶抑制因子[30],老化可能促使抑制因子的增加从而抑制了极限糊精酶的活性。 人工老化降低了淀粉酶活性,淀粉粒降解延缓,从而导致大麦种子萌发早期淀粉的分解受到抑制。本试验仅研究了老化处理对大麦种子淀粉分解的生理生化变化,对引起淀粉酶活性变化内在原因还有待进一步研究。 [1]孔治有, 刘叶菊, 覃鹏. 人工加速老化对小麦种子CAT、POD、SOD活性和可溶性蛋白质含量的影响[J]. 中国粮油学报, 2010, 25(10): 24-27 Kong Z Y, Liu Y J, Qin P. Effects of accelerated aging on CAT, POD, SOD activities and soluble protein content of wheat seeds [J]. Journal of the Chinese Cereals and Oils Association, 2010,25(10): 24-27 [2]李春雷, 马世骏, 彭滨, 等. 人工老化对玉米种子活力指标、内含物质含量及生理指标的影响[J]. 吉林农业大学学报, 2014, 36(5): 505-509, 514 Li C L, Ma S J, Peng B, et al. Effects of artificial aging on seed vigor indexes, embedded sub-stance content and physiological indexes of maize [J]. Journal of Jilin Agricultural University, 2014, 36(5): 505-509, 514 [3]Kang M Y, Sugimoto K I, Kato I,et al. Some properties of large and small starch granules of barley endosperm[J]. Agricultural and Biological Chemistry, 1985, 49(5): 1291-1297 [4]Takeda Y, Takeda A C, Mizukami H, et al. Structures of large, medium and small starch granules of barley grain[J]. Carbohydrate Polymers, 1999, 38(2): 109-114 [5]韦存虚, 张军, 周卫东, 等. 大麦胚乳小淀粉粒的发育[J]. 作物学报, 2008, 34(10): 1788-1796 Wei C X, Zhang J, Zhou W D, et al. Development of small starch granule in barley endosperm[J]. Acta Agronomica Sinica, 2008, 34(10): 1788-1796 [6]Radchuk V V, Borisjuk L, Sreenivasulu N, et al. Spatiotemporal profiling of starch biosynthesis and degradation in the developing barley grain[J]. Plant Physiology, 2009, 150(1): 190-204 [7]Yin Y A, Qi J C, Li W H, et al. Formation and developmental characteristics of A-and B-type starch granules in wheat endosperm[J]. Journal of Integrative Agriculture, 2012, 11(1): 73-81 [8]Kalinga D N, Bertoft E, Tetlow I,et al. Evolution of amylopectin structure in developing wheat endosperm starch[J]. Carbohydrate Polymers, 2014, 112: 316-324 [9]Yu X R, Yu H, Zhang J,et al. Comparison of endosperm starch granule development and physicochemical properties of starches from waxy and non-waxy Wheat[J]. International Journal of Food Properties,2015, 18(11): 2409-2421 [10]Sun Z T, Henson C A. A quantitative assessment of the importance of barley seed α-amylase, β-amylase, debranching enzyme, and α-glucosidase in starch degradation[J]. Archives of Biochemistry and Biophysics,1991, 284(2): 298-305 [11]王特, 薛永常. 国内外不同品种啤酒大麦萌发过程中酶的变化[J]. 中国酿造, 2011, 30(3): 51-54 Wang T, Xue Y C. Change of endogenous enzymes during germination of domestic and imported brewing barley[J]. China Brewing, 2011, 30(3): 51-54 [12]姜晓东, 张京, 郭刚刚. 中国大麦地方品种的α-淀粉酶酶活性研究[J]. 植物遗传资源学报, 2013, 14(2): 322-328 Jiang X D, Zhang J, Guo G G. Study on the α-amylase activity of the chinese barley landrace[J]. Journal of Plant Genetic Resources, 2013, (2): 322-328 [13]Georg-kraemer J E, Mundstockt E C, Cavalli-molina S. Developmental expression of amylase during barley malting [J]. Journal of Cereal Science, 2001, 33(3): 279-288 [14]冉景盛, 韩宗先, 陈今朝. 杂交稻种子萌发过程中淀粉酶活性的变化[J]. 安徽农业科学, 2008, 36(33): 14415-14416, 14462 Ran J S, Han Z X, Chen J Z. Changes of amylase activity in the germination process of hybrid rice seeds[J]. Journal of Anhui Agricultural Sciences, 2008, 36(33): 14415-14416, 14462 [15]管斌, 李珊, 荀娟, 等. 啤酒大麦制麦过程中淀粉酶活性变化动态的研究[J]. 中国酿造, 2009, 28(5): 69-72 Guan B, Li S, Xun J, et al. Development of three amylase activity during barely malt production[J]. China Brewing, 2009, 28(5): 69-72 [16]张瑛, 滕斌, 吴敬德, 等. 水稻种子高温高湿人工加速老化试验方法研究[J]. 中国粮油学报, 2010, 25(10): 8-12 Zhang Y, Teng B, Wu J D, et al. Study on accelerated aging test of rice seeds with high temperature and humidity[J]. Journal of the Chinese Cereals and Oils Association, 2010, 25(10): 8-12 [17]廖乐, 齐军仓, 华淼源, 等. 人工老化对大麦种子萌发过程中发芽特性及部分酶活性的影响[J]. 麦类作物学报, 2015, 35(1): 71-79 Liao L, Qi J C, Hua M Y, et al. Effects of artificial aging on germination characteristics and some enzymes activities during imbibition of barley seeds [J]. Journal of Triticeae Crops, 2015, 35(1): 71-79 [18]Peng M, Gao M, Abdel A E,et al. Separation and characterization of A-and B-type starch granules in wheat endosperm[J]. Cereal Chemistry, 1999, 76(3): 375-379 [19]李芬芬, 张本山. 淀粉颗粒粒径不同测定方法的比较[J]. 食品与发酵工业, 2010, 36(4): 171-174 Li F F, Zhang B S. Comparison of different starch granule diameter measurement methods of starch granule diameter[J]. Food and Fermentation Industries, 2010, 36(4):171-174 [20]金玉红, 张开利, 张兴春, 等. 双波长法测定小麦及小麦芽中直链、支链淀粉含量[J]. 中国粮油学报, 2009, 24(1): 137-140 Jin Y H, Zhang K L, Zhang X C, et al. Determination of amylose and amylopectin in wheat and wheat malt by dual-wavelength spectrophotometry[J]. Journal of the Chinese Cereals and Oils Association, 2009, 24(1): 137-140 [21]刘志国. 生物化学实验[M]. 武汉: 华中科技大学出版社, 2007: 123-125 Liu Z G. Biochemical experiment[M]. Wuhan: Huazhong University of Science and Technology Press, 2007: 123-125[22]Barry V M. Measurement of the content of limit-dextrinase in cereal flours[J]. Carbohydrate Research, 1992, 227: 257-268 [23]Gregory C G. On the relative role of the scutellum and aleurone in the production of hydrolases during germination of barley[J]. Carlsberg Research Communications, 1981, 46(4): 215-225 [24]李春艳, 陆振翔, 李诚, 等. 小黑麦、小麦和黑麦淀粉粒形态特征及酶解特性的差异[J]. 麦类作物学报, 2010, 30(3): 520-525 Li C Y, Lu Z X, Li C, et al. Comparisons on morphology and susceptibilities to enzymes of starch granules in triticale, wheat and rye[J]. Journal of Triticeae Crops, 2010, 30(3): 520-525 [25]银永安, 李卫华, 齐军仓, 等. 小麦胚乳A、B型淀粉粒发育特征及黏度特性[J]. 作物研究, 2012, 26(4):337-343 Yin Y A, Li W H, Qi J C, et al. Development and viscosity characteristics of A, B-type starch granule in wheat endosperm[J]. Crop Research, 2012,26(4): 337-343 [26]蔡秋华, 户媛媛, 张建福, 等. 水稻种子老化后的生理特性初步研究[J]. 福建农业学报, 2012, 27(10):1061-1066 Cai Q H, Hu Y Y, Zhang J F, et al. Preliminary study on physiological characteristics for rice seed after aging[J]. Fujian Journal of Agricultural Sciences, 2012, 27(10): 1061-1066 [27]Taiz L, Jones R L. Gibberellic acid, beta-1,3-glucanase and cell wals of barley aleurone layers[J]. Planta, 1970, 92(1): 73 [28]Nishimura I H, Nishimura M, Daussant J. Conversion of free β-amylase to bound β-amylase on starch granules in the barley endosperm during desiccation phase of seed development[J]. Protoplasma, 1986, 134(2/3): 149-153 [29]Guerin J R, Lance R C M, Wallace W. Release and activation of barley beta-amylase by malt endopeptidases[J]. Journal of Cereal Science, 1992, 15(1): 5-14 [30]Jensen J M, Vester-christensen M B, Moller M S, et al. Efficient secretory expression of functional barley limit dextrinase inhibitor by high cell-density fermentation of pichia pastoris[J]. Protein Expression and Purification,2011, 79(2): 217-222. Effect of Aging on Starch and Amylase Activity of Barley Seeds in Early Germination Wang Feng Qi Juncang Guo Yanan Zheng Xuguang Gong Lei Wang Shaoyu Chen Along Huang Xiangyi Li Zhonghao Song Ruijiao (College of Agriculture, Shihezi University, Shihezi 832003) This study was to explore the effect of aging on starch granule, starch content and amylase activity of barley seeds with high temperature and high humidity artificial aging treatment in the early stage of germination. The results showed that artificial aging had no effect on barley endosperm starch granule on the basis of morphological characteristics. However, it increased the small starch granules and reduced large starch granules of endosperm. Besides, the equatorial grooves and pin holes at the surfaces of the large starch granules decreased significantly in the germination 72 h. In addition, artificial aging induced the increasing of amylopectin and amylose content and reduced the activity of α-amylase and β-amylase. There were significant differences in starch content and amylase activity of all barley between the aging 15 d and control. It could be concluded that aging reduced amylase activity and the degradation of the starch was mitigated consequently, which resulted in the inhibition of starch mobilization of barley seed in the early stage germination. barley, artificial aging, early germination, starch depolymerization 农业部现代农业产业技术体系建设(CARS-05),石河子大学科学技术研究发展计划(gxjs2015-yz02) 2016-05-31 王凤,女,1991年出生,硕士,大麦种子生理 齐军仓,男,1971年出生,教授,大麦遗传育种与栽培技术 S512.1;S311 :A :1003-0174(2017)08-0014-08
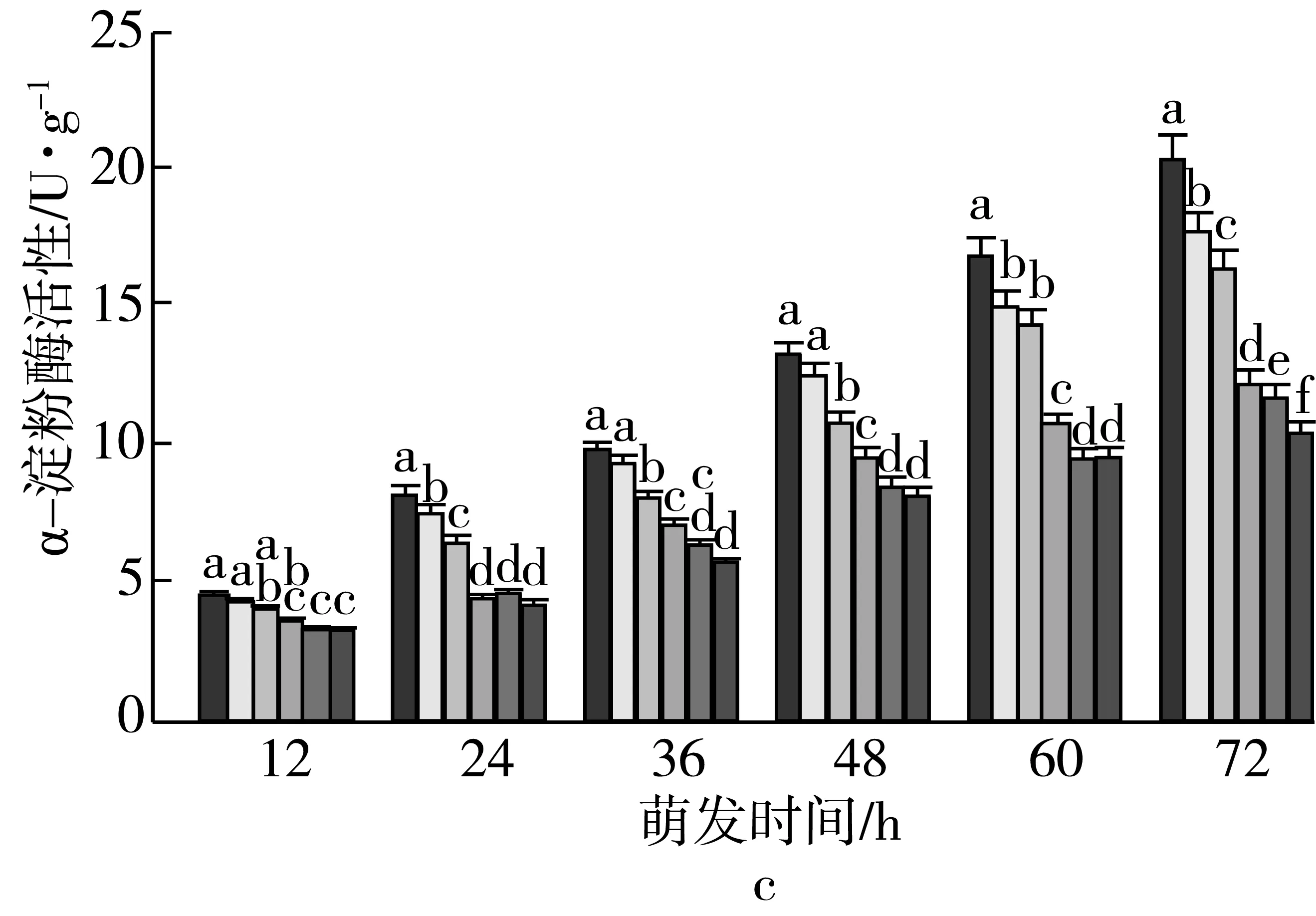

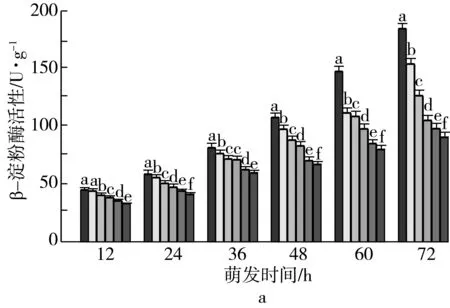
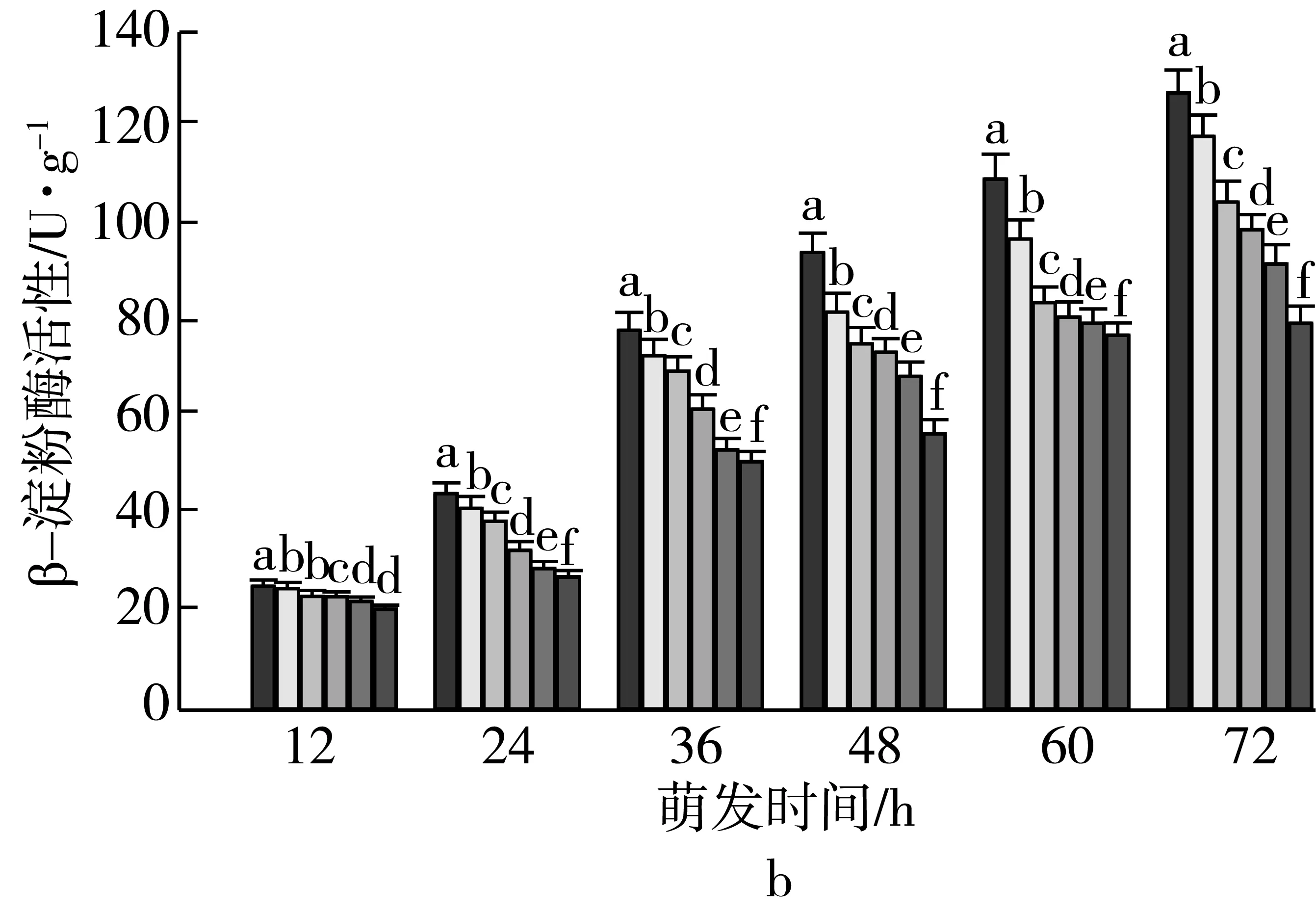
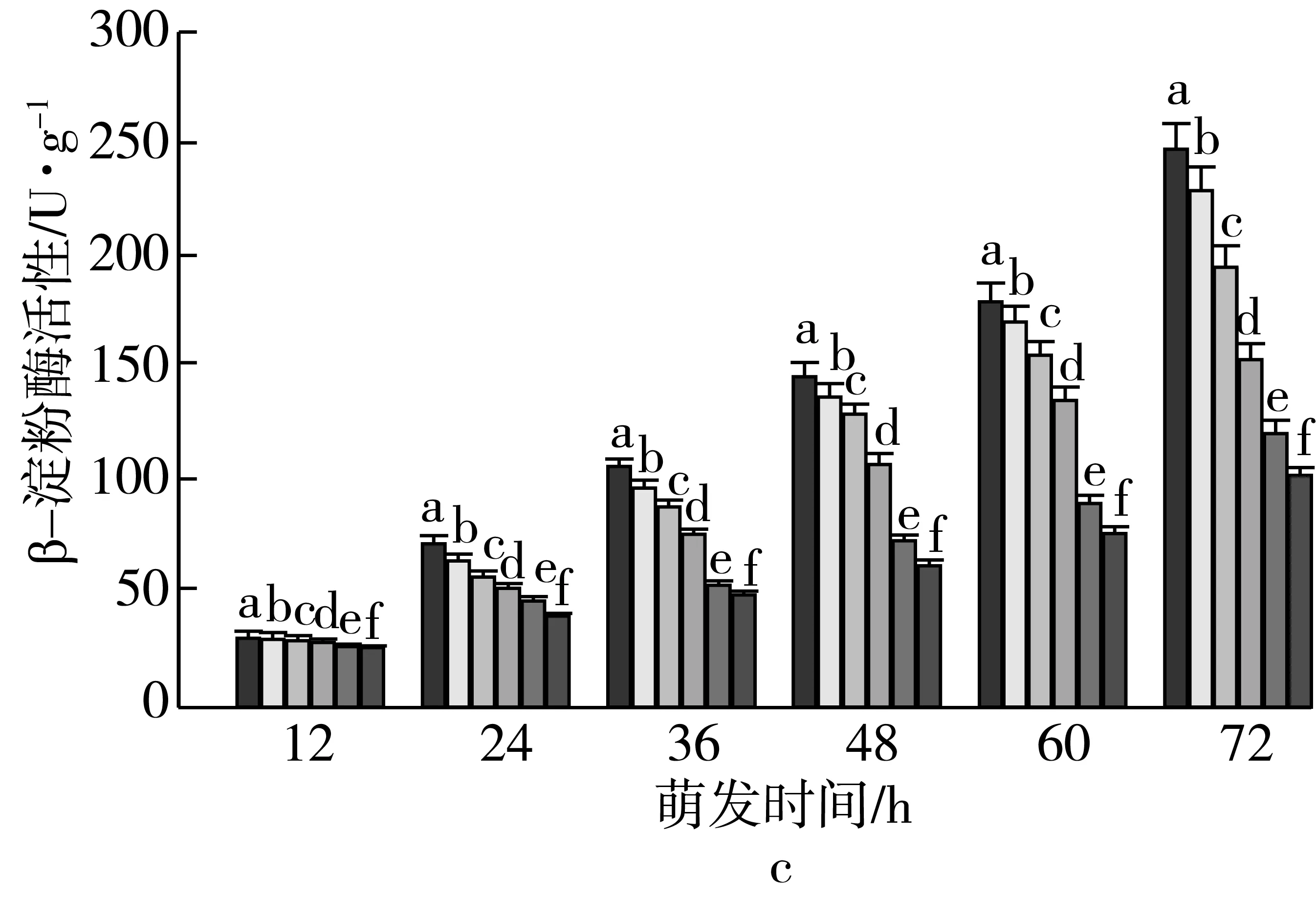



3 讨论
4 结论

