基质分散固相萃取-高效液相色谱-串联质谱法检测红薯中的植物生长调节剂
张 婧, 万慧慧, 张 华
(大连理工大学化工与环境生命学部化学分析测试中心, 辽宁 大连 116024)
研究论文
基质分散固相萃取-高效液相色谱-串联质谱法检测红薯中的植物生长调节剂
张 婧, 万慧慧*, 张 华*
(大连理工大学化工与环境生命学部化学分析测试中心, 辽宁 大连 116024)
建立了基质分散固相萃取-高效液相色谱-串联质谱测定红薯中氯吡脲、6-苄氨基嘌呤、增效胺以及多效唑含量的方法。样品经硅胶分散剂研磨分散、甲醇洗脱提取后,采用Thermo hypersil GOLD C18色谱柱(150 mm×2.1 mm, 5 μm),以甲醇和0.1%(体积分数)甲酸-5 mmol/L甲酸铵为流动相进行梯度洗脱,在电喷雾离子源正离子或负离子模式下以选择反应监测(SRM)模式检测,外标法定量。氯吡脲、6-苄氨基嘌呤、增效胺和多效唑分别在10.8~216.0、10.8~216.0、12.5~250.0和10.2~204.0 ng/g范围内呈良好的线性关系,相关系数(r2)均大于0.96。以信噪比等于10确定4种植物生长调节剂的定量限,氯吡脲、6-苄氨基嘌呤、增效胺和多效唑的定量限分别为0.1、0.3、0.2和0.1 ng/g。4种植物生长调节剂在50、100及200 ng/g加标水平下的回收率为85.3%~116.0%,相对标准偏差为0.6%~22.7%。该方法操作简单、准确,适用于红薯中氯吡脲、6-苄氨基嘌呤、增效胺以及多效唑的定量检测分析。
基质分散固相萃取;高效液相色谱-串联质谱;氯吡脲;6-苄氨基嘌呤;增效胺;多效唑;红薯
植物生长调节剂(plant growth regulators, PGRs)是一种人工合成的具有天然植物激素效能甚至更为有效的活性物质[1]。植物生长调节剂分为植物生长促进剂、植物生长抑制剂以及植物生长延缓剂。本文所研究的植物生长调节剂为氯吡脲、6-苄氨基嘌呤、增效胺和多效唑,化学结构式见图1。氯吡脲是一种植物生长促进剂,能够促进细胞分裂、延缓衰老、促进坐果、使果实膨大[2]。6-苄氨基嘌呤属于人工合成细胞分裂素,可以促进果实生长及细胞分裂,有效提高坐果率和产率,由于其低廉的价格,6-苄氨基嘌呤被广泛地应用于农业生产[3]。增效胺主要对除虫菊酯等除草剂具有增效作用[4]。多效唑属于植物生长延缓剂,是一种三唑类的杀虫剂,具有延缓植物生长的功效,能够起到抑制茎秆伸长、缩短节间、增加植物抗逆性能、提高产量等作用[5]。

图 1 氯吡脲、6-苄氨基嘌呤、增效胺以及多效唑的化学结构式Fig. 1 Chemical structures of forchlorfenuron, 6-benzylaminopurine (6-BA), N-(2-ethylhexyl)-5-norbornene-2,3-dicarboximide (MGK 264) and paclobutrazol
近年来,由于植物生长调节剂使用不当引起的食品安全问题逐渐增多,其残留问题成为食品安全的隐患。植物生长调节剂在农作物中的残留可通过食物链进入人体,轻者造成腹泻等疾病,重者会使人体免疫力下降,骨骼疏松,甚至有致畸、致癌现象[6]。氯吡脲可能会对人体带来潜在的危害,欧盟、美国、日本等国对其残留量做出了严格限定[2]。根据美国环境保护署(美国EPA)报告,6-苄氨基嘌呤会刺激眼睛[7],同时也会损坏食管、胃黏膜,刺激皮肤[1],韩国食品药品管理局设置6-苄氨基嘌呤的最大残留量为0.1 mg/kg[1]。增效胺具有低毒性,对大鼠、兔子的动物实验结果表明,对大鼠急性经口半数致死量(LD50)为2 800 mg/kg,对兔急性经皮LD50为470 mg/kg,而对于猪的实验未发现中毒,但是增效胺的低毒性还是需要警惕[4]。多效唑的不当使用也会对人体健康造成威胁,国家标准[8]限定粮食中的多效唑残留量最大不能超过0.5 mg/kg。因此,建立果蔬中植物生长调节剂的残留检测方法非常重要。
果蔬类样品中药物定量检测的前处理方法主要有固相萃取技术[9-11]、QuEChERS[12]以及基质分散固相萃取(matrix solid-phase dispersion, MSPD)技术[13]。QuEChERS作为一种操作简单、快速的样品前处理方法,主要应用于多样品大样本的快速分析。固相萃取技术与MSPD技术都对样品有净化作用,回收率、重复性较好。MSPD是近二十年发展起来的一种样品前处理方法[14],通过混匀并研磨分散剂材料和果蔬样品,使果蔬细胞破碎而均质,待测样品可以很好地分散到固相萃取材料表面,从而达到良好的分散提取效果。MSPD被广泛用于水果、蔬菜中的农药残留检测[13,15],但应用于块茎类蔬菜的研究较少,文献中未见同时检测红薯中多种植物生长调节剂的相关工作。
常见的检测植物生长调节剂的方法有气相色谱-质谱联用法[16,17]、液相色谱法[9,18]以及液相色谱-质谱联用技术[1,12,19]。气相色谱-质谱联用技术适用于对低沸点与弱极性物质的检测;液相色谱法对于中等极性以上的化合物具有很好的色谱保留,但是存在检测假阳性的缺陷。相比于液相色谱法,液相色谱-质谱联用法既可以较好地解决复杂样品中其他成分的干扰问题,同时选择性高,灵敏度高,具有较高的准确度,目前作为气相色谱-质谱联用的重要互补技术被广泛应用于食品、药品、环境等化合物的定量检测中[20-23]。
本文在前期采用疏水改性的硅胶(silica)作为分散剂材料对红薯样品中氯吡脲进行前处理工作[24]的基础上,采用亲水性分散剂材料进行提取,兼顾了提取的有效性与经济性。通过将红薯样品与硅胶分散剂研磨进行分散提取,建立了基质分散固相萃取-高效液相色谱-串联质谱(MSPD-HPLC-MS/MS)定量测定红薯中的氯吡脲、6-苄氨基嘌呤、增效胺以及多效唑含量的方法。
1 实验部分
1.1仪器与试剂
TSQ QUANTUM ULTRA液相色谱-质谱联用仪,配有ACCELA高效液相色谱系统及Xcalibur数据处理系统(美国Thermo Scientific公司);真空抽滤器(河南省予华仪器有限公司);离心机(湖南湘仪实验室仪器开发有限公司);氮吹仪(天津市恒奥科技发展有限公司); Milli-Q超纯水系统(美国Millipore公司)。
Thermo hypersil GOLD C18柱(150 mm×2.1 mm, 5 μm)和Thermo hypersil GOLD C18柱(10 mm×2.1 mm, 5 μm)购自美国Thermo Scientific公司;硅胶、C8、Click Xion-G、Click Xion(规格均为粒径60 μm、孔径10-8m)和石墨化炭黑(GCB, 150 μm)购自北京华谱新创科技有限公司。氯吡脲(分析纯,日本TCI公司); 6-苄氨基嘌呤、增效胺、多效唑(均为分析纯,上海Aladdin公司);甲酸铵(色谱纯,美国Sigma Aldrich公司);甲醇(色谱纯,德国Merck公司);甲酸(色谱纯,北京迪马科技有限公司)。注射器滤器(12 mL)与SPE筛板(北京华谱新创科技有限公司);尼龙滤膜(0.22 μm, 13 mm,天津博纳艾杰尔科技有限公司)。其他试剂均为国产分析纯。
1.2标准溶液的配制
分别准确称取0.010 8 g氯吡脲、0.010 8 g 6-苄氨基嘌呤、0.012 5 g增效胺和0.010 2 g多效唑,用甲醇溶解并定容至100 mL,作为标准储备液。分别取氯吡脲、6-苄氨基嘌呤、增效胺及多效唑的标准储备液各1 mL,混匀,稀释至100 mL,作为混合标准储备液,避光保存于4 ℃冰箱。
1.3样品前处理
准确称量0.500 0 g切碎后的红薯,置于玛瑙研钵中,研磨后加入200 μL混合标准储备液,然后再加入2.00 g硅胶吸附材料,研磨均匀后装入12 mL固相萃取柱空管中,用10 mL甲醇洗脱至15 mL离心管中。洗脱液于40 ℃水浴条件下用氮气吹干,然后用600 μL甲醇进行超声重溶,经0.22 μm尼龙滤膜过滤后置于1.5 mL离心管中,以4 000 r/min的速度离心15 min,取10 μL上清液进行液相色谱-质谱检测。
1.4色谱条件
色谱柱:Thermo hypersil GOLD C18(150 mm×2.1 mm, 5 μm);保护柱:Thermo hypersil GOLD C18(10 mm×2.1 mm, 5 μm);柱温:25 ℃;进样量:10 μL。流动相A:甲醇;流动相B: 0.1%(体积分数)甲酸-5 mmol/L甲酸铵;流速:200 μL/min。梯度洗脱程序:0~5.0 min, 10%A; 5.0~7.0 min, 10%A~90%A; 7.0~13.0 min, 90%A; 13.0~14.0 min, 90%A~10%A; 14.0~25.0 min, 10%A。
1.5质谱条件
离子源:ESI;扫描方式:选择反应监测(SRM)模式;离子扫描模式:氯吡脲为负离子扫描模式,6-苄氨基嘌呤、增效胺以及多效唑为正离子扫描模式;离子源温度:250 ℃;毛细管温度:350 ℃。电喷雾电压:3 kV(正离子模式), 2.5 kV(负离子模式);鞘气(高纯N2)压力:5.8 Pa;辅助气(高纯N2)压力:1.7 Pa;碰撞气:高纯Ar;扫描时间:0.15 s。
2 结果与讨论
2.1色谱和质谱条件的优化
将配制的氯吡脲、6-苄氨基嘌呤、增效胺及多效唑的标准储备液分别在ESI源正离子及负离子模式下进行全扫描,优化质谱参数使其母离子的响应最大化,分别选择响应强度大的检测模式。然后对其采用子离子扫描分析,通过优化碰撞能量(CE)使子离子的响应最大化。最终选择两对离子对及相应的优化参数作为最终的SRM模式质谱采集参数,其中氯吡脲为负离子扫描模式,6-苄氨基嘌呤、增效胺以及多效唑为正离子扫描模式。4种植物生长调节剂的质谱参数见表1。
采用串联质谱在相应的扫描模式下通过SRM模式定量分析,以质谱优化参数为采集参数,采用Thermo hypersil GOLD C18(150 mm×2.1 mm, 5 μm)色谱柱对氯吡脲、6-苄氨基嘌呤、增效胺、多效唑进行分离,以甲醇和0.1%(体积分数)甲酸-5 mmol/L甲酸铵作为流动相,测定混合标准储备液。如图2所示,可以看出Thermo hypersil GOLD C18对4种植物生长调节剂的色谱保留较好,且峰形对称。
2.2空白基质
除不加入混合标准储备液外,其余均按1.3节方法处理红薯空白样品,得到红薯空白基质样品,然后进行液相色谱-质谱检测,结果见图3。通过检测发现,红薯空白基质样品中不含所测物质,不存在对目标物质的干扰物。

表 1 4种植物生长调节剂的质谱参数Table 1 MS parameters of the four plant growth regulators
* Quantification ion.
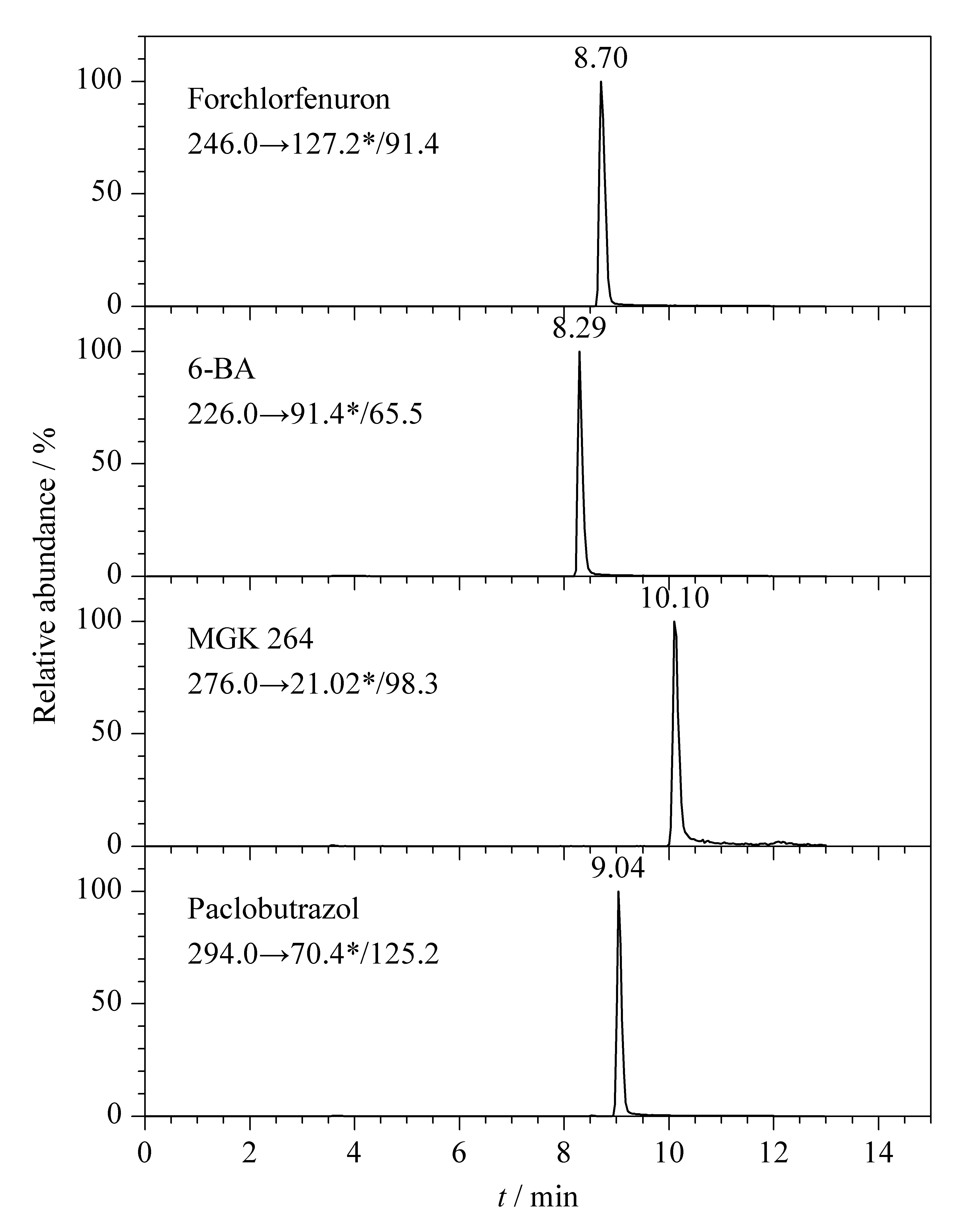
图 2 4种植物生长调节剂的HPLC-MS/MS谱图Fig. 2 HPLC-MS/MS chromatograms of the four plant growth regulators

图 3 红薯空白样品的HPLC-MS/MS谱图Fig. 3 HPLC-MS/MS chromatograms of the blank batata sample
2.3基质效应
分别采用甲醇和红薯空白基质样品配制氯吡脲(2.28 μg/L~1.14 mg/L)、6-苄氨基嘌呤(2.16 μg/L~1.08 mg/L)、增效胺(2.50 μg/L~1.25 mg/L)及多效唑(2.16 μg/L~1.08 mg/L)的标准溶液,绘制标准曲线。采用公式Rmatrixeffect=(kmatrix-kmethanol)/kmethanol计算基质效应,其中Rmatrixeffect为基质效应,kmethanol与kmatrix分别为采用甲醇和红薯空白基质样品配制标准溶液所绘制标准曲线的斜率。通过计算可知氯吡脲、6-苄氨基嘌呤、增效胺和多效唑的基质效应分别为74.4%、-37.9%、-53.0%和-59.7%。4种植物生长调节剂均存在基质效应,氯吡脲显示基质增强效应,6-苄氨基嘌呤、增效胺及多效唑显示基质抑制效应。因此,在进行定量分析时采用标准添加空白样品法配制标准溶液,从而校正基质效应。
2.4分散剂材料的选择与分散剂比例的优化
分别考察了硅胶、Click Xion、C8、GCB和Click Xion-G 5种分散剂材料,按照1.3节方法将红薯样品分别与这5种材料进行研磨提取,经前处理后进行液相色谱-质谱检测分析。结果表明:GCB作为吸附剂材料,具有类似于活性炭这类吸附剂材料的作用,可以起到很好的吸附色素、除杂作用。但是,在研磨的过程中,GCB易吸水结块、不易操作,所以不考虑GCB作为分散剂材料和除杂材料。C8作为分散剂材料时,由于硅胶表面键合C8长链,表现出一定的疏水作用,对于红薯这类富含水分的果蔬类样品,研磨提取过程中,操作不方便。亲水材料(Click Xion、硅胶、Click Xion-G)与疏水材料(GCB和C8)相比,红薯样品更适合与亲水材料混合研磨。以不同分散材料对待测化合物得到的最大峰面积为基准,其他的分散剂材料得到的同一待测化合物的峰面积与最大峰面积的比值为纵坐标,以分散剂材料的种类为横坐标,绘制Click Xion、硅胶、Click Xion-G对氯吡脲、6-苄氨基嘌呤、增效胺、多效唑的提取效果优化图(见图4)。Click Xion和硅胶的提取效率接近,Click Xion-G提取效率相对较差。另外,相比于Click Xion,硅胶更廉价易得,提取效率也较高。因此,兼顾到提取的有效性、操作的简便性以及实验的经济性,最终选择硅胶作为分散剂材料。

图 4 分散剂材料种类的优化Fig. 4 Optimization of the types of dispersant materials
样品与分散剂的质量比是MSPD中样品提取效果的关键因素。本文比较了不同样品与分散剂的质量比值对提取效率的影响,以红薯样品与分散剂的不同质量比为横坐标,以测得的各植物生长调节剂的最大峰面积为基准,测得峰面积与最大峰面积的比值为纵坐标,绘制成条形统计图。如图5所示,当红薯样品与分散剂的质量比为1∶4时,洗脱得到的4种植物生长调节剂的量相对较多。另外,由于红薯样品本身含水,样品与分散剂的质量比为1∶3时,研磨不能很好地分散红薯样品。因此采用1∶4的红薯样品与分散剂材料的质量比。

图 5 红薯样品与分散剂材料质量比例的优化Fig. 5 Optimization of the mass ratios between batatas and dispersant materials
2.5最佳洗脱体积的选择
按照1.3节方法进行前处理,分别用6~12 mL甲醇进行洗脱。以不同体积甲醇所连续洗脱样品的峰面积为纵坐标、洗脱过程所用的甲醇体积为横坐标绘制洗脱曲线,选出最优的洗脱体积。如图6所示,当使用10 mL甲醇进行洗脱时,基本洗脱完全,最终选择用10 mL甲醇进行洗脱。

图 6 洗脱体积的优化Fig. 6 Optimization of the elution volume
2.6线性关系和定量限
分别向红薯空白样品中加入不同量的甲醇稀释的混合标准溶液,按照1.3节方法进行前处理,提取4种化合物,进行液相色谱-质谱分析检测。得到4种待测化合物经红薯空白样品提取的不同质量浓度样品的液相色谱-质谱图,通过积分得到峰面积,以峰面积为纵坐标(Y)、经红薯空白样品提取的不同含量为横坐标(X, ng/g),进行线性回归分析。线性方程如表2所示,表明氯吡脲、6-苄氨基嘌呤、增效胺和多效唑4种植物生长调节剂分别在10.8~216.0、10.8~216.0、12.5~250.0和10.2~204.0 ng/g范围内线性关系良好。以信噪比(S/N)=10确定4种植物生长调节剂的定量限

表 2 4种植物生长调节剂的线性方程、相关系数(r2)和定量限Table 2 Linear equations, correlation coefficients (r2) and LOQs of the four plant growth regulators
Y: peak area;X: content, ng/g.
(LOQ),氯吡脲、6-苄氨基嘌呤、增效胺和多效唑的LOQ分别为0.1、0.3、0.2和0.1 ng/g。
2.7回收率
分别在0.500 0 g红薯空白样品中加入不同量的甲醇稀释的混合标准溶液(50、100和200 ng/g),按照1.3节方法进行前处理操作得到的样品溶液,用液相色谱-质谱检测。另外,按照1.3节方法提取3份红薯空白基质,分别加入与红薯空白样品中相当添加量的甲醇稀释的混合标准溶液(50、100和200 ng/g),涡流混匀,于40 ℃水浴中用氮气吹干,用600 μL甲醇重溶,后进行液相色谱-质谱检测。以红薯空白基质配制的50、100和200 ng/g 3个水平的混合标准溶液所测得的峰面积为基准,计算红薯空白样品加标后按照1.3节方法进行前处理操作得到样品溶液的峰面积与其比值,即得50、100和200 ng/g 3个添加水平的回收率。每个添加水平重复测试3次,结果见表3,回收率为85.3%~116.0%, RSD<25%。

表 3 红薯中植物生长调节剂的回收率(n=3)Table 3 Recoveries of the plant growth regulators in the batatas (n=3)
2.8实际样品的检测
分别购买两份不同的红薯样品,不加入混合标准储备液,按照1.3节方法进行前处理后,经液相色谱-质谱分析。表4为依据2.6节中的线性方程计算得到两份红薯样品中4种化合物的含量,试验重复3次。

表 4 实际红薯样品中植物生长调节剂的含量(n=3)Table 4 Contents of the plant growth regulators in real batata samples (n=3)
ND: not detected.
3 结论
本文将MSPD前处理技术与HPLC-MS/MS技术结合,建立了红薯中的氯吡脲、6-苄氨基嘌呤、增效胺及多效唑4种植物生长调节剂的定量检测方法。结果表明:MSPD技术可以很好地提取红薯中的氯吡脲、6-苄氨基嘌呤、增效胺以及多效唑,HPLC-MS/MS对痕量植物生长调节剂表现出较高的灵敏度和重复性。该方法操作简便、可操作性强、回收率高,适用于红薯中痕量植物生长调节剂的定量检测。同时,该方法也为其他果蔬类样品中植物生长调节剂的定量检测提供了参考。
[1] Shi X, Jin F, Huang Y, et al. J Agric Food Chem, 2012, 60(1): 60
[2] Luo W Q, Xiao X H, Li G K. Journal of Food Safety and Quality, 2013, 4(4): 1089
罗伟强, 肖小华, 李攻科. 食品安全质量检测学报, 2013, 4(4): 1089
[3] Zhang W, He L, Zhang R, et al. Food Chem, 2016, 207: 233
[4] Zhou L K, Zhou Y. Chinese Journal of Vector Biology and Control, 2007, 13(6): 468
周留坤, 周晔. 中华卫生杀虫药械, 2007, 13(6): 468
[5] Li H F, Nie J Y, Xu G F, et al. Journal of Instrumental Analysis, 2015, 34(12): 1331
李海飞, 聂继云, 徐国锋, 等. 分析测试学报, 2015, 34(12): 1331
[6] Wu F Q, Jin B H, Chen B, et al. Chinese Agricultural Science Bulletin, 2010, 26(15): 115
吴凤琪, 靳保辉, 陈波, 等. 中国农学通报, 2010, 26(15): 115
[7] 6-Benzylaminopurine Technical, EPA Reg. No. 83028-5 Container Disposal per PRN 2007-4. (2009-09-08) [2017-05-20]. https://www3.epa.gov/pesticides/chem_search/ppls/083028-00005-20090908. pdf
[8] GB 2763-2012
[9] Liu Y S, Wang B, Yan H, et al. Science and Technology of Food Industry, 2015, 36(22): 61
刘雨思, 王波, 闫衡, 等. 食品工业科技, 2015, 36(22): 61
[10] Mu Y L, Guo D H, Ding Z P. Chinese Journal of Chromatography, 2013, 31(10): 1016
牟艳莉, 郭德华, 丁卓平. 色谱, 2013, 31(10): 1016
[11] Cao H, Chen X Z, Zhu Y, et al. Agrochemicals, 2013, 51(10): 738
曹慧, 陈小珍, 祝颖, 等. 农药, 2013, 51(10): 738
[12] Huang H H, Zhang J, Xu D M, et al. Chinese Journal of Chromatography, 2014, 32(7): 707
黄何何, 张缙, 徐敦明, 等. 色谱, 2014, 32(7): 707
[13] Cao Y L, Tang H, Chen D Z, et al. J Chromatogr B, 2015, 998/999: 72
[14] Barker S A, Long A R, Short C R. J Chromatogr A, 1989, 475: 353
[15] Gong L P, Shi F, Jiang S Y, et al. Chinese Journal of Chromatography, 2015, 33(4): 408
巩丽萍, 石峰, 姜树银, 等. 色谱, 2015, 33(4): 408
[16] Wang J, Hu X Z. Journal of Anhui Agricultural Sciences, 2015, 43(18): 135
王娟, 胡西洲. 安徽农业科学, 2015, 43(18): 135
[17] Xu Y H, Jiang S, Fu H B, et al. Agrochemicals, 2014, 53(2): 113
徐宜宏, 蒋施, 付海滨, 等. 农药, 2014, 53(2): 113
[18] Zhang H R, Zhou W, Wang B, et al. Chinese Journal of Analysis Laboratory, 2014, 33(9): 1097
张慧荣, 周围, 王波, 等. 分析试验室, 2014, 33(9): 1097
[19] Li H Y, Shang D J, Gong Z G, et al. Storage and Process, 2014, 14(1): 27
李海艳, 尚德军, 巩志国, 等. 保鲜与加工, 2014, 14(1): 27
[20] Liu H C, Li N, Lin T, et al. Chinese Journal of Chromatography, 2015, 33(11): 1163
刘宏程, 李宁, 林涛, 等. 色谱, 2015, 33(11): 1163
[21] Liu Z, Chen W Q, Mao P Q, et al. Journal of Anhui Agricultural Sciences, 2015, 43(21): 274
刘柱, 陈万勤, 茅佩卿, 等. 安徽农业科学, 2015, 43(21): 274
[22] Zhao Y G, Chen X H, Yao S S, et al. Chinese Journal of Chromatography, 2012, 30(7): 665
赵永纲, 陈晓红, 姚珊珊, 等. 色谱, 2012, 30(7): 665
[23] Wang P, Guo S F, Jing T, et al. Chinese Journal of Chromatography, 2008, 26(3): 353
王鹏, 郭少飞, 荆涛, 等. 色谱, 2008, 26(3): 353
[24] Zhang J, Wan H H, Zhang H. Journal of Analytical Science, 2017, 33(3): 387
张婧, 万慧慧, 张华. 分析科学学报, 2017, 33(3): 387
Determination of the plant growth regulators in batatas by matrix solid-phase dispersive extraction and high performance liquid chromatography with tandem mass spectrometry
ZHANG Jing, WAN Huihui*, ZHANG Hua*
(Chemical Analysis and Testing Center, Faculty of Chemical, Environmental and Biological Science and Technology, Dalian University of Technology, Dalian 116024, China)
An analytical method based on matrix solid-phase dispersive (MSPD) extraction and high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) was established for the determination of forchlorfenuron, 6-benzylaminopurine (6-BA),N-(2-ethylhexyl)-5-norbornene-2,3-dicarboximide (MGK 264) and paclobutrazol in batatas. The samples were dispersed with silica by grinding, and then extracted with methanol. The determination was carried out on a Thermo hypersil GOLD C18 column (150 mm×2.1 mm, 5 μm) in gradient elution with mobile phases of methanol and ammonium formate (5 mmol/L, containing 0.1% (v/v) formic acid) and detected with tandem mass spectrometry using selected reaction monitoring (SRM) mode. The quantification was performed using external standard calibration, and the calibration curves were performed in the ranges of 10.8-216.0 ng/g (forchlorfenuron), 10.8-216.0 ng/g (6-BA), 12.5-250.0 ng/g (MGK 264), 10.2-204.0 ng/g (paclobutrazol) with the correlation coefficients larger than 0.96. The limits of quantification (LOQs) were 0.1-0.3 ng/g. The spiked recoveries at the levels of 50, 100 and 200 ng/g of these four plant growth regulators were in the range of 85.3%-116.0%, and the relative standard deviations were 0.6%-22.7%. This method has advantages of simple operation and good accuracy, and can be used for the quantitative determination of forchlorfenuron, 6-BA, MGK 264 and paclobutrazol in batatas.
matrix solid-phase dispersive (MSPD); high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS); forchlorfenuron; 6-benzylaminopurine(6-BA);N-(2-ethylhexyl)-5-norbornene-2,3-dicarboximide (MGK 264); paclobutrazol; batata
10.3724/SP.J.1123.2017.06005
2017-06-01
.E-mail:wanhuihui@dlut.edu.cn(万慧慧);zhanghua@dlut.edu.cn(张华).
国家自然科学基金项目(21505014);大连理工大学引进人才科研专题项目(DUT15RC(4)13).
O658
A
1000-8713(2017)09-0963-07
Foundation item: National Natural Science Foundation of China (No. 21505014); Dalian University of Technology for Talent Introduction (No. DUT15RC(4)13).
*
- 色谱的其它文章
- 超高效液相色谱-四极杆-飞行时间质谱法快速筛查姜和葱中44种农药残留
- Separation and purification of acteoside from Rehmanniaglutinosa by combining macroporous resin with high-speed countercurrent chromatography
- Preparation of filter paper with chiral separation function by oxidation and Schiff-base reaction
- 气相色谱法测定及预测有机磷阻燃剂的蒸气压
- 固相萃取-超高效液相色谱-高分辨质谱法快速测定食用油中4种酚类环境雌激素残留
- 《色谱》论文中可直接使用的缩略词