超高效液相色谱-四极杆-飞行时间质谱法快速筛查姜和葱中44种农药残留
刘永强, 刘 胜, 许文娟, 田国宁, 张金玲
(1. 潍坊出入境检验检疫局检验检疫技术中心, 山东 潍坊 261041;2. 淄博出入境检验检疫局检验检疫技术中心, 山东 淄博 255035)
研究论文
超高效液相色谱-四极杆-飞行时间质谱法快速筛查姜和葱中44种农药残留
刘永强1*, 刘 胜2, 许文娟1, 田国宁1, 张金玲1
(1. 潍坊出入境检验检疫局检验检疫技术中心, 山东 潍坊 261041;2. 淄博出入境检验检疫局检验检疫技术中心, 山东 淄博 255035)
建立了超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF/MS)快速筛查和确证姜和葱中44种农药残留的分析方法。样品采用QuEChERS技术进行前处理,用含0.1%(v/v)乙酸的乙腈溶液进行提取,N-丙基乙二胺(PSA)和十八烷基键合硅胶(C18)吸附剂净化。使用Poroshell 120 SB-C18色谱柱(100 mm×3.0 mm, 2.7 μm)分离,以0.1%(v/v)甲酸水溶液(含5 mmol/L乙酸铵)-乙腈为流动相,梯度洗脱,在电喷雾正离子模式下检测,外标法定量。采用全离子MS/MS模式,通过一次数据采集,同时完成化合物的定性筛查和确证。44种化合物在线性范围内线性关系良好,相关系数(r)均大于0.995。44种化合物的定量限(S/N=10)为2.5~5.0 μg/kg,在3个添加水平下的回收率为73.4%~113.7%,相对标准偏差(RSD)为0.7%~12.1%(n=6)。该法有效地提高了高分辨质谱进行农药多残留筛查时的检测效率,具有较强的实际应用价值。
超高效液相色谱-四极杆-飞行时间质谱;高分辨全离子二极质谱技术;QuEChERS;筛查;农药残留
随着社会经济的发展,人们对食品安全的关注日益提升,而食品中的农药残留是影响食品安全的重要因素。目前农药多残留的筛查方法主要有气相色谱-质谱法(GC-MS)[1-3]、液相色谱-串联质谱法(LC-MS/MS)[4-6]和液相色谱-四极杆-飞行时间质谱法(LC-Q-TOF/MS)等[7-13]。低分辨质谱由于灵敏度较低等问题使其应用受到限制[14,15],而高分辨质谱以其高分辨率、高质量精度和无需标准物质定性等优势[16-18]在农药多残留筛查检测方面得到了广泛应用[7-13,19],为农药的科学合理使用提供了有效的监管手段。
本实验以葱和姜为研究基质,以实验室日常开展的检测项目中常见的44种农药为目标物,结合QuEChERS的前处理手段和高分辨全离子MS/MS技术,建立了超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF/MS)快速筛查姜和葱中多种农药残留的方法。该法仅采集一次数据,并通过谱库检索,可同时完成目标物的定性筛查和确证,并能对确证的化合物进行准确定量,有效地提升了农药多残留筛查的检测效率。
1 实验部分
1.1仪器与试剂
1290-6530超高效液相色谱-四极杆-飞行时间质谱仪(美国Agilent公司); 5810R高速冷冻离心机(德国Eppendorf公司); R-210旋转蒸发仪(瑞士Buchi公司); T25均质器、MS3涡流混匀器(德国IKA公司); XS203S电子天平(瑞士Mettler Toledo公司); Reference A10超纯水机(美国Millipore公司); WD900微波炉(中国格兰仕集团)。
44种农药标准品(纯度93.6%~99.7%,德国Dr. Ehrenstorfer公司);乙腈(色谱纯,美国Thermo Fisher公司);甲醇(色谱纯,美国Merck公司);无水乙酸钠(分析纯,天津市科密欧化学试剂有限公司);无水硫酸镁(分析纯,天津市光复精细化工研究所);吸附剂N-丙基乙二胺(PSA)和十八烷基键合硅胶(C18)(中国天津博纳艾杰尔公司)。姜和葱样品为实验室日常送检样品。
1.2标准溶液的配制
准确称取10 mg(精确至0.01 mg)标准品,置于10 mL棕色容量瓶中,用甲醇定容至刻度,配制单标准储备液,于-18 ℃避光保存;移取适量上述溶液,用甲醇稀释,配制所需浓度的标准工作液,于4 ℃避光保存。
分别量取100 μL 44种农药的单标储备液,置于100 mL棕色容量瓶中,用甲醇定容至刻度,配制质量浓度为1.0 mg/L的混合标准溶液,现用现配。
1.3样品前处理
制备:将姜打碎,葱切成2 cm的小段,采用四分法缩分至约500 g,装入干净的样品袋中,密封,标明标记,备用。
提取:称取上述制备好的样品15.00 g(葱于微波炉(720 W)中消解50 s),置于100 mL塑料离心管中,依次加入6 g无水硫酸镁、1.5 g无水乙酸钠和30 mL含0.1%(v/v)乙酸的乙腈溶液,以11 000 r/min均质提取2 min,以10 000 r/min离心10 min,移取20 mL(相当于10.00 g样品)上层提取液,置于250 mL尖底旋蒸瓶中,于40 ℃水浴旋转浓缩至近干,用乙腈涡旋混匀、溶解残渣并定容至2.0 mL,待净化。
净化:将上述2 mL溶解液转移至装有200 mg C18、150 mg PSA吸附剂的10 mL塑料离心管中,涡旋混匀2 min,以5 000 r/min离心3 min,取1 mL上清液,置于玻璃离心管中,用氮气吹干,然后用水-乙腈(9∶1, v/v)定容至1 mL,过0.45 μm滤膜,供分析。
1.4分析条件
1.4.1色谱条件
色谱柱:Poroshell 120 SB-C18(100 mm×3.0 mm, 2.7 μm,美国Agilent公司);柱温:40 ℃;流动相:A为0.1%(v/v)甲酸水溶液(含5 mmol/L乙酸铵), B为乙腈。梯度洗脱程序:0~5.00 min, 1%B~40%B; 5.00~8.00 min, 40%B; 8.00~14.00 min, 40%B~60%B; 14.00~18.00 min, 60%B~90%B; 18.00~20.00 min, 90%B; 20.00~20.01 min, 90%B~1%B; 20.01~24.00 min, 1%B。流速:0.4 mL/min;进样量:10 μL。
1.4.2质谱条件
离子源:电喷雾电离(ESI)源,正离子模式;干燥气温度:325 ℃;干燥气流速:10 L/min;雾化器压力:276 kPa;鞘气温度:350 ℃;鞘气流速:12 L/min;毛细管电压:4 000 V;全扫描范围:m/z100~1 000;参比离子:m/z121.050 9和922.009 8(用于实时校正)。整个采集过程设为两个实验段(Experiment 1和Experiment 2),碰撞能量在实验段1和2分别设为0 eV和20 eV,用于采集全离子MS/MS模式(all ions MS/MS mode)下不同能量通道的实验数据。
2 结果与讨论
2.1质谱库的建立
在UPLC-Q-TOF/MS的全扫描模式(MS mode)下对1.0 mg/L的44种农药的混合标准溶液进行分析,获得化合物精确的相对分子质量和保留时间等信息,然后在UPLC-Q-TOF/MS的目标MS/MS模式(Targeted MS/MS mode)下分析,得到不同碰撞能量(10、20、30、40 eV)下碎片离子的质谱图,最后将两次数据采集到的化合物精确相对分子质量、保留时间和碎片离子的质谱图导入PCDL软件,完成质谱库的建立。表1列出了44种农药的分子式、保留时间、理论相对分子质量、实际测得的相对分子质量、相对分子质量偏差、母离子([M+H]+)和碰撞能量为20 eV时相对丰度最高的2个质谱碎片离子的信息。
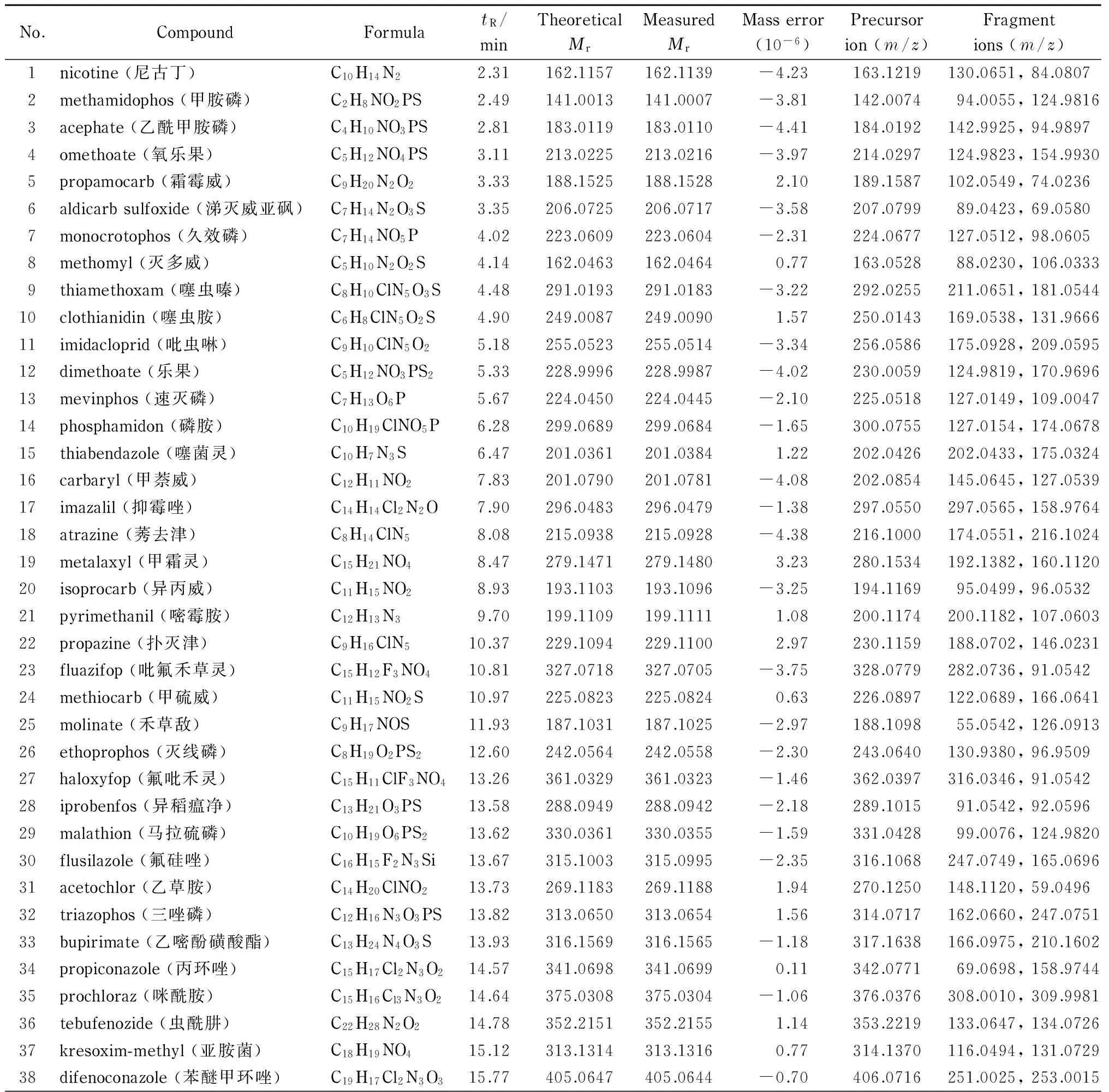
表 1 44种农药的分子式、保留时间、理论相对分子质量、实际测得的相对分子质量和其他质谱参数Table 1 Formulas, retention times (tR), theoretical Mr, measured Mr and the other mass parameters of the 44 pesticides
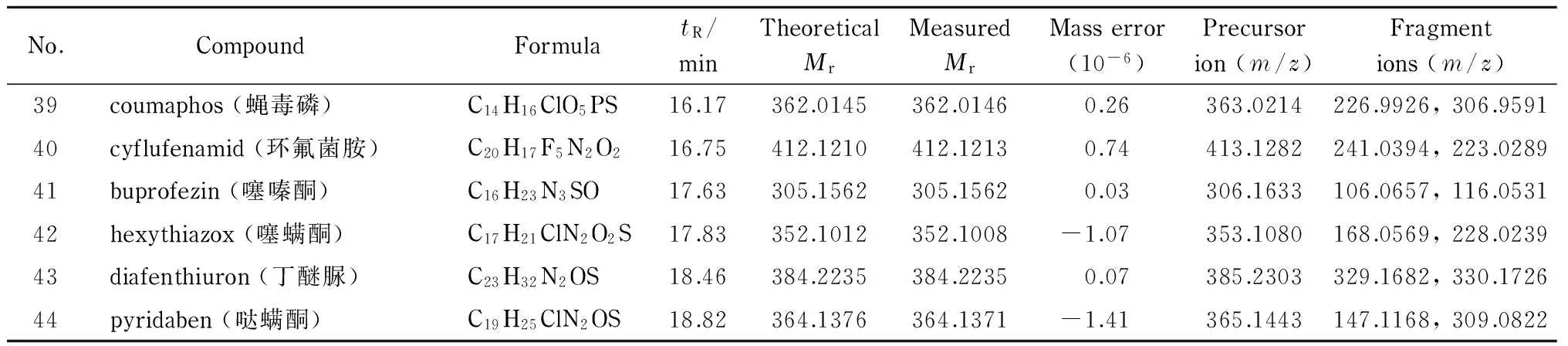
表 1 (续)Table 1 (Continued)
2.2高分辨全离子MS/MS技术
2.2.1全离子MS/MS采集模式
全离子MS/MS采集模式的数据采集过程分为高、低两个能量通道,交替生成只包含母离子的低能量通道和包含母离子及碎片离子的高能量通道的色谱图和质谱图,通过对两个能量通道的数据进行共流出分析,得到母离子和碎片离子的共流出关系。应用谱库对数据进行检索,首先根据目标物的保留时间、精确相对分子质量、同位素分布和同位素丰度比等信息进行定性筛查,然后将高能量通道中的碎片离子与谱库中的碎片离子进行匹配,证实相关离子的存在, 完成目标物的定性确证。以姜中的噻嗪酮为例,图1列出了用于定性筛查的提取离子色谱图(见图1a)、一级质谱图(见图1b)和用于确证的两个碎片离子的提取离子色谱图(见图1c)。

图 1 姜中噻嗪酮(0.1 mg/L)的(a)提取离子色谱图、(b)一级质谱图和(c)两个碎片离子的提取离子色谱图Fig. 1 (a) Extracted ion chromatogram, (b) MS spectrum and (c) extracted ion chromatograms of two fragment ions of buprofezin (0.1 mg/L) in a ginger sample
目前文献[7-9]报道的高分辨质谱筛查农药残留的方法大多需要采集两次数据,先采集一级质谱模式下的数据,然后对筛查出的疑似化合物在二级质谱模式下进行确证。而全离子MS/MS采集模式通过一次数据采集即可得到母离子和碎片离子的相关信息,完成目标物的定性筛查与确证,有效地提升了农药残留筛查的检测效率。
2.2.2碎片确证参数的设置
应用高分辨全离子MS/MS技术对目标化合物进行定性筛查与确证,需要设定确证所需碎片离子的个数、碎片离子信噪比(S/N)和母离子与碎片离子保留时间偏差等确证参数。根据欧盟SANTE/11945/2015指导文件,使用高分辨质谱对目标物确证,至少需要一个具有精确相对分子质量的母离子和一个碎片离子,为了提高筛查方法的准确性,将确证所需碎片离子的个数设为2。考虑到日常多用3倍S/N计算检出限(LOD),将碎片离子的S/N设为3。在定量限(LOQ)的添加水平上对母离子与碎片离子的保留时间偏差进行了考察,结果发现二者保留时间的最大偏差低于0.1 min,因此将母离子与碎片离子的保留时间偏差设为0.1 min。
2.2.3碰撞能量的设定
全离子MS/MS采集模式的数据采集过程分为两个能量通道,低能量通道通常将碰撞能量设为0 eV,确保母离子不发生碎裂。高能量通道碰撞能量的设定值较为关键,设置过高,低质量端的碎片离子就会增多,而杂质和溶剂的离子多位于低质量端,会导致干扰峰增多;设置过低,产生的碎片离子较少,不利于目标物的定性。本实验分析的44种目标物的相对分子质量基本位于150~350之间,属小分子化合物,碰撞能量设为20 eV,可使母离子碎裂的较为完全且离子碎片较丰富,能够满足目标物定性筛查和确证的要求。此外,应用谱库对全离子MS/MS采集模式得到的实验数据进行检索时,系统会自动生成一张平均碰撞能量碎片离子的质谱图,并且在该图中标示出用于定性确证的碎片离子,若谱库中未包含高能量通道碰撞能量下碎片离子的质谱图,软件会自动检索平均碰撞能量碎片离子质谱图中的离子,确证是否有相应碎片离子存在,完成目标物的定性,从而进一步拓宽高分辨全离子MS/MS技术的应用范围。以姜样品中的噻嗪酮为例,图2给出了平均碰撞能量碎片离子的质谱图,同时标示出了用于定性确证的m/z106.064 2和m/z116.051 6两个碎片离子。
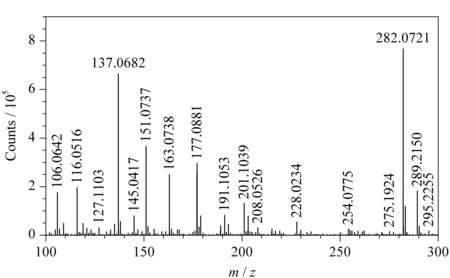
图 2 姜中噻嗪酮(0.1 mg/L)在平均碰撞能量下碎片离子的质谱图Fig. 2 MS spectrum of fragment ions of buprofezin (0.1 mg/L) in a ginger sample under average collision energy
2.3前处理条件的优化
采用QuEChERS技术对蔬菜样品进行前处理时常用的吸附剂有C18、石墨化炭黑(GCB)和PSA。C18主要用于吸附非极性干扰物;GCB可以有效地去除色素;PSA可以有效吸附有机酸、色素和部分糖。通过实验发现,GCB对噻菌灵、抑霉唑等农药的吸附性较强,可导致其回收率偏低。因此实验选择C18和PSA两种吸附剂组合进行净化,并对吸附剂的用量进行了优化。分别称取两种吸附剂各100、150、200和250 mg,两两组合考察净化效果,实验结果见图3。当C18和PSA的用量分别为200 mg和150 mg时,净化效果最好,44种农药的平均回收率为91.3%。因此实验选择C18和PSA两种吸附剂进行净化,且用量分别为200 mg和150 mg。

图 3 C18和PSA用量对44种农药回收率的影响Fig. 3 Effect of the amounts of C18 and PSA on the recoveries of the 44 pesticides C18: octadecyl bonded silica; PSA: primary secondary amine.
2.4基质效应
色谱分析中的基质效应(matrix effect, ME)是指目标测定物以外的其余组分对测定结果的影响,即基质对分析方法准确性的干扰,通常有基质增强和基质抑制两种表现形式[20]。当采用电喷雾离子源时,通常表现为基质抑制效应[7,9],即同样浓度的目标物在基质中的响应值要低于其在溶剂中的响应值。本实验分别用姜基质空白溶液和甲醇配制了系列不同质量浓度(5、10、20、50、100 μg/L)的混合标准溶液,并分别以峰面积对质量浓度绘制标准曲线,比较两条标准曲线的斜率,从而判断基质效应的强弱。具体计算公式如下:ME=基质标准曲线斜率/溶剂标准曲线斜率[21]。当ME为0.85~1.15时,基质效应较弱;当ME大于1.15时,存在较强的基质增强效应;当ME小于0.85时,存在较强的基质抑制效应。实验结果表明,44种农药中有32种农药的ME小于0.85, 12种农药的ME位于0.85~1.15范围内,无ME大于1.15的农药,说明44种农药总体上呈现基质抑制效应。为尽可能地消除基质效应的影响,使定量结果更加准确,本方法最终采用基质匹配外标校准曲线对样品中的农药残留进行定量,以抵消基质效应的影响。
2.5方法学考察
用空白样品提取液稀释,制备不同质量浓度的44种农药的混合基质标准溶液,以峰面积(Y)为纵坐标,相应的质量浓度(X, μg/L)为横坐标绘制标准曲线,以10倍信噪比(S/N)计算定量限(LOQ)。44种目标化合物在各自的线性范围内线性关系良好,相关系数(r)均大于0.995,定量限为2.5~5.0 μg/kg(见表2)。
对阴性姜和葱样品进行LOQ、2倍LOQ和5倍LOQ 3个添加水平的回收率和精密度试验,应用1.3节的方法进行样品前处理,每个添加水平做6个平行样品,结果见表2。44种目标化合物的加标回收率为73.4%~113.7%, RSD为0.7%~12.1%(n=6)。说明方法的回收率高、稳定性好,能够满足实际检测的要求。

表 2 44种农药的线性范围、定量限、线性方程、相关系数、回收率和相对标准偏差(n=6)Table 2 Linear ranges, LOQs, linear equations, correlation coefficients (r), recoveries and RSDs of the 44 pesticides (n=6)
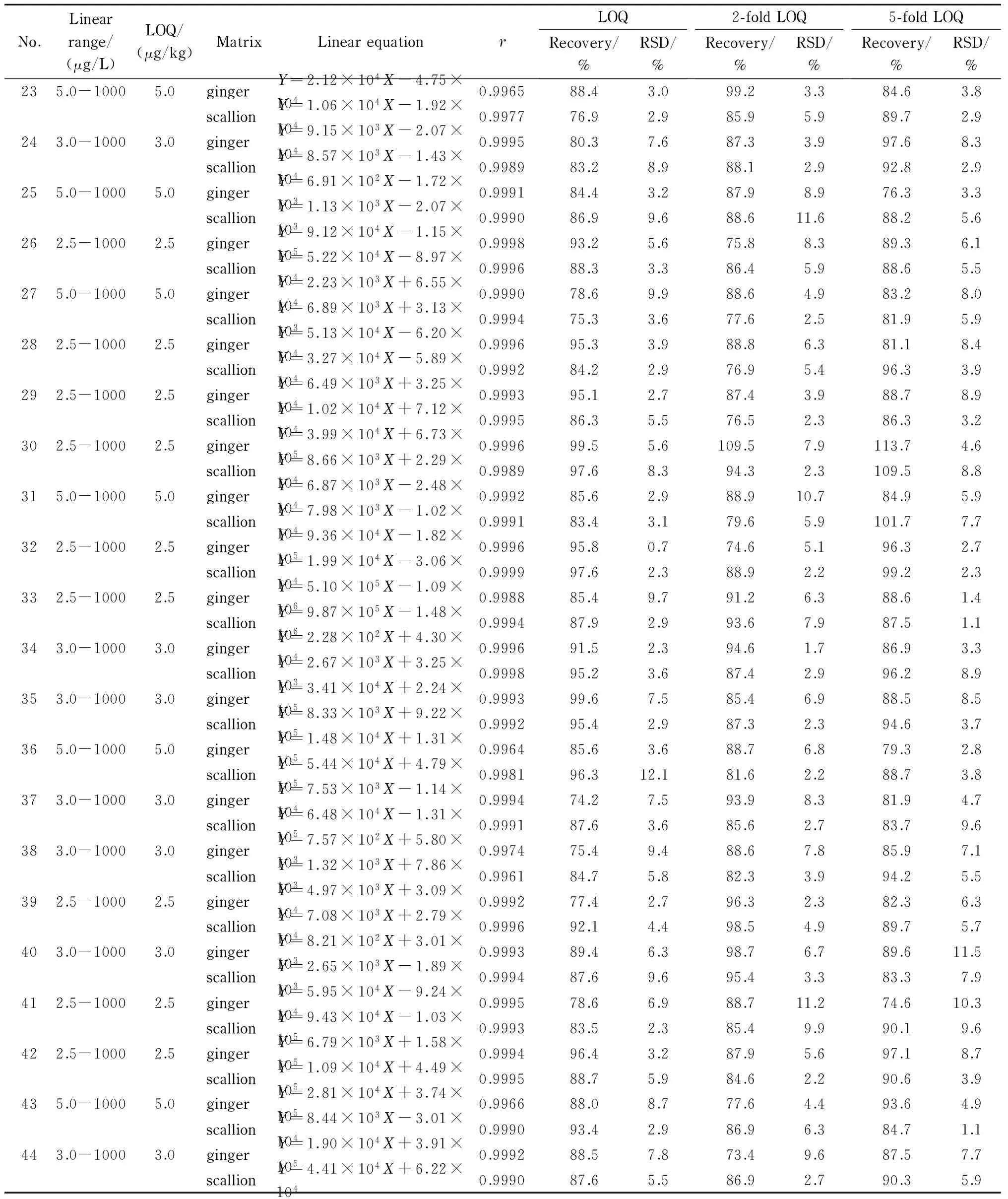
表 2 (续)Table 2 (Continued)
Nos. 1-44 were the same as in Table 1.Y: peak area of the target compound;X: mass concentration, μg/L.
2.6实际样品的检测
应用本文建立的筛查方法对实验室日常送检的10份样品(姜和葱样品各5份,分别编号为1~5)进行了检测。结果表明,10份样品中阴性样品7份、阳性样品3份(分别为3号姜样品、1号葱和5号葱样品),阳性样品中共检出7种农药,但均未超出GB 2763-2016所规定的相关农药的最大残留限量。同时采用GB/T 20769-2008方法对阳性样品进行了测定,检出农药均存在且含量与本方法测得的值基本相符。具体测定结果见表3。

表 3 实际阳性样品的测定结果Table 3 Detected results of real positive samples
3 结论
本实验建立了UPLC-Q-TOF/MS快速筛查葱和姜中多种农药残留的分析方法。利用高分辨全离子MS/MS技术,通过一次数据采集,同时完成目标物的定性筛查和确证,有效地提升了应用高分辨质谱进行农药筛查的检测效率,具有较强的实际应用价值。
[1] Rong J F, Wei H, Li Y J, et al. Chinese Journal of Chromatography, 2016, 34(2): 194
荣杰锋, 韦航, 李亦军, 等. 色谱, 2016, 34(2): 194
[2] Cui S H, Chen W S, Qian J L, et al. Chinese Journal of Chromatography, 2013, 31(9): 885
崔淑华, 陈慰双, 钱家亮, 等. 色谱, 2013, 31(9): 885
[3] Sun X J, Guo M M, Wang S Y, et al. Chinese Journal of Chromatography, 2014, 32(10): 1124
孙晓杰, 郭萌萌, 王苏玥, 等. 色谱, 2014, 32(10): 1124
[4] Liu Z Z, Qi P P, Wang X Q, er al. Chinese Journal of Chromatography, 2016, 34(8): 762
刘真真, 齐沛沛, 王新全, 等. 色谱, 2016, 34(8): 762
[5] Li L Y, Xu X M, Lin H, et al. Chinese Journal of Chromatography, 2016, 34(9): 835
李凌云, 许晓敏, 林桓, 等. 色谱, 2016, 34(9): 835
[6] Wang L Z, Li X L, Fang E H, et al. Chinese Journal of Chromatography, 2016, 34(7): 686
王连珠, 李晓莲, 方恩华, 等. 色谱, 2016, 34(7): 686
[7] Liu Y Q, Li K, Xu W J, et al. Chinese Journal of Chromatography, 2016, 34(11): 1055
刘永强, 李凯, 许文娟, 等. 色谱, 2016, 34(11): 1055
[8] Pan X B, Yi X H, Shi Y Y, et al. Chinese Journal of Analytical Chemistry, 2016, 44(7): 1125
潘孝博, 伊雄海, 时逸吟, 等. 分析化学, 2016, 44(7): 1125
[9] Yu L, Song W, Lü Y N, et al. Chinese Journal of Chromatography, 2015, 33(6): 597
余璐, 宋伟, 吕亚宁, 等. 色谱, 2015, 33(6): 597
[10] Zhao M Y, Han F, Sun J W, et al. Journal of Instrumental Analysis, 2016, 35(12): 1513
赵暮雨, 韩芳, 孙锦文, 等. 分析测试学报, 2016, 35(12): 1513
[11] Yao H B, Han G J, Liu G X, et al. Bull Environ Contam Toxicol, 2010, 85: 142
[12] Sirtori C, Agüera A, Carra I, et al. Anal Bioanal Chem, 2014, 406(11): 2549
[13] Sun B X, Guo D H, Ding Z P, et al. Journal of Instrumental Analysis, 2010, 29(10): 1017
孙碧霞, 郭德华, 丁卓平, 等. 分析测试学报, 2010, 29(10): 1017
[14] Li K, Liu Y Q, Zhang J L, et al. Chinese Journal of Analysis Laboratory, 2015, 34(2): 236
李凯, 刘永强, 张金玲, 等. 分析实验室, 2015, 34(2): 236
[15] Zhang A Z, Wang Q L, Cao L L, et al. Chinese Journal of Chromatography, 2016, 34(2): 158
张爱芝, 王全林, 曹丽丽, 等. 色谱, 2016, 34(2): 158
[16] Fontana A R, Rodriguez I, Ramil M, et al. J Chromatogr A, 2011(16), 1218: 2165
[17] Turnipseed S B, Storey J M, Clark S B, et al. J Agric Food Chem, 2011, 59(14): 7569
[18] Deng X J, Yang H Q, Li J Z, et al. J Liq Chromatogr Related Technol, 2011, 34(19): 2286
[19] Krauss M, Singer H, Hollender J. Anal Bioanal Chem, 2010, 397(3): 943
[20] Xiang P, Shen M, Zhuo X Y. Journal of Instrumental Analysis, 2009, 28(6): 753
向平, 沈敏, 卓先义. 分析测试学报, 2009, 28(6): 753
[21] Wang L Q, He L M, Zeng Z L, et al. Journal of Chinese Mass Spectrometry Society, 2011, 32(6): 321
王立琦, 贺利民, 曾振灵, 等. 质谱学报, 2011, 32(6): 321
Rapid screening of44pesticide residues in ginger and scallion by ultra performance liquid chromatography coupled with quadrupole-time of flight mass spectrometry
LIU Yongqiang1*, LIU Sheng2, XU Wenjuan1, TIAN Guoning1, ZHANG Jinling1
(1. Technical Center for Inspection & Quarantine of Weifang Entry-Exit Inspection & Quarantine Bureau,Weifang 261041, China; 2. Technical Center for Inspection & Quarantine of Zibo Entry-Exit Inspection & Quarantine Bureau, Zibo 255035, China)
An analytical method was established for the simultaneous determination of 44 pesticide residues in ginger and scallion by ultra performance liquid chromatography coupled with quadrupole-time of flight mass spectrometry (UPLC-Q-TOF/MS). The samples were extracted with acetonitrile containing 0.1% (v/v) acetic acid aqueous solution, and cleaned-up by primary secondary amine (PSA) and octadecyl bonded silica (C18) adsorbents. The compounds were separated on a Poroshell 120 SB-C18column (100 mm×3.0 mm, 2.7 μm) with 0.1% (v/v) formic acid aqueous solution containing 5 mmol/L ammonium acetate-acetonitrile as mobile phases under gradient elution. The eluent was determined by UPLC-Q-TOF/MS with electrospray ionization in positive mode. The quantification analysis was performed with the external standard method. In all ions MS/MS mode, the compounds were qualitatively screened and confirmed by one data acquisition. The correlation coefficients (r) were greater than 0.995 in the linear ranges of the 44 pesticides. The limits of quantification (LOQs,S/N=10) of the 44 pesticides were 2.5-5.0 μg/kg. At the three spiked levels, the recoveries were between 73.4% and 113.7% with the relative standard deviations (RSDs) ranging from 0.7% to 12.1% (n=6). The method effectively improves the determination efficiency of pesticide residues screening by high-resolution mass spectrometry.
ultra performance liquid chromatography coupled with quadrupole-time of flight mass spectrometry (UPLC-Q-TOF/MS); high-resolution all ions MS/MS technology; QuEChERS; screening; pesticide residues
10.3724/SP.J.1123.2017.06001
2017-05-31
.Tel:(0536)8582596,E-mail:liuyongqianga@163.com.
山东出入境检验检疫局科研课题(SK201613);国家质检总局科技计划项目(2016IK202).
O658
A
1000-8713(2017)09-0941-08
Foundation item: Program of Shandong Entry-Exit Inspection & Quarantine Bureau (No. SK201613); Science and Technology Project of Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China (No. 2016IK202).
*
- 色谱的其它文章
- 《色谱》论文中可直接使用的缩略词
- 固相萃取-超高效液相色谱-高分辨质谱法快速测定食用油中4种酚类环境雌激素残留
- 超高效液相色谱-串联质谱法检测水果中6种甲氧基丙烯酸酯类杀菌剂及其质谱裂解规律
- 气相色谱法测定及预测有机磷阻燃剂的蒸气压
- Preparation of filter paper with chiral separation function by oxidation and Schiff-base reaction
- Separation and purification of acteoside from Rehmanniaglutinosa by combining macroporous resin with high-speed countercurrent chromatography